18.7:
خلايا التركيز
18.7:
خلايا التركيز
خلية التركيز هي نوع من الخلايا الفولتية التي يتم إنشاؤها عن طريق توصيل خليتين متطابقتين تقريبًا، يعتمد كلاهما على نفس التفاعل النصفي واستخدام نفس القطب، ويختلفان فقط في تركيز نوع واحد من الأكسدة والاختزال . وبالتالي، يتم تحديد إمكانات خلية التركيز فقط من خلال اختلاف التركيز لأنواع الأكسدة والاختزال المحددة.
ضع في اعتبارك الخلية الفولتية التالية:
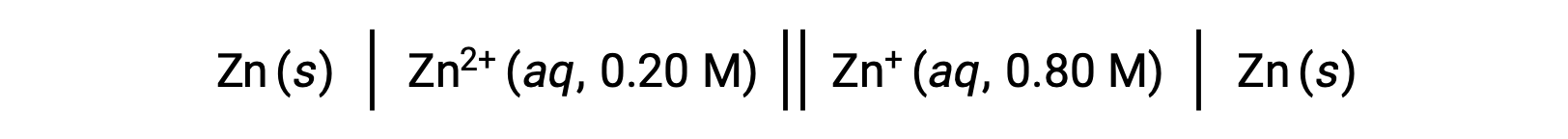
من المعلومات المقدمة، يمكن حساب جهد الخلية لخلية التركيز هذه باستخدام معادلة نرنست:

بالاستبدال في معادلة نيرنست
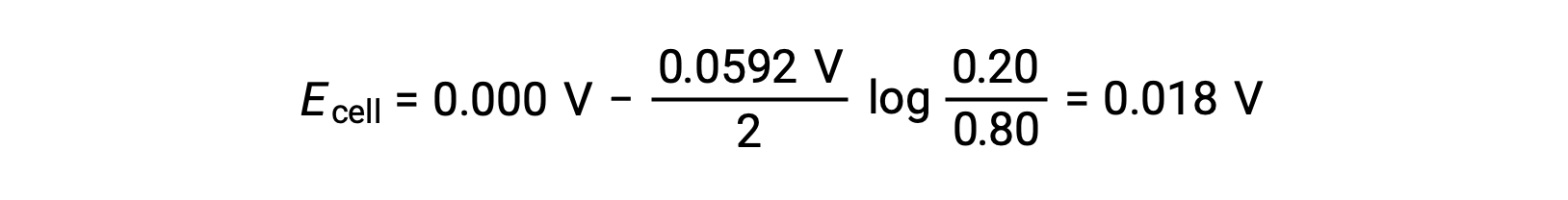
تشير القيمة الموجبة لقدرات الخلية إلى أن تفاعل الخلية الكلي يكون تلقائياً. يحدث هذا التفاعل التلقائي عندما ينخفض تركيز أيون الزنك في الكاثود (عن طريق الاختزال إلى عنصر الزنك) بينما يرتفع ذلك في الأنود (عن طريق أكسدة أنود الزنك إلى أيونات الزنك). توجد قوة دافعة أكبر لاختزال الزنك في الكاثود، حيث يكون تركيز أيون Zn2+ أكبر (Eكاثود > Eأنود).
تعمل مقاييس الأس الهيدروجيني في المختبر والقنوات الأيونية في أغشية الخلايا العصبية وخلايا عضلة القلب في جسم الإنسان على مبدأ خلايا التركيز.
هذا النص مقتبس من Openstax,Chemistry 2e,Chapter 17.4: Potential, Free Energy, and Equilibrium.
