Summary
Protéines tau non modifiées et hyperphosphorylées ont été utilisés dans deux des essais in vitro de l'agrégation de révéler la cinétique d'agrégation rapide hyperphosphorylation-dépendante. Ces dosages ouvrent la voie à de futurs écrans composés qui peuvent moduler la propension de la protéine tau hyperphosphorylée pour former des fibrilles qui sous-tendent la progression de la maladie d'Alzheimer.
Introduction
La maladie d'Alzheimer (MA) est une d'une grande collection de maladies neurodégénératives appelées tauopathies. La quintessence tauopathie pathologie sous-jacente est les enchevêtrements neurofibrillaires, NFT, dans les neurones, les astrocytes et la microglie 1-4. La densité NFT corrélation avec déficience cognitive 3,5 et neurone perte de 6. NFT contient la protéine tau hyperphosphorylée principalement (dénommé «p-tau" désormais) qui forme des filaments hélicoïdaux appariés ou droites (NP) de 7,8. Tau est une protéine associée aux microtubules pensé pour faciliter le transport axonal qui est essentiel pour la signalisation neuronale et le trafic 9,10. Chaque molécule de tau contient 2-3 phosphates dans le cerveau normal, mais le contenu phosphoryle augmente de plusieurs plis chez les patients tauopathie 11. Kinases multiples sont susceptibles de contribuer à l'hyperphosphorylation de tau y compris GSK3ß (glycogène synthase kinase 3β) et CDK5 (cycline-dekinase pendant 5) 12,13, mais la détente directe pour la phosphorylation pathologique reste insaisissable 14. Phosphorylation anormale dans ou à proximité des motifs de liaison aux microtubules se dissocie de la protéine tau des microtubules 15, et provoque une mauvaise localisation tau dans le compartiment somato-dendritique, où p-tau oligomérise en filaments hélicoïdaux appariés droites ou qui peuvent éventuellement se polymériser en inclusions NFT. Le lien étroit entre l'hyperphosphorylation de tau, la formation NFT, et la neurodégénérescence conduit à une hypothèse répandue que les enchevêtrements p-tau provoquent des réponses cytotoxiques apoptotiques et autres, et est donc la cause sous-jacente de la neurodégénérescence tauopathie 16,17. écrans de médicaments et de tests cliniques précoces basés sur cette prémisse ont été lancés 18. Cependant, cette hypothèse doit relever des défis 19,20. Par exemple, SantaCruz et al. Ont montré que les fonctions cognitives des souris transgéniques peuvent être améliorées par la suppression de l'expression d'un mutanttau humaine, même si NFT continué à se former à partir de molécules tau existants 21. Dans un modèle chez la drosophile, NFT a été montré pour séquestrer la protéine tau cytosolique toxique pour protéger les cellules neuronales 22,23 sous-jacentes. De toute évidence, le rôle de la pathogenèse des NFT, le cas échéant, aura un grand impact la direction du développement des thérapies tauopathie.
À des concentrations élevées, la protéine tau recombinante cerveau ou normal spontanément, mais lentement polymérise en une structure analogue à PHF in vitro, comme indiqué par la liaison de plusieurs feuilles β colorants fluorescents préférés, microscopie électronique, spectroscopie de diffusion de lumière et de 24 à 27. Ajout de l'héparine ou de l'acide arachidonique, un acide gras abondant dans le cerveau humain, accélère considérablement la formation de PHF et en tau isoform- inducteur concentration-dépendante manières 28-32. Curieusement, tau hyperphosphorylée purifié à partir de cerveaux AD ou préparé par exhaustive dans les réactions de phosphorylation in vitro uneggregates rapidement et plus efficacement 26,33-35. Ces résultats sont en excellent accord avec les rôles pathologiques de p-tau. Un système in vitro basée sur l'agrégation des p-tau peut donc servir comme un outil puissant pour le dépistage de la drogue AD.
Étant donné l'association étroite entre l'agrégation de la protéine tau et de la neurodégénérescence progressive de la MA, ainsi que le récent échec dans le développement de médicaments ciblant la plaque Aß, un autre marqueur histologique clé de AD 36-38, l'intérêt pour la découverte de médicaments qui contrôlent l'agrégation de la protéine tau est en hausse. En effet, plusieurs groupes ont déjà commencé écrans de drogue au débit différente, en utilisant dans les réactions d'agrégation de tau in vitro que le test primaire. Un certain nombre de produits chimiques ont été trouvés à exposer activités inhibitrices ou inversion sur l'agrégation de la protéine tau in vitro 39-42. Cependant, tous les écrans actuels de régulation de l'agrégation de la protéine tau utilisent tau non modifiée qui rate la marque pathologique clé de phosphoreylation, soulevant une préoccupation pour la spécificité et l'efficacité de l'utilisation de ces composés dans le traitement de la MA.
Un des obstacles majeurs de développement de tests d'agrégation pour la caractérisation biochimique et le dépistage des drogues AD est la production de quantités suffisantes de la protéine tau hyperphosphorylée pathophysiologiquement pertinente. Utilisation du système de catalyse Zippers-assistée dans lequel l'isoforme de la protéine tau et 1N4R la kinase GSK-3β sont co-exprimées dans E. coli comme protéines de fusion de glissière à leucine, nous avons surmonté ce défi (. Sui et al, soumis; voir la figure 1 pour les produits finaux de la protéine tau et p-tau; voir aussi 43 pour préliminaire spectrométrie de masse caractérisation de p-tau). D'un panel de neuf anticorps spécifiques des différents sites de phosphorylation de la protéine tau, des signaux positifs ont été observés dans huit positions (données non présentées). Ci-dessous, nous décrivons les protocoles et instrumentations qui peuvent se différencier l'agrégation d cinétiqueifferences entre la protéine tau non modifié et des espèces de p-tau. Ces essais ont été modifiés par des protocoles publiés qui ont mesuré l'augmentation de la fluorescence de la thioflavine T (THT) ou la thioflavine S (SAT) sur amyloïdes (agrégats de tau) contraignant 26. Dans le premier "terminal", approche sans colorant, les réactions d'agrégation sont assemblés et mis en incubation en l'absence du colorant amyloïde. A différents points dans le temps, une partie aliquote de chaque réaction est enlevé et mélangé avec un volume égal du tampon THT-contenant et pour empêcher l'agrégation ThT permettre de lier des agrégats de la protéine tau. La fluorescence est mesurée par un IAP FluoroMax-2 fluoromètre. Dans le second "avec colorant" test de surveillance continue, ThT ou ThS est inclus dans les réactions d'agrégation. Fluorescence peut être mesurée en continu tout au long de toute l'expérience manuellement ou en utilisant un lecteur multi-plaque. En outre, nous décrivons un essai qui utilise une concentration quasi-physiologique de la protéine tau et la protéine tau de p-agrégation dans le mo de mesure continuellede. L'effet de la phosphorylation reste facilement détectable. Ci-dessous, nous allons décrire les procédures étape par étape opération, et de montrer des résultats représentatifs de ces essais. Discussion de certains des avantages et inconvénients de chaque approche, ainsi que les applications potentielles de dépistage de drogue suivront.
À une concentration élevée, tau agrégats d'amyloïde dans les structures en forme spontanément. Toutefois, dans le laboratoire, tau fibrilles est généralement accélérée par ces inducteurs comme l'héparine (poids moléculaire moyen, 6000 g / mol) et l'acide arachidonique. Des exemples indiqués ici comprennent 30 uM héparine. La formation d'agrégats amyloïdes tau est contrôlée par la fluorescence résultant de la liaison de thioflavine T (ThT) ou la thioflavine S (SAT) amyloïde. Lors de la liaison à des agrégats de tau, ThT présente un décalage vers le rouge de la fluorescence (excitation: 450 nm; le pic d'émission: 485 nm). ThS, d'autre part, a faible émission à 510 nm (excitation à 450 nm) avant de se lier amyloïde, mais cette fluorescence augmente de façon significative en présence d'une protéine amyloïde tels que le tau agrégée 44. Les deux colorants fonctionnent bien dans la détection de l'agrégation de la protéine tau et p-tau. En raison de la forte pointe d'émission relativement large et de ThT (voir la figure 2), il n'y a qu'une réduction de 30% dans l'unité de fluorescence à 510 nm. Pour plus de commodité, nous utilisons la même combinaison de longueurs d'onde d'excitation / émission (ce est à dire, 450 nm / 510 nm) pour surveiller l'agrégation de la protéine tau en utilisant soit colorant.
l'agrégation de tau peut être effectuée en présence ou en l'absence du colorant, en fonction du but de l'essai et de la disponibilité de la protéine tau. Les deux modes de réactions sont présentés ci-dessous. En outre, nous démontrons l'exploitation de deux instruments différents - un seul échantillon fluoromètre (ISA-SPEX FluoroMax-2) et un lecteur multi-plaque (SpectraMax M2). Les lecteurs devraient être en mesure d'adapter ces protocoles pour répondre à leurs besoins spécifiques et de la disponibilité de l'instrument.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Préparation des réactifs
- Préparer du tampon de regroupement (20 mM de Tris, pH 7,4, NaCl 100 mM, EDTA 1 mM). Stocker à température ambiante, stable pendant des mois. Supplément 1 mM de dithiothréitol (DTT) avant utilisation.
REMARQUE: un tampon à base d'HEPES (10 mM HEPES, pH 7,5, EDTA 0,1 mM, DTT 5 mM) produit également des résultats similaires dans l'agrégation de tau. - Préparer thioflavine T ou thioflavine solution stock S (3 mM, dissous dans un tampon d'agrégation), et un filtre de 0,22 um unité de filtration stérile. Conserver à -20 ° C dans un tube couvert par une feuille d'aluminium, stable pendant des mois.
- Préparer la solution héparine de stock (300 um, dissous dans un tampon d'agrégation). Conserver à -20 ° C, stable pendant des mois.
- Préparer dithiothréitol (DTT) stock (1 M, dissous dans l'eau). Aliquote dans 1,5 ml tubes. Stocker à -20 ° C. Avant essais d'agrégation, décongeler la solution 1 M à température ambiante. De cette 1,000x mère, préparer une aliquote de 100 mM de travail avec de l'eau déminéralisée. Laisser sur la glaceavant d'être prêt.
- Retirer tau de -80 ° C congélateur. Décongeler sur la glace. Ajuster tau à une concentration prédéterminée avec le tampon d'agrégation. Centrifuger dans une microcentrifugeuse à 20 800 xg pendant 10 min à 4 ° C pour éliminer les gros agrégats préformés. Cette étape de pré-filage augmente la cohérence de la mesure de la fluorescence de chaque lot ultérieur de la préparation de protéine. Transférer le surnageant dans un autre tube; laisser sur la glace jusqu'au moment d'assembler la réaction d'agrégation.
2. Non-dye, Assay Terminal
REMARQUE: La réaction d'agrégation de ce dosage est effectué en l'absence du colorant fluorescent. Après avoir mélangé tous les composants, la réaction est laissée se dérouler à des points de temps prédéterminés. Aliquotes sont ensuite sortis de la réaction de l'agrégation et mélangés avec ThT ou ThS pour la liaison avant lecture de fluorescence amyloïde. Le volume initial de la réaction d'agrégation dépend du nombre de points de temps nécessaires. Cette approche peut REQUIRE une grande quantité de la protéine tau, mais est rapide, simple, et peut être fait dans un fluoromètre ou un lecteur de plaque multi-puits (voir Discussion). Ci-dessous est l'opération étape par étape, avec l'ISA SPEX FluoroMax-2 spectrofluorimètre compacte pour la fluorescence quantification.
- Mettre en place le mélange dans 1,5 ml agrégation des tubes Eppendorf comme dans le tableau 1. Chaque colonne représente les ingrédients nécessaires pour une réaction de 100 ul, ce qui est suffisant pour une mesure de temps de consigne. Ajustez la quantité pour l'ensemble du mélange d'agrégation sur la base des points de temps nécessaire à l'expérience particulière. Ajouter supplémentaire de 10% de chaque composant pour donner de la place pour le pipetage erreur. Le mélange réactionnel contenant de l'héparine typique représenté ici peut être remplacé par l'acide arachidonique ou un tampon d'agrégation. Ajouter du DTT à 1 mM dans le mélange réactionnel. Si la totalité de la réaction dure plus d'une journée, compléter frais TNT quotidienne (1 mM) pour assurer un environnement réducteur.
- Inverser le tube quelques fois pour mélanger. PlaCE chaque réaction dans un incubateur ou un bain d'eau à 37 ° C. L'agitation ne est pas nécessaire pour l'agrégation de tau.
- Avant de mesurer la fluorescence, allumer le spectrofluorimètre (lampe, puis ordinateur).
REMARQUE: La lampe à arc au xénon qui peut être utilisé immédiatement. Cependant, pour de meilleurs résultats permettent à la machine de se réchauffer pendant environ 10 minutes avant de lire la fluorescence. - Démarrez le logiciel sur l'ordinateur.
- Choisissez Temps réel mode Affichage en Instrument Control Center, définissez d'onde d'excitation à 450 nm (fente à 2 nm) et d'onde d'émission à 510 nm (fente à 5 nm). Fermer Temps réel fenêtre du mode d'affichage pour revenir au Centre de contrôle Instrument.
- Choisissez Analyse longueur d'onde, appuyez sur Ajouter >> touche Constant dans le cadre supérieur d'ajouter des longueurs d'onde ensembles. Régler les paramètres d'acquisition d'erreur standard à 1 et essais maximum à 3, puis cliquez sur Ajouter. Cliquez sur Go! Pour ouvrir l'affichage de donnéesfenêtre.
- Dans la fenêtre d'affichage de données, cliquez sur Démarrer Acq pour ouvrir la boîte de dialogue Nouvelle échantillon. Choisissez "inconnu" pour le type de l'échantillon.
- Pour chaque mélange de 100 ul d'agrégation, ajouter 98 ul de tampon d'agrégation et 2 pi 3 mM thioflavine T. Pipeter plusieurs fois pour mélanger.
- Transférer la totalité du mélange dans une cuvette (FCA3, dimension extérieure, lx L xh = 12,5 mm x 12,5 mm x 45 mm). Placez la cuve dans le porte-échantillon de l'échantillon compartiments et fermer le couvercle. Cliquez sur Exécuter pour recueillir les données de fluorescence. Enregistrer les données.
- Retirer la cuvette et décanter la solution. Rincer la cuvette d'eau distillée par trois fois. Sec par soufflage d'air à l'intérieur et l'extérieur de la cuvette.
3. Avec-dye, mode continue Assay sur un lecteur de plaque SpectraMax M2
REMARQUE: Cet essai diffère du précédent en ce que le colorant fluorescent ou ThT ThS est inclus dans le totalisationréaction de tion. Ceci permet la mesure en continu de la même série de réactions. En raison de l'utilisation répétitive de la réaction, ce procédé est mieux fait avec un lecteur automatique de plaque multi-puits (voir ci-dessous le fonctionnement du SpectraMax M2). Fluoromètre ordinaire fonctionne également, mais la fréquence de mesure des réactions d'agrégation rapide est quelque peu limitée en raison de la nature de l'opération manuelle.
- Mettre en place le mélange d'agrégation dans une plaque de 96 puits (96 puits plaque noire solide, bien volume 360 pi, fond plat) comme dans le tableau 2. Chaque colonne représente les ingrédients nécessaires pour une réaction de 200 pi, ce qui est suffisant pour un temps de mesure point. Mélangez bien à la pipette plusieurs fois. Supplément frais DTT 1 mM chaque jour tout au long du cours d'expériences.
- Incuber la plaque à 96 puits à 37 ° C.
- A chaque point de temps avant la mesure de la fluorescence, allumer le lecteur de microplaques multi-mode et l'ordinateur. Prévoyez suffisamment de temps pour la MAchine à stabiliser, à environ 10 min.
- Démarrez le logiciel sur l'ordinateur. Réglez la température à 37 ° C et choisissez le mode Intensité de fluorescence (FI-Top Lire), réglez la longueur d'onde d'excitation à 450 nm et d'onde d'émission à 510 nm.
- Insérez la plaque de 96 puits dans le tiroir et appuyez sur la touche READ pour démarrer la mesure.
- Après avoir lu, retirez la plaque et le retourner à la 37 ° C incubateur. Copiez les données et coller dans un tableur Excel pour l'analyse des données et de traçage.
4. Avec-dye, mode continue Assay sur une Spectrofluorometer Compact
- Mettre en place le mélange dans 1,5 ml agrégation des tubes Eppendorf comme dans le tableau 3. Chaque colonne représente les ingrédients nécessaires pour une réaction de 200 ul, ce qui est suffisant pour une mesure de temps de consigne.
- Inverser le tube quelques fois pour mélanger.
- Allumez le spectrofluorimètre et configurer le logiciel comme dans les étapes 2.3 et 2.4.
- Transférer le mélange tout l'étécuvette oa. Placez la cuve dans le porte-échantillon de l'échantillon compartiments et fermer le couvercle. Cliquez sur Exécuter pour recueillir les données de fluorescence. Enregistrer les données.
- Continuer la lecture à des intervalles appropriés en cliquant sur Exécuter et enregistrer les données. Si l'agrégation doit être surveillé à une fréquence élevée (par exemple, tous les 30 ou 60 secondes), laissez la réaction dans la cuve et dans la machine jusqu'à ce que la mesure est terminée, ou quand il ya suffisamment de temps pour échanger des réactions ou des cuvettes.
- Retirer la cuvette et décanter la solution. Rincer la cuvette d'eau distillée par trois fois. Sec par soufflage d'air à l'intérieur et l'extérieur de la cuvette.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Utilisation recombinant tau et p-tau (Figure 1), nous avons établi deux protocoles différents pour comparer la cinétique de l'agrégation de la protéine tau et p-tau, en profitant de la forte émission de fluorescence de ThT et ThS lors de la liaison à amyloïde agrégats de protéines, y compris la protéine tau et p-tau (Figure 2). Avec ou sans le colorant fluorescent dans la réaction d'agrégation, nous avons observé l'amélioration constante de l'agrégation de tau par hyperphosphorylation (figures 3-5). Cette stimulation est indépendante de l'héparine (données non présentées). Dans une réaction, tau-tau et p oligomériser typique à des taux rapides à l'intérieur de la 30 première minutes avant de ralentir de manière significative (figures 3 et 5), avec le p-tau présentant unités de fluorescence élevés tout au long de l'expérience. Y compris ThT dans les réactions d'agrégation provoque un retard important dans le taux d'agrégation (Figure 4). Les deux isoformes de plates approchéeau 160 heures après les réactions avait commencé. ThS, d'autre part, ne provoque pas de ralentissement notable de l'agrégation (Figure 5).

Figure 1. tau et la protéine tau hyperphosphorylée (p-tau) purifiée utilisée dans cette étude. Les échantillons ont été résolus par un gel SDS-PAGE à 10% et colorées par le bleu de Coomassie R250 (à gauche) ou sondées par un anticorps monoclonal anti-tau (à droite panneau). Lane M, marqueur de poids moléculaire; lignes 1 et 3, la protéine tau phosphorylée; lane2 et 4, tau hyperphosphorylée.

Les spectres d'émission Figure 2. THT (30 M) avec ou sans agrégats de tau. Acquisition émission a été s conserve de 460 nm à 600 nm (de minimum 1 nm; l'intégration de 0,1 sec, 5 nm largeur de la fente), excitation à 450 nm. agrégats de Tau ont été obtenus en permettant l'agrégation de la protéine tau 50 uM de procéder à 37 ° CO / N (voir protocole n ° 2 pour plus de détails).
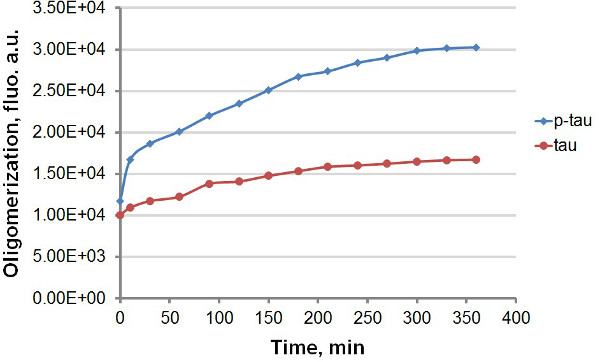
Figure 3. courbes d'agrégation pour tau et p-tau dans le dosage terminal. Agrégation de 50 uM tau et p-tau a été achevée avec 30 uM héparine comme inducteur. A différents moments après le début de la réaction, 100 ul de la réaction a été enlevé et mélangé avec un même volume de 60 uM ThT avant la mesure de fluorescence. La fluorescence a été mesurée à 450 nm excitation, 510 nm émission. «AU», unités arbitraires. A noter que l'échelle de temps est exprimé en minutes.
"Figure 4" src = "/ files / ftp_upload / 51537 / 51537fig4highres.jpg" />
Figure 4. Les courbes d'agrégation pour ThT seul, tau et p-tau dans le mode de mesure continue de la présence de ThT. Chaque réaction se composait de 0 ou de 50 uM de protéine tau ou p-tau, 30 uM de l'héparine, et 30 uM ThT dans du tampon d'agrégation . Les réactions ont été incubées à 37 ° C dans une plaque à 96 puits. A différents points dans le temps, la plaque a été retirée de l'incubateur et chargé dans le lecteur de plaque à fluorescence lecture (excitation 450 nm, émission 510 nm). Entre les lectures, la plaque a été maintenu dans l'incubateur sans agitation sous une couverture. La présence de ThT considérablement ralenti l'agrégation, mais, surtout, le tau hyperphosphorylée présentait encore un taux plus rapide de l'agrégation de fait sa contrepartie non modifiée. Notez que l'échelle de temps est en heures.
pload / 51537 / 51537fig5highres.jpg "/>
Figure 5. Les petits dosages d'agrégation de la protéine tau en présence de THS. In vitro l'agrégation induite par l'héparine de 6 uM tau-tau et p a été évaluée dans le mode de mesure continue de la thioflavine S en tant que le colorant indicateur. En plus de la protéine, chaque réaction contenait 30 uM et 20 uM héparine ThS dans l'agrégation du tampon HEPES (10 mM HEPES pH 7,5, DTT 5 mM, EDTA 0,1 mM). Tous les ingrédients sauf l'héparine ont été mélangés et équilibrés à la température ambiante. Après avoir ajouté de l'héparine, le mélange réactionnel a été transféré dans la cuvette et placé dans le porte-échantillon. La fluorescence a été comptabilisé immédiatement en T 0, et a continué pendant environ 2 heures ou jusqu'à ce que l'augmentation de fluorescence ralenti à près de zéro. En raison de la durée de réaction relativement courte, toute la réaction a été effectuée à température ambiante dans la même cuve.
| tau | p-tau | |
| 60 - 100 uM tau | 50 ul | 0 ul |
| 60 - 100 uM p-tau | 0 ul | 50 ul |
| 300 uM héparine | 10 ul | 10 ul |
| tampon d'agrégation | 39 pi | 39 pi |
| 100 mM DTT | 1 ul | 1 ul |
Tableau 1. composants du mélange d'agrégation pour sans colorant, le dosage terminal.
| tau | p-tau | Colorant seul | |
| 60 - 100 uM tau | 50 ul | 0 ul | 0 ul |
| 60 - 100 uM p-tau | 0 ul | 50 ul | |
| 300 uM héparine | 20 ul | 20 ul | 20 ul |
| 3 mM thioflavine T | 2 ul | 2 ul | 2 ul |
| tampon d'agrégation | 126 pi | 126 pi | 176 pi |
| 100 mM DTT | 2 ul | 2 ul | 2 ul |
Tableau 2. composants de mélange avec d'agrégation pour colorant, le dosage continu sur un lecteur de plaque.
| tau | p-tau | Colorant seul | |
| 60 - 100 uM tau | 5 ul | 0 ul | 0 ul |
| 60 - 100 uM p-tau | 0 ul | 5 ul | 01; l |
| 300 uM héparine | 20 ul | 20 ul | 20 ul |
| 3 mM thioflavine S | 1,5 ul | 1,5 ul | 1,5 ul |
| tampon d'agrégation | 171,5 pi | 171,5 pi | 176,5 pi |
| 100 mM DTT | 2 ul | 2 ul | 2 ul |
Tableau 3. composants de mélange avec d'agrégation pour colorant, le dosage continu sur un spectrofluoromètre compacte.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Ce protocole démontre différentes conditions et les instruments qui détectent les tau rapide cinétique d'agrégation de phosphorylation dépendante dosage. Dans l'essai du terminal, la fluorescence ThT colorant est ajouté à une partie de la réaction présente dans le mélange maître à chaque point de temps. Amyloïde liaison induite par fluorescence est ensuite mesurée 26. Dans le second, avec le mode de colorant, l'agrégation de la protéine tau est effectuée en présence de ThT ou ThS, ce qui rend ce type de réaction convenable pour l'évaluation automatique en temps réel de la croissance des agrégats de la protéine tau. Chacune de ces méthodes a ses avantages et inconvénients.
La réaction terminal mode est réalisée uniquement avec les ingrédients nécessaires pour l'agrégation de la protéine tau. La dilution et le mélange de la réaction avec de la thioflavine T ralentit considérablement baisser le taux d'augmentation de la fluorescence, arrête essentiellement la réaction de fluorescence quantification. Cette méthode est donc aussi compatible avec un fonctionnement manuel. Cependant, comme la reaction est pratiquement terminée lors de l'addition ThT, une grande quantité de tau peut être nécessaire pour tracer une courbe d'agrégation. Une autre mise en garde potentiel de cette méthode est que l'accès fréquent au mélange de réaction peut présenter une contamination microbienne ou protéolytique, ou l'oxydation des protéines. En revanche, le mode de colorant permet la génération d'amyloïde en présence de ThT ou SAT. L'avancement de l'agrégation peut être contrôlée en permanence sans jamais perturber la réaction. Cette fonctionnalité est particulièrement intéressante lorsque l'établissement d'une plate-forme de test automatisé. Cependant, différents colorants peuvent obtenir des réponses spécifiques. En effet, ThT retarde l'agrégation de la protéine tau et p-tau significative, mais ThS a peu d'effets (comparer les figures 3 et 5). Il existe plusieurs autres colorants de fluorescence, y compris les thiazines Congo et rouges, qui ont été utilisés dans les études histologiques et de biologie cellulaire à la formation de PHF. Au moins un rapport indique que certains de ces colorants peut induire l'agrégation de la protéine tau dans les tissus45 cellules de culture. Par conséquent, lors du choix de ces composés pour des études cinétiques de amyloïdogenèse, la prudence doit être pratiquée et que différents colorants peut être comparé.
En ce qui concerne le choix de l'instrument, le seul échantillon fluoromètre utilisé dans la première approche est très fiable, mais l'opération peut être laborieuse lorsque plus de quelques réactions sont à comparer. Utilisation de plusieurs cuvettes peuvent aider à éviter la contamination croisée entre les réactions, bien que le coût de ces cuves en quartz fragiles peut être prohibitif pour certains. Inversement, le lecteur de microplaques à puits multiples peut examiner des réactions multiples en même temps. L'utilisation de plaques à 96 puits à usage unique est avantageux aussi. Avec un élément de chauffage, un lecteur de microplaque peut être un dispositif spécifique pour surveiller plusieurs réactions à 37 ° C pendant une période de temps prolongée. Cependant, l'évaporation pourrait être un sujet de préoccupation. DiNitto et al. Superposée une réaction similaire avec une huile minérale pour éviterévaporation 46.
Quelques précautions sont à prendre pour les protocoles ci-dessus pour se assurer des résultats cohérents et quantitatives. Tout d'abord, tau-tau et p forment spontanément des agrégats amyloïdes dans le temps, en particulier lorsqu'il est dans une concentration élevée. Il est donc impératif de geler toutes les aliquotes d'préparations de protéines, et de dégel seul le volume nécessaire avant les expériences. Même ainsi, certains agrégats, y compris les intermédiaires granulaires détectables par ThT 47 auraient formé au cours de la préparation de protéines recombinantes. Une lecture de fluorescence initiale substantielle d'une réaction d'agrégation typique est donc commun. Néanmoins, en ajoutant une étape de pré-filage et le transfert du surnageant dans un tube séparé, même sans culot protéique visible, permet de réduire et de maintenir constante, la fluorescence initiale du même lot de tau-tau et p prép. Deuxièmement, la solution de travail du stock de ThT (soit 60 M) est stable à température ambiante pendant moins d'une semaine avant ee fluorescence diminue. Il est donc conseillé de refaire le 60 uM ThT tous les quelques jours.
Une raison importante qui sous-tend les études d'agrégation p-tau est le développement de nouveaux diagnostics et des thérapies de la MA. Les composés qui inhibent ou restaurant agrégation tau recombinant ont été identifiés à partir des écrans à haut débit et des tests ciblés 18,40,41,48. L'efficacité de ces composés pour l'agrégation tau-p reste à élucider. Ces écrans ont été effectuées dans le mode terminal de distribution d'un mélange d'agrégation commun sans le colorant à des puits individuels multidisques avec différents composés. Typiquement après O / N incubation, ThT ou ThS est ajouté pour la mesure de la fluorescence, révélant le pouvoir inhibiteur de nombreux composés. L'approche avec colorant mentionné ci-dessus et par Rankin et al. 49 doit encore être intégrées aux écrans à haut débit. Maintenant, avec la protéine tau hyperphosphorylée disponibles pour des études cinétiques et pharmaceutiques de pairesla formation de filaments hélicoïdaux, la découverte de médicaments de la maladie d'Alzheimer est susceptible de faire avancer plus loin.
Enfin, il convient de noter que l'étude de l'agrégation p-tau est d'une importance capitale non seulement pour les tauopathies, mais peut également avoir un impact d'une population encore plus large. Par exemple, il ya des rapports que les enchevêtrements neurofibrillaires sont détectables chez certains patients d'encéphalopathie traumatique chronique, comme les joueurs de football professionnels américains et les boxeurs 50-52. Corrélation similaire a également été rapportée chez les patients de lésions cérébrales traumatiques simples ou répétitives dont des soldats 53. Protocoles décrits dans ce travail peuvent ainsi aider à la découverte et le développement de nouvelles thérapeutiques ciblant agrégats p-tau dans les cellules neuronales.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Trizma base | Sigma | T1503 | |
| NaCl | Macron Fine Chemicals | MAL-7581-06 | |
| Ethylenediaminetetraacetic Acid (EDTA) | Invitrogen | 15576-028 | |
| Thioflavin T | Sigma | T3516 | Stored in dark |
| Thioflavin S | Sigma | T1892 | Stored in dark |
| heparin | Sigma | H3393 | |
| DL-Dithiothreitol (DTT) | Sigma | D9779 | Stored at 4 °C |
| 96-well plate | Corning | 3917 | |
| ISA SPEX FluoroMax-2 | Horiba | ||
| SpectraMax M2 Multi-Mode Microlate Reader | Molecular Devices | ||
| Mouse Anti-Tau Monoclonal Antibody | R&D Systems | MAB3494 | Stored at –80 °C |
References
- Lee, V. M., Goedert, M., Trojanowski, J. Q. Neurodegenerative tauopathies. Annu Rev Neurosci. 24, 1121-1159 (2001).
- Ballatore, C., Lee, V. M., Trojanowski, J. Q. Tau-mediated neurodegeneration in Alzheimer's disease and related disorders. Nat Rev Neurosci. 8 (9), 663-672 (2007).
- Arriagada, P. V., Marzloff, K., Hyman, B. T. Distribution of Alzheimer-type pathologic changes in nondemented elderly individuals matches the pattern in Alzheimer's disease. Neurology. 42 (9), 1681-1688 (1992).
- Arriagada, P. V., Growdon, J. H., Hedley-Whyte, E. T., Hyman, B. T. Neurofibrillary tangles but not senile plaques parallel duration and severity of Alzheimer's disease. Neurology. 42 (3 Pt 1), 631-639 (1992).
- Bancher, C., Braak, H., Fischer, P., Jellinger, K. A. Neuropathological staging of Alzheimer lesions and intellectual status in Alzheimer's and Parkinson's disease patients. Neurosci Lett. 162 (1-2), 179-182 (1993).
- Guillozet, A. L., Weintraub, S., Mash, D. C., Mesulam, M. M. Neurofibrillary tangles, amyloid, and memory in aging and mild cognitive impairment. Arch Neurol. 60 (5), 729-736 (2003).
- Hasegawa, M., et al. Protein sequence and mass spectrometric analyses of tau in the Alzheimer's disease brain. J Biol Chem. 267 (24), 17047-17054 (1992).
- Matsuo, E. S., et al. Biopsy-derived adult human brain tau is phosphorylated at many of the same sites as Alzheimer's disease paired helical filament tau. Neuron. 13 (4), 989-1002 (1994).
- Bamburg, J. R., Bloom, G. S. Cytoskeletal pathologies of Alzheimer disease. Cell Motil Cytoskeleton. 66 (8), 635-649 (2009).
- Denk, F., Wade-Martins, R. Knock-out and transgenic mouse models of tauopathies. Neurobiol Aging. 30 (1), 1-13 (2009).
- Gong, C. X., Iqbal, K. Hyperphosphorylation of microtubule-associated protein tau: a promising therapeutic target for Alzheimer disease. Curr Med Chem. 15 (23), 2321-2328 (2008).
- Mazanetz, M. P., Fischer, P. M. Untangling tau hyperphosphorylation in drug design for neurodegenerative diseases. Nat Rev Drug Discov. 6 (6), 464-479 (2007).
- Brunden, K. R., Trojanowski, J. Q., Lee, V. M. Advances in tau-focused drug discovery for Alzheimer's disease and related tauopathies. Nat Rev Drug Discov. 8 (10), 783-793 (2009).
- Querfurth, H. W., LaFerla, F. M. Alzheimer's disease. N Engl J Med. 362 (4), 329-344 (2010).
- Buee, L., Bussiere, T., Buee-Scherrer, V., Delacourte, A., Hof, P. R. Tau protein isoforms, phosphorylation and role in neurodegenerative disorders. Brain Res Brain Res Rev. 33 (1), 95-130 (2000).
- Lee, V. M., Brunden, K. R., Hutton, M., Trojanowski, J. Q. Developing therapeutic approaches to tau, selected kinases, and related neuronal protein targets. Cold Spring Harb Perspect Med. 1 (1), 006437 (2011).
- Mandelkow, E. M., Mandelkow, E. Biochemistry and cell biology of tau protein in neurofibrillary degeneration. Cold Spring Harb Perspect Med. 2 (7), a006247 (2012).
- Bulic, B., Pickhardt, M., Mandelkow, E. Progress and Developments in Tau Aggregation Inhibitors for Alzheimer Disease. J Med Chem. 56 (11), 4135-4155 (2013).
- Cowan, C. M., Quraishe, S., Mudher, A. What is the pathological significance of tau oligomers. Biochem Soc Trans. 40 (4), 693-697 (2012).
- Spires-Jones, T. L., Kopeikina, K. J., Koffie, R. M., de Calignon, A., Hyman, B. T. Are tangles as toxic as they look. J Mol Neurosci. 45 (3), 438-444 (2011).
- SantaCruz, K., et al. Tau suppression in a neurodegenerative mouse model improves memory function. Science. 309 (5733), 476-481 (2005).
- Wittmann, C. W., et al. Tauopathy in Drosophila: neurodegeneration without neurofibrillary tangles. Science. 293 (5530), 711-714 (2001).
- Shulman, J. M., Feany, M. B. Genetic modifiers of tauopathy in Drosophila. Genetics. 165 (3), 1233-1242 (2003).
- Wille, H., Drewes, G., Biernat, J., Mandelkow, E. M., Mandelkow, E. Alzheimer-like paired helical filaments and antiparallel dimers formed from microtubule-associated protein tau in vitro. J Cell Biol. 118 (3), 573-584 (1992).
- Alonso, A., Zaidi, T., Novak, M., Grundke-Iqbal, I., Iqbal, K. Hyperphosphorylation induces self-assembly of tau into tangles of paired helical filaments/straight filaments. Proc Natl Acad Sci U S A. 98 (12), 6923-6928 (2001).
- Barghorn, S., Biernat, J., Mandelkow, E. Purification of recombinant tau protein and preparation of Alzheimer-paired helical filaments in vitro. Methods Mol Biol. 299, 35-51 (2005).
- Wilson, D. M., Binder, L. I. Polymerization of microtubule-associated protein tau under near-physiological conditions. J Biol Chem. 270 (41), 24306-24314 (1995).
- Wilson, D. M., Binder, L. I. Free fatty acids stimulate the polymerization of tau and amyloid beta peptides. In vitro evidence for a common effector of pathogenesis in Alzheimer's disease. Am J Pathol. 150 (6), 2181-2195 (1997).
- Perez, M., Valpuesta, J. M., Medina, M., Montejo de Garcini, E., Avila, J. Polymerization of tau into filaments in the presence of heparin: the minimal sequence required for tau-tau interaction. J Neurochem. 67 (3), 1183-1190 (1996).
- Carlson, S. W., et al. A complex mechanism for inducer mediated tau polymerization. Biochemistry. 46 (30), 8838-8849 (2007).
- Goedert, M., et al. Assembly of microtubule-associated protein tau into Alzheimer-like filaments induced by sulphated glycosaminoglycans. Nature. 383 (6600), 550-553 (1996).
- King, M. E., Gamblin, T. C., Kuret, J., Binder, L. I. Differential assembly of human tau isoforms in the presence of arachidonic acid. J Neurochem. 74 (4), 1749-1757 (2000).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pseudo-phosphorylation of tau at Ser202 and Thr205 affects tau filament formation. Brain Res Mol Brain Res. 138 (1), 84-93 (2005).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pre-assembled tau filaments phosphorylated by GSK-3b form large tangle-like structures. Neurobiol Dis. 31 (3), 368-377 (2008).
- Grundke-Iqbal, I., et al. Abnormal phosphorylation of the microtubule-associated protein tau (tau) in Alzheimer cytoskeletal pathology. Proc Natl Acad Sci U S A. 83 (13), 4913-4917 (1986).
- Castellani, R. J., Perry, G. Pathogenesis and disease-modifying therapy in Alzheimer's disease: the flat line of progress. Arch Med Res. 43 (8), 694-698 (2012).
- Green, R. C., et al. Effect of tarenflurbil on cognitive decline and activities of daily living in patients with mild Alzheimer disease: a randomized controlled trial. JAMA. 302 (23), 2557-2564 (2009).
- Gauthier, S., et al. Effect of tramiprosate in patients with mild-to-moderate Alzheimer's disease: exploratory analyses of the MRI sub-group of the Alphase study. J Nutr Health Aging. 13 (6), 550-557 (2009).
- Pickhardt, M., et al. Anthraquinones inhibit tau aggregation and dissolve Alzheimer's paired helical filaments in vitro and in cells. J Biol Chem. 280 (5), 3628-3635 (2005).
- Crowe, A., Ballatore, C., Hyde, E., Trojanowski, J. Q., Lee, V. M. High throughput screening for small molecule inhibitors of heparin-induced tau fibril formation. Biochem Biophys Res Commun. 358 (1), 1-6 (2007).
- Taniguchi, S., et al. Inhibition of heparin-induced tau filament formation by phenothiazines, polyphenols, and porphyrins. J Biol Chem. 280 (9), 7614-7623 (2005).
- Sigurdsson, E. M. Tau-focused immunotherapy for Alzheimer's disease and related tauopathies. Curr Alzheimer Res. 6 (5), 446-450 (2009).
- Tan, Y. J., et al. Phosphopeptide Enrichment with TiO-Modified Membranes and Investigation of Tau Protein Phosphorylation. Anal Chem. 85 (12), 5699-5706 (2013).
- Santa-Maria, I., Perez, M., Hernandez, F., Avila, J., Moreno, F. J. Characteristics of the binding of thioflavin S to tau paired helical filaments. J Alzheimers Dis. 9 (3), 279-285 (2006).
- Lira-De Leon, K. I., et al. Molecular mechanism of tau aggregation induced by anionic and cationic dyes. J Alzheimers Dis. 35 (2), 319-334 (2013).
- DiNitto, J. P., Wang, L., Wu, J. C. Continuous fluorescence-based method for assessing dicer cleavage efficiency reveals 3' overhang nucleotide preference. BioTechniques. 48, 303-311 (2010).
- Maeda, S., et al. Granular tau oligomers as intermediates of tau filaments. Biochemistry. 46 (12), 3856-3861 (2007).
- Pickhardt, M., et al. Phenylthiazolyl-hydrazide and its derivatives are potent inhibitors of tau aggregation and toxicity in vitro and in cells. Biochemistry. 46 (35), 10016-10023 (2007).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Tau phosphorylation by GSK-3beta promotes tangle-like filament morphology. Mol Neurodegener. 2, 12 (2007).
- McKee, A. C., et al. Chronic traumatic encephalopathy in athletes: progressive tauopathy after repetitive head injury. J Neuropathol Exp Neurol. 68 (7), 709-735 (2009).
- Herrup, K. Reimagining Alzheimer's disease--an age-based hypothesis. J Neurosci. 30 (50), 16755-16762 (2010).
- Gavett, B. E., Stern, R. A., McKee, A. C. Chronic traumatic encephalopathy: a potential late effect of sport-related concussive and subconcussive head trauma. Clin Sports Med. 30 (1), 179-188 (2011).
- Tsitsopoulos, P. P., Marklund, N. Amyloid-beta Peptides and Tau Protein as Biomarkers in Cerebrospinal and Interstitial Fluid Following Traumatic Brain Injury: A Review of Experimental and Clinical Studies. Front Neurol. 4, 79 (2013).



