Summary
Proteine tau non modificate e iperfosforilata sono stati utilizzati in due metodiche di aggregazione in vitro per rivelare la cinetica di aggregazione veloce iperfosforilazione-dipendente. Questi test aprono la strada per schermi future per i composti che possono modulare la propensione di tau iperfosforilata a formare fibrille che sono alla base della progressione della malattia di Alzheimer.
Introduction
La malattia di Alzheimer (AD) è uno di una grande collezione di malattie neurodegenerative noti come taupatie. Il taupatia patologia sottostante per eccellenza sono i grovigli neurofibrillari, NFTs, in neuroni, astrociti e microglia 1-4. La densità NFT correlato con deterioramento cognitivo 3,5 e neurone perdita 6. NFT contiene proteine tau principalmente iperfosforilata (denominato "p-tau" d'ora in poi) che forma filamenti elicoidali diritte o appaiati (PHF) 7,8. Tau è una proteina associata ai microtubuli che facilita il trasporto assonale che è essenziale per la segnalazione neuronale e il traffico di 9,10. Ogni molecola tau contiene 2-3 fosfati nel cervello normale, ma il contenuto fosforil aumenta di diverse pieghe in pazienti taupatia 11. Più chinasi sono suscettibili di contribuire al tau iperfosforilazione compreso GSK3β (glicogeno sintasi chinasi 3β) e CDK5 (ciclina-dechinasi pendent 5) 12,13, ma il grilletto diretto per la fosforilazione patologico rimane sfuggente 14. Fosforilazione anormale nella zona di motivi microtubuli vincolante dissocia tau dal microtubuli 15, e causa tau mis-localizzazione al comparto Somatodendritic, dove p-tau oligomerizes in filamenti elicoidali diritti o coppie che può eventualmente polimerizzare in inclusioni NFT. Il legame stretto tra tau iperfosforilazione, formazione NFT, e neurodegenerazione ha portato ad una ipotesi prevalente che grovigli p-tau inducono risposte citotossiche apoptotici e altri, e, quindi, è la causa di fondo per taupatia neurodegenerazione 16,17. Schermi di droga e primi test clinici basati su questo presupposto sono stati lanciati 18. Tuttavia, questa ipotesi deve affrontare sfide 19,20. Ad esempio, SantaCruz et al. Hanno mostrato che le funzioni cognitive di topi transgenici possono essere migliorate sopprimendo l'espressione di un mutantetau umana, anche se NFTs continuato a formare da molecole di tau esistenti 21. In un modello di Drosophila, NFT ha dimostrato di sequestrare il citosolico tau tossico per proteggere le cellule neuronali sottostanti 22,23. Chiaramente, il ruolo patogenesi di NFT, se presente, urterà notevolmente la direzione di sviluppo terapie taupatia.
In alte concentrazioni, proteina tau cervello ricombinante o normale spontaneamente ma lentamente polimerizza in una struttura PHF-come in vitro, come indicato dal legame dei diversi coloranti β-sheet preferiti fluorescenti, microscopia elettronica, e la luce spettroscopia di scattering 24-27. L'aggiunta di eparina o acido arachidonico, un acido grasso abbondante nel cervello umano, accelera drasticamente la formazione di PHF tau in isoform- e modi di concentrazione-dipendente induttore 28-32. Curiosamente, tau iperfosforilata purificato da cervelli AD o preparato esaustivo in reazioni di fosforilazione in vitro unggregates più veloce ed efficiente 26,33-35. Questi risultati sono in eccellente accordo con i ruoli patologiche di p-tau. Un sistema in vitro basato sull'aggregazione di p-tau può quindi servire come un potente strumento per lo screening di stupefacenti AD.
Data la stretta associazione tra l'aggregazione di tau e la neurodegenerazione progressiva di AD, così come il recente fallimento nello sviluppo di farmaci mira la targa Ap, un altro tasto marcatore istologica di AD 36-38, l'interesse per la scoperta di farmaci che controllano l'aggregazione di tau è in aumento. Infatti, diversi gruppi hanno già iniziato schermi di droga a velocità differenti, utilizzando in vitro le reazioni di aggregazione tau, come il test primario. Sono stati trovati una serie di sostanze chimiche per esporre le attività inibitoria o di inversione di aggregazione tau in vitro 39-42. Tuttavia, tutti gli schermi attuali regolatore di aggregazione tau usano tau non modificato che manca il bersaglio patologico chiave di fosforoylation, sollevando una preoccupazione per la specificità e l'efficacia di utilizzo di questi composti in trattamento dC.
Uno dei principali ostacoli di sviluppare metodiche di aggregazione per la caratterizzazione biochimica e screening di farmaci AD è la produzione di quantità sufficienti di fisiopatologicamente relativa proteina tau iperfosforilata. Utilizzando il sistema di catalisi Zippers-assistita in cui l'isoforma 1N4R del tau e la chinasi GSK-3β sono co-espressi in E. coli come proteine di fusione leucina cerniera, abbiamo superato questa sfida (. Sui et al, ha presentato, vedere la Figura 1 per i prodotti finali di tau e P-tau, anche vedere 43 di pronuncia caratterizzazione spettrometria di massa di p-tau). Da un gruppo di nove anticorpi specifici per i diversi siti di fosforilazione di tau, segnali positivi sono stati osservati in otto posizioni (dati non riportati). Qui di seguito, descriviamo protocolli e strumentazioni in grado di differenziare l'aggregazione d cineticaifferences tra tau non modificato e specie p-tau. Questi test sono stati modificati da protocolli pubblicati che misuravano l'aumento della fluorescenza del tioflavina T (ThT) o thioflavin S (ThS) su amiloide (aggregati tau) vincolante 26. Nel primo "terminale", approccio senza colorante, reazioni aggregazione sono assemblati e incubate in assenza del colorante amiloide. A tempi diversi, un'aliquota di ogni reazione viene rimosso e mescolato con un volume uguale di tampone contenente ThT fermare aggregazione e consentire di impegnare ThT aggregati tau. La fluorescenza è misurata da un IAP FluoroMax-2 fluorimetro. Nel secondo "con-dye" continuo monitoraggio del dosaggio, ThT o ThS è incluso nelle reazioni di aggregazione. Fluorescenza può essere misurato continuamente durante l'intero esperimento manualmente oppure utilizzando un lettore multi-piastra. Inoltre, descriviamo un metodo che utilizza una concentrazione quasi fisiologica di tau e P-tau per l'aggregazione nel mo misura continuade. L'effetto di fosforilazione rimane facilmente rilevabile. Qui di seguito, descriveremo step-by-step procedure operative, e mostrano risultati rappresentativi di questi test. Discussione di alcuni dei pro e contro di ogni approccio, così come le potenziali applicazioni di screening di stupefacenti seguiranno.
Ad una concentrazione elevata, tau aggregati in strutture amiloidi simili spontaneamente. Tuttavia, in laboratorio, tau fibrillization è tipicamente accelerato da tali induttori come eparina (peso molecolare medio, 6.000 g / mol) e acido arachidonico. Gli esempi riportati qui sono 30 micron eparina. La formazione di tau aggregati amiloidi è monitorata dalla fluorescenza risultante di legarsi da tioflavina T (ThT) o thioflavin S (ThS) amiloide. Al legame aggregati tau, ThT presenta uno spostamento rosso della fluorescenza (eccitazione: 450 nm; picco di emissione: 485 nm). ThS, d'altra parte, ha debole emissione a 510 nm (eccitazione a 450 nm) prima dell'associazione amiloide, ma questo fluorescence aumenta significativamente in presenza di una proteina amiloide come la tau aggregato 44. Entrambi i coloranti funzionano bene nel rilevare tau e P-tau aggregazione. A causa del picco forte e relativamente ampio emissione di ThT (vedi Figura 2), vi è solo il 30% di riduzione in unità di fluorescenza a 510 nm. Per comodità, usiamo la stessa combinazione di lunghezze d'onda di eccitazione / emissione (ad esempio, 450 nm / 510 nm) per monitorare l'aggregazione di tau quando si utilizza dye.
Tau aggregazione può essere effettuata in presenza o assenza del colorante, a seconda dello scopo del dosaggio e la disponibilità di proteina tau. Entrambe le modalità di reazione sono riportati di seguito. Inoltre, abbiamo dimostrato il funzionamento di due strumenti diversi - un fluorimetro singolo campione (ISA-SPEX FluoroMax-2) e un lettore multidisco (SpectraMax M2). I lettori dovrebbero essere in grado di adattarsi questi protocolli per soddisfare le loro esigenze specifiche e la disponibilità dello strumento.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Preparazione dei reagenti
- Preparare buffer di aggregazione (20 mM Tris, pH 7,4, NaCl 100 mM, EDTA 1 mM). Conservare a temperatura ambiente, stabile per mesi. Supplemento 1 ditiotreitolo mm (DTT) prima dell'uso.
NOTA: tampone-HEPES (10 mM HEPES, pH 7,5, 0,1 mM EDTA, 5 mM DTT) produce anche risultati simili in aggregazione tau. - Preparare tioflavina T o thioflavin soluzione S stock (3 mm, disciolto in tampone aggregazione), e il filtro da 0,22 micron unità filtro sterile. Conservare a -20 ° C in un tubo rivestito da un foglio di alluminio, stabile per mesi.
- Preparare eparina soluzione madre (300 micron, disciolti in tampone di aggregazione). Conservare a -20 ° C, stabile per mesi.
- Preparare ditiotreitolo (DTT) stock (1 M, sciolto in acqua). Aliquota in provette da 1,5 ml. Conservare a -20 ° C. Prima di metodiche di aggregazione, scongelare la soluzione 1 M a RT. Da questo 1,000x magazzino, preparare una aliquota di 100 mm magazzino lavorano con acqua deionizzata. Lascia sul ghiacciofino al momento.
- Rimuovere tau da -80 ° C freezer. Scongelare su ghiaccio. Regolare tau a concentrazione prefissata con il tampone di aggregazione. Spin in una microcentrifuga a 20.800 xg per 10 min a 4 ° C per rimuovere grandi aggregati preformati. Questa fase di pre-filatura aumenta coerenza nella successiva misura della fluorescenza di ciascun lotto della preparazione proteine. Trasferire il surnatante in un'altra provetta; lasciare in ghiaccio fino al momento di montare la reazione di aggregazione.
2. No-dye, Assay Terminal
NOTA: La reazione aggregazione di questa analisi viene effettuata in assenza del colorante fluorescente. Dopo la miscelazione di tutti i componenti, la reazione viene lasciata procedere a predeterminati intervalli di tempo. Aliquote vengono poi portati fuori della reazione aggregazione e mescolati con ThT o ThS per vincolante prima della lettura della fluorescenza amiloide. Il volume iniziale della reazione aggregazione dipende dal numero di punti temporali necessari. Questo approccio può require una grande quantità di proteina tau, ma è veloce, semplice, e può essere fatto in un fluorimetro o un lettore di piastre a più pozzetti (vedi Discussione). Di seguito è riportato il funzionamento passo-passo, con l'ISA SPEX FluoroMax-2 spettrofluorimetro compatto per la fluorescenza quantificazione.
- Impostare la miscela aggregazione in 1,5 ml provette Eppendorf come in Tabella 1. Ciascuna colonna rappresenta gli ingredienti necessari per una reazione di 100 microlitri, che è sufficiente per una misurazione time-point. Regolare la quantità per l'intera miscela aggregazione in base ai punti di tempo necessari per la particolare esperimento. Aggiungere ulteriore 10% di ciascun componente per dare spazio a pipettaggio errore. La tipica reazione contenente eparina qui illustrato può essere sostituito da acido arachidonico o buffer di aggregazione. Aggiungere DTT 1 mM alla miscela di reazione. Se l'intera reazione dura più di un giorno, integrare fresco DTT quotidiana (1 mm) per garantire un ambiente riducente.
- Invertire la provetta un paio di volte per mescolare. PlaCe ogni reazione in un incubatore o bagnomaria 37 ° C. L'agitazione non è necessario per l'aggregazione tau.
- Prima di misurare la fluorescenza, accendere la spettrofluorimetro (lampada, poi computer).
NOTA: La lampada ad arco allo xeno che può essere utilizzato immediatamente. Tuttavia, per i migliori risultati permettono alla macchina di riscaldare per circa 10 minuti prima di leggere la fluorescenza. - Avviare il software sul computer.
- Scegli Tempo reale modalità di visualizzazione in Instrument Control Center, impostare l'eccitazione lunghezza d'onda di 450 nm (slit a 2 nm) e lunghezza d'onda di emissione di 510 nm (fessura di 5 nm). Chiudere la finestra Modalità di visualizzazione tempo reale per tornare al Centro di controllo dello strumento.
- Scegli Constant chiave analisi Lunghezza d'onda, premere Aggiungi >> nel frame superiore per aggiungere lunghezze d'onda set. Impostare i parametri di acquisizione di errore standard a 1 e Trials massimo a 3, quindi fare clic su Aggiungi. Fare clic su Go! Per aprire la visualizzazione di datifinestra.
- Nella finestra di visualizzazione dei dati, fare clic su Start Acq per aprire la finestra di dialogo Nuovo campione. Scegliere "sconosciuto" per tipo di campione.
- Per ogni miscela aggregazione 100 ml, aggiungere 98 microlitri di buffer di aggregazione e 2 pl 3 mM thioflavin T. Dispensare più volte per mescolare.
- Trasferire la miscela in una provetta (FCA3, la dimensione esterna, WxLxH = 12,5 millimetri x 12,5 millimetri x 45 mm). Posizionare la cuvetta nel portacampioni nel campione-vano e chiudere il coperchio. Fare clic su Esegui per raccogliere i dati di fluorescenza. Registrare i dati.
- Rimuovere la cuvetta e decantare la soluzione. Sciacquare la cuvetta da acqua distillata 3 volte. Dry soffiando aria dentro e fuori la cuvetta.
3. Con-dye, continua Modalità Assay on a Plate Reader SpectraMax M2
NOTA: Questo test differisce dalla precedente in quanto il colorante fluorescente ThT o ThS è incluso nel aggregareazione zione. Questo permette la misura continua della stessa serie di reazioni. A causa dell'uso ripetitivo della reazione, questo metodo è migliore fatto con un lettore automatico piastra multi-pozzetto (come mostrato di seguito il funzionamento del SpectraMax M2). Un fluorimetro regolare funziona anche, ma la frequenza di misura delle reazioni veloci aggregazione è piuttosto limitata, a causa della natura manuale dell'operazione.
- Impostare il mix di aggregazione in una piastra a 96 pozzetti (96 pozzetti nero piastra solida, ben volume 360 ml, fondo piatto), come nella tabella 2. Ogni colonna rappresenta gli ingredienti necessari per una reazione di 200 ml, che è sufficiente per una misurazione del tempo-point. Mescolare bene pipettando più volte. Supplemento fresco 1mM DTT ogni giorno nel corso di esperimenti.
- Incubare la piastra a 96 pozzetti a 37 ° C.
- Ad ogni punto di tempo prima della misurazione della fluorescenza, accendere il lettore di micropiastre multi-mode e il computer. Lasciare il tempo sufficiente per la machine per stabilizzare, circa 10 min.
- Avviare il software sul computer. Temperatura impostata a 37 ° C e scegli fluorescenza intensità modalità (FI-Top Read), impostare la lunghezza d'onda di eccitazione a 450 nm ed emissione lunghezza d'onda a 510 nm.
- Inserire la piastra a 96 pozzetti nel cassetto e premere il tasto per avviare la misurazione LEGGI.
- Dopo aver letto, rimuovere la piastra e tornare indietro al C incubatore 37 °. Copiare i dati e incollare in un foglio di calcolo Excel per l'analisi dei dati e la stampa.
4. Con-dye, continua la modalità del test su un Compact Spettrofluorimetro
- Impostare la miscela aggregazione in 1,5 ml provette Eppendorf come nella Tabella 3. Ciascuna colonna rappresenta gli ingredienti necessari per una reazione di 200 microlitri, che è sufficiente per una misurazione time-point.
- Invertire la provetta un paio di volte per mescolare.
- Accendere il spettrofluorimetro e impostare il software in passi 2.3 e 2.4.
- Trasferire la miscela toa cuvetta. Posizionare la cuvetta nel portacampioni nel campione-vano e chiudere il coperchio. Fare clic su Esegui per raccogliere i dati di fluorescenza. Registrare i dati.
- Continua a leggere ad intervalli appropriati facendo clic su Esegui e la registrazione dei dati. Se l'aggregazione deve essere controllata ad una frequenza elevata (ad esempio, ogni 30 o 60 sec), lasciano la reazione nella cuvetta e nella macchina fino a quando la misura è terminato, o quando vi è tempo sufficiente per scambiare reazioni o cuvette.
- Rimuovere la cuvetta e decantare la soluzione. Sciacquare la cuvetta da acqua distillata 3 volte. Dry soffiando aria dentro e fuori la cuvetta.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Utilizzando ricombinante tau e P-tau (Figura 1), abbiamo stabilito due protocolli per confrontare la cinetica di aggregazione di tau e P-tau, sfruttando la forte emissione di fluorescenza di ThT e ThS dal legame di amiloide aggregati proteici, compresi tau e p-tau (Figura 2). Con o senza colorante fluorescente nella reazione aggregazione, abbiamo osservato miglioramento consistente di aggregazione tau da hyperphosphorylation (figure 3-5). Questa stimolazione è indipendente eparina (dati non mostrati). In una tipica reazione, tau e p-tau oligomerize a tassi veloci entro i primi 30 min prima di rallentare notevolmente (figure 3 e 5), con p-tau esibendo unità fluorescenza elevati in tutto il corso dell'esperimento. Compresi ThT nelle reazioni di aggregazione provoca significativo rallentamento del tasso di aggregazione (Figura 4). Entrambe le isoforme plat avvicinatoeau 160 ore dopo le reazioni aveva iniziato. ThS, d'altra parte, non provoca sensibile rallentamento di aggregazione (figura 5).

Figura 1. purificata tau e tau iperfosforilata (p-tau) utilizzati in questo studio. I campioni sono stati risolti da un SDS-PAGE gel al 10%, e colorati con Coomassie blue R250 (sinistra) o sondato da un anticorpo monoclonale anti-tau (a destra pannello). Corsia M, marcatore di peso molecolare; corsie 1 e 3, tau fosforilata; lane2 e 4, tau iperfosforilata.

Figura 2. Spettri di emissione per ThT (30 micron), con o senza legante aggregati tau. Acquisizione di emissione è stato s scatola da 460 nm a 600 nm (1 nm incremento; integrazione 0.1 sec, 5 di larghezza fessura nm), eccitazione a 450 nm. Aggregati Tau sono stati ottenuti, consentendo 50 micron tau aggregazione di procedere a 37 ° CO / N (vedi protocollo 2 per i dettagli).
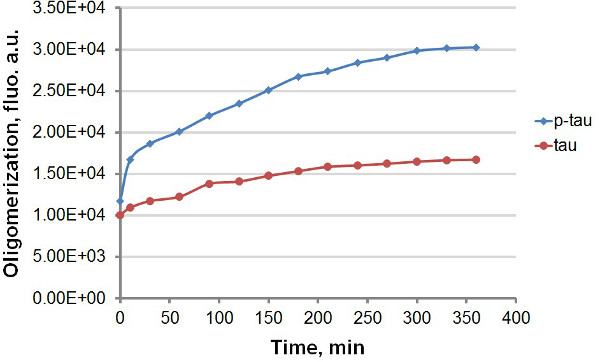
Figura 3. Curve aggregazione per tau e P-tau in test terminale. Aggregazione di 50 micron tau e P-tau si è conclusa con 30 micron eparina come induttore. In tempi diversi dopo l'inizio della reazione, 100 microlitri della reazione è stato rimosso e mescolati con ugual volume di 60 mM ThT prima della misurazione della fluorescenza. Fluorescenza è stata misurata a 450 nm di eccitazione, 510 nm di emissione. "au", unità arbitrarie. Si noti che la scala temporale è in minuti.
"Figura 4" src = "/ files / ftp_upload / 51537 / 51537fig4highres.jpg" />
Figura 4. curve di aggregazione per soli ThT, tau e p-tau in modalità di misura continua in presenza di ThT. Ciascuna reazione consistevano 0 o 50 pM tau o p-tau, 30 pM eparina, e 30 mM in tampone ThT aggregazione . Le reazioni sono state incubate a 37 ° C in una piastra a 96 pozzetti. A tempi diversi, la piastra è stata rimossa dal termostato e caricato nel lettore di piastre a fluorescenza per la lettura (eccitazione 450 nm, emissione 510 nm). Tra le letture, la piastra è stata mantenuta in incubatrice senza agitazione sotto una copertura. La presenza di ThT significativamente rallentato l'aggregazione, ma, soprattutto, il tau iperfosforilata ancora mostrato un tasso più veloce di aggregazione che ha fatto la sua controparte non modificato. Si noti che la scala del tempo è in ore.
PLOAD / 51537 / 51537fig5highres.jpg "/>
Figura 5. piccola scala metodiche di aggregazione tau in presenza di ThS. In vitro indotta da eparina aggregazione di 6 micron tau e P-tau è stata valutata in modalità di misurazione continua con thioflavin S come indicatore colorante. Oltre alla proteina, ogni reazione conteneva 30 mM e 20 mM eparina ThS nel buffer aggregazione HEPES (10 mM HEPES pH 7,5, 5 mM DTT, 0,1 mM EDTA). Tutti gli ingredienti eccetto eparina sono stati miscelati e equilibrati a RT. Dopo l'aggiunta eparina, la reazione è stata trasferita alla cuvetta e collocato nel supporto del campione. La fluorescenza è stato registrato come T 0, e continuato per circa 2 ore o fino a quando l'aumento di fluorescenza rallentato quasi a zero. A causa del periodo di reazione relativamente breve, l'intera reazione è stata condotta a temperatura ambiente nella stessa cuvetta.
| tau | p-tau | |
| 60 - 100 micron tau | 50 microlitri | 0 microlitri |
| 60 - 100 micron p-tau | 0 microlitri | 50 microlitri |
| 300 micron eparina | 10 microlitri | 10 microlitri |
| Buffer aggregazione | 39 microlitri | 39 microlitri |
| DTT 100 mM | 1 ml | 1 ml |
Tabella 1. componenti della miscela di aggregazione per i no-dye, test terminale.
| tau | p-tau | Dye da solo | |
| 60 - 100 micron tau | 50 microlitri | 0 microlitri | 0 microlitri |
| 60 - 100 micron p-tau | 0 microlitri | 50 microlitri | |
| 300 micron eparina | 20 l | 20 l | 20 l |
| 3 mM tioflavina T | 2 pl | 2 pl | 2 pl |
| Buffer Aggregazione | 126 ml | 126 ml | 176 ml |
| DTT 100 mM | 2 pl | 2 pl | 2 pl |
Tabella 2. componenti della miscela di aggregazione per la con-dye, continuo test su un lettore di piastre.
| tau | p-tau | Dye da solo | |
| 60 - 100 micron tau | 5 ml | 0 microlitri | 0 microlitri |
| 60 - 100 micron p-tau | 0 microlitri | 5 ml | 01; l |
| 300 micron eparina | 20 l | 20 l | 20 l |
| 3 mM thioflavin S | 1,5 ml | 1,5 ml | 1,5 ml |
| Buffer Aggregazione | 171,5 ml | 171,5 ml | 176,5 ml |
| DTT 100 mM | 2 pl | 2 pl | 2 pl |
Tabella 3. componenti della miscela di aggregazione per con-dye, continuo test su uno spettrofluorometro compatto.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Questo protocollo dimostra diverse condizioni e strumenti che rilevano i tau veloce cinetica di aggregazione fosforilazione-dipendente saggio. Nel saggio terminale, il colorante fluorescente ThT viene aggiunto ad una porzione della reazione rimossa dal master mix ad ogni tempo. Amiloide legame-Induced Fluorescence viene poi misurato 26. Nel secondo, con colorante modalità, aggregazione tau viene effettuata in presenza di ThT o ThS, rendendo questo tipo di reazione adatto per la valutazione automatica in tempo reale della crescita degli aggregati tau. Ciascuno di questi metodi ha i suoi pro e contro.
La reazione modalità terminale è condotta con i soli ingredienti necessari per l'aggregazione tau. Diluizione e miscela di reazione con tioflavina T rallenta drasticamente il tasso di aumento della fluorescenza, si ferma in sostanza la reazione per la fluorescenza quantificazione. Questo metodo è pertanto compatibile anche con azionamento manuale. Tuttavia, poiché il reaction è praticamente terminata su ThT Inoltre, una grande quantità di tau può essere richiesto per tracciare una curva di aggregazione. Un altro avvertimento potenziale di questo metodo è che l'accesso frequente alla miscela di reazione può introdurre o contaminazione microbica proteolitico, o proteine di ossidazione. Al contrario, la modalità con colorante consente la generazione di amiloide in presenza di ThT o ThS. L'avanzamento di aggregazione può essere monitorato in continuo senza mai disturbare la reazione. Questa funzione è particolarmente interessante quando si stabilisce una piattaforma di test automatizzato. Tuttavia, diversi coloranti possono suscitare risposte specifiche. Infatti, ThT ritarda tau e P-tau aggregazione significativamente, ma ThS ha pochi effetti (confrontare le figure 3 e 5). Ci sono diversi altri coloranti fluorescenti, tra cui Congo tiazine rosse e, che sono stati utilizzati in studi istologici e di biologia cellulare per la formazione PHF. Almeno una relazione afferma che alcuni di questi coloranti possono indurre l'aggregazione tau in tessutocellule di coltura 45. Quindi, per scegliere questi composti per cinetica amiloidogenesi studi, la cautela deve essere praticato e che i diversi coloranti potrebbe dover essere confrontato.
Per quanto riguarda la scelta dello strumento, il fluorimetro singolo campione utilizzato nel primo approccio è molto affidabile, ma l'operazione può essere laboriosa quando più di alcune reazioni devono essere comparati. Utilizzo di più cuvette possono contribuire ad evitare la contaminazione incrociata tra le reazioni, anche se il costo di queste provette di quarzo fragili può essere proibitivo per alcuni. Viceversa, il lettore di micropiastre multi-pozzo può esaminare reazioni multiple contemporaneamente. L'uso di piastre a 96 pozzetti monouso è vantaggioso pure. Con un elemento riscaldante, un lettore di micropiastre può essere un dispositivo dedicato per il monitoraggio di più reazioni a 37 ° C per un periodo di tempo prolungato. Tuttavia, l'evaporazione potrebbe essere una preoccupazione. DiNitto et al. Sovrapposta una reazione simile con olio minerale per impedirel'evaporazione 46.
Alcune precauzioni devono essere prese per i protocolli di cui sopra al fine di garantire risultati coerenti e quantitativi. In primo luogo, tau e p-tau formano spontaneamente aggregati amiloidi nel tempo, in particolare quando una concentrazione elevata. E 'quindi imperativo di congelare tutte le aliquote di preparazioni di proteine, e scongelare solo il volume necessario prima degli esperimenti. Anche così, alcuni aggregati, compresi gli intermedi granulari rilevabili da ThT 47 formatisi durante la preparazione di proteine ricombinanti. Un sostanziale lettura di fluorescenza iniziale di una tipica reazione di aggregazione è quindi comuni. Tuttavia, l'aggiunta di una fase di pre-filatura e trasferire il surnatante in un tubo separato, anche senza una proteina pellet visibile, può ridurre, e mantenere costante, fluorescenza iniziale dello stesso lotto di tau e p-tau prep. In secondo luogo, la soluzione madre di lavoro di ThT (ie, 60 micron) è stabile a temperatura ambiente per meno di una settimana prima di the la fluorescenza diminuisce. E 'quindi consigliato di rifare il 60 micron ThT ogni diversi giorni.
Uno dei motivi alla base di spicco studi di aggregazione p-tau è lo sviluppo della diagnostica AD nuove e terapie. Composti che inibiscono o ripristinare l'aggregazione di tau ricombinante sono stati identificati dagli schermi high-throughput e test mirati 18,40,41,48. Efficacia di questi composti per l'aggregazione p-tau ancora da chiarire. Questi schermi sono state effettuate in modalità terminale erogando una miscela aggregazione comune senza il colorante a singoli pozzetti multidisco con diversi composti. Tipicamente dopo O / N incubazione, ThT o ThS viene aggiunto per la misurazione di fluorescenza, rivelando la potenza inibitoria di molti composti. L'approccio con il colorante di cui sopra e da Rankin et al. 49 deve ancora essere incorporati a schermi ad alta produttività. Ora con tau iperfosforilata disponibili per studi cinetici e farmaceutici di abbinatoformazione filamento elicoidale, scoperta di nuovi farmaci morbo di Alzheimer potrebbe avanzare più lontano.
Infine, vale la pena notare che lo studio di aggregazione p-tau è di fondamentale importanza non solo per taupatie, ma può anche avere un impatto di una popolazione ancora più ampia. Ad esempio, ci sono rapporti che i grovigli neurofibrillari rilevabili in alcuni pazienti di encefalopatia traumatica cronica, come ad esempio i giocatori di football americano professionisti e pugili 50-52. Correlazione simile è stato segnalato anche per i pazienti con lesioni cerebrali traumatiche singole o ripetitive tra cui soldati 53. Protocolli descritti in questo lavoro possono quindi aiutare la scoperta e lo sviluppo di nuove terapie mirate aggregati p-tau nelle cellule neuronali.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Trizma base | Sigma | T1503 | |
| NaCl | Macron Fine Chemicals | MAL-7581-06 | |
| Ethylenediaminetetraacetic Acid (EDTA) | Invitrogen | 15576-028 | |
| Thioflavin T | Sigma | T3516 | Stored in dark |
| Thioflavin S | Sigma | T1892 | Stored in dark |
| heparin | Sigma | H3393 | |
| DL-Dithiothreitol (DTT) | Sigma | D9779 | Stored at 4 °C |
| 96-well plate | Corning | 3917 | |
| ISA SPEX FluoroMax-2 | Horiba | ||
| SpectraMax M2 Multi-Mode Microlate Reader | Molecular Devices | ||
| Mouse Anti-Tau Monoclonal Antibody | R&D Systems | MAB3494 | Stored at –80 °C |
References
- Lee, V. M., Goedert, M., Trojanowski, J. Q. Neurodegenerative tauopathies. Annu Rev Neurosci. 24, 1121-1159 (2001).
- Ballatore, C., Lee, V. M., Trojanowski, J. Q. Tau-mediated neurodegeneration in Alzheimer's disease and related disorders. Nat Rev Neurosci. 8 (9), 663-672 (2007).
- Arriagada, P. V., Marzloff, K., Hyman, B. T. Distribution of Alzheimer-type pathologic changes in nondemented elderly individuals matches the pattern in Alzheimer's disease. Neurology. 42 (9), 1681-1688 (1992).
- Arriagada, P. V., Growdon, J. H., Hedley-Whyte, E. T., Hyman, B. T. Neurofibrillary tangles but not senile plaques parallel duration and severity of Alzheimer's disease. Neurology. 42 (3 Pt 1), 631-639 (1992).
- Bancher, C., Braak, H., Fischer, P., Jellinger, K. A. Neuropathological staging of Alzheimer lesions and intellectual status in Alzheimer's and Parkinson's disease patients. Neurosci Lett. 162 (1-2), 179-182 (1993).
- Guillozet, A. L., Weintraub, S., Mash, D. C., Mesulam, M. M. Neurofibrillary tangles, amyloid, and memory in aging and mild cognitive impairment. Arch Neurol. 60 (5), 729-736 (2003).
- Hasegawa, M., et al. Protein sequence and mass spectrometric analyses of tau in the Alzheimer's disease brain. J Biol Chem. 267 (24), 17047-17054 (1992).
- Matsuo, E. S., et al. Biopsy-derived adult human brain tau is phosphorylated at many of the same sites as Alzheimer's disease paired helical filament tau. Neuron. 13 (4), 989-1002 (1994).
- Bamburg, J. R., Bloom, G. S. Cytoskeletal pathologies of Alzheimer disease. Cell Motil Cytoskeleton. 66 (8), 635-649 (2009).
- Denk, F., Wade-Martins, R. Knock-out and transgenic mouse models of tauopathies. Neurobiol Aging. 30 (1), 1-13 (2009).
- Gong, C. X., Iqbal, K. Hyperphosphorylation of microtubule-associated protein tau: a promising therapeutic target for Alzheimer disease. Curr Med Chem. 15 (23), 2321-2328 (2008).
- Mazanetz, M. P., Fischer, P. M. Untangling tau hyperphosphorylation in drug design for neurodegenerative diseases. Nat Rev Drug Discov. 6 (6), 464-479 (2007).
- Brunden, K. R., Trojanowski, J. Q., Lee, V. M. Advances in tau-focused drug discovery for Alzheimer's disease and related tauopathies. Nat Rev Drug Discov. 8 (10), 783-793 (2009).
- Querfurth, H. W., LaFerla, F. M. Alzheimer's disease. N Engl J Med. 362 (4), 329-344 (2010).
- Buee, L., Bussiere, T., Buee-Scherrer, V., Delacourte, A., Hof, P. R. Tau protein isoforms, phosphorylation and role in neurodegenerative disorders. Brain Res Brain Res Rev. 33 (1), 95-130 (2000).
- Lee, V. M., Brunden, K. R., Hutton, M., Trojanowski, J. Q. Developing therapeutic approaches to tau, selected kinases, and related neuronal protein targets. Cold Spring Harb Perspect Med. 1 (1), 006437 (2011).
- Mandelkow, E. M., Mandelkow, E. Biochemistry and cell biology of tau protein in neurofibrillary degeneration. Cold Spring Harb Perspect Med. 2 (7), a006247 (2012).
- Bulic, B., Pickhardt, M., Mandelkow, E. Progress and Developments in Tau Aggregation Inhibitors for Alzheimer Disease. J Med Chem. 56 (11), 4135-4155 (2013).
- Cowan, C. M., Quraishe, S., Mudher, A. What is the pathological significance of tau oligomers. Biochem Soc Trans. 40 (4), 693-697 (2012).
- Spires-Jones, T. L., Kopeikina, K. J., Koffie, R. M., de Calignon, A., Hyman, B. T. Are tangles as toxic as they look. J Mol Neurosci. 45 (3), 438-444 (2011).
- SantaCruz, K., et al. Tau suppression in a neurodegenerative mouse model improves memory function. Science. 309 (5733), 476-481 (2005).
- Wittmann, C. W., et al. Tauopathy in Drosophila: neurodegeneration without neurofibrillary tangles. Science. 293 (5530), 711-714 (2001).
- Shulman, J. M., Feany, M. B. Genetic modifiers of tauopathy in Drosophila. Genetics. 165 (3), 1233-1242 (2003).
- Wille, H., Drewes, G., Biernat, J., Mandelkow, E. M., Mandelkow, E. Alzheimer-like paired helical filaments and antiparallel dimers formed from microtubule-associated protein tau in vitro. J Cell Biol. 118 (3), 573-584 (1992).
- Alonso, A., Zaidi, T., Novak, M., Grundke-Iqbal, I., Iqbal, K. Hyperphosphorylation induces self-assembly of tau into tangles of paired helical filaments/straight filaments. Proc Natl Acad Sci U S A. 98 (12), 6923-6928 (2001).
- Barghorn, S., Biernat, J., Mandelkow, E. Purification of recombinant tau protein and preparation of Alzheimer-paired helical filaments in vitro. Methods Mol Biol. 299, 35-51 (2005).
- Wilson, D. M., Binder, L. I. Polymerization of microtubule-associated protein tau under near-physiological conditions. J Biol Chem. 270 (41), 24306-24314 (1995).
- Wilson, D. M., Binder, L. I. Free fatty acids stimulate the polymerization of tau and amyloid beta peptides. In vitro evidence for a common effector of pathogenesis in Alzheimer's disease. Am J Pathol. 150 (6), 2181-2195 (1997).
- Perez, M., Valpuesta, J. M., Medina, M., Montejo de Garcini, E., Avila, J. Polymerization of tau into filaments in the presence of heparin: the minimal sequence required for tau-tau interaction. J Neurochem. 67 (3), 1183-1190 (1996).
- Carlson, S. W., et al. A complex mechanism for inducer mediated tau polymerization. Biochemistry. 46 (30), 8838-8849 (2007).
- Goedert, M., et al. Assembly of microtubule-associated protein tau into Alzheimer-like filaments induced by sulphated glycosaminoglycans. Nature. 383 (6600), 550-553 (1996).
- King, M. E., Gamblin, T. C., Kuret, J., Binder, L. I. Differential assembly of human tau isoforms in the presence of arachidonic acid. J Neurochem. 74 (4), 1749-1757 (2000).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pseudo-phosphorylation of tau at Ser202 and Thr205 affects tau filament formation. Brain Res Mol Brain Res. 138 (1), 84-93 (2005).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pre-assembled tau filaments phosphorylated by GSK-3b form large tangle-like structures. Neurobiol Dis. 31 (3), 368-377 (2008).
- Grundke-Iqbal, I., et al. Abnormal phosphorylation of the microtubule-associated protein tau (tau) in Alzheimer cytoskeletal pathology. Proc Natl Acad Sci U S A. 83 (13), 4913-4917 (1986).
- Castellani, R. J., Perry, G. Pathogenesis and disease-modifying therapy in Alzheimer's disease: the flat line of progress. Arch Med Res. 43 (8), 694-698 (2012).
- Green, R. C., et al. Effect of tarenflurbil on cognitive decline and activities of daily living in patients with mild Alzheimer disease: a randomized controlled trial. JAMA. 302 (23), 2557-2564 (2009).
- Gauthier, S., et al. Effect of tramiprosate in patients with mild-to-moderate Alzheimer's disease: exploratory analyses of the MRI sub-group of the Alphase study. J Nutr Health Aging. 13 (6), 550-557 (2009).
- Pickhardt, M., et al. Anthraquinones inhibit tau aggregation and dissolve Alzheimer's paired helical filaments in vitro and in cells. J Biol Chem. 280 (5), 3628-3635 (2005).
- Crowe, A., Ballatore, C., Hyde, E., Trojanowski, J. Q., Lee, V. M. High throughput screening for small molecule inhibitors of heparin-induced tau fibril formation. Biochem Biophys Res Commun. 358 (1), 1-6 (2007).
- Taniguchi, S., et al. Inhibition of heparin-induced tau filament formation by phenothiazines, polyphenols, and porphyrins. J Biol Chem. 280 (9), 7614-7623 (2005).
- Sigurdsson, E. M. Tau-focused immunotherapy for Alzheimer's disease and related tauopathies. Curr Alzheimer Res. 6 (5), 446-450 (2009).
- Tan, Y. J., et al. Phosphopeptide Enrichment with TiO-Modified Membranes and Investigation of Tau Protein Phosphorylation. Anal Chem. 85 (12), 5699-5706 (2013).
- Santa-Maria, I., Perez, M., Hernandez, F., Avila, J., Moreno, F. J. Characteristics of the binding of thioflavin S to tau paired helical filaments. J Alzheimers Dis. 9 (3), 279-285 (2006).
- Lira-De Leon, K. I., et al. Molecular mechanism of tau aggregation induced by anionic and cationic dyes. J Alzheimers Dis. 35 (2), 319-334 (2013).
- DiNitto, J. P., Wang, L., Wu, J. C. Continuous fluorescence-based method for assessing dicer cleavage efficiency reveals 3' overhang nucleotide preference. BioTechniques. 48, 303-311 (2010).
- Maeda, S., et al. Granular tau oligomers as intermediates of tau filaments. Biochemistry. 46 (12), 3856-3861 (2007).
- Pickhardt, M., et al. Phenylthiazolyl-hydrazide and its derivatives are potent inhibitors of tau aggregation and toxicity in vitro and in cells. Biochemistry. 46 (35), 10016-10023 (2007).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Tau phosphorylation by GSK-3beta promotes tangle-like filament morphology. Mol Neurodegener. 2, 12 (2007).
- McKee, A. C., et al. Chronic traumatic encephalopathy in athletes: progressive tauopathy after repetitive head injury. J Neuropathol Exp Neurol. 68 (7), 709-735 (2009).
- Herrup, K. Reimagining Alzheimer's disease--an age-based hypothesis. J Neurosci. 30 (50), 16755-16762 (2010).
- Gavett, B. E., Stern, R. A., McKee, A. C. Chronic traumatic encephalopathy: a potential late effect of sport-related concussive and subconcussive head trauma. Clin Sports Med. 30 (1), 179-188 (2011).
- Tsitsopoulos, P. P., Marklund, N. Amyloid-beta Peptides and Tau Protein as Biomarkers in Cerebrospinal and Interstitial Fluid Following Traumatic Brain Injury: A Review of Experimental and Clinical Studies. Front Neurol. 4, 79 (2013).



