Summary
الحمضية بعد الولادة يحمي من نقص التروية الدماغية. هنا نقدم نموذجين لتنفيذ أبك. يتم تحقيقها على التوالي عن طريق نقل شرائح القشرية إلى الحامض العازلة بعد الحرمان من الأكسجين الجلوكوز في المختبر واستنشاق 20٪ كو 2 بعد انسداد الشريان الدماغي الأوسط في الجسم الحي .
Abstract
السكتة الدماغية هي واحدة من الأسباب الرئيسية للوفيات والعجز في جميع أنحاء العالم، مع نهج علاجية محدودة. باعتبارها استراتيجية الذاتية للحماية العصبية، وقد أثبتت العلاجات ما بعد التكييف لتكون علاجات واعدة ضد نقص التروية الدماغية. ومع ذلك، إجراءات معقدة وقضايا السلامة المحتملة تحد تطبيقها السريري. للتغلب على هذه العيوب، قمنا بتطوير ما بعد التكييف الحمضية (أبك) كعلاج لنقص التروية الدماغية البؤري التجريبية. أبك يشير إلى العلاج الحماض خفيفة من خلال استنشاق كو 2 خلال ضخه التالية نقص التروية. هنا نقدم نموذجين لتنفيذ أبك في المختبر وفي الجسم الحي ، على التوالي. تم استخدام الحرمان من الجلوكوز (أوغد) علاج الفئران والانسداد القشرية ووسط انسداد الشريان الدماغي (مساو) من الفئران لمحاكاة نقص التروية الدماغية. يمكن أن يتحقق أبك ببساطة عن طريق نقل شرائح الدماغ إلى عازلة الحمضية فقاعات مع 20٪ كو 2 ، سr بواسطة الفئران استنشاق 20٪ كو 2 . أظهر أبك آثار وقائية كبيرة ضد نقص التروية الدماغية، كما يتضح من بقاء الأنسجة وحجم المخ احتشاء.
Introduction
السكتة الدماغية هي واحدة من الأسباب الرئيسية للوفيات والعجز في جميع أنحاء العالم. وقد بذلت جهود كبيرة لإيجاد علاجات فعالة للسكتة الدماغية في العقود الماضية، ومع ذلك، فإن إنجاز غير مرضية تماما. عملية ما بعد التكييف هي عملية تم التلاعب بها من قبل الضغوط السامة بعد حلقة نقص تروية. ما بعد التروية، بما في ذلك نقص تروية، نقص الأكسجين، وانخفاض الجلوكوز والنائية نقص تروية بعد الولادة، وآليات التكيف الذاتية الزناد، وقد ثبت أن تكون علاجات واعدة ضد نقص التروية الدماغية 1 ، 2 ، 3 ، 4 . ومع ذلك، قد يسبب التروية بعد التروية إصابة إضافية. الطرف البعيد بعد نقص تروية الدماغية يحتاج عادة عدة دورات من 5-20 دقيقة انسداد وضخه على أطرافه المماثل أو الثنائية هند 5 ، 6 ، 7 . ثوبالتالي، هذه التلاعب ما بعد التكييف خطيرة أو غير عملية في الممارسة السريرية. للتغلب على هذه العيوب، قمنا بتطوير أبك كعلاج لنقص التروية الدماغية البؤرية في الفئران 8 . مستحث ببساطة عن طريق استنشاق 20٪ كو 2 ، أبك يقلل بشكل كبير من إصابات الدماغ الدماغية بطريقة أكثر جدوى وأكثر أمنا. في الآونة الأخيرة أثبتنا أن أبك يمتد نافذة ضخه، وتسليط الضوء على أهمية أبك للعلاج السكتة الدماغية 9 .
هنا نقدم نموذجين التجريبية لدراسة الحماية العصبية من أبك ضد نقص التروية الدماغية. الأول هو نموذج الحرمان من الجلوكوز (أوغد) في شرائح الفئران القشرية. التحضير السريع ونقل شرائح الدماغ إلى بيئة اصطناعية، عادة السائل النخاعي الاصطناعي (أسف)، يمكن الحفاظ على بقاء الخلية والدوائر العصبية، مما يجعل من الممكن لدراسة وظيفة المخ في المختبر 10 <سوب>، 11 . أوغد في أسف يحاكي نقص التروية الدماغية ويحفز إصابة الدماغية 12 ، 13 ، 14 . بعد أوغد، يتم تحديث شرائح الدماغ في أسف العادية (r-أسف) لتوفير ضخه ثم يعالج مع أبك باستخدام أسف الحمضية فقاعات مع 20٪ كو 2 . شريحة القشرية يحافظ على توصيف النسيجية سليمة مقارنة مع الخلايا المستزرعة الأولية.
لدراسة وظيفة الدماغ في الجسم الحي ، يتم استخدام الماوس الماوس انسداد الشريان الدماغي (مساو) نموذج. يتم حظر الشريان الدماغي الأوسط عن طريق إدخال حيدة مثبطة للهب عن طريق الشريان السباتي المشترك. باعتبارها واحدة من نماذج السكتة الدماغية الأكثر استخداما على نطاق واسع، يظهر نموذج مساو أهمية السريرية وتطبيق حيدة يجعل من الاسهل لتحقيق ضخه. ببساطة عن طريق استنشاق الغاز المختلط نورموكسيك تحتوي على 20٪ كو 2 بعد ظهور ريبيرفوسيوn، أظهرت أبك آثار وقائية كبيرة ضد نقص التروية الدماغية التي أشار إليها انخفاض أحجام الدماغ احتشاء.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
تمت الموافقة على جميع التجارب من قبل وأجريت وفقا للمبادئ التوجيهية الأخلاقية للجنة تشجيانغ تجريب الحيوان جامعة وكانت في الامتثال الكامل للمعاهد الوطنية للدليل الصحة لرعاية واستخدام الحيوانات المختبرية. وقد بذلت جهود للتقليل إلى أدنى حد من أي ألم أو إزعاج، واستخدم الحد الأدنى لعدد الحيوانات.
1. أوغد من شرائح القشرية
- إعداد الحل:
- إعداد 1000 مل R-أسف (124 مليمول / لتر، كلوريد الصوديوم، 5 مليمول / لتر بوكل، 1.25 مليمول / لتر خ 2 بو 4 ، 2 مليمول / L مغسو 4 ، 26 مليمول / لتر نهكو 3 ، 2 مليمول / لتر كلوريد 2 ، 10 مليمول / لتر الجلوكوز، ودرجة الحموضة النهائية 7.4). فقاعة مع 5٪ كو 2 و 95٪ O 2 طوال التجربة.
- إعداد 200 مل خالية من الجلوكوز أسف (غف-أسف) على النحو الوارد أعلاه ولكن باستثناء الجلوكوز، فقاعات مع 5٪ كو 2 و 95٪ N 2 . فقاعة الغازات لمدة 30 دقيقة قبل تطبيق ل برشرائح العين لتقليل محتوى الأكسجين في الحل. متابعة محتدما حتى يتم الانتهاء من إجراء أوغد.
- إعداد أسف الحمضية (أ-أسف) عن طريق موازنة 200 مل R-أسف مع 20٪ كو 2 و 80٪ O 2 . فقاعة الغازات لمدة 30 دقيقة قبل تطبيقها على شرائح الدماغ للحد من درجة الحموضة من الحل لدرجة الحموضة 6.8، ومواصلة محتدما حتى الانتهاء من إجراء أبك.
- وضع ثلاثة أصحاب الأنسجة في r-أسف، غف-أسف، و أسف، على التوالي.
- إعداد شريحة الدماغ:
ملاحظة: تم استخدام الفئران C57Bl / 6J الذكور من العمر 8 أسابيع، في هذه الدراسة. وكانت هذه الحيوانات تحت درجة حرارة محكومة (22 ± 2 درجة مئوية)، مع 12 ساعة ضوء دورة مظلمة والدخول إلى الغذاء والماء مكعبات.- التضحية فأر مع جرعة زائدة إيسوفلوران في غرفة الاستقراء. قطع رأس الماوس. تشريح خارج الدماغ باستخدام مقص صغير وملقط. إزالة الدماغ مع ملعقة رقيقة وإسقاطه بعناية في كوب الزجاج يخدعتاينينغ الجليد الباردة r-أسف معايرة مع 5٪ كو 2 و 95٪ O 2 .
ملاحظة: يجب أن يتم هذا الخطوات بسرعة ولكن بدقة ممكن. - الحفاظ على الدماغ في الجليد الباردة r-أسف لمدة 5 دقائق. ضبط ضغط الغاز لتجنب تحركات الدماغ.
- وضع الغراء كريوبريسيبيتات على لوحة فيبراتوم في شرائط اثنين. وضع قطعة من الاغاروز 3٪ على قطاع الغراء بعيدا عن شفرة لدعم الدماغ.
- عكس طبق بتري 10 سم على الجليد ثم وضع ورقة الترشيح على الطبق. رطوبة ورق الترشيح بقطرات من أسف الباردة r-أسف.
- نقل الدماغ إلى ورقة الترشيح مع ملقط. قطع القطب الأمامي والمخيخ مع شفرة وملقط.
ملاحظة: يجب أن تكون أقسام عرضية على نحو سلس قدر الإمكان والرأسي إلى الطائرة السهمي. - وضع أنسجة المخ المتبقية عموديا على الشريط الآخر من الغراء والحفاظ على الدماغ يميل ضد الاغاروز. إضافة الثلج الباردة r-أسف إلى خزان القطع لغمر الدماغ وإضافة الجليد إلى منطقة حامل الجليد. الحفاظ على أسف r في الخزان فقاعات مع 5٪ كو 2 و 95٪ O 2 .
- رفع الخزان وضبط الموقف من الحلاقة لوضع الحلاقة أقرب إلى الدماغ ممكن وفقط فوق الدماغ.
- اختيار وضع "كونت" لشريحة أقسام الدماغ بشكل مستمر. تعيين سمك القطع إلى 400 ميكرون، وتهتز التردد إلى 6 - 8، والسرعة إلى 3 - 4. اضغط على زر "بدء / إيقاف" لبدء القطع التلقائي.
- قطع غيض من 3 مل باستور ماصة لجعل افتتاح مطابقة حجم شرائح الدماغ.
ملاحظة: يجب أن يكون الافتتاح كبيرا بما يكفي لتجنب الأضرار الإضافية لشرائح الدماغ. - رسم خمسة شرائح الدماغ واحدا تلو الآخر مع ماصة كوتباستور طرف ووضعها في حامل الأنسجة في الجليد الباردة R-أسف فقاعات مع 5٪ كو 2 و 95٪ O 2 . لا تجمع الشريحة الأولى المنتجة. ضبط ضغط الغاز ل أفوايد تحركات شرائح الدماغ.
ملاحظة: شرائح الدماغ يجب أن لا تغطي بعضها البعض. - وضع شرائح الدماغ مع r-أسف في درجة حرارة الغرفة لمدة 30 دقيقة ثم عند 37 درجة مئوية في حمام مائي لمدة 10 دقيقة أخرى لاسترداد وظائف متشابك.
- التضحية فأر مع جرعة زائدة إيسوفلوران في غرفة الاستقراء. قطع رأس الماوس. تشريح خارج الدماغ باستخدام مقص صغير وملقط. إزالة الدماغ مع ملعقة رقيقة وإسقاطه بعناية في كوب الزجاج يخدعتاينينغ الجليد الباردة r-أسف معايرة مع 5٪ كو 2 و 95٪ O 2 .
- أوغد و أبك:
- وضع غف-أسف و أسف في حمام مائي 37 درجة مئوية، فقاعة المخازن المؤقتة مع الغازات المقابلة كما ذكر أعلاه في 1.1.2 و 1.1.3 لمدة 30 دقيقة.
- ترك شريحة واحدة في r-أسف كعنصر تحكم. نقل شرائح الدماغ الأربعة الأخرى في حامل الأنسجة مع مسخن غف-أسف بعناية واحتضان لمدة 15 دقيقة. نقل الشرائح مرة أخرى إلى حامل الأنسجة في R-أسف لتحقيق ضخه.
- لدراسة نافذة الوقت من أبك، نقل شريحة واحدة مباشرة من غف-أسف إلى أسف. نقل الشرائح الثلاث الأخرى إلى r-أسف في البداية، ومن ثم نقل اثنين منهم إلى حامل الأنسجة في أسف 5 و 15 دقيقة بعد ضخه على التوالي.
- Incubatه الشريحتين في أسف لمدة 3 دقائق ثم نقلها مرة أخرى إلى r-أسف. احتضان ثلاث شرائح في r-أسف لمدة 1 ساعة أخرى. تعيين شرائح المتبقية في أسف r كما مجموعة أوغد.
- لدراسة الاستجابة للجرعة، ونقل جميع شرائح أربعة إلى حامل الأنسجة في R-أسف في البداية بعد أوغد واحتضان لمدة 5 دقائق. ثم ترك شريحة واحدة في r-أسف كما مجموعة أوغد ونقل الشرائح الثلاث الأخرى إلى أسف. احتضان شرائح في أسف لمدة 1 و 3 و 5 دقائق على التوالي ثم نقلها مرة أخرى إلى r-أسف. احتضان ثلاث شرائح في r-أسف لمدة 1 ساعة أخرى.
- تحديد شريحة البقاء:
- إعداد 0.25٪ 2،3،5-تريفنيلتترازوليوم هيدروكلوريد (تك) محلول ملحي عادي. إضافة 1.25 غرام مسحوق تك إلى 500 مل محلول ملحي عادي.
ملاحظة: بعد مسحوق يذوب تماما، ونقل الحل إلى لوحة 24 جيدا (500 ميكرولتر لكل بئر) مغطاة في احباط وتخزينه في 4 درجات مئوية. تك والأنسجة الملطخة تك هي ضوء سينsitive. - نقل شرائح في لوحة 24 جيدا (شريحة واحدة لكل بئر) التي تحتوي على حل تك وتمتد من شريحة في الحل. احتضان شرائح في حل تك عند 37 درجة مئوية في حمام المياه الضحلة لمدة 30 دقيقة.
- نقل شرائح في أنابيب الطرد المركزي 1.5 مل نظيفة مغطاة في احباط وقياس الوزن الجاف للشرائح.
- إضافة إيثانول / ثنائي ميثيل سلفوكسيد (1: 1) في أنابيب الطرد المركزي (الخامس: ث = 10: 1) لاستخراج فورمازان. احتضان شرائح في الإيثانول / ثنائي ميثيل سلفوكسيد في درجة حرارة الغرفة بعيدا عن الضوء لمدة 24 ساعة.
- إضافة كل الإيثانول / ثنائي ميثيل سلفوكسيد في الأنابيب إلى لوحة 96 جيدا وقياس الامتصاصية في 490 نانومتر من قبل قارئ لوحة.
- تطبيع الامتصاصية إلى الوزن الجاف للشريحة والتعبير عن قابليته كنسبة مئوية من شريحة التحكم.
- إعداد 0.25٪ 2،3،5-تريفنيلتترازوليوم هيدروكلوريد (تك) محلول ملحي عادي. إضافة 1.25 غرام مسحوق تك إلى 500 مل محلول ملحي عادي.
2. مساو
- تجهيز:
- تطهير منضدة العمل، سطح دوبلر الليزر فلوميترص (لدف) الصك وملحقاته مع الكحول الإيثيلي 70٪.
- إعداد الصكوك تعقيمها: مقص اثنين، 10 سم؛ ملقطين، 10 سم؛ واحد ملقط العيون، 11 سم؛ واحد مقص العيون الصغيرة، 9 سم. واحد ميكروفسل المشبك، 1.8 سم؛ محرك أونينيدل، r 12.5 سم؛ عدة خيوط جراحية (△ 1/2 4 × 10)؛ مسحات قطنية.
- إعداد حقنة (بدون إبرة) مع محلول ملحي للحفاظ على منطقة عملية رطب.
- إعداد غاز التخدير (100٪ O 2 + إيسوفلوران).
- الكشف عن تدفق الدم في المخ:
- قم بإعداد أداة لدف.
- حقن المسكنات داخل الصفاق في الماوس: ميتاميزول 200 ملغ / كغ، كاربروفين 4 ملغ / كغ والبوبرينورفين 0.1 ملغ / كغ.
- ضع الماوس في غرفة الاستقراء مع 4٪ إيسوفلوران في الأكسجين لتخدير ذلك حتى حركة عفوية من الجسم و فيبريساي يتوقف.
- ضع الماوس في وضعية عرضية مع الأنف تركيبها في ثه مخروط الأنف والحفاظ على إيسوفلوران في 1.5٪ لإجراء لاحق.
- تطبيق مرهم العين ديكسبانتينول على كلا العينين.
- تطهير الرأس مع الكحول الإيثيلي 70٪.
- جعل الحق شق الجلد المسعف بين العينين والأذنين باستخدام مشرط لفضح بريجما.
- فرك الجمجمة مع القطن المعقم.
- تطبيق واحد أو اثنين من قطرات من الغراء الجراحي على سطح الجمجمة.
- وضع غيض من الألياف البصرية التحقيق 5 مم الذيلية إلى بريجما و 6 ملم الوحشي إلى خط الوسط.
- بدء تسجيل تدفق الدم على برامج الكمبيوتر. انتظر حتى يحدث خط أساس تدفق الدم مستقرة ومن ثم تطبيق حفاز 20 ميكرولتر على الغراء لإصلاح التحقيق.
ملاحظة: يجب أن يكون خط الأساس المثالي أكثر من 500 تدفق. - إذا كان خط الأساس أقل من 200 تدفق، ضبط الموقف ناعما للحصول على خط الأساس مناسبة. إبقاء التحقيق تعلق على الجمجمة لمدة التجربة.
- تطهير الرأس مع يودوفور أفتر الألياف البصرية التحقيق المرفقة.
- MCAO:
- مكان وإصلاح الماوس تخدير (مع لدف التحقيق تعلق على الجمجمة) في موقف ضعيف والحفاظ على درجة حرارة الجسم باستخدام مصباح الحرارة في جميع أنحاء الجراحة. تطهير الرقبة مع الكحول الإيثيلي 70٪.
- جعل شق الجلد مسعف في الرقبة باستخدام مشرط. حادة تشريح الأنسجة الرخوة مع ملقط لفضح السفن. إضافة قطرة واحدة من المياه المالحة إلى الأنسجة المكشوفة للحفاظ على هيميدراتد.
- تشريح الشريان السباتي المشترك من الأنسجة المحيطة والعصب المبهم باستخدام ملقط العيون. يجب الحرص على عدم إلحاق الضرر العصب المبهم. تطهير الجلد من الرقبة مرة أخرى مع يودوفور بعد الشريان السباتي المشترك يتعرض.
- وضع المشبك ميكروفيسل في نهاية البعيدة من الشريان السباتي المشترك ومن ثم ربط عقدة ميتة مع خيوط الحرير 6-0 في نهاية القريبة. وضع المشبك أقرب الداني لعمليات لاحقة. تأكد من أن طولتكون السفينة بين المشبك والعقدة الميتة أطول فترة ممكنة للعمليات اللاحقة.
- جعل الدرز خياطة مؤقتة إلى المشبك عن طريق ربط عقدة فضفاضة. تأكد من وجود مساحة كافية بين عقدتين لإدخال حيدة.
- جعل شق سمالونجيتودينال بين العقدتين مع مقص العيون الصغيرة. ضمان شق أقرب إلى عقدة ميتة ممكن لعمليات لاحقة. يجب الحرص على عدم قطع السفينة.
- إدراج 12 ملم غيض مونوفيلامنثثيد طرف شق لدخول التجويف الشريان وتقدمه بضعة ملم. تشديد عقدة فضفاضة حول غيض من حيدة ومن ثم إزالة المشبك.
- دفع خيوط في الشريان السباتي الداخلي (10 ملم إلى انسداد الشريان الدماغي الأوسط) مع ملقط العين حتى يظهر البرنامج لدف انخفاضا حادا (> تخفيض 80٪ من تدفق الدم الأساسي) في تدفق الدم. تسجيل وقت بدء الانسداد.
ملاحظة: إعداد أداة لدف هوالموصوفة في القسم 2.2. - تطويق الشريان الدماغي الأوسط لمدة 1 ساعة. قطع التحقيق لدف ووضع الفئران في حاضنة 30 درجة مئوية لمدة الانسداد.
- ريبيرفوسيون و أبك:
- إعادة تخدير الحيوانات مع إيسوفلوران كما هو موضح أعلاه 55 دقيقة بعد وقت بداية الانسداد. مكان وإصلاح الفئران في موقف ضعيف. فتح شق الرقبة وإعادة فضح الشريان السباتي المشترك.
- سحب بلطف خيوط مع ملقط العيون بعد فترة انسداد لتحقيق ضخه وتحويل خياطة مؤقتة إلى واحدة دائمة عن طريق تشديد عقدة.
- لعلاج الحماض، تغيير الغاز استنشق بواسطة مخروط الأنف إلى غازات مزيج تحتوي على 20٪ كو 2 ، 20٪ O 2 و 60٪ N 2 لمدة 5 دقائق في 5 أو 50 أو 100 دقيقة بعد ضخه. إغلاق شق مع خياطة الجراحية توقف.
- وضع الفئران في قفص الحرارة 30 درجة مئوية حتى الفئران استعادة وعيهومن ثم العودة الفئران لتنظيف، أقفاص الفردية. توفير الفئران مع طبق بتري من الماء والأطعمة المبللة. مراقبة الفئران عن كثب بعد الجراحة المفرطة الألم والموت.
- الدماغ حجم قياس احتشاء:
- قياس حجم احتشاء الدماغ باستخدام تلطيخ تلطيخ 24 ساعة بعد ضخه.
- إعداد حل 0.25٪ تك كما هو مذكور في الخطوة 1.4.1 قبل الوقت المعين من التضحية. نقل الحل إلى لوحة 24 جيدا (1 مل لكل بئر) مغطاة في احباط وتخزينه في 4 درجات مئوية.
ملاحظة: تك والأنسجة ملطخة تك هي حساسة للضوء. - في 24 ساعة بعد ضخه، والتضحية الحيوان مع جرعة زائدة إيسوفلوران في غرفة الاستقراء. قطع رأس الفئران. تشريح خارج العقول باستخدام مقص صغير والملقط. فحص نقاط الدم على العقول لاستبعاد الفئران التي خضعت للنزف تحت العنكبوتية في دائرة ويليس.
- وضع الدماغ على شريحة زجاجية نظيفة على -20 درجة ؛ C حزمة الجليد. وضع الدماغ والشريحة الزجاجية في الثلاجة -20 درجة مئوية لمدة 5 دقائق لجعل الدماغ أسهل لشريحة.
- إخراج الدماغ والشريحة الزجاجية من -20 درجة مئوية ووضعها مرة أخرى على -20 درجة مئوية الجليد حزمة. تشريح القطب الأمامي والمخيخ مع شفرة وملقط.
- شريحة أقسام الدماغ أفقيا لسمك 1 ملم مع شفرة لإنتاج 5 شرائح. نقل شرائح في لوحة 24-جيدا تحتوي على حل تك (1 شريحة لكل بئر) مع ملقط وتمتد من شرائح في الحل. احتضان شرائح في حل تك عند 37 درجة مئوية في حمام المياه الضحلة لمدة 30 دقيقة.
- نضح حل تك. إضافة 10٪ الفورمالديهايد (1 مل لكل بئر) واحتضان في درجة حرارة الغرفة لمدة 30 دقيقة. وضع شرائح في الترتيب الذي تم قطع على ورقة السيلوفان ومسح شرائح في تصوير لوحة التصوير الفوتوغرافي.
- تحليل حجم احتشاء كنسبة مئوية من شريحة الدماغ كله باستخدام برنامج تحليل إيماجيجلاس = "كريف"> 8 استنادا إلى التعريف البصري؛ انظر الشكل 2 (يسار).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
في نموذج شريحة القشرية الموصوفة أعلاه، تم قياس كميا بقاء شريحة القشرية بواسطة مقايسة تك في 1 ساعة بعد ضخه. وتحسب تحويل تك عن طريق تطبيع الامتصاص في 490 نانومتر إلى شريحة التحكم. وفقا لتحويل تك، أبك محمية ضد أوغد الناجم عن ضخه ضرر في وقت بداية وطريقة تعتمد على مدة. في التفاصيل، على حد سواء 1 و 3 دقيقة من العلاج الحماض تحسن كبير في البقاء على قيد الحياة في 5 دقائق بعد 15 دقيقة أوغد، في حين لم 5 دقائق لا (أوغد: 0.609 ± 0.029، 5/1: 0.758 ± 0.034، 5/3: 0.821 ± 0.041، 5/5: 0.672 ± 0.053، البيانات المبلغ عنها كمتوسط ± سيم) ( الشكل 1 أ ). بقي الحماض العصبي عن طريق العلاج الحماض واقية في غضون 5 دقائق بعد ضخه، في حين أن 15 دقيقة لم (أوغد: 0.584 ± 0.044، 0/3: 0.762 ± 0.036، 5/3: 0.833 ± 0.062، 15/3: 0.627 ± 0.038) شكل 1 g> B ).
في نموذج مساو، 5 دقائق من العلاج الحماض التي بدأت في 5 دقائق بعد ظهور ضخه الموت إنقاذ الخلايا الناجمة عن إهانة الدماغية، التي تعكسها أحجام أصغر احتشاء (مساو: 33.4 ± 4.4٪، 5/5: 16.6 ± 2.7٪، 50 / 5: 19.5 ± 2.1٪، 100/5: 37 ± 2.1٪). كانت الحماية العصبية لا تزال قوية، حتى عندما تأخر وقت البدء إلى 50 دقيقة بعد ضخه. ومع ذلك، والعلاج الحماض بدأ في 100 دقيقة لم يمنع إصابات الدماغية ( الشكل 2 ).
تم جمع جميع البيانات وتحليلها بطريقة أعمى. يتم عرض البيانات كمتوسط ± سيم. في نموذج شريحة القشرية، كل مجموعة لديها 6-8 عينات. في نموذج مساو، كل مجموعة لديها 9-10 عينات. تم تطبيق تحليل التباين الأحادي مع الاختلاف الأقل أهمية في المقارنات المتعددة.
-together.within الصفحات = "1"> 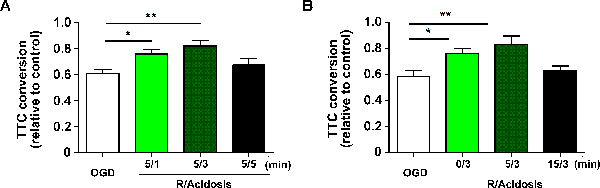
الشكل 1 . أبك يحمي ضد أوغد الناجم عن ضخه إصابة في شرائح القشرية. تم التعامل مع الشرائح القشرية مع الحماض (الرقم الهيدروجيني 6.8) للمدد المشار إليها (A) ومدد فترات الاستشفاء (B) بعد أوغد. تم تقييم بقاء الخلية من قبل 3- [4،5-ثنائي ميثيل ثيازول -2- يل] -2،5-ثنائي فينيلترازوليوم بروميد مقايسة في 24 ساعة بعد ضخه، وقياس بقاء القشرية القشرية كميا بواسطة مقايسة تك في 1 ساعة بعد ضخه. القيم تظهر يعني ± سيم. ن = 6 - 8 لكل مجموعة؛ * p <0.05 و ** p <0.01 بتحليل التباين أحادي الاتجاه؛ R، ضخه. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 2 . أبك يحمي ضد إصابة الناجمة عن تساو في الفئران. تعرضت الحيوانات إلى 60 دقيقة مساو وعولج عن طريق استنشاق 20٪ CO2 لمدة 5 دقائق في 5، 50، أو 100 دقيقة بعد ضخه. تم قياس حجم احتشاء من قبل 2،3،5-تريفنيلترازوليوم تلطيخ هيدروكلوريد في 24 ساعة بعد ضخه (المشار إليها بخط أسود منقط على اللوحة اليسرى). القيم تظهر يعني ± سيم. n = 8 - 10 لكل مجموعة؛ * p <0.05 و ** p <0.01 بتحليل التباين أحادي الاتجاه؛ R، ضخه. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
هنا نقدم نموذجين التجريبية لدراسة الحماية العصبية من أبك ضد نقص التروية الدماغية. في شرائح الدماغ، ويتحقق أبك من خلال احتضان شرائح الفئران القشرية في الحامض العازلة فقاعات مع 20٪ كو 2 بعد بداية ضخه، بينما في نموذج مساو، ويتحقق أبك عن طريق استنشاق 20٪ كو 2 إلى الفئران بعد ضخه. كلا النموذجين يعكس الحماية العصبية من أبك ضد نقص التروية الدماغية. وكانت الحماية مماثلة لتلك التي تحققت من قبل تكييف نقص تروية ولكن مع نافذة زمنية أوسع. في نموذج مساو، يمكن أن تكون نافذة الوقت ما دام 50 دقيقة بعد ضخه مقارنة مع 10 دقيقة عن نقص تروية الدماغية 15 . وبالإضافة إلى ذلك، فإن إجراءات أبك أسهل وأكثر أمنا.
في نموذج الشرائح القشرية، العمليات اللطيفة والسريعة حاسمة لضمان بقاء شرائح الدماغ إلى أقصى حد. لأداء مكاو، ومراقبة تدفق الدم في الدماغ هوالمطلوبة، ويجب ملاحظة الانخفاض الحاد في تدفق الدم لضمان انسداد الشريان الدماغي الأوسط. بعد تشريح العقول خارج ل تلطيخ تك، دراسة متأنية من العقول ضروري لاستبعاد نزيف تحت العنكبوتية.
تمديد ومدة الحماض حاسمة لتحقيق الحماية العصبية من أبك. مدة طويلة من العلاج الحماض ليست مفيدة في الشرائح القشرية نموذج ( الشكل 1 A ). وبالإضافة إلى ذلك، أظهرت دراستنا السابقة أن كلا 10٪ و 20٪ كو 2 استنشاق، بدلا من 30٪ كو 2 استنشاق تمنح الحماية العصبية على الفئران 8 . هذه تشير إلى الحماض الخفيف أمر بالغ الأهمية لالعصبية من أبك، وبالتالي تركيز كو 2 ومدة أبك لا غنى عنها للحماض العصبي.
بالإضافة إلى تلطيخ تك، يمكن الجمع بين العديد من التقنيات ل sأتيسفي الاحتياجات البحثية المتنوعة. على سبيل المثال، يمكن إضافة تسجيل كهربائي خارج الخلوية إلى الخطوة النهائية لمراقبة كيف نقص التروية والحماض تؤثر على القدرة العصبية 16 . ويمكن أيضا أن يتم جمع حل نضح شريحة الدماغ لقياس تركيز تغيير الناقلات العصبية الأحماض الأمينية بعد أبك من قبل هبلك 17 . شرائح من مناطق معينة في الدماغ يمكن أن تكون مستعدة لدراسة ردود منطقة معينة لنقص التروية و أبك. عموما، يمكن إدخال العديد من البدائل لإلقاء الضوء على آثار نقص التروية والحماض.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgments
وقد تم تمويل هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (81573406، 81373393، 81273506، 81221003، 81473186 و 81402907)، ومقاطعة تشجيانغ مؤسسة العلوم الطبيعية (LR15H310001) وبرنامج لفريق تشجيانغ الرائدة لفريق الابتكار والتكنولوجيا T (2011R50014).
Materials
| Name | Company | Catalog Number | Comments |
| Sodium chloride | Sigma | S5886 | |
| Potassium chloride | Sigma | P5405 | |
| Potassium phosphate monobasic | Sigma | P9791 | |
| Magnesium sulfate | Sigma | M2643 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Calcium chloride dihydrate | Sigma | C5080 | |
| D-(+)-Glucose | Sigma | G7021 | |
| Vibratome | Leica | VT1000 S | |
| 2,3,5-triphenyltetrazolium hydrochloride | Sigma | T8877 | |
| Absolute Ethanol | Aladdin Industrial Corporation | E111993 | |
| Dimethyl sulfoxide | Sigma | D8418 | |
| Laser Doppler Flowmetry | Moor Instruments Ltd | Model Moor VMS-LDF2 | |
| Diethyl ether anhydrous | Sinopharm Chemical Reagent Corporation | 80059618 | |
| Trichloroacetaldehycle hydrate | Sinopharm Chemical Reagent Corporation | 30037517 | |
| 10% Formalin | Aladdin Industrial Corporation | F111936 | |
| 24-well plates | Jet Biofil | TCP-010-024 |
References
- Zhao, H., Sapolsky, R. M., Steinberg, G. K. Interrupting reperfusion as a stroke therapy: ischemic postconditioning reduces infarct size after focal ischemia in rats. J Cereb Blood Flow Metab. 26 (9), 1114-1121 (2006).
- Leconte, C., et al. Delayed hypoxic postconditioning protects against cerebral ischemia in the mouse. Stroke. 40 (10), 3349-3355 (2009).
- Fan, Y. Y., et al. Transient lack of glucose but not O2 is involved in ischemic postconditioning-induced neuroprotection. CNS Neurosci Ther. 19 (1), 30-37 (2013).
- Hess, D. C., Hoda, M. N., Bhatia, K. Remote limb perconditioning [corrected] and postconditioning: will it translate into a promising treatment for acute stroke. Stroke. 44 (4), 1191-1197 (2013).
- Ren, C., Yan, Z., Wei, D., Gao, X., Chen, X., Zhao, H. Limb remote ischemic postconditioning protects against focal ischemia in rats. Brain Res. 1288, 88-94 (2009).
- Sun, J., et al. Protective effect of delayed remote limb ischemic postconditioning: role of mitochondrial K(ATP) channels in a rat model of focal cerebral ischemic reperfusion injury. J Cereb Blood Flow Metab. 32 (5), 851-859 (2012).
- Li, P., et al. Remote limb ischemic postconditioning protects mouse brain against cerebral ischemia/reperfusion injury via upregulating expression of Nrf2, HO-1 and NQO-1 in mice. Int J Neurosci. , 1-8 (2015).
- Fan, Y. Y., et al. A novel neuroprotective strategy for ischemic stroke: transient mild acidosis treatment by CO2 inhalation at reperfusion. J Cereb Blood Flow Metab. 34 (2), 275-283 (2014).
- Shen, Z., et al. PARK2-dependent mitophagy induced by acidic postconditioning protects against focal cerebral ischemia and extends the reperfusion window. Autophagy. 0, (2017).
- Skolnik, J., Takacs, L., Szende, E. In vitro oxygen consumption of slices from kidney, brain, cortex and liver in hypoxia. Nature. 209 (5020), 305 (1966).
- Lynch, G., Schubert, P. The use of in vitro. brain slices for multidisciplinary studies of synaptic function. Annu Rev Neurosci. 3, 1-22 (1980).
- Zheng, S., Zuo, Z. Isoflurane preconditioning reduces purkinje cell death in an in vitro model of rat cerebellar ischemia. Neuroscience. 118 (1), 99-106 (2003).
- Yin, B., Barrionuevo, G., Weber, S. G. Optimized real-time monitoring of glutathione redox status in single pyramidal neurons in organotypic hippocampal slices during oxygen-glucose deprivation and reperfusion. ACS Chem Neurosci. 6 (11), 1838-1848 (2015).
- Medvedeva, Y. V., Ji, S., Yin, H. Z., Weiss, J. H. Differential vulnerability of CA1 vs CA3 pyramidal neurons after ischemia: possible relationship to sources of Zn2+ accumulation and its entry into and prolonged effects on mitochondria. J Neurosci. , (2016).
- Pignataro, G., et al. In vivo and in vitro characterization of a novel neuroprotective strategy for stroke: ischemic postconditioning. J Cereb Blood Flow Metab. 28 (2), 232-241 (2008).
- Zhang, X., Ding, H. Z., Jiang, S., Zeng, Y. M., Tang, Q. F. An in vitro study of the neuroprotective effect of propofol on hypoxic hippocampal slice. Brain Inj. 28 (13-14), 1758-1765 (2014).
- Niu, Y., et al. Chemical profiling with HPLC-FTMS of exogenous and endogenous chemicals susceptible to the administration of chotosan in an animal model of type 2 diabetes-induced dementia. J Pharm Biomed Anal. 104, 21-30 (2015).



