Summary
Accic postconditioning מגן מפני איסכמיה מוחית. כאן אנו מציגים שני מודלים לביצוע APC. הם מושגים בהתאמה על ידי העברת פרוסות corticostriatal למאגר חומצי לאחר מחסור בגלוקוז חמצן במבחנה ועל ידי שאיפה 20% CO 2 לאחר חסימת עורק המוח התיכון in vivo .
Abstract
שבץ הוא אחד הגורמים המובילים לתמותה ולמוגבלות ברחבי העולם, עם גישות טיפוליות מוגבלות. כאסטרטגיה אנדוגנית עבור neuroprotection, טיפולים postconditioning הוכיחו להיות טיפולים מבטיחים נגד איסכמיה מוחית. עם זאת, נהלים מורכבים ובעיות בטיחות פוטנציאליות להגביל את היישום הקליני שלהם. כדי להתגבר על החסרונות הללו, פיתחנו חומצה postconditioning (APC) כטיפול לאיסכמיה מוחית ניסויית ניסויית. APC מתייחס לטיפול acidosis מתון על ידי שאיפה CO 2 במהלך reperfusion בעקבות איסכמיה. כאן אנו מציגים שני מודלים לבצע APC במבחנה in vivo , בהתאמה. מחסור בגלוקוז חמצן (OGD) טיפול בעכברים ואת חסימת corticostriatal ואת חסימת עורק המוח התיכון (MCAO) של עכברים הועסקו לחקות איסכמיה מוחית. APC יכול להיות מושגת רק על ידי העברת פרוסות מוח חיץ חומצי מבעבע עם 20% CO 2, oR על ידי עכברים inhaling 20% CO 2 . APC הראה השפעות הגנה משמעותיות נגד איסכמיה מוחית, כפי שמשתקף על ידי הכדאיות רקמות נפח המוח באוטם.
Introduction
שבץ הוא אחד הגורמים המובילים לתמותה ולנכות ברחבי העולם. מאמצים רבים נעשו כדי למצוא טיפולים יעילים לשבץ בעשורים האחרונים, עם זאת, ההישג הוא די משביע רצון. התנאי הוא תהליך המניפולטיבי על ידי דחקים מתוחים בעקבות אפיזודה איסכמית. בנוסף, כולל איסכמי, היפוקסי, גלוקוז נמוך, postconditioning איסכמי מרחוק, המנגנונים אנדוגניים אדפטיבית להפעיל, הוכחו להיות טיפולים מבטיחים נגד איסכמיה מוחית 1 , 2 , 3 , 4 . עם זאת, postconditioning איסכמי עלול להציג פגיעה נוספת. אימבסיס מרחוק איסכמי postconditioning בדרך כלל צריך כמה מחזורים של 5-20 דקות חסימה reperfusion על אימפיטלי ips צדדית או דו צדדית 5 , 6 , 7 . תלכן, המניפולציות האלה שלאחר המוות הן מסוכנות או לא מעשיות בתרגול הקליני. כדי להתגבר על החסרונות הללו, פיתחנו APC כטיפול לאיסכמיה מוחית מוקדמת בעכברים 8 . המושרה פשוט על ידי שאיפת 20% CO 2 , APC מפחית באופן משמעותי את פגיעה מוחית איסכמית בצורה בריאה יותר ובטוחה יותר. לאחרונה הוכחנו כי APC מרחיב את חלון reperfusion, המדגיש את המשמעות של APC לטיפול שבץ 9 .
כאן אנו מציגים שני מודלים ניסיוניים כדי לחקור את neuroprotection של APC נגד איסכמיה מוחית. הראשון הוא מחסור בגלוקוז חמצן (OGD) מודל פרוסות corticostriatal עכברים. הכנה מהירה והעברה של פרוסות המוח לסביבה מלאכותית, בדרך כלל נוזל מוחי מלאכותי (ASCF), יכולים לשמור על כדאיות התא ומעגלים נוירונים, המאפשרים ללמוד תפקוד מוחי במבחנה 10 <Sup>, 11 . OGD ב ASCF מחקה איסכמיה מוחית וגורמת פגיעה איסכמית 12 , 13 , 14 . לאחר OGD, פרוסות המוח מתרעננות באופן קבוע ASCF (r-ASCF) כדי לספק reperfusion ולאחר מכן מטופלים עם APC באמצעות ASCF חומצי מבעבע עם 20% CO 2 . פרוסת corticostriatal שומרת על אפיון היסטולוגית שלם לעומת תאים מתורבת העיקרי.
כדי לחקור את תפקוד המוח in vivo , עכבר באמצע מוחי חסימה עורק (MCAO) המודל מועסק. העורק המוחי האמצעי נחסם על ידי החדרת מונופילמנט להבה- blunted דרך עורק הצוואר המשותף. בתור אחד המודולים שבץ הנפוץ ביותר, מודל MCAO מראה הרלוונטיות הקלינית ואת היישום של monofilament מקל יותר להשיג reperfusion. פשוט על ידי שאיפת גז מעורבים normoxic המכיל 20% CO 2 לאחר הופעת reperfusioN, APC הראו השפעות הגנה משמעותיות נגד איסכמיה מוחית המצוינת על ידי נפח מופחת של המוח.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
כל הניסויים אושרו על ידי ונערכו בהתאם לקווים המנחים האתיים של ועדת הניסוי של אוניברסיטת ג'ה-ג'יאנג, ועמדו בהתאמה מלאה עם המכונים הלאומיים לבריאות הציבור לטיפול ולשימוש בחיות מעבדה. נעשו מאמצים כדי למזער כל כאב או אי-נוחות, והשתמש במספר המינימלי של בעלי-חיים.
1. OGD של פרוסות Corticostriatal
- הכנת פתרונות:
- הכנת 1,000 מ"ל / L, NaCl, 5 mmol / L KCl, 1.25 mmol / L KH 2 PO 4 , 2 mmol / L MgSO 4 , 26 mmol / L NaHCO 3 , 2 mmol / L CaCl 2 , 10 mmol / L גלוקוז, pH הסופי 7.4). בועה עם 5% CO 2 ו 95% O 2 לאורך הניסוי.
- הכן 200 מ"ל ללא גלוקוז ACSF חינם (GF-ACSF) כאמור לעיל, למעט גלוקוז, מבעבע עם 5% CO 2 ו 95% N 2 . הבועה גזים במשך 30 דקות לפני החלת ברAin פרוסות כדי להפחית את תכולת החמצן בפתרון. המשך מבעבע עד להשלמת ההליך OGD.
- הכן ACSF חומצי (A-ACSF) על ידי equilibrating 200 מ"ל R-ACSF עם 20% CO 2 ו 80% O 2 . הבועה גזים במשך 30 דקות לפני החלת פרוסות המוח כדי להפחית את ה- pH של הפתרון pH 6.8, ולהמשיך מבעבע עד הליך APC הוא סיים.
- מקום שלושה מחזיקי רקמות לתוך R-ACSF, GF-ACSF, A-ACSF, בהתאמה.
- הכנת פרוסת המוח:
הערה: בן 8 שבועות, זכר C57Bl / 6J עכברים שימשו במחקר זה. החיות שוכנו בטמפרטורה מבוקרת (22 ± 2 מעלות צלזיוס), עם מחזור 12 שעות אור כהה מחזור וגישה מזון ומים pelleted.- להקריב עכבר עם מנת יתר של isoflurane בתא אינדוקציה. לערוף את העכבר. לנתח את המוח באמצעות מספריים קטנים מלקחיים. הסר את המוח עם מרית דקה ושחרר אותו בזהירות לתוך כוס כוס ייןקשירת קר כקרח R-ACSF equilibrated עם 5% CO 2 ו 95% O 2 .
הערה: יש לבצע את הפעולות הבאות במהירות ובקלות רבה ככל האפשר. - שמור את המוח ב- R-ACSF קר כקרח במשך 5 דקות. התאם את לחץ הגז כדי למנוע תנועות של המוח.
- המקום cryoprecipitate דבק על צלחת vibratome בשני רצועות. שים פיסת agarose 3% על רצועת דבק הרחק להב לתמוך במוח.
- הפוך 10 ס"מ בצלחת פטרי על הקרח ולאחר מכן לשים נייר סינון על המנה. לחות נייר סינון עם טיפות של קר כקרח R-ACSF.
- מעבירים את המוח למסנן נייר עם מלקחיים. חותכים את המוט הקדמי ואת המוח הקטן עם להב ו מלקחיים.
הערה: החלקים רוחבי צריך להיות חלק ככל האפשר, אנכית כדי המטוס sagittal. - מניחים את רקמות המוח הנותרים אנכית על רצועת אחר של דבק ולשמור את המוח נשען על agarose. הוסף קר כקרח r-ACSF למאגר גזירה ללהטביע את המוח ולהוסיף קרח לאזור בעל הקרח. שמור את r-ACSF במאגר מבעבע עם 5% CO 2 ו 95% O 2 .
- הרם את המאגר ולהתאים את המיקום של התער כדי למקם את התער קרוב ככל האפשר למוח ורק מעל המוח.
- בחר "CONT" מצב כדי לחתוך את קטעי המוח ברציפות. הגדר את עובי חיתוך 400 מיקרומטר, תדר רוטט ל 6 - 8, ומהירות ל 3 - 4. לחץ על כפתור "התחל / להפסיק" כדי להתחיל חיתוך אוטומטי.
- חותכים את קצה פיפטה 3 מ"ל פסטר לעשות פתח התאמת גודל פרוסות המוח.
הערה: הפתח צריך להיות גדול מספיק כדי למנוע נזק נוסף לפרוסות המוח. - צייר את חמש פרוסות המוח אחד אחד עם קצה pipet cutPasteur והניח אותם לתוך בעל רקמות קר כקרח r-ACSF מבעבע עם 5% CO 2 ו 95% O 2 . אין לאסוף את הפרוסה הראשונה המיוצרת. כוונן את לחץ הגז ל- avoiתנועות של פרוסות המוח.
הערה: פרוסות המוח לא צריך לכסות אחד את השני. - מקום פרוסות המוח עם r-ACSF בטמפרטורת החדר למשך 30 דקות ולאחר מכן על 37 מעלות צלזיוס באמבט מים עוד 10 דקות להתאושש פונקציות סינפטי.
- להקריב עכבר עם מנת יתר של isoflurane בתא אינדוקציה. לערוף את העכבר. לנתח את המוח באמצעות מספריים קטנים מלקחיים. הסר את המוח עם מרית דקה ושחרר אותו בזהירות לתוך כוס כוס ייןקשירת קר כקרח R-ACSF equilibrated עם 5% CO 2 ו 95% O 2 .
- OGD ו APC:
- המקום gf-ACSF ו- ACSF לתוך אמבט מים 37 מעלות צלזיוס בועה המאגרים עם גזים המתאימים כאמור לעיל 1.1.2 ו 1.1.3 במשך 30 דקות.
- השאר פרוסה אחת ב- r-ACSF כביקורת. מעבירים את שאר ארבע פרוסות המוח לתוך בעל רקמות עם מראש GF-ACSF בזהירות דגירה במשך 15 דקות. מעבירים את הפרוסות בחזרה לתוך בעל רקמה r-ACSF להשיג reperfusion.
- כדי ללמוד את חלון הזמן של APC, להעביר פרוסה אחת ישירות מ- gf-ACSF ל- ACSF. מעבירים את שלוש פרוסות אחרות r-ACSF בהתחלה, ולאחר מכן להעביר שניים מהם למחזיק רקמות ב A-ACSF 5 ו 15 דקות לאחר reperfusion בהתאמה.
- אינקובאטE שתי פרוסות ב-ACSF במשך 3 דקות ולאחר מכן להעביר אותם חזרה r-ACSF. דגירה שלוש פרוסות r-ACSF עוד 1 שעות. הגדר את הפרוסות הנותרות ב- r-ACSF כקבוצת OGD.
- עבור מחקר תגובה מינון, להעביר את כל ארבע פרוסות לבעלים רקמה ב- R-ACSF בהתחלה לאחר OGD ו דגירה במשך 5 דקות. לאחר מכן להשאיר פרוסה אחת r-ACSF כקבוצת OGD ולהעביר את שלוש פרוסות אחרות ל- ACSF. דגירה פרוסות ב-ACSF עבור 1, 3 ו 5 דקות בהתאמה ולאחר מכן להעביר אותם חזרה r-ACSF. דגירה שלוש פרוסות r-ACSF עוד 1 שעות.
- נחישות הכדאיות:
- הכן 0.25% 2,3,5-triphenyltetrazolium הידרוכלוריד (TTC) תמיסת מלח רגיל. הוסף 1.25 גרם אבקת TTC ל 500 מ"ל תמיסת מלח רגיל.
הערה: לאחר אבקת לחלוטין מתמוסס, להעביר את הפתרון לתוך צלחת 24 היטב (500 μL לכל טוב) מכוסה בנייר כסף ולאחסן אותו ב 4 ° C. TTC ו רקמות מוכתם TTC הם אור בהיר. - מעבירים את הפרוסות לצלחת 24 גם (פרוסה אחת לכל טוב) המכיל פתרון TTC ו למתוח את הפרוסה בפתרון. דגירה פרוסות בפתרון TTC ב 37 מעלות צלזיוס באמבט מים רדודים למשך 30 דקות.
- מעבירים את פרוסות לתוך צינורות נקי 1.5 מ"ל צנטריפוגה מכוסה בנייר כסף ולמדוד את המשקל היבש של הפרוסות.
- הוסף אתנול / dimethyl sulfoxide (1: 1) לתוך צינורות צנטריפוגה (v: w = 10: 1) לחלץ formazan. דגירה פרוסות באתנול / dimethyl sulfoxide בטמפרטורת החדר הרחק מן האור במשך 24 שעות.
- מוסיפים את כל אתנול / dimethyl sulfoxide בצינורות לתוך צלחת 96-היטב ולמדוד את absorbance ב 490 ננומטר על ידי קורא צלחת.
- מנרמל את absorbance למשקל יבש של הפרוסה ואת הכדאיות להביע כאחוז של פרוסת שליטה.
- הכן 0.25% 2,3,5-triphenyltetrazolium הידרוכלוריד (TTC) תמיסת מלח רגיל. הוסף 1.25 גרם אבקת TTC ל 500 מ"ל תמיסת מלח רגיל.
2. MCAO
- הכנה:
- לחטא את שולחן העבודה, את פני השטח של Flowmetr לייזר דופלרY (LDF) ואביזרים שלה עם אלכוהול 70% אתיל.
- הכן מכשירים autoclaved: שני מספריים, 10 ס"מ; שני מלקחיים, 10 ס"מ; מלקחיים אופטלמיים, 11 ס"מ; אחד מספריים אופטלמריים מיקרו, 9 ס"מ; מהדק אחד microvessel, 1.8 ס"מ; כונן oneneedle, 12.5 ס"מ r; כמה התפרים כירורגי (½ 1 4 × 10); צמר גפן.
- הכן מזרק (ללא מחט) עם תמיסת מלח לשמור על אזור הפעולה hydrated.
- הכן את הגז הרדמה (100% O 2 + isoflurane).
- זיהוי של זרימת הדם במוח:
- הגדרת מכשיר LDF.
- להזריק משככי כאבים intraperitoneally לתוך העכבר: metamizol 200 מ"ג / ק"ג, carprofen 4 מ"ג / ק"ג ו buprenorphin 0.1 מ"ג / ק"ג.
- מניחים את העכבר לתוך החדר אינדוקציה עם isoflurane 4% בחמצן להרדים אותו עד תנועה ספונטנית של הגוף vibrissae מפסיק.
- מניחים את העכבר במצב נוטה עם האף מצויד לתוך הE חרוט האף ולשמור isoflurane ב 1.5% עבור ההליך הבא.
- החל משחת עיניים dexpanthenol על שתי העיניים.
- לחטא את הראש עם אלכוהול 70% אתיל.
- הפוך חתך העכבר פרמדיאן העכבר בין העיניים והאוזניים באמצעות מנתח לחשוף את הגרגמה.
- לשפשף את הגולגולת עם כותנה סטרילית.
- החל אחד עד שני טיפות של דבק כירורגי על פני השטח של הגולגולת.
- מניחים את קצה סיבים אופטיים בדיקה 5 הזנב מ"מ לגרגמה ו 6 מ"מ לרוחב לקו האמצע.
- התחל להקליט את זרימת הדם על תוכנת המחשב. המתן עד זרימת הדם יציב הבסיס מתרחשת ולאחר מכן להחיל זרז 20 μL על הדבק לתקן את החללית.
הערה: הבסיס הבסיסי צריך להיות יותר מ 500 השטף. - אם הבסיס הוא פחות מ 200 שטף, להתאים את המיקום דק כדי לקבל בסיס מתאים. שמור את החללית מחובר הגולגולת למשך הניסוי.
- לחטא את הראש עם אודופור afTer סיבים אופטיים בדיקה המצורפת.
- MCAO:
- מקום ולתקן את העכבר הרדים (עם בדיקה LDF המצורפת הגולגולת שלה) במצב שכיבה ולשמור על טמפרטורת הגוף שלה באמצעות מנורת חום לאורך כל הניתוח. לחטא את הצוואר עם אלכוהול 70% אתיל.
- הפוך חתך עור פרמדיאן בצוואר באמצעות איזמל; בוטה לנתח את הרקמות הרכות עם מלקחיים לחשוף כלי. הוסף טיפה אחת של מלוחים לרקמות חשופות כדי לשמור על התייבשות.
- לנתח את עורק הצוואר הנפוץ מן הרקמות הסובבות את העצב הוואג באמצעות מלקחיים עיניים. היזהר לא לפגוע בעצב הוואגוס. לחטא עור הצוואר שוב עם יודופור לאחר עורק הצוואר המשותף חשופים.
- מניחים מהדק microvessel בקצה דיסטלי של עורק הצוואר המשותף ולאחר מכן לקשור קשר מת עם תפרים משי 6-0 בסוף הפרוקסימלי. מניחים את מהדק כמו הפרוקסימלי ככל האפשר עבור הפעולות הבאות. ודא כי אורךהספינה בין מהדק לבין קשר מתים הוא זמן רב ככל האפשר עבור הפעולות הבאות.
- הפוך תפר זמני פרוקסימלי כדי מהדק ידי קשירת קשר רופף. ודא שיש מספיק מקום בין שני קשרים עבור הכניסה monofilament.
- לעשות חתך קטן בין שתי הקשרים עם מספריים עיניים מיקרו. ודא החתך הוא קרוב קרוב למת ככל האפשר עבור הפעולות הבאות. היזהר לא לחתוך את כלי השיט.
- הכנס 12 מ"מ עצה חדות מונופילמנט דרך החתך להיכנס לומן העורקים מראש זה כמה מ"מ. הדק את הקשר הרופף סביב קצה מונופילמנט ולאחר מכן להסיר את מהדק.
- לקדם את החוט לתוך עורק הצוואר הפנימי (10 מ"מ כדי לכסות את עורק המוח התיכון) עם מלקחיים עיניים עד לתוכנות LDF מראה ירידה חדה (> 80% הפחתת זרימת הדם הבסיסית) בזרימת הדם. הקלט את זמן ההתחלה של החסימה.
הערה: הגדרת מכשיר LDF היאהמתואר בסעיף 2.2. - להתעלף עורק המוח התיכון 1 שעה. לחתוך את LDF בדיקה לשים את העכברים ב 30 ° C חממה למשך החסימה.
- Reperfusion ו APC:
- Re-להרדים את החיות עם isoflurane כמתואר לעיל 55 דקות לאחר תחילת הזמן של חסימה. מקום לתקן עכברים במצב שכיבה. פתח את החתך בצוואר מחדש לחשוף את עורק הצוואר המשותף.
- בעדינות לשלוף את החוט עם מלקחיים עיניים לאחר תקופת החסימה כדי להשיג reperfusion ולהפוך את תפר זמני לתוך אחד קבוע על ידי הידוק הקשר.
- לקבלת טיפול acidosis, לשנות את הגז בשאיפה על ידי חרוט האף לערבב גזים המכילים 20% CO 2 , 20% O 2 ו 60% N 2 במשך 5 דקות ב 5, 50, או 100 דקות לאחר reperfusion. סגור את החתך עם תפר כירורגי קטע.
- עכברים מקום 30 ° C כלוב החום עד עכברים לשחזר את ההכרהולאחר מכן להחזיר את העכברים לנקות, כלובים בודדים. לספק עכברים עם צלחת פטרי של מים ואוכל לח. מעקב אחר עכברים מקרוב לאחר הניתוח על כאב מוגזם ומוות.
- מדידת נפח האינפרה של המוח:
- למדוד נפח אוטם המוח באמצעות מכתים 24 שעות לאחר reperfusion.
- הכן 0.25% פתרון TTC כאמור ב שלב 1.4.1 לפני מועד הקרבה. מעבירים את הפתרון לתוך צלחת 24 גם (1 מ"ל לכל טוב) מכוסה בנייר כסף ולאחסן אותו ב 4 מעלות צלזיוס.
הערה: TTC ורקמות מוכתם TTC הם רגישים לאור. - ב 24 שעות לאחר reperfusion, להקריב את החיה עם מנת יתר של isoflurane בחדר אינדוקציה. לערוף את העכברים. לנתח את המוח באמצעות מספריים קטנים מלקחיים. לבחון נקודות דם על המוח כדי להוציא את העכברים שעברו דימום subarachnoid במעגל ויליס.
- מניחים את המוח על שקופית זכוכית נקי על 20 מעלות חבילת קרח. מניחים את המוח ואת השקופית זכוכית במקרר -20 מעלות צלזיוס במשך 5 דקות כדי להפוך את המוח קל יותר פרוסה.
- להוציא את המוח ואת שקופית הזכוכית מ -20 מעלות צלזיוס והניח אותם בחזרה על חבילת קרח -20 מעלות צלזיוס. לנתח את המוט הקדמי ואת המוח הקטן עם להב ו מלקחיים.
- חותכים את חלקי המוח אופקית לעובי 1 מ"מ עם להב לייצר 5 פרוסות. מעבירים את הפרוסות לצלחת 24-היטב המכיל פתרון TTC (פרוסה אחת לכל טוב) עם מלקחיים למתוח את הפרוסות בפתרון. דגירה פרוסות בפתרון TTC ב 37 מעלות צלזיוס באמבט מים רדודים למשך 30 דקות.
- לשאוב את הפתרון TTC. הוסף 10% פורמלדהיד (1 מ"ל לכל טוב) ו דגירה בטמפרטורת החדר למשך 30 דקות. מניחים את פרוסות בסדר שבו הם נחתכו על גיליון צלופן לסרוק את הקטעים לתוך imager הצילום.
- לנתח את גודל אוטם כאחוז פרוסת המוח כולו באמצעות תוכנת ניתוח ImageJLass = "xref"> 8 על סמך זיהוי חזותי; ראה איור 2 (משמאל).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
במודל פרוסה corticostriatal שתואר לעיל, הכדאיות פרוסת corticostriatal היה לכמת על ידי assay TTC ב 1 שעות לאחר reperfusion. המרת TTC חושבה על ידי מנרמל את הקליטה ב 490 ננומטר לשליטה מלאה. על פי TTC המרה, APC מוגן מפני OGD- המושרה reperfusion פציעה בזמן התחלה משך תלוי. בפירוט, הן 1 ו 3 דקות של טיפול acidosis שיפור משמעותי הכדאיות ב 5 דקות לאחר 15 דקות OGD, ואילו 5 דקות לא (OGD: 0.609 ± 0.029, 5/1: 0.758 ± 0.034, 5/3: 0.821 ± 0.041, 5/5: 0.672 ± 0.053, הנתונים מדווחים כממוצע ± SEM) ( איור 1 א ). הטיפול ב- neposrotection על ידי טיפול בחומציות נשאר מוגן בתוך 5 דקות לאחר reperfusion, ואילו 15 דקות לא (OGD: 0.584 ± 0.044, 0/3: 0.762 ± 0.036, 5/3: 0.833 ± 0.062, 15/3: 0.627 ± 0.038) איור 1 G> B ).
במודל MCAO, 5 דקות של טיפול acidosis יזמה ב 5 דקות לאחר הופעת reperfusion המוות הציל את התא נגרם על ידי עלבון איסכמי, משתקף על ידי נפח infarct קטן (MCAO: 33.4 ± 4.4%, 5/5: 16.6 ± 2.7%, 50 / 5: 19.5 ± 2.1%, 100/5: 37 ± 2.1%). את neuroprotection היה עדיין חזק, גם כאשר זמן הופסקה התעכב 50 דקות לאחר reperfusion. עם זאת, טיפול acidosis יזמה ב 100 דקות לא לחסום את הפציעות איסכמי ( איור 2 ).
כל הנתונים נאספו ונותחו בצורה עיוורת. הנתונים מוצגים כ ממוצע ± SEM. במודל פרוסת corticostriatal, כל קבוצה יש 6-8 דגימות. במודל MCAO, כל קבוצה יש 9-10 דגימות. ניתוח חד-כיווני של שונות עם פער משמעותי ביותר נעשה על השוואות מרובות.
-together.within-page = "1"> 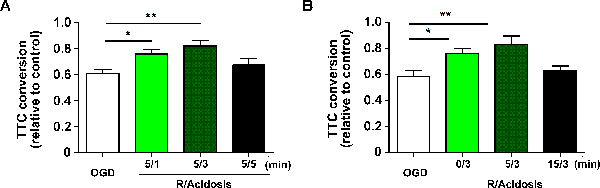
איור 1 . APC מגן מפני OGD- המושרה Reperfusion פגיעה ב Corticostriatal פרוסות. פרוסות Corticostriatal טופלו עם חומצה (pH 6.8) עבור משכי (A) וציין תקופות התאוששות (B) לאחר OGD. הכדאיות התא הוערך על ידי 3- [4,5-dimethylthiazol-2-yl] -2,5-diphenyltetrazolium assay ברומיד ב 24 שעות לאחר reperfusion, ואת הכדאיות פרוסת corticostriatal היה לכמת על ידי assay TTC בשעה 1 אחרי reperfusion. ערכים מראים ממוצע ± SEM. N = 6 - 8 עבור כל קבוצה; * P <0.05 ו ** p <0.01 על ידי ניתוח חד-כיווני של שונות; R, reperfusion. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
איור 2 . APC מגן מפני פגיעה ב- MCAO-Induced בעכברים. בעלי חיים היו נתון 60 דקות MCAO ומטופלים על ידי שאיפת 20% CO2 במשך 5 דקות ב 5, 50, או 100 דקות לאחר reperfusion. נפח אוטם היה לכמת ידי 2,3,5-triphenyltetrazolium הידרוכלוריד מכתים ב 24 שעות לאחר reperfusion (מסומן על ידי קו מנוקד שחור על הפאנל השמאלי). ערכים מראים ממוצע ± SEM. N = 8 - 10 עבור כל קבוצה; * P <0.05 ו ** p <0.01 על ידי ניתוח חד-כיווני של שונות; R, reperfusion. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
כאן אנו מציגים שני מודלים ניסיוניים כדי לחקור את neuroprotection של APC נגד איסכמיה מוחית. ב פרוסות המוח, APC מושגת על ידי דוגרים עכברים פרוסות corticostriatal חיץ חומצי מבעבע עם 20% CO 2 לאחר הופעת reperfusion, בעוד המודל MCAO, APC מושגת על ידי שאיפת 20% CO 2 לעכברים לאחר reperfusion. שני המודלים משקפים את הנוירו-פרוטקציה של APC כנגד איסכמיה מוחית. ההגנה היתה דומה לזו שהושגה על ידי התסמינים האיסכמיים אך עם חלון זמן רחב יותר. במודל MCAO, חלון הזמן יכול להיות עוד 50 דקות לאחר reperfusion לעומת 10 דקות עבור postconditioning איסכמי 15 . בנוסף, הנוהל של APC הוא קל ובטוח יותר.
במודל פרוסות corticostriatal, פעולות עדינות ומהירה חיוניים כדי להצדיק את הכדאיות של פרוסות המוח עד למקסימום. עבור הביצועים MCAO, ניטור זרימת הדם במוח הואנדרש, ואת הירידה החדה של זרימת הדם חייב להיות שנצפה כדי להבטיח חסימה של עורק מוחי באמצע. לאחר המוח גזור החוצה עבור מכתים TTC, בדיקה זהירה של המוח הכרחי עבור הרחקה של דימום subarachnoid.
ההארכה ואת משך החומצה הם קריטיים כדי להשיג את neuroprotection של APC. משך ממושך של טיפול acidosis אינו מועיל מודל פרוסות corticostriatal ( איור 1 א ). בנוסף, המחקר הקודם שלנו הראו כי הן שאיפה 10% ו 20% CO 2, ולא 30% משאיפת CO 2 להעניק neuroprotection על עכברים 8. אלה מצביעים על חומציות מתונה חיונית עבור neuroprotection של APC, ולכן הריכוז של CO 2 ומשך APC הם הכרחיים עבור neurosrotection acidosis.
בנוסף מכתים TTC, טכניקות רבות ניתן לשלב sAtisfy צרכים מחקר מגוונים. לדוגמה, הקלטה חשמלית חוץ-תאית יכולה להתווסף לשלב האחרון כדי לבחון כיצד איסכמיה וחומציות משפיעות על הפוטנציאל העצבי 16 . פתרון זלוף של פרוסת המוח יכול גם להיות שנאסף כדי למדוד את שינוי הריכוז של נוירוטרנסמיטורים חומצת אמינו לאחר APC על ידי HPLC 17 . פרוסות של אזורים מסוימים במוח יכול להיות מוכן ללמוד את התגובות של אזור מסוים איסכמיה APC. בסך הכל, חלופות רבות ניתן להציג כדי להאיר את ההשפעות של איסכמיה ו acidosis.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
למחברים אין מה לחשוף.
Acknowledgments
עבודה זו מומנה על ידי הקרן הלאומית למדעי הטבע של סין (81573406, 81373393, 81273506, 81221003, 81473186, 81473186 ו 81402907), Zhejiang מחוזי מדעי הטבע הקרן (LR15H310001) ואת התוכנית עבור Zhejiang צוות מוביל של S & T חדשנות צוות (2011R50014).
Materials
| Name | Company | Catalog Number | Comments |
| Sodium chloride | Sigma | S5886 | |
| Potassium chloride | Sigma | P5405 | |
| Potassium phosphate monobasic | Sigma | P9791 | |
| Magnesium sulfate | Sigma | M2643 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Calcium chloride dihydrate | Sigma | C5080 | |
| D-(+)-Glucose | Sigma | G7021 | |
| Vibratome | Leica | VT1000 S | |
| 2,3,5-triphenyltetrazolium hydrochloride | Sigma | T8877 | |
| Absolute Ethanol | Aladdin Industrial Corporation | E111993 | |
| Dimethyl sulfoxide | Sigma | D8418 | |
| Laser Doppler Flowmetry | Moor Instruments Ltd | Model Moor VMS-LDF2 | |
| Diethyl ether anhydrous | Sinopharm Chemical Reagent Corporation | 80059618 | |
| Trichloroacetaldehycle hydrate | Sinopharm Chemical Reagent Corporation | 30037517 | |
| 10% Formalin | Aladdin Industrial Corporation | F111936 | |
| 24-well plates | Jet Biofil | TCP-010-024 |
References
- Zhao, H., Sapolsky, R. M., Steinberg, G. K. Interrupting reperfusion as a stroke therapy: ischemic postconditioning reduces infarct size after focal ischemia in rats. J Cereb Blood Flow Metab. 26 (9), 1114-1121 (2006).
- Leconte, C., et al. Delayed hypoxic postconditioning protects against cerebral ischemia in the mouse. Stroke. 40 (10), 3349-3355 (2009).
- Fan, Y. Y., et al. Transient lack of glucose but not O2 is involved in ischemic postconditioning-induced neuroprotection. CNS Neurosci Ther. 19 (1), 30-37 (2013).
- Hess, D. C., Hoda, M. N., Bhatia, K. Remote limb perconditioning [corrected] and postconditioning: will it translate into a promising treatment for acute stroke. Stroke. 44 (4), 1191-1197 (2013).
- Ren, C., Yan, Z., Wei, D., Gao, X., Chen, X., Zhao, H. Limb remote ischemic postconditioning protects against focal ischemia in rats. Brain Res. 1288, 88-94 (2009).
- Sun, J., et al. Protective effect of delayed remote limb ischemic postconditioning: role of mitochondrial K(ATP) channels in a rat model of focal cerebral ischemic reperfusion injury. J Cereb Blood Flow Metab. 32 (5), 851-859 (2012).
- Li, P., et al. Remote limb ischemic postconditioning protects mouse brain against cerebral ischemia/reperfusion injury via upregulating expression of Nrf2, HO-1 and NQO-1 in mice. Int J Neurosci. , 1-8 (2015).
- Fan, Y. Y., et al. A novel neuroprotective strategy for ischemic stroke: transient mild acidosis treatment by CO2 inhalation at reperfusion. J Cereb Blood Flow Metab. 34 (2), 275-283 (2014).
- Shen, Z., et al. PARK2-dependent mitophagy induced by acidic postconditioning protects against focal cerebral ischemia and extends the reperfusion window. Autophagy. 0, (2017).
- Skolnik, J., Takacs, L., Szende, E. In vitro oxygen consumption of slices from kidney, brain, cortex and liver in hypoxia. Nature. 209 (5020), 305 (1966).
- Lynch, G., Schubert, P. The use of in vitro. brain slices for multidisciplinary studies of synaptic function. Annu Rev Neurosci. 3, 1-22 (1980).
- Zheng, S., Zuo, Z. Isoflurane preconditioning reduces purkinje cell death in an in vitro model of rat cerebellar ischemia. Neuroscience. 118 (1), 99-106 (2003).
- Yin, B., Barrionuevo, G., Weber, S. G. Optimized real-time monitoring of glutathione redox status in single pyramidal neurons in organotypic hippocampal slices during oxygen-glucose deprivation and reperfusion. ACS Chem Neurosci. 6 (11), 1838-1848 (2015).
- Medvedeva, Y. V., Ji, S., Yin, H. Z., Weiss, J. H. Differential vulnerability of CA1 vs CA3 pyramidal neurons after ischemia: possible relationship to sources of Zn2+ accumulation and its entry into and prolonged effects on mitochondria. J Neurosci. , (2016).
- Pignataro, G., et al. In vivo and in vitro characterization of a novel neuroprotective strategy for stroke: ischemic postconditioning. J Cereb Blood Flow Metab. 28 (2), 232-241 (2008).
- Zhang, X., Ding, H. Z., Jiang, S., Zeng, Y. M., Tang, Q. F. An in vitro study of the neuroprotective effect of propofol on hypoxic hippocampal slice. Brain Inj. 28 (13-14), 1758-1765 (2014).
- Niu, Y., et al. Chemical profiling with HPLC-FTMS of exogenous and endogenous chemicals susceptible to the administration of chotosan in an animal model of type 2 diabetes-induced dementia. J Pharm Biomed Anal. 104, 21-30 (2015).



