Summary
Spectroscopie d’impédance électrochimique (SIE) des espèces qui subissent une oxydation réversible ou réduction en solution a été utilisée pour la détermination des constantes de vitesse d’oxydation ou de réduction.
Abstract
Spectroscopie d’impédance électrochimique (SIE) a été utilisée pour la caractérisation avancée des composés organiques polymères électroactifs ainsi que de la voltampérométrie cyclique (CV). Dans le cas des processus électrochimiques rapidement réversibles, courant est sous l’influence prédominante de la vitesse de diffusion, qui est l’étape lente et limitée. EIS est une technique puissante qui permet une analyse séparée des étapes de transfert de charge qui ont différente réponse en fréquence AC. La capacité de la méthode était utilisée pour extraire la valeur de la résistance de transfert de charge, qui caractérise le taux d’échange de charge sur l’interface électrode-solution. L’application de cette technique est large, de la biochimie jusqu'à l’électronique organique. Dans ce travail, nous vous présentons la méthode d’analyse des composés organiques pour applications opto-électroniques.
Introduction
Taux d’oxydo-réduction du composé électroactif est un paramètre important qui caractérisent sa capacité à subir le processus d’oxydation ou de réduction et de prédire son comportement en présence d’oxydants forts ou les agents réducteurs ou sous potentiel appliqué. Cependant, la plupart des techniques électrochimiques ne sont en mesure de décrire qualitativement la cinétique du processus rédox. Parmi les diverses techniques électrochimiques utilisées pour les composés actifs de redox, caractérisation de voltampérométrie cyclique (CV) est la méthode la plus répandue pour la caractérisation électrochimique suffisante et rapide des diverses espèces solubles1, 2,3. La technique de CV a des applications larges, par exemple, niveaux d’énergie des estimations4,5,6, l’analyse de porteurs de charge pris en charge par spectroscopies7,8, 9 , 10, jusqu'à des modifications de surface11,12,13. Comme chaque méthode, CV n’est pas parfait, et pour augmenter l’applicabilité et la qualité des résultats, la connexion avec une autre technique spectroscopique est importante. Nous avons déjà présents plusieurs enquêtes où la technique de spectroscopie (SIE) impédance électrochimique était travailleur14,15,16 , mais dans ce travail, on veut se montrer étape par étape comment renforcer la technique de CV par EIS.
Le signal de sortie EIS se compose de deux paramètres : parties réelles et imaginaires de l’impédance en fonction de la fréquence17,18,19,20. Il permet d’estimer plusieurs paramètres responsable de transfert de charge via l’interface électrode-solution : doubler la capacité de la couche, résistance de la solution, résistance de transfert de charge, impédance de diffusion et d’autres paramètres selon le système objet d’une enquête. Résistance de transfert de charge est un objet de grande attention étant donné que ce paramètre est directement lié à la constante de vitesse d’oxydo-réduction. Même si l’oxydation et réduction des constantes de vitesse sont estimées en solution, ils peuvent généralement caractérisent l’aptitude d’un composé pour échange de charge. EIS est réputé être une technique électrochimique avancée nécessitant une profonde compréhension mathématique. Ses grands principes sont décrits dans la littérature moderne électrochimie17,18,20,du19,21,22,23.
Protocol
1. base préparation d’une expérimentation électrochimique
- Préparer 4 mL d’une solution de travail contenant 0,1 mol∙L−1 Bu4NBF4 et 0,001 mol∙L−1 étudié composé organique en ajoutant les montants calculés de solides pulvérulents dans 4 mL de dichlorométhane dans un petit bâtiment ou un tube à essai. Avec 2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenzo [b, d] thiophène-S, S-dioxyde (masse molaire 802 g∙mol−1), peser 3,208 mg de ce composé et g 0,1645 Bu4NBF4.
- Remplir une cellule électrochimique de 3 mL à 2 mL de solution à l’aide d’une pipette. La portion restante de la solution sera nécessaire plus tard pour la mesure d’impédance et de reproduire les résultats.
- Polir une électrode de disque de travail 1 mm diamètre platine (WE) pendant 30 s à l’aide d’un chiffon à lustrer imbibé de quelques gouttes de coulis d’alumine. Frottez la surface plane de l’électrode à disque avec un morceau de tissu fixé sur un support immobile (par exemple boîte de Pétri) en appliquant une pression modérée.
- Rincer l’électrode à l’eau distillée trois fois pour enlever les particules d’alumine.
- Recuire une contre-électrode (CE, fil de platine) dans une flamme de butane. Rangez soigneusement le fil de platine dans une flamme pour moins de 1 s et supprimer rapidement lorsqu’il démarre le rougissement pour éviter la fusion.
Remarque : La surface de CE n’est pas prévue mais doit être beaucoup plus élevée que la surface de l’électrode de travail. Dans ce cas, impédance d’interface électrode de travail aurait l’impact majeur sur l’impédance du système total et permettrait d’exclure impédance électrode compteur compte.- Recuire une électrode de référence (RE, fil d’argent) dans la flamme du brûleur butane de la même manière.
- Mettre tous les trois électrodes (travail, compteur et référence) dans une cellule en évitant la mutuelle contact et connecter les câbles potentiostat correspondante marquée comme nous, CE et RE. Insérer un gaz livraison tube relié avec bouteille de gaz argon pour davantage de dégazage.
- Ouvrez le robinet de gaz et purger l’air solution par argon bouillonnant dans la solution pendant 20 min. fermer la vanne de gaz avant la mesure.
2. provisoire caractérisation par voltamétrie cyclique (CVA)
- S’inscrire à la CVA de la solution de travail au sein d’une aire de répartition potentielle de −2, 0 V à + 2,0 V et scan taux 100 mV∙s−1.
- Lancez le programme voltampérométrie cyclique dans le logiciel potentiostat.
- Choisissez 0,0 V comme valeur potentielle initiale, −2, 0 V comme minime + potentiel, 2,0 V comme maximal potentiel, 100 mV∙s−1 comme vitesse d’écriture de numérisation. D’autres paramètres sont facultatifs.
- Cliquez sur le bouton Démarrer.
Remarque : Un voltamogramme type est présenté à la Figure 1.
- Déterminer la valeur potentielle de la CVA a obtenu. Notez que les valeurs potentielles lorsque maxima de positifs (max. anodique) et négatif (max. cathodique) courant apparaître et calculer la valeur moyenne.
- Ajouter 10 mg du ferrocène par spatule dans la solution de travail et purger l’air par argon bouillonnant pendant 5 min. Cela est nécessaire pour le mélange et ajouté une dissolution complète du ferrocène.
Remarque : La quantité de ferrocène n’est pas précise. Toutefois, l’ajout de moins de 1 mg ou plus de 20 mg compliquerait estimation du potentiel d’équilibre. - S’inscrire à la CVA de la solution de travail au sein de l’aire de répartition potentielle de −1, 0 V à + 1,0 V et scan taux 100 mV∙s−1. Un petit pic réversible du ferrocène s’affiche comme illustré à la Figure 1.
- Déterminer la valeur potentielle du ferrocène oxydation réversible de la CVA a obtenu. Notez que les valeurs potentielles lorsque maxima de positifs (max. anodique) et négatif (max. cathodique) courant apparaître et calculer la valeur moyenne.
- Mettre une autre partie de la solution préparée à l’étape 1.1 dans la cellule et nettoyer les électrodes en répétant la procédure décrite en 1.2 à 1.7.
3. l’enregistrement du spectre d’impédance
Remarque : Un exemple de la configuration du logiciel est illustré dans la Figure 2; un autre logiciel ou dispositif aussi peut être utilisé. Toutefois, l’arrangement d’installation peut-être différer dans des logiciels différents, bien que les grands principes restent les mêmes. Utiliser l’EIE dans un mode de l’escalier, c'est-à-dire potentiostatique spectres sont enregistrés automatiquement un après l’autre.
- Dans le logiciel, choisissez une aire de répartition potentielle de 0,2 V couvrant le sommet réversible le CVA. Exemple : Un pic d’oxydation réversible a été détecté sur CV à 0,7 V. L’aire de répartition potentielle pour CV devrait être alors de 0,6 V à 0,8 V. Les spectres sera enregistré avec l’incrément de 0,01 V, c'est-à-dire à 0,61 V, 0,62 V, etc.
- Enregistrer la procédure de mesure automatique de EIS conditions suivantes conseillé.
- Entrez les valeurs d’entrée suivantes : initial éventuel 0,6 V ; fini les potentiels 0,8 V ; augmentation d’échelon de potentielle : 0,01 V ; bande passante : allant de 10KHz à travers 100 Hz ; le nombre de fréquences en échelle logarithmique : 20 ; Attendez un moment entre les spectres : 5 s, ac tension amplitude 10 mV, minimales 2 mesures par fréquence.
- Cliquez sur le bouton Démarrer.
Remarque : dans ce cas, 21 spectres, chacun contenant 41 points de fréquence sera obtenu. L’ensemble typique des spectres enregistrés automatiquement est présenté à la Figure 3.
4. analyse du spectre d’impédance
- Lancez le programme Analyseur de spectre EIS.
- Télécharger le spectre en choisissant fichier | Ouvert.
- Dans le volet supérieur droit construire un EEC en utilisant le clic de la souris gauche/droite choisir la connexion série ou en parallèle et l’élément nécessaire dans le menu contextuel : C - condensateur, R - résistance, W - élément de Warburg. Démarrez à partir du circuit plus simple (Figure 5c).
- Choisissez les valeurs minimales et maximales initiales pour les paramètres de gauche-souris-clic des cellules de tableau et valeurs entrantes : C1 - de 1∙10-7 à 1∙10-8, R1 - de 2000 à 100, R2 - de 1000 à 100, Aw - de 50000 à 10000.
- Ajuster le modèle en choisissant modèle | Fit. Répéter l’opération plusieurs fois (habituellement environ 5 fois) jusqu'à ce que les valeurs calculées ne changent plus. Les valeurs des paramètres sont indiqués dans une table dans la fenêtre secondaire gauche supérieure.
- Vérifier les erreurs de paramètre indiquées dans la dernière colonne du tableau. Si une erreur d’un paramètre est supérieure à 100 %, cela signifie que le paramètre n’est pas nécessaire pour un circuit. Dans ce cas, essayez un autre circuit équivalent.
Remarque : Si l'on tente d’adapter un spectre expérimental correspondant au circuit simple (Figure 5c) par un circuit plus compliqué (Figure 5a), puis les erreurs des paramètres supplémentaires inutiles W et R3 serait considérablement haute. - Vérifiez les valeurs de r2(paramétrique) et r2(amplitude) présentée dans la sous-fenêtre droite inférieure. Si elles dépassent la limite 1∙10−2, répéter les procédures 4.2−4.5 à l’aide d’un autre circuit électrique équivalent (CEE) (Figure 5).
- Répétez la procédure 4.1 à 4.7 pour tous les spectres enregistrés
- Pour chaque spectre analysé, notez la valeur calculée de la résistance de transfert de charge et le potentiel correspondant où le spectre a été inscrit au.
5. calcul des constantes de vitesse d’oxydo-réduction
- Placer les valeurs de la résistance de transfert de charge inverse estimé versus potentiel. Un terrain potentiel typique de résistance de transfert de charge inverse pour le processus réversible est présenté à la Figure 6.
- Ouvrez une feuille vide du tableur.
- Entrer manuellement les valeurs des potentiels et les valeurs correspondantes de la résistance de transfert autoliquidation dans les colonnes A et B.
- Sélectionnez la plage de A1:B21 et choisissez Insert | Graph | Fait de la souris en cliquant dans le menu tâche.
- Tracer les valeurs d’une fonction théorique calculée par la formule (1) sur la même parcelle. Utilisez des valeurs constantes : F = 96485 C∙mol−1, c0 = 0,01 mol∙−1, z = 1, R = 8.314 J∙mol−1∙K−1, α = 0,5, T - température ambiante. Utilisez la valeur précédemment estimée (3.1) de E0.
 (1)
(1) (2)
(2)
Rct−1 correspondant à la valeur inverse de la résistance de transfert de charge normalisée par la surface ; z- nombre d’électrons transférés en une seule étape (acceptées étant égale 1) ; F- constante de Faraday ; c 0- concentration du composé étudié ; Α - coefficient de transfert de charge (acceptées étant égale 0,5) ; E- électrode potentiel ; paramètre θ a été introduit pour simplifier la formule finale concernant E et Rct.- Copier la première colonne de valeurs (potentiels) dans la même feuille dans la colonne D.
- Entrez les valeurs constantes de F, c0, z, R, α, T, E0, k0 inscrits ci-dessus dans les cellules C1:C8. Utilisation des valeurs E0 = 0, k0 = 1∙10−5.
- Entrez la formule (2) pour calculer θ dans la cellule E1 : = EXP($C$1*$C$3/($C$4*$C$6)*(D1-$C$7)).
- Copiez la formule dans les cellules E2:E21 en sélectionnant E1, en cliquant sur copier, gamme E2:E21 cliquant sur coller.
- Entrez la formule (1) dans la cellule F1 : = $C$8*$C$1^2*$C$3^2/($C$4*$C$6)*$C$2*E1^(1-$C$5)/(1+E1).
- Copiez la formule dans les cellules F2:F21 en sélectionnant F1, en cliquant sur copier, gamme F2:F21 cliquant sur coller.
- Faites un clic gauche sur le graphique construit à étape 5.1, choisissez Choisissez données, puis Ajouter et ajouter nouveau jeu de données en spécifiant entrer D1:D21 comme x gamme et F1:F21 comme intervalle y.
Remarque : Deux graphes : expérimentale et simulation automatiquement marquées par différentes couleurs apparaîtra sur une parcelle de coordination.
- Optimiser la fonction théorique (1) dans l’ordre aux données expérimentales de sapin par différentes valeurs du potentiel d’équilibre (E0) et la constante de vitesse standard (k,0), étant le paramètre target.
Remarque : Modifier des valeurs dans les cellules C7 (E0) et C8 (k0) entraînerait immédiatement le changement de la courbe simulée.- Modifier manuellement les valeurs dans les cellules C7 et C8 afin d’atteindre l’égalité entre expérimentale et simulation graphique.
Remarque : Le changement de E0 déplace la courbe de cloches le long de l’axe des x . Changement de k0 contrôle la hauteur de la courbe de cloches. Ainsi, variant de ces deux seuls paramètres peut être utilisé pour trouver un modèle théorique correspondant aux résultats expérimentaux (Figure 6). Paramètre α (1) contrôles symétrie de pic théorique. Toutefois, dans les systèmes réels asymétrie peut être causée par la présence de côté-processus plutôt que par α. Puisqu’elle influe sur la valeur résultante de0 knous recommande de ne pas manipuler la valeur α et de laisser égale à 0,5.
- Modifier manuellement les valeurs dans les cellules C7 et C8 afin d’atteindre l’égalité entre expérimentale et simulation graphique.
Representative Results
La première étape est la caractérisation de voltampérométrie cyclique présentée dans la Figure 1. Demande d’étude d’impact environnemental a réussi lorsque les composés a subi le processus électrochimique rapidement réversible. Un tel comportement souvent n’a été observé pour les composés organiques, mais des composés organiques possédant électroconductivité état solide s’est avéré pour être un bon spécimen pour étude cinétique électrochimique. Un tel composé organique est illustré dans le médaillon de la Figure 1.
Enregistrement de spectres d’impédance a été effectuée selon le montage expérimental (Figure 2), et typiques fichiers RAW qui en résultent est indiquées à la Figure 3. Analyse de spectres d’impédance a été réalisée à l’aide de Logiciels spéciaux24. La fenêtre du programme d’accès ouvert du spectre EIS analyseur24 au cours du traitement des résultats est illustrée à la Figure 4. Un EEC utilisé pour ajuster le spectre est construit manuellement dans la fenêtre secondaire supérieure droit. Les paramètres calculés de l’EEC (les résistances R1 et R2, capacitance C1 et diffusion impédance paramètre W1) sont indiquées dans un tableau dans la fenêtre secondaire supérieur gauche. Le graphique en bas gauche de la fenêtre sous représente l’ajustage de précision des résultats expérimentaux (points rouges) avec l’intrigue de données calculées (ligne verte).
Plusieurs différents EEC convient le spectre expérimental selon les processus qui ont lieu sur la surface de l’électrode et leurs tarifs (Figure 5). Le plus simple élément de Warburg semi-infini utilisable comme il n’y a pas de distorsion de la solution (par exemple rotation de l’électrode de mélange) et aucun enduit d’électrode limitant la diffusion. En cas de réactions électrochimiques considérablement rapide, résistance R3 (Figure 5A) était suffisamment élevée pour être négligé par rapport aux autres branches parallèles de la CEE (Figure 5B). En outre, lorsque le taux de transfert de charge (R2) est significativement plus élevée que la diffusion, l’étape de transfert de charge devient limitant et un CEE encore plus simple (Figure 5C) décrit le système.
La résistance série R1 est toujours présente dans la CEE. Il correspond à la résistance extérieure, y compris les connecteurs et solution, sauf l’interface électrode-surface. Condensateur C1 caractérise une double couche formée à l’interface de l’électrode. La branche, y compris la résistance et impédance de Warburg élément diffusion (Figure 5A) correspond à un processus électrochimique rapide comprenant deux étapes : cinétique et diffusion, respectivement. La résistance de la troisième correspond à un lent processus électrochimique qui se déroule à la surface de l’électrode et implique de solvant ou molécules ayant subi un traitement rapide oxydation ou réduction. Dans certains cas, paramètres, R3 et W1 étaient impossibles à estimer. Ensuite, ils pourraient être considérés comme absent et ne pas pris en compte comme Voir la Figure 5 b et 5C .
Bien que l’EIE fournit une estimation de plusieurs paramètres, l’élément cible qui est considérée dans ce travail est frais transfert résistance R2 habituellement assignés comme Rct dans la littérature17,18,19, qui se trouve en parallèle avec le condensateur en série avec élément de Warburg. Sa dépendance sur tension illustrée à la Figure 6.
Selon la théorie de la cinétique électrochimique (protocole, étape 5.2), la résistance de transfert de charge est directement liée à la constante cinétique électrochimique standard. Même si la correspondance entre les valeurs expérimentales et théoriques des résultats n’était pas idéal, il a permis l’estimation de la valeur de la constante de vitesse électrochimique standard et définit la valeur du potentiel d’équilibre de la position maximale.
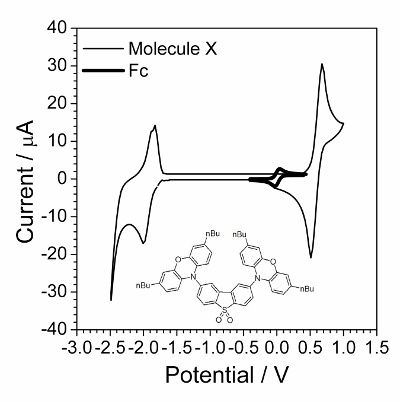
Figure 1 : Voltamogramme cyclique du composé étudié chevauchés par voltamogramme cyclique en présence d’une petite quantité du ferrocène. Solution : 1,0 mol∙L−1 Bu4NBF4 et 0,01 mol∙L−1 X dans le dichlorométhane. Structure du composé X (2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenzo [b, d] thiophène-S, S-dioxyde) est illustrée dans le médaillon. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Montage expérimental contrôle d’inscription de 20 spectres dans la plage de tension de 0,6 à 0,8 V dans la gamme de fréquences allant de 10KHz à 100 Hz avec 20 points pour chaque décennie. Eje, Ef- initiaux et finaux potentiels respectivement, N - nombre de marches, ts- temps d’attente avant chaque mesure, fréquence initiale et finale de dt - intervalle de temps record, fi, ff-, ND- nombre de fréquence points dans un spectre, Vun- ac amplitude, pw - partie de temps en ce qui concerne un point d’enregistrement utilisé pour passer à une autre fréquence, Na- nombre de mesures à une seule fréquence, série E, je range, bande passante - paramètres techniques. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Balayage de l’écran lors de l’enregistrement de spectres impédance. Fenêtre secondaire supérieure droite : dépendance escalier du potentiel de l’électrode à l’heure. Supérieur gauche de la fenêtre sous : terrain de Nyquist, imaginaire impédance (ordonnée), impédance réelle (abciss). Inférieur gauche de la fenêtre sous : Bode intrigue, module de l’impédance (échelle de gauche), décalage de phase (échelle de droite), fréquence (échelle horizontale). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Fenêtre de programme « EIS Spectrum analyzer » au cours du traitement des résultats. Supérieur gauche de la fenêtre secondaire : tableau de valeurs de paramètre : C1 - capacitance, R1, R2 - résistances, W1 - élément de Warburg ; inférieur gauche de la fenêtre sous : experimental (points verts) et les spectres de modèle théorique (ligne rouge) ; fenêtre secondaire supérieure droite : circuit électrique équivalent ; sous-fenêtre droite inférieure : calcule les statistiques du raccord. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Circuits électriques équivalents trouvent pour tenir les spectres d’impédance des processus d’oxydoréduction sur la surface de l’électrode. (A) - processus électrochimique réversible accompagnée d’un processus irréversible parallèle, (B) - réversible électrochimique, (C) - électrochimique processus avec stade de limitation cinétique. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 : Valeurs inverses gratuitement transférer la résistance estimée à partir de EIS versus potentiel électrode. La ligne représente la dépendance théoriquement prévue selon la formule (2).
Discussion
Cette partie des travaux sera consacrée à une explication des conditions expérimentales choisies et discussion des applications possibles de la méthode présentée.
Analyse du spectre d’impédance peut être effectuée par divers logiciels. Ici les recommandations de base pour la méthode d’analyse de CEE sont discutées. Il faut savoir qu’il existe de nombreux algorithmes d’ajustement et de divers moyens d’estimation de l’erreur. Nous présentons un exemple d’utilisation de logiciel libre accès développé par A. Bondarenko et G. Ragoisha24 (Figure 4).
Estimation exacte de la valeur de REC était l’objectif principal de l’ouvrage. Une des raisons pour le choix des conditions expérimentales avait l’intention de dissimuler l’impact de la diffusion. Ainsi, la concentration de la solution devait être aussi haut que possible. Tout en obtenant les résultats expérimentaux ci-contre, la concentration était limitée pour des raisons économiques. La gamme de fréquences de 10 kHz à 100 Hz a été choisie pour éliminer l’effet de diffusion aussi bien. Impédance de diffusion est inversement proportionnelle à la fréquence, tandis que la résistance n’est pas dépendante de la fréquence. L’effet de la résistance dans la partie haute fréquence du spectre a été plus élevé que dans la partie de basse fréquence. Les spectres ont été enregistrées pas aux fréquences inférieures à 100 Hz car ces données serait inutiles pour le calcul de la résistance. Tous les résultats électrochimiques obtenus dans un solvant non aqueux sont présentés contre ferrocène-oxydé / ferrocène couplé potentiel d’équilibre. Pour cette raison, les étapes 2,3 et 2,5 sont effectuées.
Nous avons tenu compte EIS demande à la caractérisation des molécules organiques. Analyse d’autres paramètres de l’EEC et leurs dépendances éventuelles en perspective peut conduire à la révélation d’autres effets et caractérisation électrochimique des composés en solution. Estimation des constantes de vitesse d’oxydo-réduction est utile pour décrire la cinétique d’oxydation ou de réduction des composés électroactifs et prédire le comportement en oxydation ou réduction moyenne.
Disclosures
Les auteurs n’ont rien à divulguer.
Acknowledgments
Les auteurs remercient l’appui financier du projet « Excilight » « Donneur-accepteur Light Emitting Exciplexes comme matériaux pour facile-à-tailleur foudre OLED ultra efficace » (H2020-ACEM-ITN-2015/674990) financé par Marie Skłodowska-Curie Actions dans le cadre du programme de recherche et d’innovations « Horizon-2020 ».
Materials
| Name | Company | Catalog Number | Comments |
| Potentiostat | BioLogic | SP-150 | |
| Platinum disc electrode | eDAQ | ET075 | 1 mm diameter |
| Platinum wire | − | − | counter electrode |
| Silver wire | − | − | silver electrode |
| Electrochemical cell | eDAQ | ET080 | 3 mL volume |
| Polishing cloth | eDAQ | ET030 | |
| Alumina slurry | eDAQ | ET033 | 0.05 µm |
| Butane torch | Portasol | Mini-Torch/Heat Gun | |
| Dichloromethane (DCM) | Sigma-Aldrich | 106048 | |
| Tetrabutylammonium tetrafluoroborate (Bu4NBF4) | Sigma-Aldrich | 86896 |
References
- Cunningham, A. J., Underwood, A. L. Cyclic Voltammetry of the Pyridine Nucleotides and a Series of Nicotinamide Model Compounds. Biochemistry. 6, 266-271 (1967).
- Laba, K., et al. Diquinoline derivatives as materials for potential optoelectronic applications. J Phys Chem C. 119, 13129-13137 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Electrochemistry and spectroelectrochemistry of a novel selenophene-based monomer. Electrochim Acta. 59, 567-572 (2012).
- Laba, K., et al. Electrochemically induced synthesis of poly(2,6-carbazole). Macromol Rapid Commun. 36, 1749-1755 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of alkyl chain on electrochemical and spectroscopic properties of polyselenophenes. Electrochim Acta. 87, 438-449 (2013).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of heteroaryl group on electrochemical and spectroscopic properties of conjugated polymers. Electrochim Acta. 83, 271-282 (2012).
- Gora, M., et al. EPR and UV-vis spectroelectrochemical studies of diketopyrrolopyrroles disubstituted with alkylated thiophenes. Synth Met. 216, 75-82 (2016).
- Pluczyk, S., Zassowski, P., Quinton, C., Audebert, P., Alain-Rizzo, V., Lapkowski, M. Unusual Electrochemical Properties of the Electropolymerized Thin Layer Based on a s-Tetrazine-Triphenylamine Monomer. J Phys Chem C. 120, 4382-4391 (2016).
- Data, P., Motyka, M., Lapkowski, M., Suwinski, J., Monkman, A. Spectroelectrochemical Analysis of Charge Carries as a Way of Improving Poly(p-phenylene) Based Electrochromic Windows. J Phys Chem C. 119, 20188-20200 (2015).
- Enengl, S., et al. Spectroscopic characterization of charge carriers of the organic semiconductor quinacridone compared with pentacene during redox reactions. J Mater Chem C. 4, 10265-10278 (2016).
- Piwowar, K., Blacha-Grzechnik, A., Turczyn, R., Zak, J. Electropolymerized phenothiazines for the photochemical generation of singlet oxygen. Electrochim Acta. 141, 182-188 (2014).
- Blacha-Grzechnik, A., Turczyn, R., Burek, M., Zak, J. In situ Raman spectroscopic studies on potential-induced structural changes in polyaniline thin films synthesized via surface-initiated electropolymerization on covalently modified gold surface. Vib Spectrosc. 71, 30-36 (2014).
- Blacha-Grzechnik, A., et al. Phenothiazines grafted on the electrode surface from diazonium salts as molecular layers for photochemical generation of singlet oxygen. Electrochim Acta. 182, 1085-1092 (2015).
- Data, P., et al. Evidence for Solid State Electrochemical Degradation Within a Small Molecule OLED. Electrochim Acta. 184, 86-93 (2015).
- Data, P., et al. Electrochemically Induced Synthesis of Triphenylamine-based Polyhydrazones. Electrochim Acta. 230, 10-21 (2017).
- Data, P., et al. Kesterite Inorganic-Organic Heterojunction for Solution Processable Solar Cells. Electrochim Acta. 201, 78-85 (2016).
- Barsoukov, E., Macdonald, J. R. Impedance Spectroscopy: Theory, Experiment, and Applications. , Wiley. (2005).
- Orazem, M. E., Tribollet, B. Electrochemical Impedance Spectroscopy. , Wiley. (2008).
- Lasia, A. Electrochemical Impedance Spectroscopy and its Applications. , Springer. (2014).
- Bard, A. J., Faulkner, L. R. Electrochemical Methods: Fundamentals and Applications. , Wiley. (2013).
- Scholz, F. Electroanalytical methods: Guide to Experiment and Application. , Springer. (2010).
- Conway, B. E., Bockris, J. O. 'M., White, R. E. Modern Aspects of Electrochemistry. 32, Kluwer Academic Publishers. (2002).
- Encyclopedia of Electrochemistry: V. 3. Instrumentation and Electroanalytical Chemistry. Bard, A. J., Starttman, M., Unwin, P. R. , Wiley. (2003).
- EIS spectrum analyser software. , Available from: http://www.abc.chemistry.bsu.by/vi/analyser (2017).



 (1)
(1) (2)
(2)