Summary
Elektrokjemiske impedans spektroskopi (EIS) av arter som gjennomgår reversibel oksidasjon eller reduksjon i løsningen ble brukt bestemmelse av rate konstanter av oksidasjon eller reduksjon.
Abstract
Elektrokjemiske impedans spektroskopi (EIS) ble brukt for avansert karakterisering av organisk electroactive forbindelser med syklisk voltammetry (CV). Ved Fort reversibel elektrokjemiske prosesser, er gjeldende hovedsakelig påvirket av frekvensen av diffusjon, som er den tregeste og begrensende scenen. EIS er en kraftfull teknikk som tillater egen analyse av stadier av gratis transport som har forskjellige AC frekvensrespons. Evnen til metoden ble brukt til å hente verdien av gratis overføring motstand, som preger kursen kostnad på elektroden-løsning-grensesnittet. Bruk av denne teknikken er bred, fra biokjemi til organisk elektronikk. I dette arbeidet presenterer vi metoden for analyse av organiske forbindelser for Optoelektronisk programmer.
Introduction
Redoks er electroactive sammensatte en viktig parameter som karakteriserer sin evne til å gjennomgå oksidasjon eller reduksjon og forutsi sin atferd i nærvær av sterk oksiderende eller reduserer agenter eller under anvendt potensial. Men er de fleste elektrokjemiske teknikkene bare kunne beskrive kvalitativt the kinetics av redoks prosessen. Blant ulike elektrokjemiske teknikker ansatt redoks aktive forbindelser, er karakterisering syklisk voltammetry (CV) den mest rådende metoden for rask og tilstrekkelig elektrokjemiske karakteristikk av ulike løselig arter1, 2,3. CV-teknikken har bred programmer, f.eks, energi beregninger4,5,6, kostnader bærere analysen støttes av spectroscopies7,8, 9 , 10til overflaten modifikasjoner11,12,13. Som hver metode, CV er ikke perfekt, og for å øke anvendbarhet og kvaliteten på resultatene, tilkoblingen med en annen spektroskopiske teknikk er viktig. Vi finnes allerede flere undersøkelser der elektrokjemiske impedans spektroskopi (EIS) teknikken var ansatt14,15,16 , men i dette arbeidet, vi skal vise trinnvis hvordan du forsterke CV teknikken av EIS.
EIS utgangssignalet består av to parametere: reelle og imaginære delene av impedans som funksjoner frekvens17,18,19,20. Det tillater estimering av flere parametere ansvarlig for kostnader overføring gjennom elektrode-løsning grensesnittet: doble lag kapasitans, løsning motstand, gratis overføring motstand, diffusjon impedans og andre parametere avhengig av system undersøkt. Gratis overføre motstanden var et objekt av høy oppmerksomhet siden denne parameteren er direkte relatert til redoks rate konstant. Selv om oksidering og reduksjon rate konstanter er beregnet i løsningen, preger de kan vanligvis evnen til et stoff for gratis utveksling. EIS anses å være en avansert elektrokjemiske teknikken krever dyp matematiske forståelse. Sine viktigste prinsipper er beskrevet i moderne elektrokjemi litteratur17,18,19,20,21,22,23.
Protocol
1. grunnleggende utarbeidelse av et elektrokjemiske eksperiment
- Forberede 4 mL av en fungerende løsning som inneholder 0.1 mol∙L−1 Bu4NBF4 og 0,001 mol∙L−1 undersøkt organisk forbindelse ved å legge til beregnede mengder solid pulver i 4 mL diklormetan i en liten beholder eller et reagensrør. Med 2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenzo [b, d] tiofen-S, S-dioxide (molar masse 802 g∙mol−1), kan du veie 3.208 mg av denne sammensatte og 0.1645 g Bu4NBF4.
- Fylle ut en 3 mL elektrokjemiske cellen med 2 mL bruker en pipette. Den gjenstående delen av løsningen vil være nødvendig senere for impedansmåling og reprodusere resultatene.
- Polsk en 1 mm diameter platina arbeider plate elektrode (vi) for 30 s med polering klut fuktet med flere dråper alumina slurry. Gni den flate overflaten på platen elektroden med et stykke tøy montert på en immobile støtte (f.eks Petriskål) ved å bruke moderate trykk.
- Skyll elektroden med destillert vann tre ganger fjerne alumina partikler.
- Anneal en counter elektrode (CE, platina wire) i en butan brenner flamme. Forsiktig satt platina ledningen i en flamme for mindre enn 1 s og raskt fjerne når den starter rød for å unngå smelter.
Merk: Arealet CE er ikke fastsatt men må være mye høyere enn arealet av arbeider elektroden. I dette tilfellet impedans på arbeider elektrode grensesnitt vil ha stor innvirkning på den totale systemet impedansen og ville tillate unntatt counter elektrode impedans fra vurdering.- Anneal en referanse elektrode (RE, sølv wire) i butan brenner flammer på samme måte.
- Sett alle tre elektroder (arbeider, teller og referanse) i en celle unngå gjensidig kontakt og koble til tilsvarende potentiostat kabler merket som vi, CE og RE. Sett inn en gass leverer rør med argon gassflaske for ytterligere deaeration.
- Åpne gassventilen og deaerate løsning av boblende argon løsningen i 20 min. lukker gassventilen før måling.
2. foreløpig karakterisering av syklisk Voltammetry (slag)
- Registrere i CVA arbeider løsningen i potensielle området fra −2.0 V til + 2.0 V og skanne rate 100 mV∙s−1.
- Innlede programmet syklisk voltammetry potentiostat programvaren.
- Velg 0,0 V som potensielle startverdien, −2.0 V som minimal potensial, + 2.0 V som maksimal skanning potensial, 100 mV∙s−1 som skanning rate. Andre er valgfrie.
- Klikk Start-knappen.
Merk: En typisk voltammogram vises i figur 1.
- Bestemme den potensielle verdien fra CVA innhentet. Merk de potensielle verdiene når maxima positive (anodic peak) og negative (Katodisk peak) gjeldende vises og beregne gjennomsnittsverdien.
- Legg til 10 mg av ferrocene ved slikkepott til fungerende løsning og deaerate det av argon bobler i 5 min. Dette er nødvendig for å blande og komplett oppløsningen av ferrocene lagt til.
Merk: Hvor ferrocene er ikke nøyaktig. Men vil legger til mindre enn 1 mg eller mer enn 20 mg komplisere estimering av likevekt potensielle. - Registrere i CVA arbeider løsningen innen potensielle fra −1.0 V til +1.0 V og skanne rate 100 mV∙s−1. En liten reversibel topp på ferrocene vises som vist i figur 1.
- Bestemme den potensielle verdien av ferrocene reversibel oksidasjon fra CVA innhentet. Merk de potensielle verdiene når maxima positive (anodic peak) og negative (Katodisk peak) gjeldende vises og beregne gjennomsnittsverdien.
- Sette en annen del av løsningen forberedt på trinn 1.1 i cellen og rengjør elektrodene ved å gjenta prosedyren beskrevet i 1.2-1.7.
3. registrering av impedans spektrum
Merk: Et eksempel på oppsettet i programvare er vist i figur 2; noen annen programvare eller andre enheten kan også bli brukt. Imidlertid kan installasjonsprogrammet ordningen variere i forskjellige programvare, selv om de viktigste prinsippene er de samme. Bruk EIS i en trapp modus, i.e. potentiostatic spectra registreres automatisk etter hverandre.
- Velg en potensiell rekke 0,2 V dekker reversibel toppen i CVA i programvaren. Eksempel: En reversibel oksidasjon topp ble oppdaget på CV på 0.7 V. Potensielle området for CV skal være så fra 0,6 V 0,8 V. Til spectra blir registrert med angir hvor 0,01 V, dvs på 0,61 V, 0,62 V, etc.
- Registrere EIS automatisk måling prosedyren under følgende rådet.
- Angi følgende verdiene: første potensielle 0,6 V; fullføre potensielle 0,8 V; potensielle økningen: 0,01 V; frekvensområde: fra 10 kHz gjennom 100 Hz; antall frekvenser i logaritmisk skala: 20; vente på en tid mellom til spectra: 5 s, ac spenning amplitude 10 mV, minimal 2 tiltak pr frekvensområde.
- Klikk Start-knappen.
Merk: I dette tilfellet 21 spectra, hver med 41 frekvens poeng oppnås. Den typiske rekke automatisk registrerte spectra vises i Figur 3.
4. analyse av impedans spektrum
- Starte programmet EIS dynamikken.
- Last ned spekteret ved å velge fil | Åpne.
- I øvre høyre sub vinduet konstruere en EEC ved hjelp av venstre/høyre-museklikk velger serien eller parallell forbindelse og nødvendig element på hurtigmenyen: C - kondensator, R - motstand, W - Warburg element. Start fra den enkleste kretsen (figur 5c).
- Velg første minimal og maksimal for parametere av venstre-mus-klikke tabellceller og skrive inn verdier: C1 - fra 1∙10-7 å 1∙10-8, R1 - fra 2000 til 100, R2 - fra 1000 til 100, Aw - fra 50 000 til 10000.
- Passer modellen ved å velge modell | Tilpass. Gjenta dette flere ganger (vanligvis ca 5 ganger) før de beregnede verdiene ikke lenger endre. Parameterverdiene vises i en tabell i det øvre venstre sub vinduet.
- Når parameteren feil i den siste kolonnen i tabellen. Hvis en feil av en parameter overskrider 100%, som betyr at parameteren ikke er nødvendig for en krets. I så fall kan du prøve en annen tilsvarende krets.
Merk: Hvis man forsøker å passe en eksperimentell spektrum tilsvarer enkel kretsen (figur 5c) for en mer komplisert kretsen (figur 5en), så feil av unødvendige tilleggsparametere W og R3 ville være betydelig høy. - Kontroller verdiene av r2(parametrisk) og r2(amplituden) i det nederste høyre sub vinduet. Hvis de overskrider grensen 1∙102, gjentar du fremgangsmåtene-4.2−4.5 bruker en annen tilsvarende elektrisk krets (EØF) (figur 5).
- Gjenta denne fremgangsmåten 4.1-4.7 for alle spektra registrert
- Hver spektrum analysert, skriv ned den beregnede verdien avgift overføring motstand og tilsvarende potensialet som spekteret ble registrert på.
5. beregning av redoks Rate konstanter
- Sette verdiene for anslagsvis omvendt kostnad overføring motstanden mot muligheter. En typisk potensielle tomt omvendt kostnad overføring motstand for reversibel prosessen vises i figur 6.
- Åpne et tomt ark regneark.
- Angi manuelt verdiene av potensialer og tilsvarende verdier avregnings overføring motstand i kolonne A og B.
- Velg A1:B21 og velge Sett inn | Grafen | Pekte av musen å klikke i oppgave-menyen.
- Tegne inn verdiene for en teoretisk funksjon beregnet av formelen (1) like. Bruke konstantverdier: F = 96485 C∙mol−1, c0 = 0,01 mol∙−1, z = 1, R = 8.314 J∙mol−1∙K−1, α = 0,5, T - omgivelsestemperatur. Bruk tidligere anslått verdi (3.1) E0.
 (1)
(1) (2)
(2)
der Rct−1 er invers verdi for kostnad overføring motstand normalisert av areal; z- antall elektroner overført i ett trinn (akseptert å være lik 1); F- Faraday konstant; c 0- konsentrasjon av undersøkte sammensatt; Α - lade overføring koeffisient (akseptert å være lik 0,5); E- elektrode potensielle; parameteren θ ble introdusert for å forenkle den siste formelen knyttet E og Rct.- Kopier den første kolonnen med verdier (mulige verdier) i samme ark i kolonne D.
- Registrere konstantverdier F, c0, z, R, α, T, E0 k0 engasjert over i celler C1:C8. Bruk verdier E0 = 0, k0 = 1∙10−5.
- Angi formelen (2) for å beregne θ i celle E1: = EXP($C$1*$C$3/($C$4*$C$6)*(D1-$C$7)).
- Kopiere formelen til celler E2:E21 ved å velge E1, klikker Kopier, velge området E2:E21 og klikke Lim inn.
- Legge inn formelen (1) i celle F1: = $C$8*$C$1^2*$C$3^2/($C$4*$C$6)*$C$2*E1^(1-$C$5)/(1+E1).
- Kopiere formelen til celler F2:F21 ved å velge F1, klikker Kopier, velge området F2:F21 og klikke Lim inn.
- Venstre klikk på diagrammet bygget på trinn 5.1, velge Velg data, deretter Legg til og legge til nye datasett ved å angi inn D1:D21 som x området og F1:F21 som y område.
Merk: To grafene: eksperimentelle og simulert automatisk preget av forskjellige farger vises på en koordinere handling.
- Optimalisere funksjonen teoretiske (1) for fir eksperimentelle data av forskjellige verdier av likevekt potensielle (E0) og standard timepris konstant (k0), som target-parameteren.
Merk: Endring av verdiene i celle C7 (E0) og C8 (k0) ville umiddelbart føre til endring av simulert grafen.- Endre verdier i cellene C7 og C8 manuelt for å oppnå likestilling mellom eksperimentelle og simulert graf.
Merk: Endre E0 flytter klokke-lignende kurven langs x -aksen. Endre k0 Angir høyden på klokke-lignende kurven. Dermed kan varierende de to eneste parameterne brukes til å finne en teoretisk modell tilsvarer eksperimentelle resultater (figur 6). Parameteren î± (1) kontroller symmetri av teoretisk topp. Men i virkelige systemer kan asymmetri være forårsaket av forekomsten av side-prosessen i stedet for α. Siden det påvirker k0 resultatverdien anbefaler vi ikke å manipulere α verdi og overlate til lik 0,5.
- Endre verdier i cellene C7 og C8 manuelt for å oppnå likestilling mellom eksperimentelle og simulert graf.
Representative Results
Det første trinnet er syklisk voltammetry karakterisering presentert i figur 1. Anvendelse av EIS var vellykket når forbindelser gjennomgikk rask reversibel elektrokjemiske prosessen. Slik oppførsel var ofte ikke observert for organiske forbindelser men organiske forbindelser som har electroconductivity i et solid state ble funnet for å være en god prøve elektrokjemiske kinetic gransking. Ett slikt organisk forbindelse vises i rammemargen i figur 1.
Registrering av impedans spectra ble gjennomført i henhold til eksperimentelle oppsettet (figur 2), og typisk resulterende rådata er vist i Figur 3. Analyse av impedans spectra ble utført ved hjelp av spesialprogramvare24. Vinduet av programmet åpen tilgang EIS Spectrum analyser24 under resultater behandling er vist i Figur 4. En EEC brukes til å passe spekteret bygges manuelt i øvre høyre sub vinduet. Beregnet EEC parametrene (motstand R1 og R2, kapasitans C1 og diffusion impedans parameter W1) vises i en tabell i venstre øvre sub vinduet. Grafen i nedre venstre sub vinduet illustrerer montering av eksperimentelle resultater (rød poeng) med teoretisk beregnede dataene handlingen (grønn linje).
Flere forskjellige EEC kan passe eksperimentelle spektrum avhengig av prosessene som foregår på elektroden overflaten og deres priser (figur 5). Enkleste semi-uendelig Warburg elementet kan brukes som det ikke er noen forvrengning løsning (f.eks roterende av elektrode) og ingen elektrode belegg begrense spredningen. Ved betydelig rask elektrokjemiske reaksjoner, motstand R3 (figur 5et) var høy nok til å bli neglisjert sammenlignet med andre parallelle grener EØF (figur 5B). Videre når kostnad overføringshastighet (R2) er betydelig høyere enn diffusjon, gratis overføring trinnet blir begrense og en enda enklere EEC (figur 5C) beskriver systemet.
Motstanden R1 er alltid tilstede i EEC. Det tilsvarer eksterne motstanden inkludert kontakter og løsning, unntatt elektrode-surface grensesnitt. Kondensator C1 karakteriserer et dobbelt lag dannet på elektroden grensesnittet. Grenen inkludert motstand og Warburg element diffusjon impedans (figur 5et) tilsvarer en rask elektrokjemiske prosess inkludert to etapper: kinetic og diffusjon, henholdsvis. Tredje Motstandsverdien tilsvarer en tregere elektrokjemiske prosess som foregår på elektroden overflaten og innebærer løsemiddel eller molekyler som har gjennomgått rask oksidering eller reduksjon. I noen tilfeller var parametere, R3 og W1 umulig å beregne. Deretter kan de være betraktet som fraværende og ikke tatt hensyn som figur 5B og 5 C .
Selv om EIS gir en vurdering av flere parametere, er målet element som regnes i dette arbeidet gratis overføring motstanden R2 vanligvis tilordnes som Rct i litteratur17,18,19, som står i parallell til kondensatoren og i serien Warburg element. Sin avhengighet av spenning er vist i figur 6.
Ifølge teorien om elektrokjemiske kinetics (Protocol, trinn 5.2), er gratis overføring motstand direkte relatert til elektrokjemiske standardsats konstant. Selv om eksperimentelle og teoretiske resultatene var ikke ideell, tillatt estimering av verdien av elektrokjemiske standardsats konstante og definert verdien av likevekt potensielle ved maksimal posisjon.
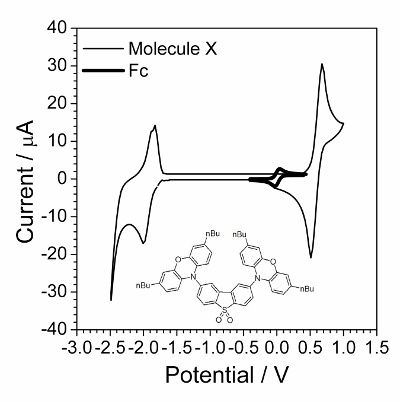
Figur 1 : Syklisk voltammogram av undersøkte sammensatte overlappes av syklisk voltammogram i nærvær av liten mengde ferrocene. Løsning: 1,0 mol∙L−1 Bu4NBF4 og 0,01 mol∙L−1 X i diklormetan. Strukturen av sammensatte X (2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenzo [b, d] tiofen-S, S-dioksid) vises i innfelt. Klikk her for å se en større versjon av dette tallet.

Figur 2 : Eksperimentelle oppsett kontrollerer registrering av 20 spectra innen spenning fra 0,6 til 0,8 V i frekvensområdet fra 10 kHz til 100 Hz med 20 poeng for hvert tiår. Ejeg, Ef- innledende og avsluttende potensialer henholdsvis N - antall trinn, ts- ventetid før hver måling, dt - posten tidsintervall, fjeg, ff- innledende og avsluttende frekvens, ND- antall frekvens poeng i en spektrum, Ven- ac amplitude, pw - del tid i forhold til ett punkt registrering brukes til å bytte til en annen frekvens, Nen- antall målinger på en frekvens, E området, jeg rekkevidde, båndbredde - tekniske parametere. Klikk her for å se en større versjon av dette tallet.

Figur 3 : Skanning av skjermen under impedans spectra registreringen. Øvre høyre sub vinduet: trapp avhengighet av elektroden potensielle tid. Øvre venstre sub vinduet: Nyquist tomten, imaginære impedans (Ordinat), ekte impedans (abciss). Nederste venstre sub vinduet: lover tomten, impedans modul (venstre skala), faseskift (høyre skala), frekvens (vannrett skala). Klikk her for å se en større versjon av dette tallet.

Figur 4 : «EIS spektrum analysator» programvinduet under resultater behandling. Øvre venstre sub vinduet: parametertabellen verdier: C1 - kapasitans, R1, R2 - motstand, W1 - Warburg element; nederste venstre sub vinduet: eksperimentell (grønn poeng) og teoretisk modell (rød linje) spektra; øvre høyre sub vinduet: tilsvarende elektrisk krets; nedre høyre sub vinduet: beregnet statistikk passer. Klikk her for å se en større versjon av dette tallet.

Figur 5 : Tilsvarende kretser funnet for å passe impedans spektra av redoks prosesser på elektroden overflaten. (A) - reversibel elektrokjemiske prosessen med parallell irreversibel prosess, (B) - reversibel elektrokjemiske prosess, (C) - elektrokjemiske prosess med kinetic begrensning scenen. Klikk her for å se en større versjon av dette tallet.

Figur 6 : Inverse verdier av Last overføre motstand beregnet fra EIS mot elektrode muligheter. Linjen viser teoretisk spådd avhengighet etter formelen (2).
Discussion
Denne delen av arbeidet vil bli viet til en forklaring på valgte eksperimentelle forhold og diskusjon av mulige anvendelser av metoden presentert.
Analyse av impedans spektrum kan utføres av forskjellige programvare. De grunnleggende anbefalingene for EEC analysemetode diskuteres her. Må man vet at det er flere passende algoritmer og ulike måter å feil estimering. Vi presenterer et eksempel bruker åpen tilgang programvare utviklet av A. Bondarenko og G. Ragoisha24 (Figur 4).
Nøyaktig anslag av Rct verdi var Hovedmålet med arbeidet. En av årsakene til valg av eksperimentelle forhold var en intensjon å skjule effekten av spredningen. Dermed måtte løsning konsentrasjonen være så høyt som mulig. Mens anskaffe eksperimentelle resultatene som vises her, var konsentrasjonen begrenset på grunn av økonomiske grunner. Frekvensområdet fra 10 kHz til 100 Hz ble valgt å fjerne effekten av diffusjon også. Diffusjon impedans er omvendt proporsjonal med frekvensen mens motstand ikke er avhengig av frekvensen. Effekten av motstand i den høyfrekvente delen av spekteret var høyere enn i den lavfrekvente delen. Spectra ble ikke registrert ved frekvenser som er lavere enn 100 Hz fordi disse data ville være unyttig for motstand beregning. Alle elektrokjemiske resultatene i ikke-vandig løsemiddel presenteres versus ferrocene-oksidert / ferrocene kombinert likevekt potensielle. Derfor utføres trinnene 2.3-2.5.
Vi vurderte EIS programmet organiske molekyler karakterisering. Analyse av andre EEC-parametere og deres mulige avhengigheter i perspektiv kan føre til andre effekter åpenbaring og elektrokjemiske karakterisering av forbindelser i løsningen. Estimering av redoks rate konstanter er nyttig for å beskrive the kinetics av electroactive sammensatte reduksjon eller oksidering og forutsi materiale atferd i oksiderende eller redusere middels.
Disclosures
Forfatterne ikke avsløre.
Acknowledgments
Forfatterne takknemlig anerkjenner økonomisk støtte av "Excilight" prosjekt "Donor-Acceptor lys Emitting Exciplexes som materiale for enkel-å-skreddersy supereffektive OLED lyn" (H2020-MSCA-ITN-2015/674990) finansiert av Marie Skłodowska-Curie Handlinger i rammeprogram for forskning og innovasjon "Horizon-2020".
Materials
| Name | Company | Catalog Number | Comments |
| Potentiostat | BioLogic | SP-150 | |
| Platinum disc electrode | eDAQ | ET075 | 1 mm diameter |
| Platinum wire | − | − | counter electrode |
| Silver wire | − | − | silver electrode |
| Electrochemical cell | eDAQ | ET080 | 3 mL volume |
| Polishing cloth | eDAQ | ET030 | |
| Alumina slurry | eDAQ | ET033 | 0.05 µm |
| Butane torch | Portasol | Mini-Torch/Heat Gun | |
| Dichloromethane (DCM) | Sigma-Aldrich | 106048 | |
| Tetrabutylammonium tetrafluoroborate (Bu4NBF4) | Sigma-Aldrich | 86896 |
References
- Cunningham, A. J., Underwood, A. L. Cyclic Voltammetry of the Pyridine Nucleotides and a Series of Nicotinamide Model Compounds. Biochemistry. 6, 266-271 (1967).
- Laba, K., et al. Diquinoline derivatives as materials for potential optoelectronic applications. J Phys Chem C. 119, 13129-13137 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Electrochemistry and spectroelectrochemistry of a novel selenophene-based monomer. Electrochim Acta. 59, 567-572 (2012).
- Laba, K., et al. Electrochemically induced synthesis of poly(2,6-carbazole). Macromol Rapid Commun. 36, 1749-1755 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of alkyl chain on electrochemical and spectroscopic properties of polyselenophenes. Electrochim Acta. 87, 438-449 (2013).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of heteroaryl group on electrochemical and spectroscopic properties of conjugated polymers. Electrochim Acta. 83, 271-282 (2012).
- Gora, M., et al. EPR and UV-vis spectroelectrochemical studies of diketopyrrolopyrroles disubstituted with alkylated thiophenes. Synth Met. 216, 75-82 (2016).
- Pluczyk, S., Zassowski, P., Quinton, C., Audebert, P., Alain-Rizzo, V., Lapkowski, M. Unusual Electrochemical Properties of the Electropolymerized Thin Layer Based on a s-Tetrazine-Triphenylamine Monomer. J Phys Chem C. 120, 4382-4391 (2016).
- Data, P., Motyka, M., Lapkowski, M., Suwinski, J., Monkman, A. Spectroelectrochemical Analysis of Charge Carries as a Way of Improving Poly(p-phenylene) Based Electrochromic Windows. J Phys Chem C. 119, 20188-20200 (2015).
- Enengl, S., et al. Spectroscopic characterization of charge carriers of the organic semiconductor quinacridone compared with pentacene during redox reactions. J Mater Chem C. 4, 10265-10278 (2016).
- Piwowar, K., Blacha-Grzechnik, A., Turczyn, R., Zak, J. Electropolymerized phenothiazines for the photochemical generation of singlet oxygen. Electrochim Acta. 141, 182-188 (2014).
- Blacha-Grzechnik, A., Turczyn, R., Burek, M., Zak, J. In situ Raman spectroscopic studies on potential-induced structural changes in polyaniline thin films synthesized via surface-initiated electropolymerization on covalently modified gold surface. Vib Spectrosc. 71, 30-36 (2014).
- Blacha-Grzechnik, A., et al. Phenothiazines grafted on the electrode surface from diazonium salts as molecular layers for photochemical generation of singlet oxygen. Electrochim Acta. 182, 1085-1092 (2015).
- Data, P., et al. Evidence for Solid State Electrochemical Degradation Within a Small Molecule OLED. Electrochim Acta. 184, 86-93 (2015).
- Data, P., et al. Electrochemically Induced Synthesis of Triphenylamine-based Polyhydrazones. Electrochim Acta. 230, 10-21 (2017).
- Data, P., et al. Kesterite Inorganic-Organic Heterojunction for Solution Processable Solar Cells. Electrochim Acta. 201, 78-85 (2016).
- Barsoukov, E., Macdonald, J. R. Impedance Spectroscopy: Theory, Experiment, and Applications. , Wiley. (2005).
- Orazem, M. E., Tribollet, B. Electrochemical Impedance Spectroscopy. , Wiley. (2008).
- Lasia, A. Electrochemical Impedance Spectroscopy and its Applications. , Springer. (2014).
- Bard, A. J., Faulkner, L. R. Electrochemical Methods: Fundamentals and Applications. , Wiley. (2013).
- Scholz, F. Electroanalytical methods: Guide to Experiment and Application. , Springer. (2010).
- Conway, B. E., Bockris, J. O. 'M., White, R. E. Modern Aspects of Electrochemistry. 32, Kluwer Academic Publishers. (2002).
- Encyclopedia of Electrochemistry: V. 3. Instrumentation and Electroanalytical Chemistry. Bard, A. J., Starttman, M., Unwin, P. R. , Wiley. (2003).
- EIS spectrum analyser software. , Available from: http://www.abc.chemistry.bsu.by/vi/analyser (2017).



 (1)
(1) (2)
(2)