Summary
Espectroscopia de impedância eletroquímica (EIS) das espécies que sofrem oxidação reversível ou redução em solução foi utilizada para determinação das constantes de velocidade de oxidação ou redução.
Abstract
Espectroscopia de impedância eletroquímica (EIS) foi usada para avançado caracterização de compostos orgânicos eletroativos juntamente com voltametria cíclica (CV). No caso de processos eletroquímicos rapidamente reversíveis, corrente é predominantemente afetado pela taxa de difusão, que é a etapa mais lenta e limitante. SIE é uma técnica poderosa que permite uma análise separada de etapas de transferência de carga que tem resposta de frequência AC diferente. A capacidade do método foi usada para extrair o valor da resistência de transferência de carga, que caracteriza a taxa de câmbio de carga na interface eletrodo-solução. A aplicação desta técnica é ampla, de bioquímica até eletrônica orgânica. Neste trabalho, apresentamos o método de análise de compostos orgânicos para aplicações de optoeletrônicos.
Introduction
Taxa de redox do complexo eletroativos é um parâmetro importante, caracterizando a sua capacidade de sofrer processos de oxidação ou redução e prever o seu comportamento na presença de oxidantes fortes ou agentes redutores ou sob potencial aplicada. No entanto, a maioria das técnicas eletroquímicas só é capazes de descrever qualitativamente a cinética do processo redox. Entre várias técnicas eletroquímicas empregadas para compostos ativos redox, caracterização de voltametria cíclica (CV) é o método mais prevalecente para caracterização eletroquímica rápida e suficiente de várias espécies solúveis1, 2,3. A técnica de CV tem amplas aplicações, por exemplo, as estimativas de níveis de energia a4,5,6, a análise de portadores de carga suportada pela espectroscopia7,8, 9 , 10, até modificações de superfície11,12,13. Como cada método, CV não é perfeito e para aumentar a aplicabilidade e a qualidade dos resultados, a conexão com outra técnica espectroscópica é importante. Já apresentamos várias investigações onde foi a técnica de espectroscopia (EIS) de impedância electroquímica independentes14,15,16 , mas neste trabalho, pretendemos mostrar passo a passo como reforçar a técnica de CV por EIS.
O sinal de saída do SIE consiste de dois parâmetros: as partes real e imaginária da impedância como funções de frequência17,18,19,20. Permite estimativa de vários parâmetros do responsável pela transferência de carga através da interface eletrodo-solução: dobro da capacidade da camada, resistência de solução, resistência de transferência de carga, impedância de difusão e outros parâmetros dependendo do sistema investigada. Resistência de transferência de carga foi um objeto de atenção elevada, desde que este parâmetro está diretamente relacionado com a constante de velocidade de redox. Apesar de constantes de taxa de oxidação e redução são estimados em solução, eles geralmente podem caracterizar a capacidade de um composto para a troca de carga. SIE é considerado uma técnica avançada de eletroquímica necessidade de profundo conhecimento matemático. Seus principais princípios são descritos em eletroquímica moderna literatura17,18,19,20,21,22,23.
Protocol
1. preparação básica de um experimento de eletroquímica
- Preparar 4 mL de uma solução de trabalho contendo 0,1 mol∙L− 1 Bu4NBF4 e 0,001 mol∙L− 1 investigado composto orgânico pela adição de quantidades calculadas de pós sólidos em 4 mL de diclorometano em um pequeno vaso ou um tubo de ensaio. Com 2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenzo [b, d] tiofeno-S, S-dióxido (massa molar 802 g∙mol− 1), pese 3,208 mg deste composto e 0,1645 g de Bu4NBF4.
- Preencha uma célula eletroquímica de 3 mL com 2 mL de solução com uma pipeta. A parte restante da solução será necessário mais tarde para a medição de impedância e reproduzir os resultados.
- Polir um eletrodo de disco de trabalho (WE) 1 mm diâmetro platina durante 30 s usando um polimento pano umedecido por algumas gotas de chorume da alumina. Esfregue a superfície plana do eléctrodo disco com um pedaço de pano montado sobre um suporte imóvel (por exemplo, placa de Petri), aplicando uma pressão moderada.
- Lave o eletrodo com água destilada três vezes para remover partículas de alumina.
- Recoze a um elétrodo contrário (CE, fio de platina), em uma chama do queimador de butano. Cuidadosamente coloque o fio de platina em uma chama para menos de 1 s e remover rapidamente quando começa a vermelhidão para evitar derretimento.
Nota: A área de superfície de CE não é estipulada, mas deve ser muito maior do que a área da superfície do eletrodo de trabalho. Neste caso, impedância da interface do eletrodo de trabalho teria o maior impacto sobre a impedância total do sistema e permitiria que, excluindo a impedância do eléctrodo de contador de consideração.- Recoze a um eléctrodo de referência (RE, fio de prata) na chama do queimador butano da mesma maneira.
- Coloque todos os três eletrodos (trabalho, contador e referência) numa célula evitando mútuos entre em contato e conectem os cabos de potentiostat correspondente marcado como nós, CE e RE. Inserir um gás entregando tubo conectado com a garrafa de gás argônio para mais de desaeração.
- Abra a válvula de gás e desarear solução por argônio subido através da solução de 20 min. fechar a válvula de gás antes da medição.
2. preliminar caracterização por voltametria cíclica (CVA)
- Registrar o CVA da solução de trabalho dentro de uma faixa de potencial de −2.0 V a 2,0 V e digitalizar taxa 100 mV∙s− 1.
- Lançamento do programa voltametria cíclica no software potentiostat.
- Escolha 0.0 V como valor potencial inicial, −2.0 V como mínimo potencial, 2,0 V como máximo potencial, 100 mV∙s− 1 como taxa de varredura de digitalização. Outros parâmetros são opcionais.
- Clique no botão Iniciar.
Nota: Um voltammogram típico é apresentado na Figura 1.
- Determine o valor potencial de CVA obtido. Observe os valores potenciais quando maxima de positivo (pico anódico) e negativo (pico catódico) corrente aparece e calcular o valor médio.
- Adicionar 10 mg de ferroceno, espátula para a solução de trabalho e desareá-lo por argônio borbulhando por 5 min. Isto é necessário para a mistura e dissolução completa do ferroceno adicionado.
Nota: A quantidade de ferroceno não seja precisa. No entanto, adicionando-se menos de 1 mg ou mais de 20 mg complicaria a estimativa do potencial de equilíbrio. - Registrar o CVA da solução de trabalho dentro do intervalo de potencial de −1.0 V a 1,0 V e digitalizar taxa 100 mV∙s− 1. Um pequeno pico reversível de ferroceno aparecerá como mostrado na Figura 1.
- Determine o valor potencial de oxidação reversível de ferroceno de CVA obtido. Observe os valores potenciais quando maxima de positivo (pico anódico) e negativo (pico catódico) corrente aparece e calcular o valor médio.
- Coloque outra porção de solução preparada no passo 1.1 dentro da célula e limpe os eléctrodos, repetindo o procedimento descrito em 1,2-1,7.
3. registro do espectro de impedância
Nota: Um exemplo de configuração do software é mostrado na Figura 2; qualquer outro software ou dispositivo também pode ser usado. No entanto, o arranjo de configuração pode diferir em software diferente, embora os princípios essenciais permanecem os mesmos. Use o sie em um modo de escada, ou seja, potentiostatic espectros são registrados automaticamente um após o outro.
- No software, escolha uma gama potencial de 0,2 V cobrindo o pico reversível da CVA. Exemplo: Um pico de oxidação reversível foi detectado no CV em 0.7 V. O alcance potencial para CV deve ser em seguida de 0,6 V 0.8 V. Os espectros serão registrados com o incremento de 0,01 V, ou seja, em 0,61 V, 0.62 V, etc.
- Registre o procedimento de medição automática de sie seguintes condições aconselhado.
- Insira os seguintes valores de entrada: inicial potencial 0.6 V; terminar o potencial 0.8 V; incremento potencial: 0,01 V; escala de frequência: de 10 kHz através de 100 Hz; o número de frequências em escala logarítmica: 20; esperar por um tempo entre os espectros: 5 s, ac tensão amplitude 10 mV, mínimas 2 medidas por frequência.
- Clique no botão Iniciar.
Nota: neste caso, 21 espectros, cada um contendo 41 pontos de frequência será obtido. O conjunto típico de espectros automaticamente registrados é apresentado na Figura 3.
4. análise do espectro de impedância
- Lançamento do programa analisador de espectro de sie.
- Baixar o espectro escolhendo arquivo | Aberto.
- Na janela superior direito sub construir um EEC usando clique esquerdo/direito do mouse, escolhendo a conexão de série ou paralelo e elemento necessário no menu de contexto: C - capacitor, R - resistor, W - elemento de Warburg. Iniciar a partir do circuito mais simples (Figura 5c).
- Escolha iniciais valores mínimos e máximas para parâmetros pela esquerda-clique do mouse as células da tabela e entrando no: C1 - de 1∙10-7 a 1∙10-8, R1 - 2000-100, R2 - de 1000 para 100, Aw - de 50000 para 10000.
- Ajustar o modelo escolhendo modelo | Ajuste. Repita o procedimento várias vezes (geralmente cerca de 5 vezes) até que os valores calculados já não mudam. Valores de parâmetro são mostrados em uma tabela na janela sub esquerda superior.
- Verifique os erros de parâmetro mostrados na última coluna da tabela. Se um erro de um parâmetro excede 100%, isso significa que o parâmetro não é necessário para um circuito. Nesse caso, tente outro circuito equivalente.
Nota: Se um tenta encaixar um espectro experimental correspondente ao circuito simples (Figura 5c) por um circuito mais complicado (Figura 5um), então erros de parâmetros adicionais desnecessários W e R3 seria consideravelmente alta. - Verifique os valores de r2(paramétrico) e r2(amplitude) apresentado na janela inferior direita sub. Se ultrapassarem o limite 1∙10− 2, repita os procedimentos 4.2−4.5 usando outro circuito elétrico equivalente (CEE) (Figura 5).
- Repita o procedimento 4.1-4,7 para todos os espectros registrados
- Para cada espectro analisado, anote o valor calculado da resistência de transferência de carga e o potencial correspondente que o espectro foi registrado no.
5. cálculo das constantes de velocidade de Redox
- Colocar os valores da resistência contra a potencial transferência estimada carga inversa. Uma típica trama potencial de resistência de transferência carga inversa pelo processo reversível é apresentada na Figura 6.
- Abra uma folha vazia do software de planilha eletrônica.
- Inserir manualmente os valores de potenciais e os correspondentes valores de resistência de transferência de autoliquidação nas colunas A e B.
- Selecione o intervalo de A1:B21 e escolha Insert | Gráfico | Apontou pelo mouse, clicando no menu tarefa.
- Plotar os valores de uma função teórica calculada pela fórmula (1) sobre o mesmo enredo. Usar valores de constantes: F = 96485 C∙mol− 1, c0 = 0,01 mol∙− 1, z = 1, R = 8.314 J∙mol− 1∙K− 1, α = 0,5, T - temperatura ambiente. Use o valor estimado anteriormente (3.1) E0.
 (1)
(1) (2)
(2)
onde Rct− 1 é o valor inverso da resistência de transferência de carga normalizado por área de superfície; z- número de elétrons transferidos em uma única etapa (aceito sendo igual 1); F- constante de Faraday; c 0- concentração do composto investigado; Α - coeficiente de transferência de carga (aceito sendo igual 0.5); E- eletrodo de potencial; parâmetro θ foi introduzido para simplificar a fórmula final relativas E e Rct.- Copie a primeira coluna de valores (valores potenciais) na mesma folha na coluna D.
- Insira os valores de constantes de F, c0, z, R, α, T, E0, k0 alistados acima em células C1:C8. Valores de uso E0 = 0, k0 = 1∙105.
- Digite a fórmula (2) para calcular θ na célula E1: = EXP($C$1*$C$3/($C$4*$C$6)*(D1-$C$7)).
- Copie a fórmula para células E2:E21 selecionando E1, clicando em copiar, selecionar o intervalo E2:E21 e clicar em colar.
- Insira a fórmula (1) na célula F1: = $C$8*$C$1^2*$C$3^2/($C$4*$C$6)*$C$2*E1^(1-$C$5)/(1+E1).
- Copie a fórmula para células F2:F21 selecionando F1, clicando em copiar, selecionar o intervalo F2:F21 e clicar em colar.
- Clique com o botão esquerdo no gráfico construído no passo 5.1, escolha escolher dados, em seguida, Adicionar e adicionar o novo conjunto de dados especificando entrando D1:D21 como x gama e F1:F21 como intervalo de y.
Nota: Dois grafos: experimental e simulado automaticamente marcado por cores diferentes aparecerão em um terreno de coordenadas.
- Otimize a função teórica (1) a fim de dados experimentais do abeto por diferentes valores de equilíbrio potencial (E0) e constante de taxa padrão (k0), sendo o parâmetro de destino.
Nota: Alterar os valores nas células C7 (E0) e C8 (k0) imediatamente causaria mudança do gráfico simulado.- Alterar valores em células C7 e C8 manualmente a fim de alcançar a igualdade entre gráfico experimental e simulado.
Nota: Mudança E0 move-se a curva de sino, como ao longo do eixo x . Mudança de k0 controla a altura da curva de sino-como. Assim, variar os dois únicos parâmetros pode ser usado para encontrar um modelo teórico correspondente aos resultados experimentais (Figura 6). Parâmetro α (1) controles simetria de pico teórica. No entanto, em sistemas reais a assimetria pode ser causada pela ocorrência de lado-processo, em vez de α. Desde que isso influencia o valor resultante de0 k, recomendamos não para manipular o valor α e deixá-lo igual a 0,5.
- Alterar valores em células C7 e C8 manualmente a fim de alcançar a igualdade entre gráfico experimental e simulado.
Representative Results
O primeiro passo é a caracterização de voltametria cíclica, apresentada na Figura 1. Aplicação do sie foi bem-sucedida quando compostos foi submetido o processo eletroquímico rapidamente reversível. Tal comportamento muitas vezes não foi observado por compostos orgânicos, mas compostos orgânicos que possuem eletrocondutividade em estado sólido foi encontrado para ser um bom espécime para investigação cinética eletroquímica. Um tal composto orgânico é mostrado a inserção da Figura 1.
Registo de espectros de impedância foi realizado de acordo com a instalação experimental (Figura 2), e dados resultantes crus típicos são mostrados na Figura 3. Análise dos espectros de impedância foi realizada usando um software especial24. A janela do programa de acesso aberto de analisador de espectro EIS24 durante o processamento de resultados é mostrada na Figura 4. Um EEC costumava caber o espectro é construído manualmente na janela superior direito sub. Os parâmetros de EEC calculados (Resistências R1 e R2, capacitância C1 e difusão impedância parâmetro W1) são mostrados em uma tabela na janela sub superior esquerda. O gráfico na janela sub esquerda inferior ilustra o encaixe de resultados experimentais (pontos vermelhos), com o enredo de dados calculados teoricamente (linha verde).
Vários diferentes EEC pode caber espectro experimental dependendo dos processos que ocorrem na superfície do elétrodo e suas taxas (Figura 5). O elemento de Warburg semi-infinita mais simples pode ser usado como não há nenhuma distorção da solução (por exemplo, rotação de misturar o eletrodo) e sem revestimento de eletrodo, limitando a difusão. Em caso de reações eletroquímicas consideravelmente rápido, resistência R3 (Figura 5A) era alta o suficiente para ser negligenciada em comparação com outros ramos paralelos da CEE (Figura 5B). Além disso, quando a taxa de transferência de carga (R2) é significativamente maior do que a difusão, a etapa de transferência de carga torna-se limitando e uma CEE ainda mais simples (Figura 5C) descreve o sistema.
O resistor série R1 está sempre presente na CEE. Corresponde à resistência externa incluindo conectores e solução, exceto interface eletrodo-superfície. Capacitor C1 caracteriza uma dupla camada formada na interface do eletrodo. O ramo incluindo Warburg elemento difusão impedância (Figura 5A) e o resistor corresponde a um processo rápido eletroquímico, incluindo duas fases: cinética e difusão, respectivamente. O terceiro resistor corresponde a um lento processo eletroquímico que ocorre na superfície do eletrodo e envolve solvente ou moléculas que sofreram rápida oxidação ou redução. Em alguns casos, parâmetros, R3 e W1 eram impossíveis de estimar. Então eles podem ser considerados como ausente e não tidos em conta como mostra Figura 5B e 5C .
Embora EIS fornece uma estimativa de vários parâmetros, o elemento de destino, que é considerado neste trabalho é resistor de transferência de carga R2 normalmente atribuído como Rct em literatura17,18,19, que fica em paralelo com o capacitor e em série para o elemento de Warburg. Sua dependência da tensão é mostrada na Figura 6.
De acordo com a teoria da cinética eletroquímica (protocolo, passo 5.2), resistência de transferência de carga está diretamente relacionada com a constante de taxa padrão eletroquímico. Mesmo que a correspondência entre experimental e teórica resultados não era ideal, permitiu a estimativa do valor da constante taxa padrão eletroquímico e definido o valor do potencial de equilíbrio por posição máxima.
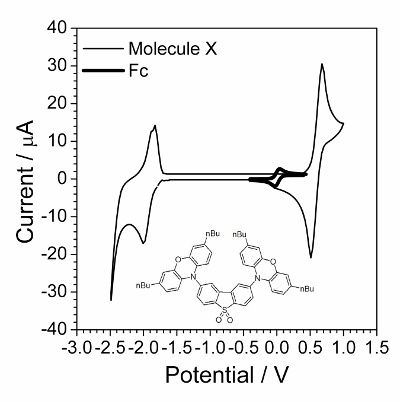
Figura 1 : Voltammogram cíclica do composto investigado sobreposto por voltammogram cíclica na presença de pequena quantidade de ferroceno. Solução: 1,0 mol∙L− 1 Bu4NBF4 e 0,01 mol∙L− 1 X em diclorometano. Estrutura do composto X (2,8-bis(3,7-dibutyl-10H-phenoxazin-10-yl) dibenzo [b, d] tiofeno-S, S-dióxido) é mostrado no baixo-relevo. Clique aqui para ver uma versão maior desta figura.

Figura 2 : Instalação experimental controlando registro dos 20 espectros dentro do intervalo de tensão de 0,6 a 0,8 V na faixa de frequência de 10 kHz a 100 Hz com 20 pontos para cada década. Eeu, Ef- potenciais de iniciais e finais respectivamente, N - número de passos, ts- tempo de espera antes de cada medição, frequência inicial e final dt - intervalo de tempo recorde, feu, f,f- N-D- número de frequência pontos em um espectro, Vum- ac amplitude, pw - parte do tempo a respeito de um ponto de registro usado para alternar para outra frequência, Num- número de medições em uma frequência, gama E, distância, largura de banda - parâmetros técnicos. Clique aqui para ver uma versão maior desta figura.

Figura 3 : Varredura de tela durante o registo de espectros de impedância. Superior direita sub janela: dependência da escadaria do potencial de eletrodo no tempo. Superior esquerda sub-janela: lote de Nyquist, imaginária impedância (ordenada), impedância real (abciss). Inferior esquerda sub-janela: Bode plot, módulo de impedância (escala esquerda), mudança de fase (escala da direita), frequência (escala horizontal). Clique aqui para ver uma versão maior desta figura.

Figura 4 : Janela de programa «Analisador de espectro EIS» durante o processamento de resultados. Superior esquerda sub-janela: tabela de valores de parâmetro: C1 - capacitância, R1, R2 - resistências, W1 - elemento de Warburg; inferior esquerda sub-janela: experimentais (pontos verdes) e espectros de modelo teórico (linha vermelha); superior direita sub janela: circuito elétrico equivalente; inferior direita sub janela: calculadas estatísticas de encaixe. Clique aqui para ver uma versão maior desta figura.

Figura 5 : Circuitos elétricos equivalentes encontraram para caber os espectros de impedância de processos redox na superfície do eletrodo. (A) processo de reversível processo electroquímico, (C) - eletroquímica - processo eletroquímico reversível acompanhado por paralelo processo irreversível, (B) - com palco cinético de limitação. Clique aqui para ver uma versão maior desta figura.

Figura 6 : Transferência de valores inverso da carga resistência estimada a partir de EIS contra o potencial de eletrodo. A linha retrata a dependência teoricamente prevista de acordo com a fórmula (2).
Discussion
Esta parte do trabalho será dedicada à explicação das condições experimentais escolhidas e discussão de possíveis aplicações do método apresentado.
Análise de espectro de impedância pode ser realizada por diversos softwares. Aqui, as recomendações básicas para o método de análise de EEC são discutidas. É preciso saber que existem vários algoritmos de encaixe e várias formas de estimativa de erro. Nós apresentamos um exemplo do uso de software de acesso aberto, desenvolvido pela r. Bondarenko e Ragoisha G.24 (Figura 4).
Estimativa exata de Rct valor foi o principal objetivo do trabalho. Uma das razões para a escolha das condições experimentais foi a intenção de esconder o impacto de difusão. Assim, a concentração da solução tinha que ser o mais alto possível. Ao adquirir os resultados experimentais mostrados aqui, a concentração foi limitada devido a razões econômicas. A gama de frequências de 10 kHz a 100 Hz foi escolhida para eliminar o efeito de difusão também. Impedância de difusão é inversamente proporcional à frequência, enquanto que a resistência não é dependente da frequência. O efeito da resistência na parte do espectro de alta frequência foi maior do que na parte de baixa frequência. Espectros não foram registrados nas frequências inferiores a 100 Hz, porque estes dados seria inútil para cálculo de resistência. Todos os resultados de eletroquímicos obtidos em solventes não aquosos são apresentados contra ferroceno-oxidado / ferroceno acoplado equilíbrio potencial. Por esta razão, são realizadas etapas 2.3-2.5.
Consideramos o aplicativo sie para caracterização de moléculas orgânicas. Análise de outros parâmetros de EEC e suas dependências potenciais em perspectiva pode levar à revelação de outros efeitos e caracterização eletroquímica de compostos em solução. Estimativa das constantes de velocidade de redox é útil para descrever a cinética de redução de compostos eletroativos ou oxidação e predizer o comportamento do material em oxidação ou redução média.
Disclosures
Os autores não têm nada para divulgar.
Acknowledgments
Os autores reconhecem com gratidão o apoio financeiro do projeto "Excilight", "Doador-aceitador Light Emitting Exciplexes como materiais para fácil-para-alfaiate ultra-eficiente OLED relâmpago" (H2020-ACEM-ITN-2015/674990) financiado pela Marie Skłodowska-Curie Ações no âmbito do programa quadro de investigação e de inovações "Horizonte 2020".
Materials
| Name | Company | Catalog Number | Comments |
| Potentiostat | BioLogic | SP-150 | |
| Platinum disc electrode | eDAQ | ET075 | 1 mm diameter |
| Platinum wire | − | − | counter electrode |
| Silver wire | − | − | silver electrode |
| Electrochemical cell | eDAQ | ET080 | 3 mL volume |
| Polishing cloth | eDAQ | ET030 | |
| Alumina slurry | eDAQ | ET033 | 0.05 µm |
| Butane torch | Portasol | Mini-Torch/Heat Gun | |
| Dichloromethane (DCM) | Sigma-Aldrich | 106048 | |
| Tetrabutylammonium tetrafluoroborate (Bu4NBF4) | Sigma-Aldrich | 86896 |
References
- Cunningham, A. J., Underwood, A. L. Cyclic Voltammetry of the Pyridine Nucleotides and a Series of Nicotinamide Model Compounds. Biochemistry. 6, 266-271 (1967).
- Laba, K., et al. Diquinoline derivatives as materials for potential optoelectronic applications. J Phys Chem C. 119, 13129-13137 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Electrochemistry and spectroelectrochemistry of a novel selenophene-based monomer. Electrochim Acta. 59, 567-572 (2012).
- Laba, K., et al. Electrochemically induced synthesis of poly(2,6-carbazole). Macromol Rapid Commun. 36, 1749-1755 (2015).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of alkyl chain on electrochemical and spectroscopic properties of polyselenophenes. Electrochim Acta. 87, 438-449 (2013).
- Data, P., Lapkowski, M., Motyka, M., Suwinski, J. Influence of heteroaryl group on electrochemical and spectroscopic properties of conjugated polymers. Electrochim Acta. 83, 271-282 (2012).
- Gora, M., et al. EPR and UV-vis spectroelectrochemical studies of diketopyrrolopyrroles disubstituted with alkylated thiophenes. Synth Met. 216, 75-82 (2016).
- Pluczyk, S., Zassowski, P., Quinton, C., Audebert, P., Alain-Rizzo, V., Lapkowski, M. Unusual Electrochemical Properties of the Electropolymerized Thin Layer Based on a s-Tetrazine-Triphenylamine Monomer. J Phys Chem C. 120, 4382-4391 (2016).
- Data, P., Motyka, M., Lapkowski, M., Suwinski, J., Monkman, A. Spectroelectrochemical Analysis of Charge Carries as a Way of Improving Poly(p-phenylene) Based Electrochromic Windows. J Phys Chem C. 119, 20188-20200 (2015).
- Enengl, S., et al. Spectroscopic characterization of charge carriers of the organic semiconductor quinacridone compared with pentacene during redox reactions. J Mater Chem C. 4, 10265-10278 (2016).
- Piwowar, K., Blacha-Grzechnik, A., Turczyn, R., Zak, J. Electropolymerized phenothiazines for the photochemical generation of singlet oxygen. Electrochim Acta. 141, 182-188 (2014).
- Blacha-Grzechnik, A., Turczyn, R., Burek, M., Zak, J. In situ Raman spectroscopic studies on potential-induced structural changes in polyaniline thin films synthesized via surface-initiated electropolymerization on covalently modified gold surface. Vib Spectrosc. 71, 30-36 (2014).
- Blacha-Grzechnik, A., et al. Phenothiazines grafted on the electrode surface from diazonium salts as molecular layers for photochemical generation of singlet oxygen. Electrochim Acta. 182, 1085-1092 (2015).
- Data, P., et al. Evidence for Solid State Electrochemical Degradation Within a Small Molecule OLED. Electrochim Acta. 184, 86-93 (2015).
- Data, P., et al. Electrochemically Induced Synthesis of Triphenylamine-based Polyhydrazones. Electrochim Acta. 230, 10-21 (2017).
- Data, P., et al. Kesterite Inorganic-Organic Heterojunction for Solution Processable Solar Cells. Electrochim Acta. 201, 78-85 (2016).
- Barsoukov, E., Macdonald, J. R. Impedance Spectroscopy: Theory, Experiment, and Applications. , Wiley. (2005).
- Orazem, M. E., Tribollet, B. Electrochemical Impedance Spectroscopy. , Wiley. (2008).
- Lasia, A. Electrochemical Impedance Spectroscopy and its Applications. , Springer. (2014).
- Bard, A. J., Faulkner, L. R. Electrochemical Methods: Fundamentals and Applications. , Wiley. (2013).
- Scholz, F. Electroanalytical methods: Guide to Experiment and Application. , Springer. (2010).
- Conway, B. E., Bockris, J. O. 'M., White, R. E. Modern Aspects of Electrochemistry. 32, Kluwer Academic Publishers. (2002).
- Encyclopedia of Electrochemistry: V. 3. Instrumentation and Electroanalytical Chemistry. Bard, A. J., Starttman, M., Unwin, P. R. , Wiley. (2003).
- EIS spectrum analyser software. , Available from: http://www.abc.chemistry.bsu.by/vi/analyser (2017).



 (1)
(1) (2)
(2)