Summary
Um protocolo para a síntese de um 1,2-Ditiolano modificado de peptídeo e a caracterização das estruturas supramoleculares resultantes do peptide auto-montagem.
Abstract
Este relatório centra-se na síntese de um N-terminal 1,2-Ditiolano modificado auto-montagem de peptídeo e a caracterização dos resultante Self montadas estruturas supramoleculares. A rota sintética tira proveito da síntese do peptide de fase sólida com o engate em resina Ditiolano precursor da molécula de, 3-(acetylthio) -2-ácido (acetylthiomethyl) e o tioacetato assistida por microondas deprotection do peptide N-terminal antes de clivagem final da resina para produzir o 1,2-Ditiolano modificado do peptide. Após a purificação de cromatografia líquida de alto desempenho (HPLC) do peptide 1,2-Ditiolano, derivado do núcleo de nucleação do peptide Aβ associado com a doença de Alzheimer, o peptídeo é mostrado a auto-montagem em fibras de amiloides Cruz-β. Protocolos para caracterizar as fibras amiloides por espectroscopia de infravermelho-transformada de Fourier (FT-IR), espectroscopia de Dicroísmo circular (CD) e microscopia eletrônica de transmissão (TEM) são apresentados. Os métodos de modificação do N-terminal com um grupo de 1,2-Ditiolano bem caracterizadas péptidos auto-montagem agora podem ser explorados como sistemas modelo para desenvolver estratégias de modificação pós-montagem e explorar o dinâmica química covalente superfícies de nanofibras de peptídeo supramolecular.
Introduction
Robusta peptídica formando a química envolvida na síntese do peptide de fase sólida e a capacidade de controlar a composição e o comprimento da sequência fazer os peptídeos que auto-montagem em estruturas supramoleculares um campo fortemente pesquisado. Os fatores que controlam e estabilizar a estrutura Self montada do peptide, incluindo cadeia lateral estérica e interações eletrostáticas, ligações de hidrogênio e efeitos hidrofóbicos1, servem como um conjunto de regras de design. Como a investigação sobre essas regras de design fundamental continua a progredir, o próximo passo lógico na peptídeo auto-montagem envolve expandir a diversidade de funções e estruturas do peptide-baseado. Ao montar auto peptídeos são um biomaterial versátil que foram usados para muitas aplicações biomédicas ajustando o peptídeo sequência ou conjunto condições2,3,4, o desenvolvimento de estratégias para modificações pós-montagem do peptide nanofibras5,6,7,8,9 continua a ser uma área relativamente inexplorada.
Bissulfeto dinâmico intercâmbio e tiol química na superfície de estruturas supramoleculares é uma área que tem potencial para produzir biomateriais novos e funcionais. A incorporação de partes de 1,2-Ditiolano (comumente um derivado do ácido lipoico (la) ou asparagúsico (aa)) têm sido relatados em lipossomas sistemas10,11,12,de copolímeros bloco13e como organizando as âncoras às superfícies14,15. Neste documento, nós relatamos a síntese e caracterização de um peptídeo de auto-montagem derivado do núcleo de nucleação do peptide Aβ associado com a doença de Alzheimer que é modificada no N-terminal com um grupo funcional de 1,2-Ditiolano16, 17. As fibras supramoleculares resultantes agora servem como uma plataforma experimental para estudar a reatividade de bissulfeto-troca e tiol na superfície supramolecular de fibras amiloides18.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. síntese e purificação de 1,2-Ditiolano modificado do Peptide
- Síntese do precursor de Ditiolano, 3-(acetylthio) -2-(acetylthiomethyl) ácido propanoico19.
- Adicionar 1 g de 3-bromo - 2-(bromomethyl) ácido propiônico (1 equiv) dissolvido em uma quantidade mínima de 1 M NaOH (aproximadamente 4 mL) para um balão de fundo redondo de 25 mL reação agitando a 55 ° C. Selar o balão de reação com um septos e coloque sob atmosfera de nitrogênio.
- Preparar uma solução contendo 1,49 g de tioacetato de potássio (3.2 equiv) em 4 mL de água desionizada e 3 mL de ácido sulfúrico de 2 M (H2SO4) para criar tioacético ácido em situ.
- Puxe a solução ácida tioacético em uma seringa de plástico descartável 10 mL e coloque uma agulha na seringa. Adicione a mistura de gota a gota no balão de reação por perfuração através de septos com a agulha. Continuar a reação durante a noite a 55 ° C.
- Monitore a reação por cromatografia em camada fina (TLC) em placas de sílica gel 60 F254 usando uma mistura de metanol e diclorometano (1:9). Visualize o progresso de reação pela mancha verde de bromocresol. O produto tem um Rf = 0,57.
- Depois que a reação é completa e refrigeração à temperatura ambiente, acidificar a mistura de pH de 1 com 2 M de H2então4. Um óleo amarelo separa fora da solução.
- Extrair o produto com clorofórmio frio (40 mL x 3). Combine as camadas orgânicas e secar sobre sulfato de magnésio. Remova o clorofórmio sob pressão reduzida.
- Confirme a identidade do produto isolado, 1, por espectroscopia de ressonância magnética nuclear (NMR), como mostrado nas Figuras 1B e C. Esperar os seguintes resultados: 1H NMR, CDCl3, 300 MHz: d = 10.1 (b, 1 H) 3.2 (m, 4h), 2.9 (m, 1 H), 2.4 (s, H 6); 13 C NMR, CDCl3, 75 MHz: d = 195.1 (CH3COS-), 177.6 (-COOH), 45,1 (-CH2S), 30.5 (C. H), 29,2 (-SCOCH3).
Nota: O produto é um óleo amarelo e tem um rendimento total de 83%. Utilize o produto sem mais purificação.
- SPPS e acoplamento na resina de Ditiolano Precursor
Nota: A síntese do peptide de fase sólida descrita abaixo foi realizada em um sintetizador de peptídeo automatizado, seguindo o protocolo recomendado do fabricante. Configurações e reagentes podem ser adaptados para outros instrumentos comerciais ou ao usar aminoácidos especializados.- Pesar 0,156 g de resina de 4-methylbenzhydrylamine (MBHA) de amida de Rink (0,1 mmol) e coloque em um recipiente de reação. Inche a resina em dimetilformamida (DMF) durante pelo menos 15 minutos antes do início da síntese.
- Pesagem para fora 4 equivalentes de cada fluorenylmethyloxycarbonyl (Fmoc) protegido aminoácido (0,4 mmol) na sequência e 0,152 g de N, N, N', N'- tetrametil-O-(1H- benotriazol-1-yl) Hexafluorofosfato de urânio (0,4 mmol, HBTU) para cada aminoácido na sequência. Cada cartucho contém o aminoácido Fmoc-protegido e HBTU.
- Depois de executar todos os pre-síntese verifica para o sintetizador (reencher os reagentes, liberadas linhas de reagente e pressurizado todos os frascos de reagente), coloque os cartuchos de aminoácido no carrossel no C' n ' direção do terminal. Coloque um cartucho vazio após a posição final de aminoácidos para a etapa final de desproteção de Fmoc N-terminal.
- Sintetiza o peptídeo usando as configurações padrão e recomendadas.
- DePROTECT o grupo de Fmoc da resina com 5 mL de piperidina de 20% em DMF (5 min x 2).
- Lave a resina com DMF (6 x 5 mL) antes da etapa de acoplamento.
- Para um passo único acoplamento, adicione 4 mL de 0,4 M N-methylmorpholine em DMF para o aminoácido Fmoc-protegido e HBTU. Ativar a solução de aminoácido Fmoc-protegido por 30 s antes de transferir a solução para o recipiente de reação.
Nota: O sintetizador de peptídeo automatizado mistura da resina e a solução pela subida N2 gás cada 30 s por 20 min enquanto a reação de acoplamento leva a lugares. Para a síntese do peptide manual, coloque o recipiente de reação em um agitador orbital a baixa velocidade para a duração da etapa de acoplamento. - Escorra a solução e lavar a resina com DMF (3 x 5 mL).
- Repita as etapas 1.2.4.1 através de 1.2.4.4 para cada aminoácido Fmoc-protegido no C' n '-direção de terminal para sintetizar o peptídeo de interesse.
- Após a etapa final de desproteção N-terminal, transferi a resina uma seringa descartável fritada. Lave a resina com DMF (3 x 5 mL) e diclorometano (DCM, 3 x 5 mL).
Nota: A resina pode ser armazenada após DCM lavagem num exsicador de vácuo. Se a resina foi armazenada antes do engate, certifique-se para inchar a resina em DMF antes da reação de acoplamento. - Alguns o precursor de Ditiolano (1) para N-terminal do peptide na resina, adicionando 4 equivalentes de 1, 5ml de DMF, 4 equivalentes de HBTU e 10 equivalentes de N, N-diisopropylethylamine (DIPEA). Pre-ative a mistura de acoplamento por 10 min antes de adicionar à resina contendo seringa fritada.
- Agite a reação de acoplamento para 2 h. Após 2 h, lave a resina com DMF (3 x 5 mL) e repetir a reação de acoplamento com agitação durante a noite.
- Após o segundo acoplamento, lave a resina com DMF (3 x 5 mL) e DCM (3 x 5 mL).
Nota: A resina pode ser armazenada neste momento sob vácuo, até o decote.
- Tioacetato desproteção e clivagem de peptídeo de resina
- Para deprotect o grupo de tioacetato do precursor do Ditiolano N-terminal, transferir a resina seca para um tubo de reação de microondas de 10 mL e adicione 2 mL de DMF. Permitir que a resina a inchar, adicionar uma barra de agitação magnética pequena para o navio e re-suspender com baixa velocidade de agitação magnética por 15 min.
- Adicionar 2 mL de hidróxido de amônio concentrado, a embarcação da reação com os septos do silicone do tampão e coloque o recipiente de reação em um reator de microondas usando as configurações de microondas de 75 ° C por 45 min com agitação.
- Após a reação de microondas completa, transferi a resina uma seringa limpa descartável fritada. Lave com DMF (2 x 5 mL) e metanol (MeOH, 2 x 5 mL).
- Adicione uma solução de hidróxido de amônio concentrado em metanol (1:4), para um volume total de 5 mL. Deixe a tremer durante a noite para aumentar a oxidação intramolecular de ligação dissulfeto no anel Ditiolano.
- Lave a resina com MeOH (2 x 5 mL) e DCM (3 x 5 mL).
Nota: A resina seca pode ser armazenada num exsicador de vácuo neste ponto. - Adicione o cocktail de clivagem para a resina contendo seringa agitando suavemente para 1,5 h. O cocktail de clivagem usado é 95% o ácido trifluoroacético (TFA), 2,5% triisopropylsilane (dicas) e 2,5% de água em um volume total de 5 mL.
Cuidado: Trabalho sob coifa química. TFA é volátil e corrosivo.
Nota: Para a maioria de sequências peptídicas e aminoácido sidechain proteger grupos, a solução acima de cocktail clivagem é suficiente; no entanto, coquetéis de clivagem alternativos podem ser necessários para certa cadeia lateral de ácido aminado proteger grupos (em particulares peptídeos contendo Cys, Met, Trp e Arg) ou outra resina química20. - Precipitar o peptídeo bruto em 25 mL de frio em um tubo cónico de 50 mL de éter dietílico por adição gota a gota da seringa fritada. O peptídeo precipita-se como um sólido branco. Pelota do peptide por centrifugação a 1300 x g durante 10 min. decantar cuidadosamente o éter etílico em um recipiente separado para recolha de resíduos.
- Adicionar mais 25 mL de éter dietílico para o tubo cônico e ressuspender o precipitado pela utilização do vortex. Repetir a centrifugação a 1300 x g por 10 min e decantar o éter dietílico novamente. Seque a pelota sob vácuo.
- Purificação de 1,2-Ditiolano modificado do Peptide
Nota: Purifica o peptídeo bruto por HPLC-fase reversa. Coletar e combinar os picos do peptide e confirmar a massa por espectrometria de massa MALDI-TOF.- Dissolva a pelota crua peptídeo em quantidade mínima de acetonitrilo com 0,1% TFA. Devido a hidrofobicidade do peptide e propensão de agregação, aquece lentamente a amostra a 40 ° C, para auxiliar na solubilidade.
Nota: Evite maiores temperaturas e sonication do peptide para evitar potenciais bissulfeto troca reações21,22,23. - Para preparar 1 mL de peptídeo bruto para a purificação de HPLC, adicione 400 μL de estoque concentrado peptídeo em acetonitrila para 600 μL de H2O com 0,1% TFA e filtro através de um filtro de seringa 22 μm dentro de um frasco de HPLC. Um isopropanol 5% adicionais pode ser adicionado para evitar a precipitação e a agregação de peptídeo.
- Purificar o peptídeo com C-18 semipreparativa coluna com uma vazão de 3 mL/min, ao longo de um gradiente linear de 15-55% acetonitrila em 20 min. conjunto dos detectores de UV para 222 nm (espinha dorsal Amida) e 330 nm (ligação dissulfeto). Coletar e combinar os picos de interesse (Figura 2A).
- Confirme a massa de produto de peptídeo pelo espectrômetro de massa MALDI-TOF no modo reflectron (Figura 2B). Para análise, misturar 0,5 μL do pico coletado na placa MALDI com 0,5 μL de matriz de ácido (DHB) 2,5-benzoico (10 mg/mL em 50% acetonitrila, 0,1% DHB TFA).
Nota: Comum adutos em MALDI-TOF espectrometria de massa incluem o sódio e o sal de potássio aduto ([M + nd]+ e [M + K]+) picos. Dessalinização da amostra antes da análise recomenda-se a picos de sal aduto suprimem o sinal do principal pico [M + H]+ . Além disso, um pico de oxidado de [M + O]+ também é detectado no peptídeo de 1,2-Ditiolano modificado. Um relatório sobre laser induzida por oxidação da ionização de MALDI usando DHB matrix sugere que fatores incluindo a concentração da amostra, solvente e intensidade do laser podem ser modificados para limitar o MALDI induzida por oxidação artefato24. - Após a confirmação da correta massa MALDI-TOF lyophilize o peptídeo após congelamento flash. Manter o pó liofilizado peptídeo sob vácuo até montagem.
- Dissolva a pelota crua peptídeo em quantidade mínima de acetonitrilo com 0,1% TFA. Devido a hidrofobicidade do peptide e propensão de agregação, aquece lentamente a amostra a 40 ° C, para auxiliar na solubilidade.
2. caracterização de Supramolecular auto-montagem estruturas
-
Formação de fibras amiloides
- Para preparar a auto-montagem solução, pese 1 mg do pó do peptide usando uma balança analítica. Dissolver em uma mistura (pH 7,5) de 20% acetonitrila e 10 mM (4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) em um tubo de microcentrifugadora de 1,5 mL, para uma concentração final da mistura de montagem de peptídeo de 1 mg/mL. Vórtice a solução de montagem e deixar de reunir-se na temperatura ambiente.
-
Caracterização espectroscópica de fibras amiloides
- Siga o processo de montagem do peptídeo via transformada de Fourier espectroscopia de infravermelho (FTIR) todos os dias. Um pico amplo, centrado em torno de 1670 cm-1 é a assinatura de IR decorrentes de peptídeos desmontados em amostra17. As amostras de montagem de peptídeo costumam levam uma ou duas semanas para o amplo pico desmontado desaparecer e alcançar a maturação.
- Seco, uma alíquota de 8-10 μL da solução de montagem como um filme fino sobre o cristal de diamante ATR. Monitore o desaparecimento de um pico de água grande e amplo de 1640 a 1630 cm-1 , como as formas de película seca.
- Aquisição de espectros de IR de 1500-1800 cm-1 , com média de 50 digitalizações com resolução de 2 cm-1 . Adquirir e subtrair as varreduras em segundo plano antes de cada verificação de amostra. A assinatura de IR para a montagem de β-folha é um pico afiado entre 1625 e 1635 cm-1 (Figura 3A)25,26.
- Caracteriza o assembly de peptídeo em estruturas supramoleculares ricos de β-folha por Dicroísmo circular (CD). Grave os espectros usando spectropolarimeter um CD com um sistema de controle de temperatura Peltier.
- Adicionar 30 μL da solução de montagem em um microcuvette de comprimento de caminho de 0,1 mm.
Nota: O titular de uma célula é necessária para fixar e posicionar a célula de comprimento de caminho mais curto no instrumento. - Para cada espectro, definir o instrumento de CD para os seguintes parâmetros: digitalização de comprimentos de onda de 300 nm a 180 nm, taxa de exploração de 100/min, largura de banda de 1 nm, 25 ° C, média de três exames.
- Coletar um espectro do buffer (20% acetonitrila/10 mM HEPES, pH 7,5) e subtrair de cada amostra de verificação como um controle. A assinatura de CD para β-folhas é que uma mínimo de elipticidade centrado em torno de 220 nm (Figura 3B)27.
- Adicionar 30 μL da solução de montagem em um microcuvette de comprimento de caminho de 0,1 mm.
- Siga o processo de montagem do peptídeo via transformada de Fourier espectroscopia de infravermelho (FTIR) todos os dias. Um pico amplo, centrado em torno de 1670 cm-1 é a assinatura de IR decorrentes de peptídeos desmontados em amostra17. As amostras de montagem de peptídeo costumam levam uma ou duas semanas para o amplo pico desmontado desaparecer e alcançar a maturação.
-
Microscopia de fibras amiloides
- Permitir que duas a três semanas para as amostras de peptídeo amadurecer-se em estruturas supramoleculares ricas de β-folha.
Nota: Os módulos (assemblies) pode ser fotografada usando microscopia eletrônica de transmissão (TEM) em fases anteriores do processo de montagem também.- Adicionar 10 μL da solução de montagem de peptídeo para a superfície da grade de carbono TEM.
Nota: tenha cuidado para não tocar a ponta da pipeta para a superfície da grade. Alta precisão, de fecho automático pinças são usadas para segurar a grade TEM durante a preparação. - Espere 1-2 min para permitir que os assemblies de adsorção na superfície da grade. Retire o excesso amostra, tocando o papel de filtro para a borda da grade.
- Prepare uma mancha de acetato de uranilo 2% adicionando 100 μL de água desionizada para solução de acetato de uranilo 4% comercialmente disponível. Adicionar 10 μL da mancha de acetato de uranilo de 2% para a superfície da grade e incubar durante 2-3 min. Após a incubação, remova mancha em excesso, tocando o papel de filtro para a borda da grade.
- Coloca as grades TEM num exsicador de vácuo durante a noite. Armazenar sob vácuo até imagens.
- Imagem as amostras preparadas com temperatura (Figura 3). Parâmetros típicos para microscopia são como segue: imagens em ampliações variando de 9.300 X 23, 000 X, filamento de tungstênio com uma tensão de aceleração de 120 kV.
Nota: ImageJ pode ser usado para medir a largura média da fibra das estruturas supramoleculares de de imagens adquiridas TEM28.
Atenção: Por favor consulte todas as folhas de dados relevantes de segurança (SDS) antes do uso. Vários produtos químicos usados na síntese, purificação, caracterização dos peptides auto-montagem descrita 1,2-Ditiolano modificado são corrosivos ou tóxicos e só deve ser usado sob uma coifa de química. Use sempre equipamento de protecção adequado (incluindo óculos de segurança, jaleco, calça comprida, sapatos fechados) quando se trabalha no laboratório.
- Adicionar 10 μL da solução de montagem de peptídeo para a superfície da grade de carbono TEM.
- Permitir que duas a três semanas para as amostras de peptídeo amadurecer-se em estruturas supramoleculares ricas de β-folha.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Afora a síntese de uma etapa inicial da molécula precursora de Ditiolano, o resto da síntese do peptide 1,2-Ditiolano modificado ocorre na sustentação contínua (figura 1A). A conversão da 3-bromo - 2-(bromomethyl) ácido propiônico para 3-(acetylthio) -2-ácido (acetylthiomethyl), o precursor de Ditiolano, é confirmado por 1H e 13C NMR (figura 1B e C) antes está acoplada à livre N-terminal amina de um peptídeo ainda na resina. A desproteção de tioacetato de tióis com hidróxido de amônio é executada usando um reator de microondas e o 1,2-Ditiolano é oxidado a noite em metanol antes o peptídeo de 1,2-Ditiolano modificado é clivado da resina. O peptídeo bruto é purificado por fase reversa HPLC (Figura 2A) e a massa do produto é confirmada por espectrometria de massa MALDI-TOF (Figura 2B).
O peptídeo de 1,2-Ditiolano purificado Self monta em fibras de amiloides maduras durante 2-3 semanas. FT-IR (Figura 3A) e espectroscopia de CD (Figura 3B) são usados para acompanhar o processo de montagem e para caracterizar a conformação β-folha estendida. As fibras são fotografadas pela TEM (Figura 3).
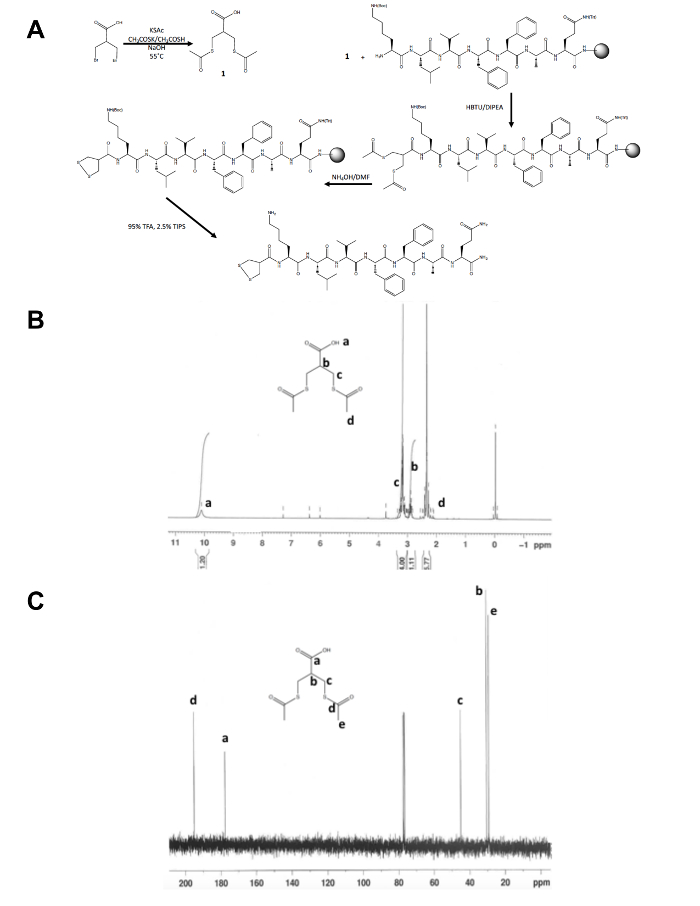
Figura 1. Esquema sintética para a caracterização da molécula precursora de 1,2-Ditiolano. (A) esquema sintética do peptide final 1,2-Ditiolano modificado, 1,2-Ditiolano-KLVFFAQ-NH2. (B) 1H-NMR de 3-(acetylthio) -2 - ácido (acetylthiomethyl) em CDCl3 em 300 MHz. (C)13C-NMR de 3-(acetylthio) -2 - ácido em CDCl3 de 75 MHz. (acetylthiomethyl) por favor clique aqui para ver uma versão maior desta figura.

Figura 2. Síntese de 1,2-Ditiolano modificado do peptide. Cromatograma HPLC (A) de purificação de 1,2-Ditiolano - KLVFFAQ-NH2. (B) espectro de massa MALDI-TOF do pico principal de purificação de HPLC (tempo de retenção de ~17.5 min) no modo reflectron usando matriz DHB confirma a massa calculada de 1,2-Ditiolano-KLVFFAQ-NH2. Comum adutos também são identificados. Clique aqui para ver uma versão maior desta figura.

Figura 3. Caracterização supramolecular de 1,2-Ditiolano modificado do peptide. (A) FT-IR de fibras de 1 mg/mL de 1,2-Ditiolano-KLVFFAQ-NH2 montado em 10 mM HEPES, pH 7,5 em 20% CH3CN. O pico em 1627 cm-1 é consistente com os peptídeos montados em uma conformação β-folha. (B) CD de fibras de 1 mg/mL de 1,2-Ditiolano-KLVFFAQ-NH2 montado em 10 mM HEPES, pH 7,5 em 20% CH3CN. A elipticidade mínima em 218 nm é consistente com os peptídeos montados em uma conformação β-folha. (C) imagem da fibra de 1,2-Ditiolano-KLVFFAQ-NH2 amiloide (mancha negativa de 2% de acetato de uranilo) pela TEM. Barra de escala é 100 nm. Clique aqui para ver uma versão maior desta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Este artigo discute os detalhes de tanto a síntese e a purificação de um peptídeo de auto-montagem de 1,2-Ditiolano modificado N-terminal e a caracterização das estruturas supramoleculares resultantes. A síntese do peptide 1,2-Ditiolano relatado aqui tem as vantagens, incluindo a síntese de uma etapa para produzir o precursor de Ditiolano, 3-(acetylthio) -2-ácido (acetylthiomethyl) e a resina no microondas reação de desproteção do precursor tioacetato grupo para render o moiety oxidado 1,2-Ditiolano, utilizando hidróxido de amônio, como uma alternativa mais segura para a desproteção de hidrazina tóxica relatado anteriormente29a proteger. A síntese do peptide de fase sólida em geral do peptide 1,2-Ditiolano (figura 1A) pode ser facilmente modificada, alterando o comprimento da sequência e composição, incluindo o uso de aminoácidos protegidos Fmoc antinaturais e C-terminal da resina química para atender muitas aplicações diferentes de pesquisa.
Para evitar subprodutos indesejados do peptide quando os aminoácidos com cadeias laterais nucleofílica ou os aminoácidos com proteger grupos tem produtos de clivagem reativa, catadores adicionais devem ser adicionados para o cocktail de clivagem20. Uma teste de clivagem de uma parcela pequena (menos de 10% do total da resina) pode ser realizada antes da etapa de desproteção de microondas em resina para assegurar um alto rendimento da reação de acoplamento. Usando a coluna e condições HPLC descritas no relatório, o pico de peptídeo de precursor de protegido de 1,2-Ditiolano tioacetato elutes 5 min após o peptídeo desacopladas amina livre. Se uma quantidade significativa de peptídeo de amina livre continua a ser, mais um passo de acoplamento com 3-(acetylthio) -2-ácido (acetylthiomethyl) é recomendado. A ligação dissulfeto intramoleculares 1,2-Ditiolano é detectada sobre a HPLC, monitorando a absorvência de ligação dissulfeto fraco em 330 nm. O pico HPLC correspondente a 1,2-Ditiolano oxidado é confirmado pela adição de 100 L de tris(2-carboxyethyl)phosphine(TCEP) de 100 mM para uma amostra de peptídeo em uma separado HPLC executar. O tiol TCEP reduzida contendo peptídeos terá um tempo de retenção diferentes do que o peptídeo de bissulfeto oxidado. O tiol contendo o peptídeo elutes aproximadamente 1 min mais tarde do que o peptídeo de bissulfeto usando a coluna e condições descritas no relatório. Uma matriz de MALDI alternativo adequado para peptídeos é ácido α-cyano-4-hidroxicinâmicos (CHCA) e é preparado pela adição de 1 mL de 50% acetonitrila com 0,1% TFA a 5 mg de CHCA. As amostras podem ser postas por meio de uma fecho de correr C18-ponta antes da análise de massa MALDI-TOF se os picos de sal aduto (at+ e K+) suprimem significativamente o pico [M + H]+ .
A sequência do peptídeo escolhida para estes estudos é derivada do holandês mutante do Aβ-peptide associado com a doença de Alzheimer,30e tem sido mostrada anteriormente a auto-montagem em fibras de amiloides de β-folhas paralelas16,17 . Conforme os resultados representativos, Figura 3A-C, o peptídeo de 1,2-Ditiolano-KLVFFAQ-NH2 também monta em fibras de amiloide. A amida FTIR estendo centralizada em 1627cm-1 e CD elipticidade mínima em 218 nm são assinaturas espectroscópicas de assemblies de β-folha25,26,27e o estiramento de carbonila CO em 1676 cm-1 correspondente ao ordenado interações cadeia lateral de glutamina sugerem que os peptídeos são organizados em hiper-velocidade β-16,31,32.
Imagens de microscopia eletrônica de transmissão, usando 2% mancha negativa de acetato de uranilo, mostram estendidas e torção de fibras supramoleculares que são aproximadamente 10 nm de largura. As fibras do peptide N-terminal acetilado, Ac-KLVFFAQ-NH2, são lisas e retas, com uma largura um pouco maior de quase 12 nm16. Desde grades TEM a preparar e a aquisição de imagens são um processo intensivo, é melhor preparar vários grades TEM da mesma amostra montagem ao mesmo tempo de diferentes concentrações de peptídeo. Prepare uma amostra diluída para TEM (01:50 ou 1: 100) juntamente com a amostra de solução de montagem original. As fibras amiloides em concentrações elevadas podem aderir à grade em aglomerados ou patches e aquisição de imagens de fibras individuais pode ser difícil. É importante ver as bordas das fibras individuais para medições de largura e a visualização da fibra helicity é muitas vezes obscurecida por amostras superlotadas.
Como estão a ser exploradas mais aplicações utilizando biomateriais supramoleculares, há uma necessidade de integrar potencialmente reativos grupos funcionais que são ortogonais para o processo Self-assembly em monômeros a auto-montagem. Os métodos descritos neste relatório destacam-se uma abordagem em resina para a síntese de um peptídeo de auto-montagem de 1,2-Ditiolano modificado e caracterização espectroscópica de estruturas supramoleculares.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não têm nada para divulgar.
Acknowledgments
Os autores gostaria de agradecer o Dr. B. Ellen Scanley para sua formação técnica e ajudar usando a temperatura no centro da Universidade (CSCU) e faculdades do estado de Connecticut para nanotecnologia e Dr. Ishita Mukerji na Universidade wesleyana para acesso ao seu CD Espectrofotómetro. O trabalho relatado foi apoiado em parte pelo Instituto de Ciências da Universidade de Fairfield, a NASA Connecticut Space Grant Consortium e pela National Science Foundation sob Grant número-1624774.
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



