Summary
Ein Protokoll für die Synthese von 1,2-Dithiolane modifizierte Peptid und die Charakterisierung der supramolekularen Strukturen durch das Peptid Selbstmontage.
Abstract
Dieser Bericht konzentriert sich auf die Synthese von 1,2-Dithiolane ein N-Terminus selbstorganisierende Peptid und die Charakterisierung der resultierenden geändert selbst montiert supramolekulare Strukturen. Der Syntheseweg nutzt der Festphasen-Peptidsynthese mit der auf-Harz-Kopplung von Dithiolane Vorläufer Molekül, 3-(Acetylthio) -2-(Acetylthiomethyl) Propanoic Säure und die Mikrowellen-gestützte Thioacetate deprotection des Peptids N-Terminus vor dem endgültigen Spaltung aus dem Harz der 1,2-Dithiolane Ausbeute geändert Peptid. Nach der Hochleistungs-Flüssigkeitschromatographie (HPLC) Reinigung des 1,2-Dithiolane Peptids, abgeleitet aus dem nukleierenden Kern der Aβ-Peptid verbunden mit Krankheit Alzheimers zeigt das Peptid in Kreuz-β-Amyloid-Fasern selbst zusammensetzen. Protokolle zur Charakterisierung der Amyloid Fasern von Fourier-Transform-Infrarot-Spektroskopie (FT-IR), kreisförmigen Dichroismus Spektroskopie (CD) und Transmissionselektronenmikroskopie (TEM) werden vorgestellt. Die Methoden von N-terminale Anpassung mit einem 1,2-Dithiolane Glyko-gut charakterisierten selbstorganisierende Peptide können jetzt erkundet werden, als Modellsysteme, Post-Montage Modifikation Strategien entwickeln und dynamische kovalente Chemie zu erkunden Supramolekulare Peptid Nanofaser Oberflächen.
Introduction
Die robuste Peptidbindung bilden Chemie beteiligt Festphasen-Peptidsynthese und die Fähigkeit zur Steuerung der Reihenfolge Länge und Zusammensetzung machen die Peptide, die in supramolekularen Strukturen stark erforschten Bereich selbst zusammensetzen. Die Faktoren, die zu kontrollieren und zu stabilisieren, Peptid selbst-zusammengebauten Strukturen, einschließlich Side-Chain sterische und elektrostatische Wechselwirkungen, Wasserstoff-Bindung und hydrophobe Effekte1, dienen als eine Reihe von Design-Regeln. Wie die Forschung zu diesen grundlegenden Designregeln schreitet weiter voran, geht der nächste logische Schritt in Peptid Selbstmontage erweitert die Vielfalt der Peptid-basierte Strukturen und Funktionen. Während der Montage selbst Peptide sind vielseitige Biomaterial, das für viele biomedizinische Anwendungen herangezogen wurden, durch tuning die Peptid-Sequenz oder einer Baugruppe Bedingungen2,3,4, die Entwicklung von Strategien für nach dem Zusammenbau Änderungen an Peptid Nanofasern5,6,7,8,9 bleibt ein relativ unerforschten Bereich.
Dynamische Disulfid-Austausch und Thiol-Chemie an der Oberfläche der supramolekularen Strukturen ist ein Bereich, der das Potenzial hat, neuen und funktionalen Biomaterialien ergeben. Die Einbeziehung von 1,2-Dithiolane Moieties (häufig ein Derivat von Liponsäure (la) oder asparagusic Säure (aa)) gemeldet wurden, in Liposomen Systeme10,11, Block-Copolymere12,13, sowie Organisation von Ankern an Oberflächen14,15. Hier berichten wir über die Synthese und Charakterisierung eines selbstorganisierenden Peptids, abgeleitet aus dem nukleierenden Kern der Aβ-Peptid Zusammenhang mit Alzheimer-Krankheit, die am N-Terminus mit einem 1,2-Dithiolane funktionelle Gruppe16geändert wird, 17. Die daraus resultierenden supramolekularen Fasern dienen nun als eine experimentelle Plattform die Disulfid-Austausch und Thiol Reaktivität an der supramolekularen Oberfläche des Amyloid Fasern18zu studieren.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
(1) Synthese und Reinigung von 1,2-Dithiolane geändert Peptid
- Synthese von Dithiolane Vorstufe, 3-(Acetylthio) -2-(Acetylthiomethyl) Propanoic Säure19.
- Fügen Sie 1 g 3-Bromo - 2-(Bromomethyl) Propionsäure (1 Äquiv) aufgelöst in minimaler Menge von 1 M NaOH (ca. 4 mL), einen 25-mL Rundboden Reaktionskolben unter Rühren bei 55 ° C. Versiegeln der Reaktionskolben mit einem Septen und unter Stickstoffatmosphäre statt.
- Bereiten Sie eine Lösung mit 1,49 g Kalium Thioacetate (3.2 Äquiv) in 4 mL entionisiertem Wasser und 3 mL 2 M Schwefelsäure (H2SO4), Thioacetic Säure in Situzu schaffen.
- Ziehen Sie die Thioacetic Säurelösung in eine Plastik Einweg-10 mL-Spritze und legen Sie eine Nadel auf die Spritze. Fügen Sie die Mischung tropfenweise zu den Reaktionskolben durch piercing durch die Septen mit der Nadel. Weiter die Reaktion über Nacht bei 55 ° C.
- Beobachten Sie die Reaktion durch Dünnschichtchromatographie (TLC) auf Kieselgel 60 F254 Platten mit einer Mischung aus Methanol und Dichlormethan (1:9). Visualisieren Sie den Fortschritt der Reaktion von Bromocresol grünen Fleck. Das Produkt hat eine Rf = 0,57.
- Nachdem die Reaktion abgeschlossen und auf Raumtemperatur abgekühlt ist, Ansäuern der Mischung auf pH 1 mit 2 M H2SO4. Ein gelbes Öl trennt aus der Lösung.
- Extrahieren Sie das Produkt mit kalten Chloroform (40 mL x 3). Kombinieren Sie die organischen Schichten und Trocknen über Magnesium-Sulfat. Entfernen Sie das Chloroform unter vermindertem Druck.
- Bestätigen Sie die Identität des Messguts isoliert, 1, durch Kernresonanzspektroskopie (NMR), wie in den Figuren 1 b und Cdargestellt. Die folgenden Ergebnisse zu erwarten: 1H NMR, CDCl3, 300 MHz: d = 10,1 (b, 1 H), 3.2 (m, 4 H), 2,9 (m, 1 H), 2.4 (s, 6 H); 13 C-NMR, CDCl3, 75 MHz: d = 195.1 (CH3COS-), 177.6 (-COOH), 45,1 (-CH2S-), 30,5 (CH), 29.2 (-SCOCH3).
Hinweis: Das Produkt ist ein gelbes Öl und hat einen Gesamtertrag von 83 %. Verwenden Sie das Produkt ohne weitere Reinigung.
- SPPS und am Harz Kupplung Dithiolane Vorstufe
Hinweis: Die Festphasen-Peptidsynthese beschrieben wurde auf eine automatisierte Peptid-Synthesizer, die empfohlenen Hersteller-Protokolle durchgeführt. Einstellungen und Reagenzien möglicherweise für andere kommerzielle Instrumente oder angepasst, bei Verwendung spezieller Aminosäuren.- 0,156 g Rink Amid 4-Methylbenzhydrylamine (MBHA) Harz (0,1 Mmol) abwiegen und in einem Reaktionsgefäß platzieren. Anschwellen des Harzes in Dimethylformamid (DMF) für mindestens 15 Minuten vor Beginn der Synthese.
- Wiegen, 4 Entsprechungen der einzelnen Fluorenylmethyloxycarbonyl (Fmoc) geschützten Aminosäure (0,4 Mmol) in der Sequenz und 0,152 g N, N, N', N'- Tetramethyl-O-(1H- Benotriazol-1-Yl) Uran Hexafluorophosphate (0,4 Mmol, HBTU) für jede Aminosäure in der Sequenz. Jede Patrone enthält die Fmoc-geschützten Aminosäure und HBTU.
- Nach dem ausführen alle Pre-Synthese prüft auf dem Synthesizer (Nachfüllen Reagenzien, Reagenz Leitungen gespült und unter Druck alle Flaschen Reagenz), legen die Aminosäure-Patronen in das Karussell in der C' n ' Endstation Richtung. Legen Sie eine leere Patrone nach der endgültigen Aminosäure-Position für den letzten Schritt der N-terminalen Fmoc Deprotection.
- Das Peptid mit den empfohlenen Standardeinstellungen zu synthetisieren.
- DEPROTECT der Fmoc-Gruppe aus dem Harz mit 5 mL der 20 % Piperidin in DMF (5 min x 2).
- Waschen Sie das Harz mit DMF (6 x 5 mL) vor der Kupplung Schritt.
- Für einen einzigen Kupplung Schritt hinzu kommen 4 mL 0,4 M N-Methylmorpholine im DMF die Fmoc-geschützten Aminosäure und HBTU. Aktivieren Sie die Fmoc-geschützten Aminosäure-Lösung für 30 s bevor Sie die Lösung auf das Reaktionsgefäß übertragen.
Hinweis: Die automatisierte Peptid-Synthesizer mischt das Harz und die Lösung von sprudelnden N2 Gas alle 30 s für 20 min während der Koppelung Reaktion erfolgt. Legen Sie für manuelle Peptidsynthese den Reaktionsbehälter auf einem Orbitalschüttler bei niedriger Drehzahl für die Dauer der Kupplung Schritt. - Abtropfen Sie die Lösung und waschen Sie das Harz mit DMF (3 x 5 mL).
- Wiederholen Sie die Schritte 1.2.4.1. durch 1.2.4.4 für jede Fmoc-geschützten Aminosäure in der C' n '-Endstation Richtung synthetisieren das Peptid von Interesse.
- Übertragen Sie nach der letzten N-terminalen Deprotection Schritt das Harz in einer Einwegspritze fritted. Waschen Sie das Harz mit DMF (3 x 5 mL) und Dichlormethan (DCM, 3 x 5 mL).
Hinweis: Das Harz kann nach DCM Waschen in einem Vakuum Exsikkator aufzubewahren. Wenn das Harz vor der Kupplung gelagert wurde, sicherstellen Sie, dass das Harz in DMF vor der Kupplung Reaktion anschwellen. - Ein paar den Dithiolane Vorläufer (1) an den N-Terminus des Peptids auf Harz durch Zugabe von 4 Entsprechungen von 1, 5 mL DMF, 4 Entsprechungen von HBTU und 10 Entsprechungen von N, N-Diisopropylethylamine (DIPEA). Pre-aktivieren Sie die Kupplung Mischung für 10 min vor der Zugabe in das Harz mit fritted Spritze.
- Schütteln Sie die Kupplung Reaktion für 2 h. Waschen Sie nach 2 h des Harzes mit DMF (3 x 5 mL) und wiederholen Sie die Koppelung Reaktion mit schütteln über Nacht.
- Nach der zweiten Kupplung Waschen des Harzes mit DMF (3 x 5 mL) und DCM (3 x 5 mL).
Hinweis: Das Harz kann an dieser Stelle unter Vakuum bis Dekolleté gespeichert werden.
- Thioacetate Deprotection und Peptid Dekolleté aus Harz
- Um die Thioacetate-Gruppe aus der N-Terminus Dithiolane Vorläufer deprotect, übertragen Sie das getrocknete Harz auf einer 10 mL-Mikrowelle-Reaktionsgefäß und 2 mL DMF. Lassen Sie das Harz zu Schwellen, das Schiff eine kleine magnetische Stir Bar hinzu, und mit einer niedrigen Geschwindigkeit von magnetischen rühren 15 min. wieder auszusetzen.
- Fügen Sie 2 mL konzentrierter Ammonium Hydroxid, Kappe das Reaktionsgefäß mit Silikon Septen und legen Sie den Reaktionsbehälter in eine Mikrowelle-Reaktor mit Hilfe der Mikrowelle Einstellungen von 75 ° C für 45 min. unter Rühren.
- Nachdem die Mikrowelle Reaktion abgeschlossen ist, übertragen Sie das Harz in saubere Einwegspritze fritted. Waschen Sie mit DMF (2 x 5 mL) und Methanol (MeOH, 2 x 5 mL).
- Fügen Sie eine Lösung der konzentrierten Ammonium Hydroxid in Methanol (1:4), für ein Gesamtvolumen von 5 mL. Lassen Sie über Nacht zu erhöhen Intramolekulare Oxidation von Disulfid Bindung in Dithiolane Ring zu schütteln.
- Waschen Sie das Harz mit MeOH (2 x 5 mL) und DCM (3 x 5 mL).
Hinweis: Das getrocknete Harz kann in einem Vakuum Exsikkator zu diesem Zeitpunkt gespeichert werden. - Das Harz mit Spritze mit sanft Schütteln für 1,5 h fügen Sie den Spaltung Cocktail hinzu. Die Spaltung cocktail verwendet ist 95 % Trifluoroacetic Säure (TFA), 2,5 % Triisopropylsilane (Tipps) und 2,5 % Wasser auf ein Gesamtvolumen von 5 mL.
Achtung: Arbeiten Sie unter chemischen Dampfhaube nur. TFA ist flüchtig und ätzend.
Hinweis: Für die Mehrheit der Peptid-Sequenzen und Aminosäure Sidechain Gruppen zu schützen, ist die oben genannte Spaltung cocktail Lösung ausreichend; Allerdings können alternative Spaltung Cocktails für bestimmte Aminosäure-Seitenkette schützen Gruppen (in bestimmten Peptide mit Met, Trp, Cys und Arg) oder andere Harz Chemie20benötigt. - Überstürzen Sie sich Rohöl Peptids in 25 mL kalte Diethylether in einem 50 mL konische Röhrchen durch tropfenweise Zugabe aus der fritted Spritze. Das Peptid ausfällt als weißer Feststoff. Pellet das Peptid durch Zentrifugation bei 1300 X g für 10 min. Dekantieren sorgfältig die Diethylether in einen separaten Behälter für Abfallsammlung.
- Das konische Rohr eine weitere 25 mL Diethylether hinzufügen und erneut aussetzen des Niederschlags durch aufschütteln. Wiederholen Sie die Zentrifugation bei 1300 X g für 10 min und Dekantieren Sie der Diethylether wieder. Trocknen Sie die Pellets unter Vakuum.
- Reinigung von 1,2-Dithiolane geändert Peptid
Hinweis: Das rohe-Peptid durch reverse-Phase-HPLC zu reinigen. Sammeln Sie und kombinieren Sie die Peptid-Gipfel und bestätigen Sie die Masse durch MALDI-TOF-Massenspektrometrie.- Löst das Roh-Peptid Pellet in minimaler Menge von Acetonitril mit 0,1 % TFA. Erhitzen Sie durch das Peptid Hydrophobie und Aggregation Neigung sich die Probe bei 40 ° C um Löslichkeit zu unterstützen.
Hinweis: Vermeiden Sie höhere Temperaturen und Beschallung des Peptids zur Vermeidung von möglichen Disulfid Austausch Reaktionen21,22,23. - Um 1 mL der Roh-Peptid für HPLC-Reinigung vorzubereiten, fügen Sie 400 μl konzentrierte Peptid-Lager in Acetonitril 600 μL von H2O mit 0,1 % TFA und Filter durch einen 22 μm Spritze Filter in ein HPLC-Fläschchen hinzu. Eine zusätzliche 5 % Isopropanol kann hinzugefügt werden, um Peptid-Aggregation und Niederschlag zu verhindern.
- Reinigen Sie dem Peptid mit C-18 Semi-präparative Spalte mit einer Durchflussmenge von 3 mL/min über einen linearen Farbverlauf von 15-55 % Acetonitril in 20 min. Set UV-Detektoren zu 222 nm (Amid Backbone) und 330 nm (Disulfid Bindung). Sammle und kombiniere die Gipfel von Interesse (Abb. 2A).
- Bestätigen Sie die Peptid-Produkt-Masse von MALDI-TOF Massenspektrometer im reflektron Modus (Abb. 2 b). Für die Analyse, mischen 0,5 μL des gesammelten Peak auf der MALDI-Platte mit 0,5 μl 2,5-Dihydroxybenzoic Acid (DHB) Matrix (10 mg/mL DHB in 50 % Acetonitril, 0,1 % TFA).
Hinweis: Gemeinsame Addukte im MALDI-TOF-Massenspektrometrie umfassen das Natrium und Kaliumsalz Addukt ([M + Na]+ und [M + K]+) Gipfeln. Entsalzung der Probe vor der Analyse wird empfohlen, wenn die Salz Addukt Gipfeln das Signal der Hauptgipfel [M + H]+ unterdrücken. Darüber hinaus ist ein oxidierter Höhepunkt [M + O]+ auch in das 1,2-Dithiolane geändert-Peptid erkannt. Ein Bericht über Laser-induzierter Oxidation von der MALDI-Ionisation mit DHB-Matrix legt nahe, dass Faktoren wie probenkonzentration, Lösungsmittel und Laserintensität geändert werden können, um die MALDI induzierte Oxidation Artefakt24zu begrenzen. - Nach der Bestätigung der richtigen Masse MALDI-TOF lyophilize das Peptid nach flash einfrieren. Bewahren Sie die lyophilisierten Peptid-Pulver unter Vakuum bis Montage.
- Löst das Roh-Peptid Pellet in minimaler Menge von Acetonitril mit 0,1 % TFA. Erhitzen Sie durch das Peptid Hydrophobie und Aggregation Neigung sich die Probe bei 40 ° C um Löslichkeit zu unterstützen.
2. Charakterisierung der supramolekularen Strukturen Self-Assembly
-
Bildung von Amyloid Fasern
- Zur Selbstmontage Vorbereitung Lösung 1 mg das Peptid-Pulver mit einer Analysenwaage abwiegen. Lösen sich in einer Mischung (pH 7,5) von 20 % Acetonitril und 10 mM (4-(2-hydroxyethyl)-1-Piperazineethanesulfonic Säure (HEPES) in einem 1,5 mL Microcentrifuge Schlauch, eine Endkonzentration von 1 mg/mL-Peptid-Montage-Mischung. Wirbel der Montagelösung und lassen bei Raumtemperatur zu montieren.
-
Spektroskopische Charakterisierung von Amyloid Fasern
- Folgen Sie der Peptid-Montage über Fourier-Transform Infrarotspektroskopie (FTIR) alle paar Tage. Eine breite Spitze zentriert um 1670 cm-1 ist die IR-Signatur aus unmontiert Peptide in der Probe-17. Die Peptid-Montage-Proben finden in der Regel ein bis zwei Wochen für die Breite unmontiert Peak zu verschwinden und Reifung zu erreichen.
- Trocknen Sie ein Aliquot von 8-10 μL der Montage-Lösung als dünner Film auf der ATR-Diamant-Kristall. Das Verschwinden eines großen und breiten Wasser-Peaks von 1640 bis 1630 cm-1 als die trockenen Film Formen zu überwachen.
- Erwerben Sie IR-Spektren von 1500-1800 cm-1 im Durchschnitt 50 Scans mit einer 2 cm-1 Auflösung. Subtrahieren Sie die Hintergrund-Scans vor jeder Probe-Scan und erwerben. Die IR-Signatur für β-Bogenmontage ist eine scharfe Spitze zwischen 1625 und 1635 cm-1 (Abbildung 3A)25,26.
- Charakterisieren Sie die Peptid-Montage in β-Sheet reichen supramolekularen Strukturen durch kreisförmigen Dichroismus (CD). Notieren Sie die Spektren, die mit einem CD-Spectropolarimeter mit einem Peltier Temperatur-Kontrollsystem.
- Die Montage-Lösung in eine 0,1 mm Weg Länge Küvette 30 μl Pipette.
Hinweis: Eine Küvettenhalter wird benötigt zum Spannen und positionieren Sie die kurzen Weg Länge Zelle in das Instrument. - Legen Sie für jedes Spektrum CD-Instrument auf die folgenden Parameter: Scannen Wellenlängen von 300 nm bis 180 nm, Abtastrate von 100/min, Bandbreite von 1 nm, 25 ° C, durchschnittlich drei Scans.
- Sammeln Sie ein Spektrum des Puffers (20 % Acetonitril/10 mM HEPES, pH 7,5) und ziehen Sie von jeder Probe-Scan als Kontrolle. Die CD-Signatur für β-Bettwäsche ist eine minimale Ellipticity rund 220 nm (Abb. 3 b)27zentriert.
- Die Montage-Lösung in eine 0,1 mm Weg Länge Küvette 30 μl Pipette.
- Folgen Sie der Peptid-Montage über Fourier-Transform Infrarotspektroskopie (FTIR) alle paar Tage. Eine breite Spitze zentriert um 1670 cm-1 ist die IR-Signatur aus unmontiert Peptide in der Probe-17. Die Peptid-Montage-Proben finden in der Regel ein bis zwei Wochen für die Breite unmontiert Peak zu verschwinden und Reifung zu erreichen.
-
Mikroskopie von Amyloid Fasern
- Lassen Sie zwei bis drei Wochen für das Peptid Proben in β-Sheet reichen supramolekularen Strukturen Reifen.
Hinweis: Die Baugruppen können mit Transmissions-Elektronenmikroskopie (TEM) in früheren Stadien des Montageprozesses sowie abgebildet werden.- Pipette 10 μL der Peptid-Montagelösung auf die Oberfläche des TEM Kohlenstoff-Gitter.
Hinweis: Achten Sie darauf, die PIPETTENSPITZE an die rasteroberfläche nicht berühren. Hohe Präzision, selbstschließende Pinzette werden verwendet, um TEM Netz während der Vorbereitung zu halten. - Warten Sie 1-2 min damit die Assemblys, auf die rasteroberfläche adsorbieren kann. Entfernen Sie überschüssige Probe durch berühren Filterpapier an den Rand des Rasters.
- Bereiten Sie einen 2 %-Uranyl-Acetat-Fleck durch Zugabe von 100 μl deionisiertes Wasser, im Handel erhältlichen 4 % Uranyl-Acetat-Lösung. Pipette 10 μL der 2 % Uranyl Acetat Fleck auf der Oberfläche und 2-3 min inkubieren. Entfernen Sie nach der Inkubation überschüssige Fleck indem Sie auf Filterpapier an den Rand des Rasters.
- Legen Sie die TEM-Raster in ein Vakuum Exsikkator über Nacht. Speichern Sie unter Vakuum bis Bildgebung.
- Bild der vorbereiteten Proben mit TEM (Abbildung 3). Typische Kennwerte zur Mikroskopie sind wie folgt: Bilder bei Vergrößerungen von 9.300 X bis hin zu 23, 000 X, Wolfram-Glühfaden mit einer Beschleunigungsspannung von 120 kV.
Hinweis: ImageJ kann verwendet werden, um durchschnittliche Faser Breite der supramolekularen Strukturen der erworbenen TEM Bilder28messen.
Achtung: Bitte konsultieren Sie alle relevanten Sicherheitsdatenblätter (SDB) vor dem Gebrauch. Verschiedene Chemikalien in der Synthese, Reinigung, und Charakterisierung der beschriebenen 1,2-Dithiolane geändert selbstorganisierende Peptide sind ätzende oder giftige und sollte nur unter einem chemischen Abzug verwendet werden. Verwenden Sie stets geeignetsten persönlichen Schutzausrüstung (einschließlich Schutzbrille, Kittel, voller Länge Hose, geschlossene Schuhe) bei der Arbeit im Labor.
- Pipette 10 μL der Peptid-Montagelösung auf die Oberfläche des TEM Kohlenstoff-Gitter.
- Lassen Sie zwei bis drei Wochen für das Peptid Proben in β-Sheet reichen supramolekularen Strukturen Reifen.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Abgesehen von der ersten einstufigen Synthese von Dithiolane Vorläufer Molekül tritt auf der Rest der Peptid-Synthese von 1,2-Dithiolane geändert auf festen Unterlage (Abb. 1A). Die Umwandlung von 3-Bromo - 2-(Bromomethyl) Propionsäure, 3-(Acetylthio) -2-(Acetylthiomethyl) Propanoic Säure, die Dithiolane Vorläufer wird bestätigt von 1H und 13C-NMR (Abbildung 1 b und C) bevor es ist gekoppelt an die kostenlose Amin der N-Terminus eines Peptids noch Harz. Die Deprotection Thioacetate, Thiole mit Ammonium Hydroxid erfolgt mit Hilfe eines Mikrowelle Reaktors und 1,2-Dithiolane ist über Nacht in Methanol oxidiert, bevor das 1,2-Dithiolane geändert-Peptid aus dem Harz gespalten ist. Das rohe-Peptid wird durch umgekehrter Phase HPLC (Abbildung 2A) gereinigt und das Produkt Masse wird durch MALDI-TOF-Massenspektrometrie (Abb. 2 b) bestätigt.
Das gereinigte 1,2-Dithiolane Peptid montiert selbst zu Reifen Amyloid Fasern über einen Zeitraum von 2-3 Wochen. FT-IR (Abbildung 3A) und CD-Spektroskopie (Abb. 3 b) dienen dazu, den Montageprozess zu folgen und die erweiterten β-Sheet-Konformation zu charakterisieren. Die Fasern werden durch TEM (Abbildung 3) abgebildet.
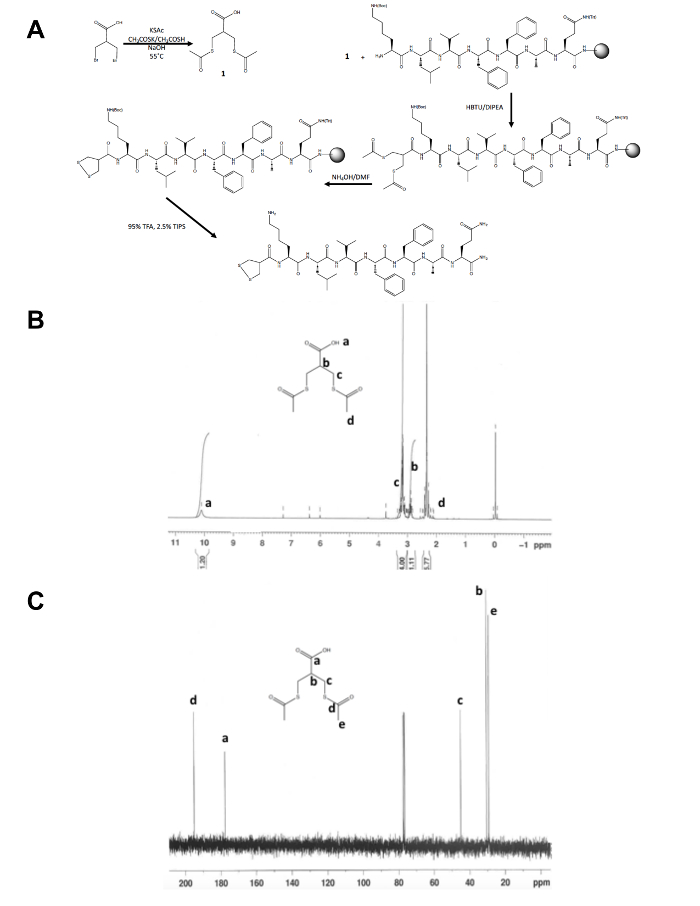
Abbildung 1: Synthetische Schema für die Charakterisierung von 1,2-Dithiolane Vorläufer Molekül. (A) synthetische Schema des endgültigen 1,2-Dithiolane geändert Peptids, 1,2-Dithiolane-KLVFFAQ-NH2. (B) 1H-NMR von 3-(Acetylthio) -2-(Acetylthiomethyl) Propanoic Säure in CDCl3 bei 300 MHz. (C)13C-NMR des 3-(Acetylthio) -2-(Acetylthiomethyl) Propanoic Säure in CDCl3 bei 75 MHz. Klicken Sie bitte hier um eine größere Version dieser Figur sehen.

Abbildung 2: Synthese von 1,2-Dithiolane geändert Peptid. (A) HPLC-Chromatogramm von der Reinigung des 1,2-Dithiolane - KLVFFAQ-NH2. (B) MALDI-TOF Massenspektrum von den Hauptgipfel von HPLC-Reinigung (Retentionszeit von ~17.5 min) im reflektron Modus mit DHB-Matrix bestätigt die berechnete Masse von 1,2-Dithiolane-KLVFFAQ-NH2. Gemeinsamen Addukte werden auch identifiziert. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3. Supramolekulare Charakterisierung von 1,2-Dithiolane geändert Peptid. (A) FT-IR-1 mg/mL 1,2-Dithiolane-KLVFFAQ-NH2 Fasern in 10 mM HEPES, pH 7,5 in 20 % CH3CN montiert. Der Peak bei 1627 cm-1 steht im Einklang mit der Peptide in eine β-Sheet-Konformation montiert. (B) CD von 1 mg/mL 1,2-Dithiolane-KLVFFAQ-NH2 Fasern in 10 mM HEPES, pH 7,5 in 20 % CH3CN montiert. Die minimale bei 218 Ellipticity nm steht im Einklang mit der Peptide in eine β-Sheet-Konformation montiert. (C) Bild der 1,2-Dithiolane-KLVFFAQ-NH2 Amyloid Faser (negative Fleck von 2 % Uranyl Acetat) durch TEM. Maßstabsleiste beträgt 100 nm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Dieser Artikel beschreibt die Details der Synthese und Reinigung von einer N-terminalen 1,2-Dithiolane geändert selbstorganisierende Peptid und die Charakterisierung der daraus resultierenden supramolekularen Strukturen. Die Synthese von 1,2-Dithiolane Peptids hier berichtet hat die Vorteile, einschließlich einer einstufigen Synthesis um Dithiolane Vorstufe, 3-(Acetylthio)-2 zu produzieren-Propanoic Säure (Acetylthiomethyl) und das Harz Mikrowelle Deprotection Reaktion der Vorläufer Thioacetate Schutz der Gruppe, um die Ausbeute der oxidierten 1,2-Dithiolane Glyko-Ammonium Hydroxid zu nutzen, wie eine sicherere Alternative zu den giftigen Hydrazin-Deprotection bereits29berichtet. Die insgesamt Festphasen-Peptidsynthese von 1,2-Dithiolane Peptids (Abbildung 1A) kann leicht geändert werden, indem die Sequenz Länge und Zusammensetzung, einschließlich der Verwendung von Fmoc-geschützte unnatürlichen Aminosäuren und C-terminalen Harz Chemie entsprechend viele verschiedene Forschungsanwendungen.
Um unerwünschte Peptid Nebenprodukte zu verhindern, wenn die Aminosäuren mit nukleophilen Seitenketten oder Aminosäuren mit dem Schutz der Gruppen reaktive Spaltprodukte haben, sollte die Spaltung cocktail20zusätzliche Radikalfänger hinzugefügt werden. Eine Test-Spaltung eines kleinen Teils (weniger als 10 % des gesamten Harzes) kann vor dem am Harz Mikrowelle Deprotection Schritt zu gewährleisten eine hohe Ausbeute an Kupplung Reaktion durchgeführt werden. Mit der Spalte und HPLC-Bedingungen, die im Bericht beschriebenen, elutes Thioacetate geschützten 1,2-Dithiolane Vorläufer Peptid Peak 5 min nach der abgekoppelt freie Amin-Peptid. Wenn eine erhebliche Menge an freien Amin Peptid bleibt, ein weiterer Schritt der Kupplung mit 3-(Acetylthio) -2-Propanoic Säure (Acetylthiomethyl) wird empfohlen. Die Intramolekulare 1,2-Dithiolane Disulfid Bindung ist auf der HPLC erkannt, durch die Überwachung der schwachen Disulfid Bindung Extinktion bei 330 nm. Der HPLC-Peak entspricht der oxidierten 1,2-Dithiolane wird bestätigt, indem Sie eine Peptid-Probe in einem separaten HPLC laufen 100 L 100 mM tris(2-carboxyethyl)phosphine(TCEP) hinzufügen. Die DÄMMUND reduziert Thiol mit Peptid haben eine unterschiedliche Verweildauer als das oxidierte Disulfid-Peptid. Die Thiol Peptid mit elutes ca. 1 min später als das Disulfid-Peptid mit der Säule und im Bericht beschriebenen Bedingungen. Eine geeignete alternative MALDI Matrix für Peptide ist α-Cyano-4-Hydroxycinnamic Säure (CHCA) und wird vorbereitet, indem man 1 mL 50 % Acetonitril mit 0,1 % TFA auf 5 mg CHCA. Die Proben können durch mit einer C18 Zip-Spitze vor der Masse MALDI-TOF-Analyse, wenn die Salz Addukt (Na+ und K+) Gipfel deutlich [M + H]+ Peak unterdrücken entsalzt werden.
Für diese Studien gewählte Peptidsequenz stammt vom niederländischen Mutante von Aβ-Peptid, verbunden mit der Alzheimer-Krankheit30und hat bisher gezeigt, dass in Amyloid Fasern des parallelen β-Blatt16,17 selbst zusammensetzen . Wie dargestellt in die repräsentativen Ergebnisse Abbildung 3A-C, versammelt das 1,2-Dithiolane-KLVFFAQ-NH2 -Peptid auch in Amyloid Fasern. Die FTIR Amid ich Strecke zentriert auf 1627cm-1 und CD Ellipticity minimale bei 218 nm sind spektroskopische Unterschriften der β-Sheet Baugruppen25,26,27"und" die Carbonylgruppe CO dehnen 1676 cm-1 entsprechend bestellt Glutamin Sidechain-Interaktionen deuten darauf hin, dass die Peptide in parallelen β-Stränge16,31,32organisiert sind.
Übertragung Elektronenmikroskopie Bilder, mit 2 % Uranyl Acetat negative Fleck, zeigen erweiterte und verdrehen supramolekulare Fasern, die etwa 10 nm in der Breite. Die Fasern des Peptids N-Terminal acetyliert, Ac-KLVFFAQ-NH2, sind glatt und gerade, mit einer etwas größeren Breite von fast 12 nm16. Da TEM Netze vorbereiten und Importieren von Bildern eine zeitintensive Prozess ist, empfiehlt es sich, mehrere TEM Raster aus der gleichen Baugruppe Probe gleichzeitig mit unterschiedlichen Konzentrationen Peptid vorzubereiten. Bereiten Sie eine verdünnte Probe für TEM (01:50 oder 1: 100) neben der Originalprobe Montage-Lösung. Die Amyloid Fasern bei hohen Konzentrationen können an das Stromnetz in Klumpen oder Patches haften und Importieren von Bildern der einzelnen Fasern kann schwierig sein. Es ist wichtig zu sehen, die Kanten der einzelnen Fasern für Breite Messungen und die Visualisierung der Faser Helizität ist oft verdeckt durch überfüllte Proben.
Da mehr Anwendungen mit supramolekularen Biomaterialien erforscht werden, braucht eine potenziell reaktiven funktionelle Gruppen zu integrieren, der orthogonal zur Selbstmontage Prozess in die Selbstorganisierende Monomere sind. In diesem Bericht beschriebenen Methoden markieren einen auf Harz-Ansatz für ein 1,2-Dithiolane geändert selbstorganisierende Peptid-Synthese und spektroskopische Charakterisierung der supramolekularen Strukturen.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Die Autoren haben nichts preisgeben.
Acknowledgments
Die Autoren möchten Danke Dr. B. Ellen Scanley für ihre technische Ausbildung und hilf mit die TEM an der Connecticut State Colleges und University (CSCU) Zentrum für Nanotechnologie und Dr. Ishita Mukerji an der Wesleyan University für den Zugriff auf ihre CD Spektrophotometer. Die Arbeit berichtet wurde zum Teil durch das Science Institute an der Fairfield University, die NASA Connecticut Space Grant-Konsortium und der National Science Foundation unter Grant Anzahl CHE-1624774 unterstützt.
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



