Summary
En protokoll for syntesen av en 1,2-dithiolane endret peptid og karakterisering av supramolecular strukturer som følge av peptid selvtillit forsamlingen.
Abstract
Rapporten fokuserer på syntesen av en N-terminus 1,2-dithiolane endret selv montasje peptid og karakterisering av den resulterende samlet selv supramolecular strukturer. Syntetisk ruten tar nytte av solid-fase peptid syntese med på harpiks koblingen av dithiolane Forløperen molekylet, 3-(acetylthio) -2-(acetylthiomethyl) propanoic syre og mikrobølgeovn-assistert thioacetate deprotection av peptid N-terminus før siste cleavage fra harpiks til 1,2-dithiolane endret peptid. Etter høy ytelse flytende kromatografi (HPLC) rensing av 1,2-dithiolane peptid, avledet fra nucleating kjernen i Aβ peptid forbundet med Alzheimers sykdom, vises peptid å selv samle til kryss-β amyloid fiber. Protokoller som karakteriserer amyloid fiber av Fourier-transform infrarød spektroskopi (FT-IR), sirkulære dichroism spektroskopi (CD) og overføring elektronmikroskop (TEM) presenteres. Metoder for N-terminal endring med en 1,2-dithiolane moiety godt karakterisert selv av peptider kan nå bli utforsket som modellsystemer å utvikle etter montering endring strategier og utforske dynamiske kovalente kjemi på supramolecular peptid nanofiber overflater.
Introduction
Robust peptid bond danner kjemi involvert i solid-fase peptid syntese og kontrollere rekkefølgen lengde og komposisjon gjøre peptidene som selv samle inn supramolecular strukturer et tungt undersøkt felt. Faktorene som kontrollere og stabilisere peptid selv montert strukturer, inkludert side kjede steric og elektrostatiske interaksjoner, hydrogenbinding og hydrofobe effekter1, tjene som et sett med utformingsregler. Som forskningen på disse grunnleggende regler fortsetter å gå videre, innebærer det logiske neste skrittet i peptid selvtillit forsamlingen utvide mangfoldet av peptid-baserte strukturer og funksjoner. Mens selv monterer peptider er en allsidig biomateriale som har blitt brukt for mange biomedisinsk programmer av tuning peptid sekvens eller montering forhold2,3,4, utvikling av strategier for etter montering endringer peptid nanofibers5,6,7,8,9 fortsatt en relativt uutforsket område.
Dynamisk disulfide exchange og thiol kjemi på overflaten av supramolecular strukturer er et område som har potensial til å gi ny og funksjonell biologisk materiale. Inkorporering av 1,2-dithiolane moieties (vanligvis et derivat av lipoic syre (la) eller asparagusic syre (aa)) er rapportert i liposome systemer10,11, blokk copolymers12,13, og som organisere ankere overflater14,15. Her, rapportere vi syntese og karakterisering av en selvstendig montering peptid avledet fra nucleating kjernen i Aβ peptid forbundet med Alzheimers sykdom som er endret på N-terminus med en 1,2-dithiolane funksjonsgruppe16, 17. Den resulterende supramolecular fiber nå fungere som en eksperimentell plattform å studere disulfide-utveksling og thiol reaktivitet på supramolecular overflaten av amyloid fiber18.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. syntese og rensing av 1,2-Dithiolane endret peptid
- Syntese av dithiolane forløper, 3-(acetylthio) -2-(acetylthiomethyl) propanoic syre19.
- Legge 1 g av 3-bromo - 2-(bromomethyl) propionsyre acid (1 hovedfag) oppløst i minimum av 1 M NaOH (ca 4 mL) til en 25-mL runde bunnen reaksjon flasken stirring ved 55 ° C. Forsegle en septa reaksjonen flasken og plasser under nitrogen atmosfære.
- Forberede en løsning som inneholder 1.49 g av kalium thioacetate (3.2 hovedfag) i 4 mL deionisert vann og 3 mL 2 M svovelsyre (H2SO4) til å opprette thioacetic syre i situ.
- Trekk thioacetic syre løsningen i en plast disponibel 10 mL sprøyte og plassere en nålen på sprøyten. Legge til blandingen dropwise reaksjon kolbe av piercing gjennom septa med nålen. Fortsette reaksjonen natten på 55 ° C.
- Overvåke reaksjonen av tynt lag kromatografi (TLC) på silica gel 60 F254 plater bruker en blanding av metanol og diklormetan (1:9). Visualisere reaksjon fremdriften av bromocresol grønne flekken. Produktet har en Rf = 0.57.
- Etter reaksjonen er fullført og avkjølt til romtemperatur, syre blandingen til pH 1 med 2 H M2så4. En gul olje skiller ut av løsning.
- Pakk ut produktet med kaldt kloroform (40 mL x 3). Kombinere de organiske lagene og tørr over magnesium sulfat. Fjerne kloroform under redusert trykk.
- Bekrefte identiteten til det isolerte produktet, 1, av kjernefysiske magnetisk resonans (NRM) spektroskopi som vist i tall 1B og C. Forventer du følgende resultater: 1H-NMR, CDCl3, 300 MHz: d = 10.1 (b, 1 H), 3.2 (m, 4 H), 2.9 (m, 1 H), 2,4 (s, 6 H); 13 C NMR, CDCl3, 75 MHz: d = 195.1 (CH3COS-), 177.6 (-COOH), 45,1 (-CH2S-), 30,5 (CH), 29,2 (-SCOCH3).
Merk: Produktet er en gul olje og har en samlet avkastning på 83%. Bruk produktet uten ytterligere rensing.
- SPPER og på-harpiks koblingen av Dithiolane forløper
Merk: Solid-fase peptid syntese beskrevet nedenfor ble utført på en automatisert peptid synthesizer, følgende anbefalte produsentens protokoller. Innstillinger og reagenser kan tilpasses for andre kommersielle instrumenter eller ved spesialiserte aminosyrer.- Veie ut 0.156 g Rink amid 4-methylbenzhydrylamine (MBHA) harpiks (0,1 mmol) og plasser i en reaksjonen fartøyet. Svelle harpiks i vannistedenfor (DMF) i minst 15 min før starten av syntese.
- Veie ut 4 ekvivalenter av hver fluorenylmethyloxycarbonyl (Fmoc) beskyttet aminosyre (0,4 mmol) i sekvensen og 0.152 g N, N, N', N'- tetramethyl-O-(1H- benotriazol-1-yl) uran hexafluorophosphate (0,4 mmol, HBTU) for hver aminosyre i sekvensen. Hver kassett inneholder både Fmoc-beskyttet aminosyre og HBTU.
- Etter running alle pre syntese kontrollerer på en synthesizer (fylle reagenser, tømmes reagens linjer og trykk alle reagensflasker), plassere aminosyre patronene i karusellen i C' til N' terminus retning. Plass en tomme patronen etter siste aminosyre posisjonen for det siste N-terminal Fmoc deprotection trinnet.
- Syntetisere peptid ved hjelp av standard anbefalte innstillinger.
- Deprotect Fmoc gruppen fra harpiks med 5 mL av 20% piperidine i DMF (5 min x 2).
- Vask harpiks med DMF (6 x 5 mL) før kopling trinn.
- For en enkelt kobling skritt, legge til 4 mL 0,4 M N-methylmorpholine i DMF Fmoc-beskyttet aminosyrer og HBTU. Aktivere Fmoc-beskyttet aminosyre løsningen for 30 før overføre løsningen til reaksjonen fartøyet.
Merk: Automatisert peptid synthesizeren blander harpiks og løsningen av boblende N2 gass hvert 30 s for 20 min mens kopling reaksjonen tar. For manuell peptid syntese, plassere reaksjonen fartøyet på en orbital shaker ved lav hastighet for varigheten av koblingen trinnet. - Avløp løsningen og vaske harpiks med DMF (3 x 5 mL).
- Gjenta trinn 1.2.4.1 gjennom 1.2.4.4 for hver Fmoc-beskyttet aminosyre i C' til N'-terminus retning å syntetisere peptid rundt.
- Etter siste N-terminal deprotection trinn, overføre harpiks disponibel fritted sprøyter til. Vask harpiks DMF (3 x 5 mL) og diklormetan (DCM, 3 x 5 mL).
Merk: Harpiks lagres etter DCM vaske i et vakuum desiccator. Hvis resinen ble lagret før kopling, sikre for å svelle harpiks i DMF før kopling reaksjonen. - Par dithiolane forløperen (1) til N-terminus av på-harpiks peptid ved å legge 4 tilsvarer 1, 5 mL DMF, 4 ekvivalenter av HBTU og 10 ekvivalenter av N, N-diisopropylethylamine (DIPEA). Pre-aktivere koblingen blandingen for 10 min før du legger til harpiks inneholder fritted sprøyten.
- Riste kopling reaksjonen for 2T. Etter 2 h, vask harpiks med DMF (3 x 5 mL) og gjenta kopling reaksjon med risting over natten.
- Andre koblingen, vaskes harpiks DMF (3 x 5 mL) og DCM (3 x 5 mL).
Merk: Resinen kan lagres på dette punktet under vakuum før cleavage.
- Thioacetate Deprotection og peptid Cleavage fra harpiks
- For å deprotect thioacetate gruppen fra N-terminus dithiolane forløperen, overføre tørket harpiks slik 10 mL mikrobølgeovn reaksjon og legge 2 mL DMF. Tillate skal svu, legge til en liten magnetic røre bar fartøyet og å suspendere med en lav hastighet magnetiske røring i 15 min.
- Legge til 2 mL konsentrert ammonium hydroksid cap reaksjonen fartøyet med silikon septa og plassere reaksjonen fartøyet i en mikrobølgeovn reaktor med mikrobølgeovn innstillingene for 75 ° C for 45 min med omrøring.
- Når mikrobølgeovn reaksjonen er fullført, kan du overføre harpiks ren disponibel fritted sprøyter til. Vask med DMF (2 x 5 mL) og metanol (MeOH, 2 x 5 mL).
- Legge til en løsning av konsentrert ammonium hydroxide i metanol (1:4), for et totalvolum på 5 mL. La riste over natten for å øke intramolekylære oksidasjon av disulfide obligasjonslån i dithiolane ringen.
- Vask harpiks med MeOH (2 x 5 mL) og DCM (3 x 5 mL).
Merk: Tørket harpiksen kan lagres i et vakuum desiccator på dette punktet. - Legge til spalting cocktail harpiks inneholder sprøyte med forsiktig risting for 1,5 t. Kløv cocktail brukes er 95% trifluoroacetic acid (TFA), 2,5% triisopropylsilane (TIPS) og 2,5% vann på et totalvolum på 5 mL.
FORSIKTIG: Arbeid under kjemiske avtrekksvifte bare. TFA er flyktig og etsende.
Merk: For fleste peptid sekvenser og aminosyre sidechain beskytte grupper, over cleavage cocktail løsningen er nok; men kan alternative cleavage cocktailer være nødvendig for visse aminosyre side kjede beskytte grupper (i bestemt peptider som inneholder Cys, Met, Trp og Arg) eller andre harpiks kjemi20. - Utløse den rå peptid i 25 mL kaldt diethyl Ether i et 50 mL konisk rør av dropwise tillegg fra fritted sprøyten. Peptid precipitates som en hvit solid. Pellet peptid med sentrifugering 1300 x g for 10 min. Dekanter nøye diethyl Eter i en egen beholder for innsamling.
- Legge til en annen 25 mL diethyl Ether konisk røret og suspendere re utløse av vortexing. Gjenta sentrifugering 1300 x g for 10 min og Dekanter diethyl Eter igjen. Tørr pellets under vakuum.
- Rensing av 1,2-Dithiolane endret peptid
Merk: Rense den rå peptid ved omvendt fase-HPLC. Samle inn og kombinere peptid toppene og bekrefte massen av MALDI-TOF massespektrometri.- Oppløse råolje peptid pellet i minimal mengde acetonitrile med 0,1% TFA. Peptids hydrophobicity og aggregering tilbøyelighet, forsiktig varme eksemplet på 40 ° C til hjelp i oppløselighet.
Merk: Unngå høyere temperaturer og sonication av peptid for å hindre potensielle disulfide exchange reaksjoner21,22,23. - For å forberede 1 mL av råolje peptid HPLC rensing, legge 400 μL konsentrert peptid lager i acetonitrile til 600 μL H2O med 0,1% TFA og filtrere gjennom en 22 μm sprøyten i HPLC ampuller. En ekstra 5% isopropanol kan legges til forhindre peptid aggregering og nedbør.
- Rense peptid C-18 semi preparative kolonnen med en strømningshastighet på 3 mL/min over en lineær gradient 15-55% acetonitrile i 20 min. sett UV-detektorer til 222 nm (amid ryggraden) og 330 nm (disulfide obligasjon). Samle og kombinere toppene av interesse (figur 2A).
- Bekreft peptid produkt massen av MALDI-TOF masse spectrometer i reflectron modus (figur 2B). For analyse, bland 0,5 μL samlet peak på MALDI plate med 0,5 μL 2,5-dihydroxybenzoic syre (DHB) matrix (10 mg/mL DHB i 50% acetonitrile, 0,1% TFA).
Merk: Felles addukter i MALDI-TOF massespektrometri inkluderer natrium og kalium salt adduct ([M + Na]+ og [M + K]+) topper. Avsalte prøven før analysen anbefales hvis salt adduct toppene undertrykke signalet fra hoved [M + H]+ peak. I tillegg en oksidert toppen av [M + O]+ er også oppdaget i 1,2-dithiolane endret peptid. En rapport om laser indusert oksidasjon fra MALDI ionization hjelp av DHB matrise antyder at faktorer inkludert eksempel konsentrasjon, løsningsmiddel og laser intensitet kan endres for å begrense MALDI indusert oksidasjon gjenstand24. - Etter MALDI-TOF bekreftelse av riktig massen, lyophilize peptid etter flash frysing. Holde lyofilisert peptid pulveret under vakuum før montering.
- Oppløse råolje peptid pellet i minimal mengde acetonitrile med 0,1% TFA. Peptids hydrophobicity og aggregering tilbøyelighet, forsiktig varme eksemplet på 40 ° C til hjelp i oppløselighet.
2. karakterisering av Supramolecular strukturer selvtillit forsamlingen
-
Dannelsen av Amyloid Fibre
- For å forberede selvtillit forsamlingen løsning, veie ut 1 mg av peptid pulver bruker en analytical balanse. Oppløses i en blanding (pH 7.5) av 20% acetonitrile og 10 mM (4-(2-hydroxyethyl)-1-piperazineethanesulfonic syre (HEPES) i en 1,5 mL microcentrifuge tube, til en siste konsentrasjon av 1 mg/mL peptid montering blanding. Vortex montering løsningen og la til å montere ved romtemperatur.
-
Spektroskopiske karakterisering av Amyloid Fibre
- Følg monteringen peptid via Fourier-transform infrarødspektroskopi (FTIR) alle dagene. En bred topp sentrert rundt 1670 cm-1 er IR signaturen fremkommer fra umontert peptider i eksempel17. Peptid montering prøvene tar vanligvis en til to uker for bred umontert toppen å forsvinne og nå modning.
- Tørr en aliquot av 8-10 μL montering løsningen som en tynn film på ATR diamant krystall. Overvåke forsvinningen av en stor og bred topp fra 1640 til 1630 cm-1 som tørr filmen former.
- Erverve IR spectra fra 1800-1500 cm-1 gjennomsnitt 50 skanner med 2 cm-1 oppløsning. Skaffe og trekke bakgrunnsskanning før hver prøve skanning. IR-signaturen for β arks montering er en skarp mellom 1625 og 1635 cm-1 (figur 3A)25,26.
- Karakterisere peptid forsamlingen β arks rik supramolecular strukturer av sirkulære dichroism (CD). Registrere spectra med en CD-spectropolarimeter med et Peltier temperatur kontrollsystem.
- Pipetter 30 μL montering løsningen i en 0,1 mm banen lengde microcuvette.
Merk: Cellen innehaver er nødvendig å klemme og holdning den korte vei lengde cellen i instrumentet. - For hver spektrum, sette CD instrumentet til følgende parametere: skanning bølgelengder av 300 nm 180 nm, skanning hastighet på 100/min, båndbredde 1 nm, 25 ° C, gjennomsnittlig tre skanninger.
- Samle et spekter av bufferen (20% acetonitrile/10 mM HEPES, pH 7.5) og trekke fra hver prøve skanning som en kontroll. CD signaturen for β-ark er en ellipticity minimum sentrert rundt 220 nm (figur 3B)27.
- Pipetter 30 μL montering løsningen i en 0,1 mm banen lengde microcuvette.
- Følg monteringen peptid via Fourier-transform infrarødspektroskopi (FTIR) alle dagene. En bred topp sentrert rundt 1670 cm-1 er IR signaturen fremkommer fra umontert peptider i eksempel17. Peptid montering prøvene tar vanligvis en til to uker for bred umontert toppen å forsvinne og nå modning.
-
Mikroskopi Amyloid Fibre
- La to til tre uker for peptid prøvene å modne i β arks rik supramolecular strukturer.
Merk: Samlingene kan avbildes bruker overføring elektronmikroskop (TEM) på tidligere stadier av samlingen prosessen også.- Pipetter 10 μL peptid montering løsningen på overflaten av TEM karbon rutenett.
Merk: ta vare ikke for å røre pipette spissen til rutenettet overflaten. Høy presisjon, selv stenge pinsetter brukes til å holde TEM rutenettet under forberedelse. - Vent 1-2 min slik at samlingene til adsorberes på rutenettet overflaten. Fjern overflødig prøven ved å berøre filter papir til kanten av rutenettet.
- Forberede en 2% uranyl acetate flekk ved å legge til 100 μL deionisert vann kommersielt tilgjengelig 4% uranyl acetate løsning. Pipetter 10 μL 2% uranyl acetate flekken på rutenettet overflaten og ruge for 2-3 minutter. Etter inkubasjon, fjerne overflødig flekken ved å berøre filter papir til kanten av rutenettet.
- Plass TEM rutenettene i et vakuum desiccator over natten. Lagre under vakuum til bildebehandling.
- Bilde forberedt prøvene med TEM (Figur 3 c). Typisk parametere for mikroskopi er som følger: bilder med forstørrelse mellom 9300 X 23, 000 X, glødetråd med en akselererende spenning 120 kV.
Merk: ImageJ kan brukes til å måle gjennomsnittlig fiber bredden av supramolecular strukturer ervervet TEM bilder28.
FORSIKTIG: Se alle relevante Produktdatablad (SDS) før bruk. Flere kjemikalier som brukes i syntese, rensing, og karakterisering av beskrevet 1,2-dithiolane endret selv av peptider er skadelig eller giftig og bør bare brukes under kjemiske avtrekksvifte. Alltid bruke riktig personlig verneutstyr (inkludert vernebriller, laboratoriefrakk, full lengde bukser, lukket-toe sko) når du arbeider i laboratoriet.
- Pipetter 10 μL peptid montering løsningen på overflaten av TEM karbon rutenett.
- La to til tre uker for peptid prøvene å modne i β arks rik supramolecular strukturer.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Bortsett fra første ettrinns syntese av dithiolane Forløperen molekylet oppstår resten av 1,2-dithiolane endret peptid syntese på solid støtte (figur 1A). Konvertering av 3-bromo - 2-(bromomethyl) propionsyre acid 3-(acetylthio) -2-(acetylthiomethyl) propanoic acid, dithiolane forløperen, bekreftes av 1H og 13C NMR (figur 1B og C) før den er koblet til den frie N-terminus Amin i et peptid fortsatt på-harpiks. Deprotection av thioacetate til thiols med ammonium hydroksid utføres med en mikrobølgeovn reaktoren og 1,2-dithiolane er oksidert overnatting i metanol før 1,2-dithiolane endret peptid er kløyvde fra harpiks. Den rå peptid er renset av omvendt fase HPLC (figur 2A) og produktets masse er bekreftet av MALDI-TOF massespektrometri (figur 2B).
Renset 1,2-dithiolane peptid samler selv inn modne amyloid fiber over en periode på 2-3 uker. FT-IR (figur 3A) og CD spektroskopi (figur 3B) brukes til å følge monteringen og karakterisere utvidet β arks konformasjon. Fibrene er fotografert av TEM (Figur 3 c).
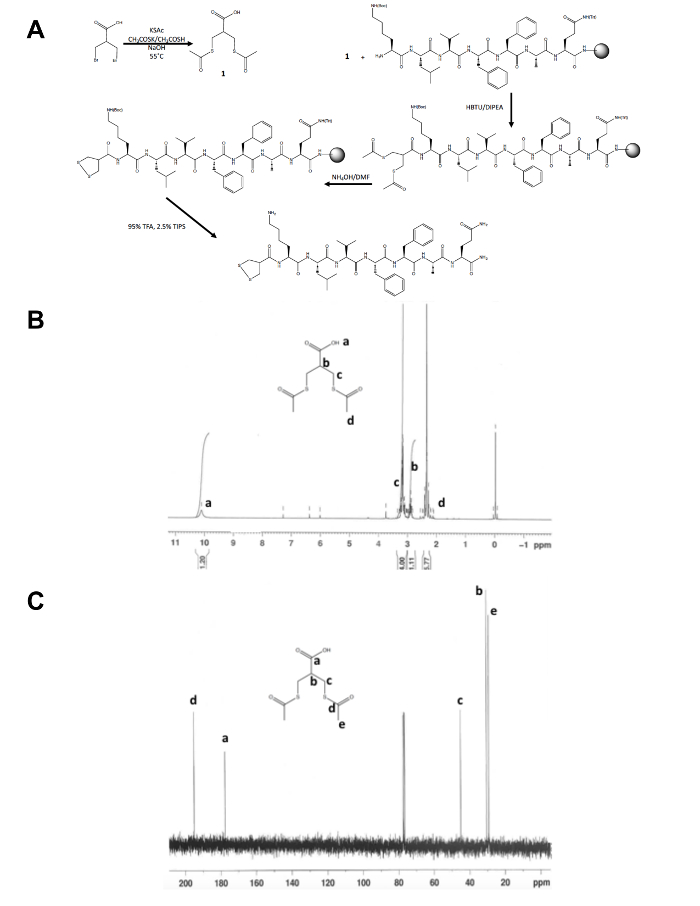
Figur 1. Syntetisk ordning for karakterisering av 1,2-dithiolane Forløperen molekylet. (A) syntetisk ordningen med den endelige 1,2-dithiolane endret peptid, 1,2-dithiolane-KLVFFAQ-NH2. (B) 1H-NMR av 3-(acetylthio) -2-(acetylthiomethyl) propanoic syre i CDCl3 300 MHz. (C)13C-NMR 3-(acetylthio) -2-(acetylthiomethyl) propanoic syre i CDCl3 på 75 MHz. Klikk her vise en større versjon av dette tallet.

Figur 2. Syntese av 1,2-dithiolane endret peptid. (A) HPLC chromatogram av rensing av 1,2-dithiolane - KLVFFAQ-NH2. (B) MALDI-TOF mass spekteret av den største høydepunkt fra HPLC rensing (tiden av ~17.5 min) i reflectron-modus bruker DHB matrix bekrefter beregnet masse 1,2-dithiolane-KLVFFAQ-NH2. Felles addukter identifiseres også. Klikk her for å se en større versjon av dette tallet.

Figur 3. Supramolecular karakteristikk av 1,2-dithiolane endret peptid. (A) FT-IR 1 mg/mL 1,2-dithiolane-KLVFFAQ-NH2 fibre samlet i 10 mM HEPES, pH 7.5 i 20% CH3CN. Høyden på 1627 cm-1 stemmer overens med peptidene samlet i en β arks konformasjon. (B) CD 1 mg/mL 1,2-dithiolane-KLVFFAQ-NH2 fibre samlet i 10 mM HEPES, pH 7.5 i 20% CH3CN. Ellipticity minst på 218 nm er forenlig med peptidene samlet i en β arks konformasjon. (C) bilde av 1,2-dithiolane-KLVFFAQ-NH2 amyloid fiber (negativ flekk av 2% uranyl acetate) av TEM. Skala bar er 100 nm. Klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Denne artikkelen diskuterer detaljer om både syntese og rensing av en N-terminal 1,2-dithiolane endret selv montasje peptid og karakterisering av de resulterende supramolecular strukturene. Syntese av 1,2-dithiolane peptid rapporterte her har fordeler, inkludert en ettrinns syntese å produsere dithiolane forløperen, 3-(acetylthio) -2-(acetylthiomethyl) propanoic syre, og på-harpiks mikrobølgeovn deprotection reaksjon av det forløperen thioacetate beskytte gruppe å gi oksidert 1,2-dithiolane moiety utnytte ammonium hydroksid som et tryggere alternativ til giftige hydrazine deprotection rapportert tidligere29. Samlet solid-fase peptid syntesen av 1,2-dithiolane peptid (figur 1A) kan enkelt endres ved å endre sekvensen lengde og komposisjon, inkludert bruk av Fmoc-beskyttet unaturlig aminosyrer, og C-terminalen harpiks kjemi som passer mange forskjellige forskning.
For å hindre uønskede peptid biprodukter når aminosyrer med nukleofil siden kjeder eller aminosyrer med beskytte grupper har reaktive cleavage produkter, bør ekstra renovasjonsarbeider legges til spalting cocktail20. En test spalting av en liten del (mindre enn 10% av totale harpiks) kan utføres før på harpiks mikrobølgeovn deprotection trinn å sikre en høy avkastning av reaksjonen. Bruke kolonnen og HPLC forholdene beskrevet i rapporten, elutes thioacetate beskyttet 1,2-dithiolane forløper peptid toppen 5 min etter montert gratis Amin peptid. Hvis en betydelig mengde gratis Amin peptid forblir, et koblingen steg med 3-(acetylthio) -2-(acetylthiomethyl) propanoic syre anbefales. Intramolekylære 1,2-dithiolane disulfide obligasjon oppdages på HPLC ved å overvåke svak disulfide obligasjon absorbansen på 330 nm. HPLC toppen tilsvarer det oksidert 1,2-dithiolane er bekreftet ved å legge til 100 L av 100 mM tris(2-carboxyethyl)phosphine(TCEP) et peptid utvalg i en separat HPLC kjøre. TCEP redusert thiol som inneholder peptid vil ha en annen tiden enn oksidert disulfide peptid. Thiol som inneholder peptid elutes ca 1 min senest disulfide peptid kolonne og betingelsene beskrevet i rapporten. En egnet alternativ MALDI matrise for peptider er α-cyano-4-hydroxycinnamic acid (CHCA) og er utarbeidet ved å legge til 1 mL av 50% acetonitrile med 0,1% TFA til 5 mg CHCA. Eksemplene kan være desalted ved hjelp av en C18 zip-spissen før MALDI-TOF masse analyse hvis salt adduct (Na+ og K+) toppene betydelig undertrykke [M + H]+ toppen.
Peptid sekvensen valgt for disse studiene er avledet fra nederlandsk mutant av Aβ-peptid forbundet med Alzheimers30, og har tidligere vist seg å selv samle til amyloid fiber parallelle β-ark16,17 . Som vist i representant resultatene figur 3A-C, samler 1,2-dithiolane-KLVFFAQ-NH2 peptid også inn amyloid fiber. FTIR amid jeg strekke sentrert i 1627cm-1 og CD ellipticity minimum på 218 nm er spektroskopiske signaturer β arks samlinger25,26,27og karbonyl CO strekningen på 1676 cm-1 tilsvarer bestilt glutamin side-kjeden interaksjoner foreslår at peptidene er organisert i parallell β-tråder16,31,32.
Overføring elektronmikroskop bilder ved bruk av 2% uranyl acetate negative flekken, Vis utvidet og kronglete supramolecular fiber som er ca 10 nm i bredde. Fiber av N-terminal acetylated peptid, Ac-KLVFFAQ-NH2, er jevne og rette, med en litt større bredde på nesten 12 nm16. Siden forberede TEM rutenett og henting av bilder er en tid intensive prosessen, er det best å forberede flere TEM rutenett fra samme montering eksempel samtidig av varierende peptid konsentrasjoner. Forberede en utvannet prøve TEM (1:50 eller 1: 100) sammen med den opprinnelige montering løsning prøven. Amyloid fibrene i høy konsentrasjoner kan overholde rutenettet i klumper eller oppdateringer og henting av bilder av personlige Fibre kan være vanskelig. Det er viktig å se kantene på individuelle fiber for bredden målinger og visualisering av fiber helicity er ofte skjult av overfylte prøver.
Som flere programmer bruker supramolecular biologisk materiale blir undersøkt, er det behov for å integrere potensielt reaktive funksjonelle grupper som er ortogonale til selvstendig montering prosess i de selv montasje monomerer. Metodene som er beskrevet i denne rapporten markere på harpiks tilnærming til syntesen av en 1,2-dithiolane endret selv montasje peptid og spektroskopiske karakterisering av supramolecular strukturer.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne ikke avsløre.
Acknowledgments
Forfatterne vil takke Dr. B. Ellen Scanley for hennes teknisk opplæring og hjelp til TEM på Connecticut statlige høgskoler og University (CSCU) senter for nanoteknologi og Dr. Ishita Mukerji ved Wesleyan University for tilgang til hennes CD spektrofotometeret. Arbeidet som er rapportert ble delvis støttet av Science Institute ved Fairfield University, NASA Connecticut plass Grant konsortiet, og National Science Foundation under Grant nummer CHE-1624774.
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



