Summary
1, 2-dithiolane의 합성에 대 한 프로토콜 펩 티 드와 펩 티 드에서 자기 조립 결과 supramolecular 구조의 특성 수정.
Abstract
이 보고서는 N-터미널 1, 2-dithiolane의 합성에 초점을 맞추고 수정 자가 조립 펩 티 드 및 그 결과의 특성은 자기 supramolecular 구조를 조립. 합성 경로 dithiolane 선구자 분자, 3-(acetylthio)-2의 수 지에 결합 된 단단한 단계 펩 티 드 종합의 이용-(acetylthiomethyl) propanoic 산, 그리고 전자 레인지를 이용한 thioacetate는 펩 티 드의 deprotection 1, 2-dithiolane를 수 지에서 최종 분열 하기 전에 N-말단 펩 티 드를 수정. 1, 2-dithiolane 펩타이드, Alzheimer의 질병과 관련 된 Aβ 펩 티 드의 nucleating 코어에서 파생 된의 고성능 액체 크로마토그래피 (HPLC) 정화 후 펩 티 드 크로스-β 녹말 체 섬유에 조립 자체에 표시 됩니다. 푸리에 변환 적외선 분광학 (IR FT), 원형이 색 성 분광학 (CD) 및 전송 전자 현미경 (TEM) 녹말 체 섬유의 특성 프로토콜 표시 됩니다. 잘 특징이 자가 조립 펩 티 드를 1, 2 dithiolane moiety와 N 맨끝 수정 방법 지금 모델 시스템 조립 후 수정 전략을 개발 하 고에 동적 공유 화학 탐험 탐험 하실 수 있습니다. supramolecular 펩타이드 nanofiber 표면입니다.
Introduction
단단한 단계 펩 티 드 합성에 참여 하는 강력한 펩 티 드 결합 형성 화학 고 제어 시퀀스 길이 구성 능력 자체는 무 겁 게 연구 분야 supramolecular 구조로 조립 펩 티 드. 펩타이드 자기 조립된 구조, 입체 사이드 체인을 포함 하 여 있고 정전기 상호 작용, 수소 결합, 소수 성 효과1, 안정화 및 제어 하는 요소는 디자인 규칙의 집합으로 제공 합니다. 이러한 기본적인 디자인 규칙에 대 한 연구 진행을 계속, 펩 티 드에 논리적인 다음 단계 자기 조립 포함 한다 펩 티 드 기반 구조와 기능의 다양성을 확대. 펩 티 드를 자체 조립 하는 동안은 많은 생물 의학 응용 프로그램에 대 한 펩 티 드 순서 또는 어셈블리 조건2,3,4, 개발 전략을 조정 하 여 사용 된 다양 한 소재 펩 티 드 nanofibers5,6,7,,89 조립 후 수정 상대적으로 미개척된 지역에 남아 있다.
Supramolecular 구조의 표면에 동적 이황화 exchange thiol 화학 잠재력이 새로운 고 기능성 바이오 소재를 하나의 영역입니다. Liposome 시스템10,11, 블록 공중 합체12,13에서 것과 같이 1, 2 dithiolane moieties (일반적으로 리 포 산 (la) 또는 asparagusic 산 (aa)의 파생)의 보고 표면14,15에서 앵커를 조직. 여기, 우리 보고 합성과 자기 조립 펩 티 드에는 N-1, 2-dithiolane 기능 그룹16, 수정 된 Alzheimer의 질병과 관련 된 Aβ 펩 티 드의 nucleating 코어에서 파생 된의 17. 결과 supramolecular 섬유는 지금 녹말 체 섬유18supramolecular 표면에 이황화 교환 및 thiol 반응성 연구 실험 플랫폼 역할을 합니다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. 합성 및 1, 2-Dithiolane의 정화 수정 펩 티 드
- Dithiolane 선구자, 3-(acetylthio)-2의 합성-(acetylthiomethyl) propanoic 산19.
- 3의 1 g 추가-브로 모-2-(bromomethyl) 프로 산 (1 equiv.) 최소한의 55 ° c.에 감동과 25 mL 둥근 바닥 반응 플라스 크를 1 M NaOH (약 4 mL)에 녹 격 막으로 반응 플라스 크를 밀봉 하 고 질소 분위기에서 장소.
- 칼륨 thioacetate의 1.49 g를 포함 하는 솔루션을 준비 (3.2 equiv.) 4 ml 이온된 수의 및 2 M 황산의 3 mL (H2등4) 만드는 thioacetic 산 현장에.
- 플라스틱 일회용 10 mL 주사기로 thioacetic 산 성 솔루션을 당겨 하 고 주사기에 바늘을 놓습니다. 추가 혼합물 dropwise 반응 플라스 크에는 septa 통해 바늘과 피어 싱으로. 55 ° c.에 반응을 밤새 계속
- 메탄올과 dichloromethane (1:9)의 혼합물을 사용 하 여 실리 카 젤 60 F254 접시에 얇은 층 크로마토그래피 (TLC)에 의해 반응을 모니터링 합니다. Bromocresol 녹색 얼룩에 의해 반응 진행을 시각화. 제품에는 Rf = 0.57.
- 반응이 완전 하 고 실내 온도에 냉각 후 시 어 지 다 pH 1 2 M H2에 혼합 그래서4. 노란 기름 솔루션에서 분리합니다.
- 감기 클로 프롬 (40 mL x 3)와 함께 제품을 압축을 풉니다. 유기 레이어를 결합 하 고 황산 마그네슘에 건조. 감소 된 압력 하에서 클로 프롬을 제거 합니다.
- 그림 1B 와 C에서 같이 핵 자기 공명 (NMR) 분광학에 의해 절연된 제품, 1의 id를 확인 합니다. 다음과 같은 결과: 1H NMR, CDCl3, 300 MHz: d = 10.1 (b, 1 시간), 3.2 (m, 4 시간), (m, 1 시간) 2.9, 2.4 (s, 6 H); 13 C NMR, CDCl3, 75 MHz: d 195.1 (채널3C운영 체제-) = 177.6 (-C우), 45.1 (-CH2S-), 30.5 (CH), 29.2 (-SCOCH3).
참고: 제품 노란색 오일 이며, 83%의 전반적인 수확량을 있다. 더 정화 없이 제품을 사용 합니다.
- SPPS과 Dithiolane 전조의 수 지에 결합
참고: 아래 설명 된 단단한 단계 펩 티 드 합성 자동된 펩타이드 합성기, 권장된 제조업체의 프로토콜 다음에 실시 됐다. 특수 아미노산을 사용 하는 경우 설정 및 시 약 또는 다른 상업적인 악기에 대 한 적응 수 있습니다.- 그리고 링크 아 미드 4-methylbenzhydrylamine (MBHA) 수 지 (0.1 m m o l)의 0.156 g 밖으로 무게는 반응 용기에. 합성의 시작 이전에 적어도 15 분 동안 dimethylformamide (DMF)에서 수 지를 팽창.
- 4 해당 각 fluorenylmethyloxycarbonyl (Fmoc)의 밖으로 무게 순서에 0.152 g의 아미노산 (0.4 mmol) 보호 N, N, N', N'-tetramethyl-O-(1H-benotriazol-1-yl) 우라늄 hexafluorophosphate (0.4 mmol, HBTU)에 대 한 시퀀스에 있는 각 아미노산의 산. 각 카트리지는 보호 Fmoc 아미노산 및 HBTU 포함 되어 있습니다.
- 모든 사전 합성 신디사이저에 대 한 검사를 실행 한 후 (리필 시 약, 시 약 라인 플러시 및 가압 모든 시 약 병), c에서 회전 목마에 아미노산 카트리지를 놓고 ' n ' 종점 방향. 마지막 N 맨끝 Fmoc deprotection 단계에 대 한 최종 아미노산 위치 후 빈 카트리지를 놓습니다.
- 표준 권장된 설정을 사용 하 여 펩 티 드를 음성 합성.
- DMF (5 분 x 2)에서 20 %piperidine 5 mL와 수 지에서 Fmoc 그룹 deprotect
- 커플링 단계 전에 DMF (6 x 5 mL)와 수 지를 세척.
- 단일 결합 단계에 대 한 보호 Fmoc 아미노산을 HBTU 사용 DMF에 0.4 M N-methylmorpholine의 4 mL을 추가 합니다. 30 아미노산 Fmoc 보호 솔루션 활성화 솔루션 반응 배를 전송 하기 전에 s.
참고: 자동된 펩타이드 합성기는 수 지와 혼합 솔루션 버블링 N2 가스에 의해 모든 30의 커플링 반응 하면서 20 분 걸립니다 장소. 수동 펩 티 드 합성에 대 한 연결 단계 동안 낮은 속도로 궤도 셰이 커에 반응 배를 놓습니다. - 솔루션 배수와 DMF (3 x 5 mL)와 수 지를 세척.
- 1.2.4.1 1.2.4.4 통해 단계를 반복 하 여 C에서 각 보호 Fmoc 아미노산에 대 한 ' n '-관심의 펩 티 드를 합성 하 종점 방향.
- 마지막 N 맨끝 deprotection 단계 후 일회용 fritted 주사기에 수 지를 전송 합니다. DMF (3 x 5 mL)와 dichloromethane (DCM, 3 x 5 mL) 수 지를 세척.
참고: 수 지 DCM 진공 desiccator 세척 후 저장할 수 있습니다. 수 지 커플링 이전 저장 된 경우 커플링 반응 전에 DMF에 수 지를 확인 합니다. - N, N-diisopropylethylamine (DIPEA)의 HBTU의 4 등가물와 10 1, DMF의 5 mL의 4 항목을 추가 하 여 dithiolane 전조 (1)-수 지 펩 티 드의 N-말단에 결합. 미리 fritted 주사기를 포함 하는 수 지를 추가 하기 전에 10 분 동안 커플링 혼합물을 활성화 합니다.
- 흔들어 2 h에 대 한 커플링 반응. 2 시간 후 DMF (3 x 5 mL)와 수 지를 세척 하 고 하룻밤 떨고와 커플링 반응 반복 합니다.
- 두 번째 연결 후 DCM (3 x 5 mL)와 DMF (3 x 5 mL) 수 지를 세척.
참고: 수 지 저장할 수 있습니다 진공에서이 시점에서 분열까지.
- Thioacetate Deprotection 및 수 지에서 펩 티 드 분열
- N-말단 dithiolane 전조에서 thioacetate 그룹 deprotect, 10 mL 전자 레인지 반응 관에 말린된 수 지를 전송를 DMF의 2 개 mL를 추가 합니다. 팽창, 선박, 작은 자석 볶음 바를 추가 하 고 다시 15 분 동안 자석 교 반 속도가 낮은 중단에 수 지를 수 있습니다.
- 수산화 암모늄 농도의 2 개 mL를 추가, 실리콘 격 막과 반응 배 모자 고 반응 배 감동으로 45 분 75 ° C의 전자 레인지 설정을 사용 하 여 전자 레인지 반응 합니다.
- 전자 레인지 반응 완료 후 깨끗 한 일회용 fritted 주사기에 수 지를 전송 합니다. DMF (2 x 5 mL)와 메탄올 (MeOH, 2 x 5 mL) 씻으십시오.
- 5 mL의 전체 볼륨에 대 한 메탄올 (1:4)에 집중된 수산화 암모늄의 솔루션을 추가 합니다. Dithiolane 링에서 이황화 결합의 intramolecular 산화를 증가 하룻밤 흔들어 둡니다.
- 워시 MeOH (2 x 5 mL)와 DCM (3 x 5 mL) 수 지.
참고: 말린된 수 지 저장할 수 있습니다 진공 desiccator에이 시점에서. - 부드럽게 1.5 h에 대 한 동요와 주사기를 포함 하는 수 지에 분열 칵테일을 추가 합니다. 사용 분열 칵테일 95 %trifluoroacetic 산 (TFA), 2.5 %triisopropylsilane (팁), 그리고 2.5% 물 5 mL의 총 볼륨입니다.
주의: 화학 연기 후드만 작동 합니다. TFA는 휘발성과 부식성.
참고: 시퀀스 펩 티 드와 아미노산 sidechain 보호 그룹의 대부분 위의 절단 칵테일 솔루션은 충분 한; 그러나, 다른 분열 칵테일 보호 그룹 (Arg, Trp, 메트로, Cys 포함 된 특정 펩 티 드) 또는 다른 수 지 화학20특정 아미노산 사이드 체인에 대 한 필요할 수 있습니다. - Fritted 주사기에서 dropwise 추가 의해 원유 펩 티 드 25 mL 50 mL 원뿔 튜브에 차가운 diethyl 에테르로 침전. 펩 티 드 흰색 고체로 침전. 펠 릿 10 분 대 한 1300 x g에서 원심 분리 하 여 펩타이드는 신중 하 게 쓰레기 수 거에 대 한 별도 용기에 diethyl 에테르를 가만히 따르다.
- Diethyl 에테르의 또 다른 25 mL 원뿔 튜브를 추가 하 고 다시 침전 vortexing에 의해 일시 중단. 10 분 동안 1300 x g에서 원심 분리를 반복 하 고 다시 diethyl 에테르를 가만히 따르다. 진공에서 펠 릿 건조.
- 1, 2-Dithiolane의 정화 수정 펩 티 드
참고: 역 상 HPLC에 의해 원유 펩 티 드를 정화. 수집 및 결합 하는 펩 티 드 봉우리 고 TOF MALDI 질량 분석에 의해 질량을 확인 합니다.- 최소한의 양의 0.1% 이기에 원유 펩 티 드 펠 릿 분해 TFA. 펩 티 드의 hydrophobicity 및 집계 성향, 가용성에 원조를 40 ° C에서 샘플을 열 부드럽게.
참고: 잠재적인 이황화 교환 반응21,,2223을 방지 하기 위해 높은 온도 및 펩 티 드의 쥡니다 피하십시오. - 원유 펩 티 드의 1 mL HPLC 정화를 준비 하려면 추가할 집중된 펩 티 드의 400 μ 이기에 H2O 0.1 %TFA 필터의 600 μ 22 μ m 주사기 필터를 통해 HPLC 유리병에. 추가 5% 소 프로 파 놀 펩타이드 집계 및 강 수를 방지 하기 위해 추가할 수 있습니다.
- 정화 C-18 반 대리점 열을 사용 하 여 20 분 세트 15-55% 이기의 선형 그라데이션을 통해 3 mL/min의 유량과 펩 티 드 222에 UV 검출기 (아 미드 백본) 및 330 nm (이황화 결합). 수집 하 고 (그림 2A)의 봉우리를 결합.
- MALDI TOF 질량 분석기 reflectron 모드 (그림 2B)에 의해 펩 티 드 제품 질량을 확인 합니다. 분석, 2, 5-dihydroxybenzoic 산 (DHB) 매트릭스의 0.5 μ MALDI 격판덮개에 수집 된 피크의 0.5 μ 혼합 (10 mg/mL DHB 50% 이기, 0.1 %TFA).
참고: 일반적인 adducts MALDI TOF에서 질량 분석 포함 나트륨 및 칼륨 소금 adduct ([M + 나]+ [M + k]+) 봉우리. 권장 분석 전에 샘플 담 소금 adduct 봉우리 주요 [M + H]+ 의 신호를 억제. 또한, [M + O]+ 의 산화 피크 감지 1, 2-dithiolane 수정 펩 티 드에. DHB 매트릭스를 사용 하 여 MALDI 이온화에서 레이저 유도 된 산화에 대 한 보고서 샘플 농도, 용 매, 및 레이저 강도 포함 하 여 요인 제한 MALDI 유발 산화 유물24수정할 수 있습니다 제안 합니다. - 정확한 질량의 MALDI TOF 확인, 후 플래시 동결 후 펩 티 드를 lyophilize. 어셈블리까지 진공에서 동결 건조 된 펩 티 드 분말을 유지.
- 최소한의 양의 0.1% 이기에 원유 펩 티 드 펠 릿 분해 TFA. 펩 티 드의 hydrophobicity 및 집계 성향, 가용성에 원조를 40 ° C에서 샘플을 열 부드럽게.
2. 특성화 Supramolecular의 자기 조립 구조
-
녹말 체 섬유의 형성
- 자기 집합 솔루션을 준비 하려면 분석 균형을 사용 하 여 펩 티 드 분말의 1 밀리 그램으로 무게. 20% 이기와 10 mM (4-(2-hydroxyethyl)-1-piperazineethanesulfonic 산 (HEPES) 1 mg/mL의 펩 티 드 어셈블리 혼합물의 최종 농도에 1.5 mL microcentrifuge 튜브 혼합 (pH 7.5)로. 소용돌이 어셈블리 솔루션 고 떠나 실 온에서 조립.
-
녹말 체 섬유의 분 광 특성
- 며칠 마다 퓨 리에 변환 적외선 (FTIR) 분광학을 통해 펩 티 드 어셈블리 프로세스를 따릅니다. 1670 c m-1 을 중심으로 광범위 한 피크 샘플17unassembled 펩 티 드에서 발생 하는 IR 서명입니다. 펩 티 드 어셈블리 샘플은 보통 1 ~ 2 주 사라지고 성숙에 도달 하는 광범위 한 unassembled 피크에 대 한 가져가 라.
- ATR 다이아몬드 크리스탈에 박막으로 어셈블리 솔루션의 8-10 μ의 약 수를 건조. 드라이 필름 양식으로 1640에서 1630 cm-1 에 크고 넓은 물 피크의 실종을 모니터링 합니다.
- 2 cm-1 해상도 50 검사 평균 1500-1800 c m-1 에서 IR 스펙트럼을 취득 합니다. 취득 하 고 각 샘플 스캔 이전 배경 검사를 뺍니다. Β-시트 어셈블리에 대 한 IR 서명을 1625 및 1635 c m-1 (그림 3A)25,26사이 예리한 피크입니다.
- 원형이 색 성 (CD)에 의해 β 시트 풍부한 supramolecular 구조로 펩 티 드 어셈블리를 특징. Peltier 온도 조절 시스템 CD spectropolarimeter를 사용 하 여 스펙트럼을 기록 합니다.
- 30 μ를 0.1 m m 경로 길이 microcuvette에서 어셈블리 솔루션의 플라스틱
참고: 셀 홀더 클램프 및 악기의 짧은 경로 길이 셀 위치에 필요 합니다. - 각 스펙트럼에 대 한 다음 매개 변수를 CD 악기 설정: 스캔 300의 파장 180 nm, 100/min의 스캐닝 비율, 밴드 너비 1 nm, 25 ° C, 평균 3 검사의 nm.
- 버퍼 (20% 이기/10 mM HEPES, pH 7.5)의 스펙트럼을 수집 하 고 각 샘플 스캔 컨트롤에서 뺍니다. Β-시트의 CD 서명을 한 타원 최소 중심 약 220 nm (그림 3B)27이다.
- 30 μ를 0.1 m m 경로 길이 microcuvette에서 어셈블리 솔루션의 플라스틱
- 며칠 마다 퓨 리에 변환 적외선 (FTIR) 분광학을 통해 펩 티 드 어셈블리 프로세스를 따릅니다. 1670 c m-1 을 중심으로 광범위 한 피크 샘플17unassembled 펩 티 드에서 발생 하는 IR 서명입니다. 펩 티 드 어셈블리 샘플은 보통 1 ~ 2 주 사라지고 성숙에 도달 하는 광범위 한 unassembled 피크에 대 한 가져가 라.
-
녹말 체 섬유의 현미경 검사 법
- Β-시트 풍부한 supramolecular 구조로 성숙 펩 티 드 샘플에 대 한 2 ~ 3 주가 소요 됩니다.
참고: 어셈블리 수 수 몇 군데 뿐만 아니라 어셈블리 프로세스의 이전 단계에서 전송 전자 현미경 (TEM)을 사용 하 여.- 10 μ 가장 탄소 격자의 표면에 펩 티 드 어셈블리 솔루션의 플라스틱
참고:을 격자 표면에 피 펫 팁을 건드리지 않도록 주의 합니다. 높은 정밀도, 자동 닫기 핀셋 준비 도중 가장 그리드를 개최 하는 데 사용 됩니다. - 어셈블리 격자 표면에 흡착 수 있도록 1-2 분 기다립니다. 격자의 가장자리에 필터 종이 만져 초과 샘플을 제거 합니다.
- 이온을 제거 된 물 100 μ 상용 4 %uranyl 아세테이트 솔루션에 추가 하 여 2 %uranyl 아세테이트 얼룩을 준비 합니다. 플라스틱 격자 표면에 2 %uranyl 아세테이트 얼룩의 10 μ 그리고 2-3 분 동안 품 어. 부 화 후는 격자의 가장자리에 필터 종이 만져 초과 얼룩을 제거 합니다.
- 밤새 진공 desiccator에 가장 격자 배치 합니다. 진공에서 영상까지 저장 합니다.
- 가장 (그림 3C)와 함께 준비 된 샘플 이미지. 현미경 검사 법에 대 한 일반 매개 변수는 다음과 같습니다: 9300 X에서에서 23 일 까지의 배율에서 이미지 000 X, 텅스텐 필 라 멘 트 120의 가속 전압 kV.
참고: ImageJ supramolecular 구조의 획득된 가장 이미지28의 평균 섬유 폭을 측정 하는 사용할 수 있습니다.
주의: 사용 하기 전에 모든 관련 안전 데이터 시트 (SDS)를 참조 하십시오. 여러 화학 물질 합성, 정화, 사용 그리고 설명된 1, 2-dithiolane의 수정 자가 조립 펩 티 드의 부식성 또는 독성 화학 증기 두건에서 사용 해야 합니다. 항상 적절 한 개인 보호 장비 (안전 안경, 연구실 코트, 전체 길이 바지, 폐쇄 발가락 신발 포함)를 사용 하 여 실험실에서 작업 하는 경우.
- 10 μ 가장 탄소 격자의 표면에 펩 티 드 어셈블리 솔루션의 플라스틱
- Β-시트 풍부한 supramolecular 구조로 성숙 펩 티 드 샘플에 대 한 2 ~ 3 주가 소요 됩니다.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Dithiolane 선구자 분자의 초기 단계 합성 이외에도 1, 2-dithiolane 수정 펩 티 드 종합의 나머지 고체 지원 (그림 1A)에서 발생합니다. 3의 변환-브로 모-2-(bromomethyl) 프로 산 3-(acetylthio)-2-(acetylthiomethyl) propanoic 산, dithiolane 전조 1H에 의해 확인 되 고 전에 13C NMR (그림 1B 와 C)는 자유에 결합 여전히 수 지에 펩 티 드의 N-말단 아민. 수산화 암모늄과 thiols에 thioacetate의 deprotection 전자 레인지 반응 기를 사용 하 여 수행 되 고 1, 2-dithiolane 수정 펩 티 드 수 지에서 죽 습 하기 전에 1, 2-dithiolane 메탄올에서 하룻밤 산화 이다. 원유 펩 티 드 역 상 HPLC (그림 2A) 정화 하 고 제품의 질량 TOF MALDI 질량 분석 (그림 2B)에 의해 확인 됩니다.
자체 정화 1, 2-dithiolane 펩 티 드 2-3 주 동안 성숙한 녹말 체 섬유에 조립. FT-적외선 (그림 3A)와 CD 분광학 (그림 3B) 어셈블리 프로세스를 수행 하 고 확장된 β 장 구조 특성에 사용 됩니다. 섬유는 가장 (그림 3C)에 의해 몇 군데.
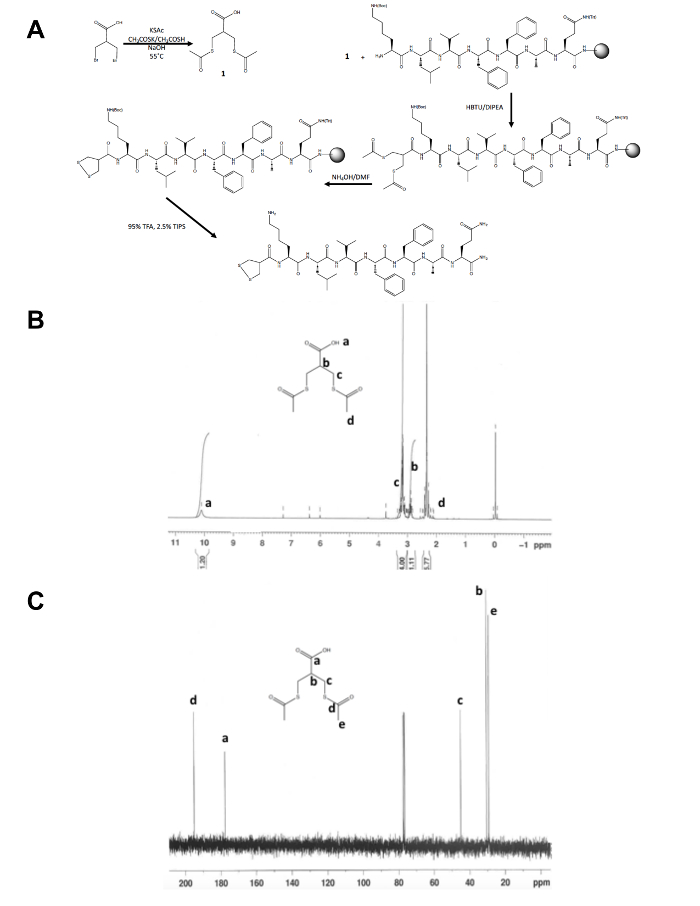
그림 1입니다. 1, 2 dithiolane 선구자 분자의 특성에 대 한 합성 체계. 최종 1, 2-dithiolane 수정 펩 티 드, 1, 2-dithiolane-KLVFFAQ-NH2의 (A) 합성 체계. (B) 1H NMR의 3-(acetylthio)-2-300 MHz. (C)13C NMR의 3-(acetylthio)-2 CDCl3 propanoic 산 (acetylthiomethyl)-(acetylthiomethyl) propanoic 산 CDCl3 에 75 MHz. 에서에서 여기를 클릭 하십시오 이 그림의 더 큰 버전을 보려면.

그림 2입니다. 1, 2-dithiolane의 합성 펩 티 드를 수정. 1, 2-dithiolane-KLVFFAQ-NH2의 정화에서 (A) HPLC 크로마. (B) reflectron 모드 DHB 매트릭스를 사용 하 여 HPLC 정화 (~17.5 분의 보존 기간)에서 주요 피크의 MALDI TOF 질량 스펙트럼의 1, 2-dithiolane-KLVFFAQ-NH2계산 된 질량을 확인 합니다. 공통 adducts도 식별 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3입니다. 1, 2-dithiolane의 supramolecular 특성 수정 펩 티 드. (A) FT-적외선 1 mg/mL 1, 2-dithiolane-KLVFFAQ-NH2 섬유의 조립 10 mM HEPES, pH 7.5에 20%에서에서 CH3CN. 1627 c m-1 에서 피크는 펩 티 드 β 장 구조에 일치 합니다. (B) 1 mg/mL 1, 2-dithiolane-KLVFFAQ-NH2 섬유의 CD 10 mM HEPES, pH 7.5에 20% 채널3CN에서에서 조립. 218에서 최소 타원 nm β 장 구조에 조립 하는 펩 티 드와 일치 하는. (C) 가장에 의해 1, 2-dithiolane-KLVFFAQ-NH2 녹말 체 섬유 (2 %uranyl 아세테이트의 부정적인 얼룩)의 이미지. 눈금 막대는 100 nm. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
이 문서는 모두 종합의 세부 사항 및 N 맨끝 1, 2-dithiolane 수정 자가 조립 펩타이드의 정화와 결과 supramolecular 구조의 특성을 설명합니다. 여기에서 보고 된 1, 2-dithiolane 펩타이드의 합성 장점이, dithiolane 선구자, 3-(acetylthio)-2 생산 하기 위해 한 단계 합성을 포함 하 여-(acetylthiomethyl) propanoic 산, 고 수 지에의 deprotection 반응 전자 레인지는 히드라 진 독성 deprotection 안전한 대안 보고 이전29수산화 암모늄을 이용 하 여 산화 1, 2-dithiolane moiety를 그룹을 보호 하는 선구자 thioacetate. (그림 1A) 1, 2 dithiolane 펩 티 드의 전반적인 단단한 단계 펩 티 드 합성 시퀀스 길이 및 구성, Fmoc 보호 부자연 스러운 아미노산, 및 C 터미널 수 지 화학에 맞게 사용 하는 등 변경 하 여 쉽게 수정할 수 있습니다. 많은 다른 연구 응용 프로그램입니다.
방지 하기 위해 원치 않는 펩 티 드 부산물 및 사이드 체인 아미노산 또는 아미노산 그룹 보호와 사후 분열 제품 있을 때, 추가적인 청소부 분열 칵테일20에 추가 되어야 합니다. 작은 부분 (10% 미만 총 수 지의)의 테스트 분열 커플링 반응의 높은 수익률을 보장 하는 수 지에 전자 레인지 deprotection 단계 전에 수행할 수 있습니다. 열 및 HPLC 조건 보고서에 설명 된 사용 하 여, thioacetate 보호 1, 2-dithiolane 전조 펩타이드 피크 uncoupled 무료 아민 펩 티 드 후 5 분을 elutes. 경우 무료 아민 펩 티 드의 상당량 남아, 다른 커플링 단계 3-(acetylthio)-2-(acetylthiomethyl) propanoic 산 것이 좋습니다. Intramolecular 1, 2-dithiolane 이황화 결합에서 HPLC에 330에 약한 이황화 결합 흡 광도 모니터링 하 여 감지 되 nm. HPLC 피크에 해당 하는 산화 1, 2-dithiolane를 실행 하는 별도 HPLC에 펩 티 드 샘플 100 m m tris(2-carboxyethyl)phosphine(TCEP)의 100 L을 추가 하 여 확인 된다. TCEP 감소 thiol 펩 티 드를 포함 하는 산화 이황화 펩 티 드 보다는 다른 보존 시간이 있을 것 이다. Thiol 펩 티 드를 포함 하는 약 1 분 나중에 보고서에 설명 된 조건과 열을 사용 하 여 이황화 펩 티 드 보다 elutes. 펩 티 드에 대 한 적당 한 대체 MALDI 행렬은 α-cyano-4-hydroxycinnamic 산 (CHCA) 및 0.1%와 50% 이기의 1 mL을 추가 하 여 준비 TFA CHCA의 5 밀리 그램. 샘플 (+ Na와 K+) 소금 adduct 봉우리는 크게 [M + H]+ 피크 억제 TOF MALDI 질량 분석 전에 C18 zip-팁을 사용 하 여 desalted 될 수 있습니다.
이러한 연구에 대 한 선택 하는 펩 티 드 순서30, Alzheimer의 질병 관련 된 Aβ-펩타이드의 네덜란드 돌연변이에서 파생 됩니다 그리고 이전 자체 평행 β-시트16,17의 녹말 체 섬유에 조립 보여왔다 . 대표 결과,-C, 그림 3A같이 1, 2-dithiolane-KLVFFAQ-NH2 펩 티 드 또한 녹말 체 섬유에 조립. FTIR 아 미드 나 스트레칭 1627 c m-1 와 CD 타원 218에서 최소 중심으로 nm는 β-시트 어셈블리25,,2627, 1676 cm-1에 생성 CO 스트레치의 분 광 서명을 글루타민 사이드 체인 상호 작용 제안 병렬 β-가닥16,,3132에 펩 티 드 구성 됩니다 주문에 해당 하.
2 %uranyl 아세테이트 부정적인 얼룩를 사용 하 여 전송 전자 현미경 이미지 표시 확장 및 왜곡 supramolecular 섬유를 약 10 nm 폭에서. N 맨끝 acetylated 펩 티 드, Ac-KLVFFAQ-NH2의 섬유는 부드럽고 거의 12 nm16의 약간 더 큰 폭으로 직선. 이므로 가장 격자를 준비 하 고 이미지 획득 시간 집중 과정, 한 번에 다양 한 펩 티 드 농도의 동일한 어셈블리 샘플에서 여러 편 격자 준비 최상 이다. 원래 어셈블리 솔루션 샘플 함께 가장 1시 50분 (1: 100)에 대 한 희석된 샘플을 준비 합니다. 높은 농도에서 녹말 체 섬유 수 있습니다 덩어리 또는 패치 그리드를 준수 하 고 개별 섬유의 이미지를 획득 하는 어려울 수 있습니다. 폭 측정에 대 한 개별 섬유의 가장자리를 참조 하는 것이 중요 하다 고 섬유 helicity의 시각화는 종종 밀된 샘플에 의해 가려진.
Supramolecular 생체 재료를 사용 하 여 더 많은 응용 프로그램을 탐험 되 고는, 자기 조립 자가 조립 단위체에 프로세스에 직교 하는 잠재적으로 반응성 기능 그룹을 통합할 필요가 있다. 이 보고서에 설명 된 방법을 supramolecular 구조의 광 특성 및 1, 2-dithiolane 수정 자가 조립 펩 티 드의 합성 수 지에 접근을 강조 표시 합니다.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
저자는 공개 없다.
Acknowledgments
저자 박사 B. 엘렌 Scanley 그녀의 기술 교육에 대 한 감사 하 고 사용 하 여 도움말에서 가장 코네티컷 주립 대학 및 대학 (CSCU) 센터에 나노기술 및 박사 크레이지 Mukerji 웨슬리언 대학에서 그녀의 CD에 대 한 접근 하 고 싶습니다. 분 광 광도 계입니다. 페어필드 대학, NASA 코네티컷 공간 그랜트 협회에서 과학 연구소 및 국립 과학 재단 그랜트 수 체-1624774에서 보고 작업 부분에 지원 한다.
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



