Summary
Un protocolo para la síntesis de un 1, 2-dithiolane modificada de péptidos y la caracterización de las estructuras supramoleculares resultantes del peptide uno mismo-Asamblea.
Abstract
Este informe se centra en la síntesis de un N-terminal 1, 2-dithiolane modificado peptide uno mismo-montaje y la caracterización de la resultante uno mismo-montar estructuras supramoleculares. La ruta sintética aprovecha la síntesis de péptidos de fase sólida con el acoplamiento en la resina de la molécula del precursor dithiolane, 3-(acetylthio) -2-(acetylthiomethyl) propanoico ácido y la thioacetate asistida por microondas deprotection del péptido N-terminal antes de la división final de la resina para dar 1, 2-dithiolane modificado péptido. Después de la purificación de la cromatografía líquida de alto rendimiento (HPLC) del péptido 1, 2-dithiolane, derivado de la base nucleating del péptido Aβ asociado con la enfermedad de Alzheimer, el péptido aparece uno mismo-montar en fibras amiloideas Cruz-β. Protocolos para la caracterización de las fibras amiloides por espectroscopia infrarroja de Fourier (FT-IR), espectroscopía de dicroísmo circular (CD) y microscopía electrónica de transmisión (TEM) se presentan. Ahora pueden explorar los métodos de modificación de la N-terminal con una molécula de 1, 2-dithiolane a péptidos uno mismo-montaje bien caracterizados como sistemas modelo para desarrollar estrategias de modificación de la Asamblea y explorar la química covalente dinámica en superficies de nanofibras de péptido supramolecular.
Introduction
El enlace peptídico sólido formación química implicada en síntesis del peptide de la fase sólida y la capacidad para controlar la composición y la longitud de la secuencia hacen los péptidos que uno mismo-montan en estructuras supramoleculares un campo muy investigado. Los factores que controlan y estabilizan péptido uno mismo-montado estructuras, incluyendo cadena lateral estérico e interacciones electrostáticas, hidrógeno y efectos hidrofóbicos1, servir como un conjunto de reglas de diseño. Como la investigación en estas reglas de diseño fundamental continúa progresando, el siguiente paso lógico en péptido autoensamblaje implica ampliar la diversidad de funciones y estructuras de péptidos. Mientras que uno mismo-montaje de péptidos es un biomaterial versátil que se han utilizado para muchas aplicaciones biomédicas templando el péptido secuencia o conjunto de condiciones2,3,4, el desarrollo de estrategias para la Asamblea modificaciones a péptido nanofibras en5,6,7,8,9 sigue siendo un área relativamente inexplorada.
Química intercambio y tiol disulfuro dinámicos en la superficie de estructuras supramoleculares es un área que tiene el potencial para producir biomateriales nuevos y funcionales. La incorporación de moléculas de 1, 2-dithiolane (comúnmente un derivado de ácido lipoico (la) o ácido asparagusic (aa)) se han divulgado en liposomas sistemas10,11, bloque copolímeros12,13y como Organización de anclajes en superficies14,15. Adjunto, divulgamos la síntesis y caracterización de un peptide uno mismo-montaje derivado del núcleo nucleating del péptido Aβ asociado con la enfermedad de Alzheimer que es modificada en el N-terminal con 1, 2-dithiolane grupo funcional16, 17. Las fibras supramoleculares que ahora sirven como una plataforma experimental para el estudio de la reactividad en la superficie supramolecular de fibras amiloides18intercambio de disulfuro y tiol.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. síntesis y purificación de 1, 2-Dithiolane péptido modificado
- Síntesis del precursor dithiolane, 3-(acetylthio) -2-(acetylthiomethyl) propanoico ácido19.
- Añadir 1 g de 3-bromo - 2-(bromometil) ácido propiónico (1 equivalente) disuelto en una cantidad mínima de 1 M NaOH (aproximadamente 4 mL) a un matraz de reacción de fondo redondo de 25 mL con agitación a 55 ° C. Tapar el matraz de reacción con un septo y bajo atmósfera de nitrógeno.
- Preparar una solución que contiene 1,49 g de potasio thioacetate (3.2 equiv) en 4 mL de agua desionizada y 3 mL de ácido sulfúrico de 2 M (H2SO4) crear thioacetic ácido en situ.
- Tire la solución ácido thioacetic en una jeringa de plástico desechable de 10 mL y colocar una aguja en la jeringa. Añadir gota a gota la mezcla en el matraz de reacción por la perforación a través de los tabiques con la aguja. Continuar la reacción durante la noche a 55 º C.
- Vigilar la reacción por cromatografía en capa fina (CCF) en gel de sílice 60 F254 placas usando una mezcla de metanol y diclorometano (1:9). Visualizar el progreso de la reacción por la mancha verde de bromocresol. El producto tiene un Rf = 0.57.
- Después de la reacción es completa y enfriados a la temperatura ambiente, acidificar la mezcla a pH 1 con 2 M H2hasta4. Un aceite amarillo se separa de la solución.
- Extraer el producto con cloroformo frío (40 mL x 3). Combinar las capas orgánicas y seca sobre sulfato de magnesio. Retire el cloroformo a presión reducida.
- Para confirmar la identidad del producto aislado, 1, espectroscopia de resonancia magnética nuclear (RMN) como se muestra en las figuras 1B y C. Esperar los resultados siguientes: 1H NMR, CDCl3, 300 MHz: d = 10.1 (b, 1 H), 3.2 (m, 4 H), 2,9 (m, 1 H), 2.4 (s, 6 H); 13 C RMN CDCl3, 75 MHz: d = 195,1 (CH3COS-), 177.6 (-OOHC), 45.1 (-CH2S-), 30.5 (CH) 29.2 (-SCOCH3).
Nota: El producto es un aceite amarillo y tiene un rendimiento global del 83%. Utilizar el producto sin una posterior purificación.
- SPPS y acoplamiento en resina de Dithiolane Precursor
Nota: La síntesis del peptide de la fase sólida que se describe a continuación se llevó a cabo en un sintetizador de péptidos automatizada, siguiendo los protocolos recomendados del fabricante. Configuración y reactivos pueden ser adaptados para otros instrumentos comerciales o al usar aminoácidos especializados.- Pesar 0,156 g de resina de 4-methylbenzhydrylamine (MBHA) pista amida (0.1 mmol) y colocar en un recipiente de la reacción. Hincharse la resina en dimetilformamida (DMF) para por lo menos 15 minutos antes del inicio de la síntesis.
- Peso a 4 equivalentes de cada fluorenylmethyloxycarbonyl (Fmoc) protegido del aminoácido (0.4 mmol) en la secuencia y 0,152 g de N, N, N', N'- tetrametil-O-(1H- benotriazol-1-yl) hexafluorofosfato de uranio (0.4 mmol, HBTU) para cada aminoácido en la secuencia. Cada cartucho contiene los aminoácidos Fmoc-protegido y HBTU.
- Después de ejecutar todas la síntesis comprueba en el sintetizador (rellenar reactivos, lavado de líneas de reactivo y a presión todas las botellas de reactivos), coloque los cartuchos del aminoácido en el carrusel en el C' n ' Dirección terminal. Coloque un cartucho vacío después de la posición final del aminoácido para el paso final de la desprotección de N-terminal Fmoc.
- Sintetizar el péptido usando la configuración recomendada estándar.
- Desprotejera el grupo Fmoc de la resina con 5 mL de 20% piperidina en DMF (5 min x 2).
- Lavar la resina con DMF (6 x 5 mL) antes de la etapa de acoplamiento.
- Para un acoplamiento único paso, añadir 4 mL de 0,4 M de N-methylmorpholine en DMF y el protegido de Fmoc Aminoácidos HBTU. Activar la solución de aminoácidos Fmoc-protegido por 30 s antes de transferir la solución al recipiente de reacción.
Nota: El sintetizador de péptidos automatizada mezcla la resina y la solución por los burbujeantes N2 gas cada 30 s por 20 min mientras que la reacción de acoplamiento toma lugares. Para síntesis de péptidos manual, coloque el recipiente de la reacción en un agitador orbital a una velocidad baja para la duración de la etapa de acoplamiento. - Vaciar la solución y lavar la resina con DMF (3 x 5 mL).
- Repita los pasos 1.2.4.1 a través 1.2.4.4 para cada aminoácidos Fmoc-protegidos en el C' n '-dirección de terminus para sintetizar el péptido de interés.
- Después de la etapa final de la desprotección de N-terminal, transferencia de la resina en una jeringa desechable de sinterizado. Lavar la resina con el DMF (3 x 5 mL) y diclorometano (DCM, 3 x 5 mL).
Nota: La resina se puede almacenar después de DCM en un desecador de vacío. Si la resina ha sido seleccionada antes de acoplamiento, asegúrese de hincharse la resina en DMF antes de la reacción de acoplamiento. - Pareja dithiolane precursor (1) a N-terminal del péptido de la resina mediante la adición de 4 equivalentes de 1, 5 mL de DMF, 4 equivalentes de HBTU y 10 equivalentes de N, N-diisopropylethylamine (DIPEA). Activar previamente la mezcla de acoplamiento por 10 min antes de agregar a la resina que contiene la jeringa sinterizado.
- Agite la reacción de acoplamiento de 2 h. Después de 2 h, lavar la resina con DMF (3 x 5 mL) y repetir la reacción de acoplamiento con agitación durante la noche.
- Después el segundo acoplamiento, lavar la resina con el DMF (3 x 5 mL) y DCM (3 x 5 mL).
Nota: La resina se puede almacenar en este punto bajo vacío hasta el escote.
- Thioacetate desprotección y escote de péptido de la resina
- Para desprotejera del grupo thioacetate el precursor de dithiolane N-terminal, transferir la resina seca a un tubo de reacción de microondas de 10 mL y añadir 2 mL de DMF. Permita que la resina se hinchan, añadir una barra de agitación magnética pequeña al recipiente y resuspender con baja velocidad de agitación magnética durante 15 minutos.
- Añadir 2 mL de hidróxido de amonio concentrado, tapa el recipiente de la reacción con los tabiques de silicona y coloque el recipiente de la reacción en un reactor de microondas utilizando la configuración de microondas de 75 ° C por 45 min con agitación.
- Una vez finalizada la reacción de la microonda, transferencia de la resina en una jeringa desechable limpias de sinterizado. Lave con DMF (2 x 5 mL) y metanol (MeOH, 2 x 5 mL).
- Agregar una solución de hidróxido de amonio concentrado en metanol (1:4), para un volumen total de 5 mL. Deje a temblar durante la noche para aumentar la oxidación intramolecular del enlace de disulfuro en dithiolane anillo.
- Lavar la resina con MeOH (2 x 5 mL) y DCM (3 x 5 mL).
Nota: La resina seca se puede almacenar en un desecador de vacío en este punto. - Añadir el cóctel de escote a la resina que contiene jeringa con agitándolo suavemente durante 1,5 h. El escote cóctel utilizado es de 95% de ácido trifluoroacético (TFA), Triisopropilsilano (TIPS) de 2,5% y 2.5% de agua en un volumen total de 5 mL.
Atención: Trabajar bajo campana química solamente. TFA es volátil y corrosivo.
Nota: Para la mayoría de secuencias de péptidos y aminoácidos cadena protección de los grupos, la solución cóctel escote anterior es suficiente; sin embargo, cocteles escote alternativos pueden ser necesaria para cierta cadena lateral del aminoácido protección grupos (en particular péptidos que contienen Cys, Met, Trp y Arg) u otra resina química20. - Precipitar el péptido crudo en 25 mL de frío éter etílico en un tubo cónico de 50 mL por adición gota a gota desde la jeringa sinterizada. El péptido se precipita como un sólido blanco. Pelotilla del péptido por centrifugación a 1300 x g durante 10 minutos decantar con cuidado el éter dietílico en un contenedor separado para recogida de residuos.
- Agregar otros 25 mL de éter etílico en el tubo cónico y Resuspenda el precipitado con un vórtex. Repetir la centrifugación 1300 x g durante 10 minutos y decantar el éter dietílico otra vez. Secar el precipitado al vacío.
- Purificación de 1, 2-Dithiolane modificado péptido
Nota: Purificar el péptido crudo por HPLC de fase reversa. Recoger y combinar los picos del péptido y confirmar la masa por espectrometría de masas MALDI-TOF.- Disolver los pellets de peptide crudo en cantidad mínima de acetonitrilo con 0,1% TFA. Debido a la hidrofobicidad del péptido y propensión de agregación, calentar suavemente la muestra a 40 º C para facilitar la solubilidad.
Nota: Evite mayores temperaturas y sonicación del péptido para evitar potencial intercambio de disulfuro reacciones21,de22,23. - Para preparar 1 mL de crudo péptido para la purificación del HPLC, añadir 400 μL de caldo concentrado de péptidos en acetonitrilo a 600 μL de H2O con 0,1% TFA y el filtro a través de un filtro de jeringa de 22 μm en un frasco HPLC. Puede añadirse un isopropanol al 5% adicional para prevenir la precipitación y la agregación del péptido.
- Purificar el péptido utilizando columna semi-preparativa C-18 con un caudal de 3 mL/min en un gradiente lineal de acetonitrilo de 15-55% en conjunto de 20 minutos los detectores UV a 222 nm (espina dorsal amida) y 330 nm (Enlace disulfuro). Reunir y combinar los picos de interés (figura 2A).
- Confirmar la masa de producto péptido por espectrómetro de masas MALDI-TOF en el modo reflectron (figura 2B). Para el análisis, mezclar 0,5 μL de pico recogido en la placa MALDI con 0,5 μL de la matriz de ácido (DHB) 2,5-dihydroxybenzoic (10 mg/mL DHB en 50% acetonitrilo, 0.1% TFA).
Nota: Común aductos en MALDI-TOF espectrometría de masas son el sodio y potasio aducción ([M + Na]+ y [M + K]+) picos. La muestra antes del análisis de la desalación se recomienda si los picos de aducto de sal suprimen la señal del pico [M + H]+ principal. Además, un pico oxidado [M + o]+ se detecta también en el péptido de 1, 2-dithiolane modificado. Un informe sobre la oxidación inducida por láser de la ionización MALDI utilizando DHB matriz sugiere que factores como la concentración de muestra, solvente y la intensidad de láser pueden ser modificados para limitar el MALDI inducido por oxidación artefacto24. - Después de la confirmación de MALDI-TOF de la masa correcta, liofilizar el péptido después de congelación flash. Mantenga el polvo liofilizado péptido bajo vacío hasta asamblea.
- Disolver los pellets de peptide crudo en cantidad mínima de acetonitrilo con 0,1% TFA. Debido a la hidrofobicidad del péptido y propensión de agregación, calentar suavemente la muestra a 40 º C para facilitar la solubilidad.
2. Caracterización de Supramolecular uno mismo-montaje de estructuras
-
Formación de fibras amiloides
- Para preparar uno mismo-Asamblea solución, pesar 1 mg de polvo péptido utilizando una balanza analítica. Disolver en una mezcla (pH 7,5) de 20% de acetonitrilo y 10 mM (4-(2-hydroxyethyl)-1--1-ácido ácido (HEPES) en un tubo de microcentrífuga de 1,5 mL, a una concentración final de 1 mg/mL péptido ensamblado de una mezcla. Mezclar la solución de montaje y dejar montar a temperatura ambiente.
-
Caracterización espectroscópica de fibras amiloides
- Seguir el proceso de ensamblaje del péptido mediante la espectroscopia infrarrojo de Fourier (FTIR) cada pocos días. Un amplio pico centrado alrededor de 1670 cm-1 es la firma IR derivados de péptidos sin montar en la muestra17. Las muestras de ensamblaje del péptido suelen tener una o dos semanas para el amplio pico sin montar desaparecer y llegar a maduración.
- Una alícuota de 8-10 μL de la solución de montaje en seco como una película fina sobre el cristal de diamante ATR. Seguimiento de la desaparición de un pico de agua grande y amplio de 1640 a 1630 cm-1 como las formas de la película seca.
- Adquisición de espectros IR de 1500-1800 cm-1 con un promedio de 50 escaneos con una resolución de 2 cm-1 . Adquirir y resta el análisis de fondo antes de cada exploración de muestra. La firma de IR para el montaje de la β-hoja es un pico agudo entre 1625 y 1635 cm-1 (Figura 3A)25,26.
- Caracterizar el conjunto péptido β-hoja ricas estructuras supramoleculares por dicroísmo circular (CD). Registrar los espectros usando un spectropolarimeter de CD con un sistema de control de temperatura Peltier.
- Tomar con pipeta 30 μL de la solución de montaje en un camino 0,1 mm longitud microcubeta.
Nota: Es necesario un soporte de celular a la abrazadera y coloque la celda de longitud de ruta corta en el instrumento. - Para cada espectro, establece el instrumento de CD en los siguientes parámetros: Análisis de longitudes de onda de 300 nm a 180 nm, velocidad de barrido de 100/min, ancho de banda de 1 nm, 25 ° C, promedio de tres análisis.
- Recoge un espectro del búfer (20% acetonitrilo/10 mM HEPES, pH 7,5) y restar cada scan muestra como control. La firma de CD para las β-hojas es que una elipticidad mínima centrado alrededor 220 nm (figura 3B)27.
- Tomar con pipeta 30 μL de la solución de montaje en un camino 0,1 mm longitud microcubeta.
- Seguir el proceso de ensamblaje del péptido mediante la espectroscopia infrarrojo de Fourier (FTIR) cada pocos días. Un amplio pico centrado alrededor de 1670 cm-1 es la firma IR derivados de péptidos sin montar en la muestra17. Las muestras de ensamblaje del péptido suelen tener una o dos semanas para el amplio pico sin montar desaparecer y llegar a maduración.
-
Microscopia de fibras amiloides
- Permiten dos o tres semanas para las muestras del péptido madurar en β-hoja ricas estructuras supramoleculares.
Nota: Las Asambleas pueden ser reflejadas mediante microscopía electrónica de transmisión (TEM) en las etapas anteriores del proceso de montaje.- Pipetear 10 μL de la solución de montaje del péptido en la superficie de la rejilla del carbón TEM.
Nota: tenga cuidado para no tocar la punta de la pipeta a la superficie de la rejilla. Alta precisión, cierre pinzas se utilizan para sostener la rejilla TEM durante la preparación. - Esperar 1-2 minutos para permitir que las Asambleas fijar por adsorción sobre la superficie de la rejilla. Quitar exceso muestra por contacto con papel de filtro en el borde de la cuadrícula.
- Preparar una tinción de acetato de uranilo 2% mediante la adición de 100 μL de agua desionizada para la solución de acetato de uranilo 4% disponible en el mercado. Pipetee 10 μL de la mancha de acetato de uranilo 2% sobre la superficie de la rejilla e incubar durante 2-3 minutos. Después de la incubación, retirar exceso mancha por contacto con papel de filtro en el borde de la cuadrícula.
- Coloque las rejillas TEM en un desecador de vacío durante la noche. Almacenar bajo vacío hasta la proyección de imagen.
- Imagen de las muestras preparadas con TEM (figura 3). Parámetros típicos para microscopía son las siguientes: imágenes con aumentos que van desde 9.300 X 23, 000 X, filamento de tungsteno con un voltaje de aceleración de 120 kV.
Nota: ImageJ puede utilizarse para medir el ancho de la fibra media de las estructuras supramoleculares de adquirido TEM imágenes28.
PRECAUCIÓN: Por favor consulte todas hojas de datos de seguridad (SDS) antes de su uso. Varios productos químicos utilizan en la síntesis, purificación, y caracterización de los péptidos de uno mismo-montaje descrito 1, 2-dithiolane modificado son tóxicos o corrosivos y debe utilizarse sólo bajo una campana de humos químicos. Utilice siempre equipos de protección personal (incluyendo gafas de seguridad, bata de laboratorio, pantalón largo, zapatos cerrados) cuando se trabaja en el laboratorio.
- Pipetear 10 μL de la solución de montaje del péptido en la superficie de la rejilla del carbón TEM.
- Permiten dos o tres semanas para las muestras del péptido madurar en β-hoja ricas estructuras supramoleculares.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Aparte de la síntesis de un paso inicial de la molécula del precursor dithiolane, el resto de la síntesis del péptido 1, 2-dithiolane modificado se realiza en soporte sólido (figura 1A). La conversión de 3-bromo - 2-(bromometil) ácido propiónico para 3-(acetylthio) -2-(acetylthiomethyl) propanoico ácido dithiolane precursor, es confirmado por 1H y 13C NMR (figura 1B y C) antes de que se acopla a la enciclopedia libre Amina del N-terminal de un péptido aún en resina. La desprotección de thioacetate a tioles con hidróxido de amonio se realiza utilizando un reactor de microondas y el 1, 2-dithiolane es oxidado durante la noche en metanol antes de que el péptido de 1, 2-dithiolane modificado es dividido de la resina. El péptido crudo se purifica por HPLC (figura 2A) de fase inversa y masa de producto es confirmada por espectrometría de masas MALDI-TOF (figura 2B).
El péptido purificado 1, 2-dithiolane uno mismo-monta en fibras amiloideas maduras durante 2-3 semanas. FT-IR (Figura 3A) y la espectroscopia del CD (figura 3B) se utilizan para seguir el proceso de montaje y para caracterizar la conformación extendida de la β-hoja. Las fibras son imagen de TEM (figura 3).
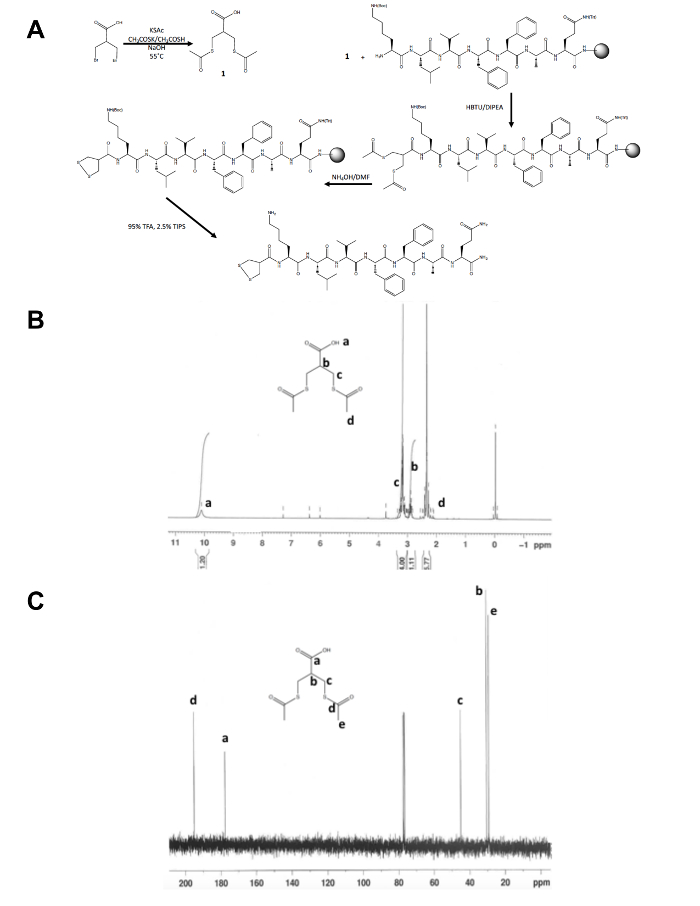
Figura 1. Esquema sintético para la caracterización de la molécula del precursor de 1, 2-dithiolane. (A) esquema sintético del péptido 1, 2-dithiolane final modificado, 1, 2-dithiolane-KLVFFAQ-NH2. (B) 1H-RMN de 3-(acetylthio) -2-(acetylthiomethyl) propanoico ácido en CDCl3 a 300 MHz. (C)13C-RMN de 3-(acetylthio) -2-(acetylthiomethyl) propanoico ácido en CDCl3 a 75 MHz. haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Síntesis de 1, 2-dithiolane modifican péptido. Cromatograma HPLC (A) de la purificación de 1, 2-dithiolane - KLVFFAQ-NH2. (B) espectro de masas MALDI-TOF del pico principal de la purificación de HPLC (tiempo de retención de ~17.5 min) en el modo reflectron utilizando matriz DHB confirma la masa calculada de 1, 2-dithiolane-KLVFFAQ-NH2. Aductores de común también se identifican. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Caracterización Supramolecular de 1, 2-dithiolane modificado péptido. (A) FT-IR de fibras de 1 mg/mL 1, 2-dithiolane-KLVFFAQ-NH2 montado en 10 mM HEPES, pH 7,5 en 20% CH3CN. El pico en 1627 cm-1 es consistente con los péptidos ensamblados en una conformación β-hoja. (B) CD de fibras de 1 mg/mL 1, 2-dithiolane-KLVFFAQ-NH2 montado en 10 mM HEPES, pH 7,5 en 20% CH3CN. La elipticidad mínimoa a 218 nm es consistente con los péptidos ensamblados en una conformación β-hoja. (C) imagen de la fibra amiloide (mancha negativa de 2% acetato de uranilo) de 1, 2-dithiolane-KLVFFAQ-NH2 por TEM. Barra de escala es de 100 nm. Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Este artículo discute los detalles de la síntesis y la purificación de un peptide uno mismo-montaje N-terminal 1, 2-dithiolane modificado y la caracterización de las estructuras supramoleculares resultantes. La síntesis del péptido 1, 2-dithiolane divulgado aquí tiene las ventajas, incluyendo una síntesis de un solo paso para producir el precursor dithiolane, 3-(acetylthio) -2-(acetylthiomethyl) propanoico ácido y la resina en microondas reacción de desprotección de la precursor thioacetate protección de grupo para producir la molécula de 1, 2-dithiolane oxidado utilizando hidróxido de amonio como una alternativa más segura a la desprotección de hidracina tóxica había divulgado previamente29. La síntesis de péptidos de fase sólida total del péptido 1, 2-dithiolane (figura 1A) se puede modificar fácilmente al cambiar la longitud de la secuencia y composición, incluyendo el uso de Fmoc-protegido artificiales aminoácidos y C-terminal resina química para adaptarse a muchas aplicaciones de la investigación.
Para evitar derivados de péptidos no deseados cuando los aminoácidos con cadenas laterales nucleofílica o los aminoácidos con grupos de protección tienen escote reactivos productos, carroñeros adicionales deben agregarse al cóctel Escote20. Un escote de prueba de una pequeña porción (menos del 10% de resina total) puede realizarse antes de la etapa de desprotección en resina microondas para asegurar un alto rendimiento de la reacción de acoplamiento. Usando la columna y las condiciones HPLC descritas en el informe, el pico de péptido precursor de thioacetate protegidas de 1, 2-dithiolane elutes 5 minutos después el péptido desacoplados amina libre. Si una cantidad significativa de péptido amino libre permanece, otro paso de acoplamiento con 3-(acetylthio) -2-(acetylthiomethyl) propanoico ácido se recomienda. El enlace de disulfuro intramolecular de 1, 2-dithiolane se detecta en el HPLC mediante el control de la absorbancia del enlace de disulfuro débil a 330 nm. El pico HPLC correspondiente a la 1, 2-dithiolane oxidado se confirma mediante la adición de 100 L de tris(2-carboxyethyl)phosphine(TCEP) de 100 mM a una muestra de péptido en un HPLC separado ejecutar. El tiol TCEP reducido que contenga péptido tendrá un tiempo de retención diferente que el péptido de disulfuro oxidado. El tiol que contiene péptidos elutes aproximadamente 1 minuto más tarde que el péptido de disulfuro con la columna y las condiciones descritas en el informe. Una adecuada matriz MALDI alternativa para péptidos es el ácido α-ciano-4-hidroxicinámico (CHCA) y es preparada agregando 1 mL de acetonitrilo 50% con 0.1% TFA a 5 mg de CHCA. Las muestras pueden ser desaladas mediante un zip-tip de C18 antes del análisis de masas MALDI-TOF, si los picos de aducto de sal (Na+ y K+) suprimen significativamente el pico [M + H]+ .
La secuencia del péptido para estos estudios se deriva de holandés mutante del péptido Aβ asociados con la enfermedad de Alzheimer30y se ha demostrado previamente para uno mismo-montar en fibras amiloideas de hojas β paralelas16,17 . Como se muestra en los resultados representativos, Figura 3A-C, el péptido de 1, 2-dithiolane-KLVFFAQ-NH2 reúne también en fibras amiloides. La amida FTIR estirar centrada en 1627cm-1 y CD elipticidad mínimoa a 218 nm son firmas espectroscópicas de asambleas de la β-hoja25,26,27y el estiramiento carbonilo CO en 1676 cm-1 correspondiente a pedir interacciones de cadena lateral de glutamina sugieren que los péptidos están organizados en paralelo β-filamentos16,31,32.
Imágenes de microscopia electrónica de transmisión, mediante tinción negativa de 2% uranilo acetato, muestran fibras supramoleculares extendidas y retorcidas que son aproximadamente 10 nm de ancho. Las fibras del péptido N-terminal acetilado, CA-KLVFFAQ-NH2, son lisas y rectas, con una anchura un poco más grande de la casi 12 nm16. Como preparar rejillas TEM y adquisición de imágenes son un proceso intensivo de tiempo, es mejor preparar varias rejillas TEM de la misma muestra de Asamblea a la vez de diferentes concentraciones de péptido. Preparar una muestra diluida de TEM (1:50 o 1: 100) junto con la muestra original de la solución de montaje. Las fibras amiloides en altas concentraciones pueden adherirse a la red en grupos o parches y adquisición de imágenes de fibras individuales puede ser difícil. Es importante ver los bordes de las fibras individuales para las medidas de ancho y la visualización de helicidad de fibra es a menudo oscurecida por muestras de hacinamiento.
Como se exploran aplicaciones de más uso en biomateriales supramoleculares, hay una necesidad de integrar grupos funcionales potencialmente reactivos que son ortogonales a la uno mismo-montaje proceso en los monómeros de la uno mismo-montaje. Los métodos descritos en este informe ponen de relieve un enfoque en la resina para la síntesis de un péptido de uno mismo-montaje de 1, 2-dithiolane modificado y caracterización espectroscópica de las estructuras supramoleculares.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores no tienen nada que revelar.
Acknowledgments
Los autores desean agradecer al Dr. B. Ellen Scanley su capacitación técnica y ayuda usar la temperatura en el centro de la Universidad (CSCU) y universidades del estado de Connecticut para nanotecnología y Dr. Ishita Mukerji en Universidad de Wesleyan para tener acceso a su CD Espectrofotómetro. El trabajo divulgado fue apoyado en parte por el Instituto de Ciencias en la Universidad de Fairfield, Connecticut NASA espacio Grant consorcio y por la National Science Foundation bajo la beca número-1624774.
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



