Summary
1,2-dithiolane sentezi için bir protokol peptid ve peptid kendinden montajlı kaynaklanan supramolecular yapıları karakterizasyonu değiştiren.
Abstract
Kendi kendine montaj peptid ve sonucu olan karakterizasyonu bir N-terminus 1,2-dithiolane sentezi üzerinde duruluyor değiştiren bu rapor supramolecular yapıları kendi kendine monte. Katı faz peptid sentez dithiolane habercisi molekülü 3-(acetylthio) -2-reçine MANŞONLA sentetik rota yararlanır-(acetylthiomethyl) propanoic asit ve mikrodalga destekli thioacetate deprotection peptid N-terminus reçine üzerinden son bölünme önce 1,2-dithiolane vermeye peptid değiştiren. Alzheimer hastalığı, ilişkili Aβ peptid nucleating çekirdeğinden elde edilen 1,2-dithiolane peptid, yüksek performanslı sıvı kromatografi (HPLC) arıtma sonra peptid çapraz-β amiloid lifleri kendi kendine montajı gösterilmiştir. Fourier dönüşümü kızılötesi spektroskopi (FT-IR), dairesel dichroism spektroskopisi (CD) ve transmisyon elektron mikroskobu (TEM) amiloid lifler karakterize etmek için protokolleri mevcuttur. N-terminal geliştirmeleriyle 1,2-dithiolane yan iyi karakterize kendi kendine montaj peptidler yöntemleri şimdi sonrası derleme değişiklik stratejiler geliştirmek ve dinamik kovalent kimya üzerinde keşfetmek için model sistemleri olarak keşfedilmeyi olabilir Supramolecular peptid nanofiber yüzeyler.
Introduction
Kimya şekillendirme sağlam peptit bağı katı fazlı peptid sentezinde yer ve sıra uzunluğu ve kompozisyon kontrol yeteneği yapmak supramolecular yapılarına ağır araştırılmış bir alanı kendi kendine araya peptidler. Kontrol ve yan zincir steric dahil olmak üzere peptid kendi kendine monte yapılar ve elektrostatik etkileşimler, hidrojen bağı ve hidrofobik etkileri1, stabilize faktörler tasarım kuralları kümesi olarak hizmet vermektedir. Bu temel tasarım kuralları içine araştırma ilerlemeye devam ediyor gibi peptid mantıksal sonraki adımda kendinden montajlı çeşitliliği peptid temel yapıları ve işlevleri genişletme kapsar. Kendi kendine peptidler montaj sırasında birçok biyomedikal uygulamalarda peptit dizisi veya derleme koşullar2,3,4, için strateji geliştirme ayarlama tarafından kullanılan çok yönlü bir biomaterial vardır peptid nanofibers5,6,7,8,9 sonrası derleme değişiklikler nispeten keşfedilmemiş bir alan kalır.
Dinamik disülfür exchange ve thiol Kimya supramolecular yapıları yüzeyde yeni ve işlevsel Biyomalzeme verim potansiyeline sahip bir alandır. 1,2-dithiolane moieties (genellikle bir türevi lipoic asit (la) veya asparagusic asit (aa)) birleşme, lipozom sistemleri10,11, blok kopolimerler12,13ve olarak bildirilmiştir çapa yüzeyler14,15düzenleme. Burada, biz sentezi ve karakterizasyonu, N-terminus bir 1,2-dithiolane fonksiyonel grup16ile değiştirilir Alzheimer Hastaligi ile ilişkili Aβ peptid nucleating çekirdeğinden elde edilen bir kendi kendine montaj peptid raporu, 17. Elde edilen supramolecular lifleri şimdi amiloid lifleri18supramolecular yüzeyde disülfür-Satım ve thiol reaktivite çalışmaya deneysel bir platform olarak hizmet vermektedir.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. sentez ve 1,2-Dithiolane arınma peptid modifiye
- Sentezi dithiolane habercisi, 3-(acetylthio) -2-(acetylthiomethyl) propanoic asit19.
- 3 1 g ekleyin-bromo - 2-(bromomethyl) propiyonik asit (1 eşdeğeri) 1 M NaOH (yaklaşık 4 mL) 55 ° C'de karıştırma ile 25 mL yuvarlak alt tepki şişesi için en az miktarda çözünmüş Reaksiyon şişeye bir septa ile mühür ve azot atmosferi altında yerleştirin.
- 1,49 g potasyum thioacetate içeren bir çözüm hazırlamak (3.2 eşdeğeri) 4 ml deiyonize su ve 2 M sülfürik asit 3 mL (H2SO4) Tioasetik asit in situoluşturmak için.
- Tioasetik asit solüsyonu çek plastik tek kullanımlık 10 mL şırınga ve iğne şırıngayı yerleştirin. Karışımı dropwise septa iğneyle delme tarafından tepki şişeye ekleyin. Reaksiyon gecede 55 ° C'de devam
- Metanol ve diklorometan (1:9) karışımı kullanarak silika jel 60 F254 tabaklarda ince tabaka Kromatografi (TLC) tarafından tepki izlemek. Bromocresol yeşil leke tarafından reaksiyon ilerleme görselleştirin. Ürün bir Rf vardır 0,57 =.
- Tepki tam ve soğutmalı için oda sıcaklığında sonra pH 1 2 M H2karışıma çok acidify4. Sarı bir yağ dışarı çözüm ayırır.
- Soğuk kloroform (40 mL x 3) ile ürün ayıklayın. Organik katmanları birleştirmek ve magnezyum sülfat üzerinde kuru. Düşük basınç altında kloroform kaldırmak.
- İzole ürün, 1, kimliğini rakamlar 1B ve Cgösterildiği gibi nükleer manyetik rezonans (NMR) spektroskopisi ile onaylayın. Aşağıdaki sonuçlar bekliyoruz: 1H NMR, CDCl3, 300 MHz: d = 10.1 (b, 1 H), 3.2 (m, 4 H), (m, 1 H) 2,9, 2.4 (s, 6 H); 13 C NMR, CDCl3, 75 MHz: d = 195.1 (CH3COS-), 177.6 (-COOH), 45.1 (-CH2S-), 30.5 (CH), 29,2 (-SCOCH3).
Not: Ürün sarı yağ ve % 83 genel bir verim vardır. Olmadan daha fazla arıtma ürün kullanın.
- SPP'ler ve Dithiolane habercisi-reçine kaplin
Not: aşağıda açıklanan katı fazlı peptid sentez önerilen üreticinin iletişim kurallarını izleyen bir otomatik peptid synthesizer üzerinde yapılmıştır. Ayarları ve Kimyasalları uzman amino asitler kullanırken veya diğer ticari araçlar için adapte olabilir.- Rink Amid 4-methylbenzhydrylamine (MBHA) reçine (0,1 mmol) 0,156 g tartmak ve bir reaksiyon gemi yerleştirin. Dimethylformamide (DMF) reçine en az 15 dk önce sentez başlangıcı için güzel.
- Her fluorenylmethyloxycarbonyl (Fmoc) 4 karşılıkları dışarı tartmak korumalı amino asit (0.4 mmol) dizisi ve 0,152 g N, N, N', N'- tetramethyl-O-(1H- benotriazol-1-yl) uranyum hexafluorophosphate (0.4 mmol, HBTU) için dizideki her amino asit. Her kartuş Fmoc korumalı amino asit ve HBTU içerir.
- Tüm ön sentez denetler synthesizer üzerinde çalıştırdıktan sonra (reaktifler, dolum reaktif satırları temizlenen ve tüm reaktif şişe basınçlı), c atlıkarınca amino asit kartuşları yerleştirin ' n ' terminus yön. Son amino asit pozisyon için son N-terminal Fmoc deprotection adım sonra bir boş kartuşu yerleştirin.
- Standart önerilen ayarlar kullanıldığında peptid sentez.
- Reçine ile 5 mL Fmoc grubundan, % 20 Piperodin DMF (5 dk x 2) içinde deprotect.
- DMF (6 x 5 mL) ile reçine kaplin adım önce yıkayın.
- Tek kaplin adım için 0.4 M N-methylmorpholine 4 mL DMF içinde Fmoc korumalı amino asit ve HBTU ekleyin. 30 amino asit Fmoc korumalı çözümü etkinleştirin çözüm tepki taşıyıcıyı aktarmadan önce s.
Not: Otomatik peptid synthesizer reçine ve çözüm kabarcıklanma N2 gaz tarafından her 30 karışımları için 20 dk kaplin reaksiyon sırasında yer alır. El ile peptid sentez için tepki gemi bir orbital çalkalayıcı düşük hızda bağlantı adım süresince yerleştirin. - Çözüm drenaj ve reçine DMF (3 x 5 mL) ile yıkayın.
- Her Fmoc korumalı amino asit c için adımları 1.2.4.1 1.2.4.4 aracılığıyla yineleyin ' n '-peptid ilgi sentezlemek için terminus yön.
- Son N-terminal deprotection adım sonra reçine tek kullanımlık fritted enjektör aktarın. Reçine DMF (3 x 5 mL) ve diklorometan (DCM, 3 x 5 mL) ile yıkayın.
Not: Bir vakum desiccator yıkama DCM sonra reçine depolanabilir. Reçine kaplin önceki depolanmışsa, DMF reçine kaplin reaksiyon önce şişmeye emin olun. - Dithiolane öncül (1)-reçine peptid N-terminus 1, 5 mL DMF, de HBTU 4 karşılıkları ve n, N-diisopropylethylamine (DIPEA) 10 eşdeğerleri 4 karşılıkları ekleyerek birkaç. 10 dk kaplin karışımı fritted şırınga içeren reçine eklemeden önce önceden etkinleştirin.
- Kaplin reaksiyon 2s için salla. 2 h sonra reçine DMF (3 x 5 mL) ile yıkayın ve bir gecede sallayarak ile kaplin tepki tekrarlayın.
- Sonra ikinci bağlantı, reçine DMF (3 x 5 mL) ve DCM (3 x 5 mL) ile yıkayın.
Not: Reçine vakum altında bu noktada bölünme kadar saklanabilir.
- Thioacetate Deprotection ve peptid bölünme reçine üzerinden
- N-terminus dithiolane habercisi thioacetate grubundan deprotect için kuru reçine bir 10 mL mikrodalga tepki tüp aktarmak ve DMF 2 mL ekleyin. Reçine şişmeye, gemi küçük manyetik heyecan çubuğu eklemek ve bir alçak hız-in manyetik karıştırarak 15 dakika ile yeniden askıya sağlar.
- 2 mL konsantre amonyum hidroksit ekleyin, reaksiyon teknesi ile silikon septa kap ve reaksiyon taşıyıcıyı karıştırma ile 45 dk için 75 ° C mikrodalga ayarlarını kullanarak bir mikrodalga reaktör içine koyun.
- Mikrodalga Reaksiyon tamamlandıktan sonra reçine temiz tek kullanımlık fritted enjektör aktarın. DMF (2 x 5 mL) ve metanol (MeOH, 2 x 5 mL) ile yıkayın.
- Metanol (1:4), konsantre amonyum hidroksit çözeltisi toplam hacmi 5 mL için ekleyin. Dithiolane ringde disülfür bağ intramolecular oksidasyon artırmak için gecede sallamak için bırakın.
- Reçine MeOH (2 x 5 mL) ve DCM (3 x 5 mL) ile yıkayın.
Not: Kurutulmuş reçine bir vakum desiccator bu noktada depolanabilir. - Bölünme kokteyl ile 1,5 saat için hafifçe sallayarak şırınga içeren reçine ekleyin. Göğüs arası kokteyl kullanılan % 95 trifluoroacetic asit (TFA), % 2.5 triisopropylsilane (ipuçları) ve toplam hacmi 5 mL % 2.5 su var.
Dikkat: sadece kimyasal duman başlık altında çalışır. TFA uçucu ve aşındırıcı.
Not: Yukarıdaki bölünme kokteyl çözüm peptid dizileri ve amino asit sidechain grupları korumak çoğunluğu için yeterlidir; Ancak, alternatif bölünme kokteyller için belirli amino asit yan zinciri gruplarında (belirli peptidler Cys, Met, Trp ve Arg içeren) veya diğer reçine Kimya20korunması gerekli olabilir. - Dropwise ek fritted şırıngadan tarafından 25 mL 50 mL konik tüp içinde soğuk dietil eter içine ham peptid çökelti. Peptid beyaz katı precipitates. Pelet peptid Santrifüjü 1300 x g 10 dakika süreyle de tarafından özenle dikkatle boşaltmak dietil eter atık toplama için ayrı bir kaba.
- Başka bir 25 mL dietil eter konik tüp ekleyin ve çökelti vortexing tarafından yeniden askıya alma. Santrifüjü 1300 x g de 10 dakikadır tekrar ve tekrar dietil eter dikkatle boşaltmak. Pelet vakum altında kuru.
- 1,2-Dithiolane arınma peptid modifiye
Not: ham peptid ters faz-HPLC tarafından arındırmak. Toplamak ve peptid doruklarına birleştirmek ve kitle tarafından MALDI-TOF Kütle spektrometresi onaylayın.- Asetonitril % 0.1 ile en az miktarda ham peptid Pelet dağıtılması TFA. Peptid'ın hydrophobicity ve toplama eğilimi nedeniyle örnek 40 ° C'de çözünürlük içinde yardım etmek için ısı yavaşça.
Not: potansiyel disülfür Satım reaksiyonlar21,22,23önlemek için daha yüksek sıcaklık ve peptid sonication kaçının. - Ham peptid 1 mL HPLC arıtma için hazırlamak için konsantre peptid stokunun 400 μL Asetonitril içinde H2O %0.1 TFA ve filtre ile 600 μL 22 mikron şırınga filtreden HPLC şişe ekleyin. Ek bir % 5 isopropanol peptid toplama ve yağış önlemek için ilave edilebilir.
- 3 mL/dk 15-%55 Asetonitril 20 dak Set doğrusal bir gradyan üzerinde bir akış hızı ile C-18 yarı partiye hazırlık sütun kullanarak peptid 222 için UV dedektörleri arındırmak nm (Amid omurga) ve 330 nm (disülfür bağ). Toplamak ve faiz (Şekil 2A) doruklarına birleştirmek.
- Peptid ürün kitle tarafından MALDI-TOF Kütle Spektrometre reflektron modunda (Şekil 2B) onaylayın. Analiz için 0.5 μL maldı plaka üzerinde toplanan Peak 2,5-dihidroksibenzoik asit (DHB) matris 0.5 μL ile karıştırın (10 mg/mL DHB % 50 Asetonitril, % 0,1 TFA).
Not: Ortak adducts MALDI-TOF Kütle spektrometresi dahil sodyum ve potasyum tuzu adduct ([M + Na]+ ve [M + K]+) tepeler. Örnek analiz önce desalting tavsiye edilir Eğer tuz adduct doruklarına ana [M + H]+ en yüksek sinyal bastırmak. Ayrıca, [M + O]+ oksitlenmiş bir zirve da tespit 1,2-dithiolane değiştiren peptid. Lazer indüklenen oksidasyon DHB matrisi kullanarak maldı iyonlaşma gelen raporda örnek toplama, solvent ve lazer şiddeti gibi faktörlere bağlı maldı oksidasyon artifakı24sınırlamak için değiştirilebilir öneriyor. - Onay alındıktan sonra MALDI-TOF'doğru kütlesinin peptid sonra flaş dondurma lyophilize. Peptid liyofilize toz vakum altında derleme kadar tutun.
- Asetonitril % 0.1 ile en az miktarda ham peptid Pelet dağıtılması TFA. Peptid'ın hydrophobicity ve toplama eğilimi nedeniyle örnek 40 ° C'de çözünürlük içinde yardım etmek için ısı yavaşça.
2. karakterizasyonu Supramolecular kendinden montajlı yapıları
-
Amiloid lifleri oluşumu
- Kendinden montajlı çözüm hazırlamak için bir analitik denge kullanarak peptid toz 1 mg tartın. (PH 7.5) % 20 Asetonitril ve karışımı 10 mM (4-(2-hydroxyethyl)-1-piperazineethanesulfonic asit (HEPES) son konsantrasyonu 1 mg/mL peptid derleme karışımı bir 1.5 mL microcentrifuge tüp. içine dağıtılması Girdap derleme çözüm ve oda sıcaklığında bir araya bırakın.
-
Amiloid liflerinin spektroskopik karakterizasyonu
- Peptid derleme işlemi birkaç günde Fourier dönüşümü kızılötesi (FTIR) spektroskopisi ile izleyin. Örnek17unassembled peptidler kaynaklanan IR imza, 1670 cm-1 merkezli bir geniş tepedir. Peptid montaj örnekleri genellikle kaybolur ve olgunlaşma ulaşmak geniş unassembled zirve için bir iki hafta sürebilir.
- ATR elmas kristal üzerinde ince bir film olarak 8-10 μL derleme çözümün bir aliquot kuru. 1640 1630 cm-1 bir büyük ve geniş su tepe kaybolması Kuru film formları olarak izlemek.
- IR spectra 2 cm-1 çözünürlük 50 taramaları ortalama 1500-1800 cm-1 üzerinden elde etmek. Elde etmek ve arka plan inceden inceye gözden geçirmek her örnek taramadan önce çıkarma. Cm-1 (Şekil 3A)25,261625 ve 1635 arasında keskin bir tepe β-yapraklık derleme için IR imzadır.
- β-yapraklık zengin supramolecular yapıları peptid derlemesini dairesel dichroism (CD) tarafından karakterize. CD spectropolarimeter ile Peltier bir sıcaklık kontrol sistemi kullanarak spectra kaydedin.
- 0,1 mm yol uzunluğu microcuvette içinde derleme çözümün 30 μL pipet.
Not: Bir hücre tutucu klamp ve araç kısa yol uzunluğu hücreye yerleştirin için gereklidir. - Her spektrum için CD enstrüman için aşağıdaki parametreleri ayarlayın: 300 dalga boylarında tarama nm 180 nm, tarama hızı 100/dk, bant genişliği 1 nm, 25 ° C, ortalama üç inceden inceye gözden geçirmek için.
- Arabellek (% 20 Asetonitril/10 mM HEPES, pH 7.5) bir spektrum toplamak ve her örnek tarama denetimi olarak değerden çıkarmak. β-yaprak CD imzası şöyledir: bir ellipticity en az yaklaşık 220 nm (Şekil 3B)27merkezli.
- 0,1 mm yol uzunluğu microcuvette içinde derleme çözümün 30 μL pipet.
- Peptid derleme işlemi birkaç günde Fourier dönüşümü kızılötesi (FTIR) spektroskopisi ile izleyin. Örnek17unassembled peptidler kaynaklanan IR imza, 1670 cm-1 merkezli bir geniş tepedir. Peptid montaj örnekleri genellikle kaybolur ve olgunlaşma ulaşmak geniş unassembled zirve için bir iki hafta sürebilir.
-
Amiloid liflerinin mikroskobu
- 2-3 hafta β-yapraklık zengin supramolecular yapılarına olgunlaşmaya peptid örnekleri için izin.
Not: Derlemelerin derleme işlemi de daha önceki aşamalarında transmisyon elektron mikroskobu (TEM) kullanarak yansıma.- Peptid derleme çözüm TEM karbon kılavuz yüzeyinin 10 μL pipet.
Not: pipet ucu ızgara yüzeyine dokunmamaya dikkat çekmek. Yüksek hassasiyetli, kendi kendine kapanış cımbız TEM kılavuz hazırlık sırasında tutmak için kullanılır. - Derlemeler ızgara yüzeyine absorbe izin vermek için 1-2 dakika bekleyin. Aşırı örnek filtre kağıdı kılavuz kenarına dokunarak kaldırın.
- % 2 uranyl asetat leke piyasada bulunan %4 uranyl asetat eriyik-e doğru 100 μL deiyonize su ekleyerek hazırlayın. % 2 uranyl asetat leke kılavuz yüzeyine 10 μL pipet ve 2-3 dakika için kuluçkaya. Kuluçka sonra fazla leke kılavuz kenarına filtre kağıdı dokunarak kaldırın.
- TEM Izgaralar bir vakum desiccator gecede yerleştirin. Vakum altında görüntüleme kadar saklayın.
- TEM (Şekil 3 c) ile hazırlanmış örnekler görüntü. Mikroskopi için tipik parametreleri aşağıdaki gibidir: 9.300 X 23 için değişen büyüklüklerde görüntülere 000 X, tungsten filaman 120 hızlanan bir gerilim ile kV.
Not: ImageJ edinsel TEM görüntüleri28supramolecular yapılarının ortalama lif genişliğini ölçmek için kullanılabilir.
Dikkat: Tüm ilgili güvenlik bilgi formları (SDS) kullanmadan önce lütfen danışın. Çeşitli kimyasalların sentezinde, arıtma, kullanılan ve açıklanan 1,2-dithiolane değiştiren Self montaj peptidler karakterizasyonu aşındırıcı veya toksik ve yalnızca bir kimyasal duman başlık altında kullanılmalıdır. Her zaman uygun kişisel koruyucu ekipman (koruyucu gözlük, laboratuvar önlüğü, tam uzunlukta pantolon, kapalı-toe Ayakkabı dahil olmak üzere) kullan laboratuvar olarak çalışırken.
- Peptid derleme çözüm TEM karbon kılavuz yüzeyinin 10 μL pipet.
- 2-3 hafta β-yapraklık zengin supramolecular yapılarına olgunlaşmaya peptid örnekleri için izin.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Dithiolane öncül molekül ilk tek adımlı sentezi kenara 1,2-dithiolane değiştiren peptid sentez geri kalanı sağlam destek (Şekil 1A) oluşur. 3 dönüşüm-bromo - 2-(bromomethyl) propiyonik asit 3-(acetylthio) -2-(acetylthiomethyl) propanoic asit, dithiolane habercisi 1tarafından H doğruladı ve 13C NMR (Şekil 1B ve C) daha önce ücretsiz için birleştiğinde Bir peptid hala-reçine N-terminus Amin. Thioacetate için thiols amonyum hidroksit ile deprotection mikrodalga reaktör kullanılarak gerçekleştirilir ve 1,2-dithiolane değiştiren peptid reçine--dan i ciddi önce metanol içinde gecede 1,2-dithiolane okside. Ham peptid ters faz HPLC (Şekil 2A) tarafından saflaştırılmış ve ürünün kitle MALDI-TOF Kütle spektrometresi (Şekil 2B) tarafından doğrulanır.
Arıtılmış 1,2-dithiolane peptid olgun amiloid lifleri bir 2-3 hafta süre içinde kendiliğinden toplanır. FT-IR (Şekil 3A) ve CD spektroskopisi (Şekil 3B) derleme süreci takip etmek ve genişletilmiş β-yapraklık uyum tanımlamak için kullanılır. Lifleri tarafından TEM (Şekil 3 c) görüntüsü.
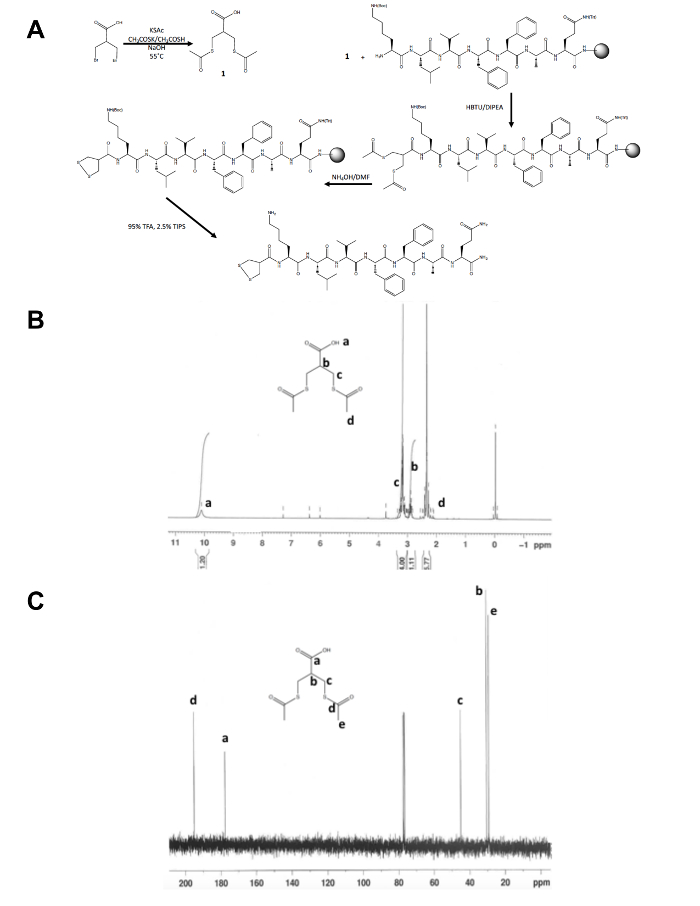
Şekil 1. 1,2-dithiolane habercisi molekülü karakterizasyonu için sentetik düzeni. (A) sentetik şeması değiştirilmiş son 1,2-dithiolane peptid, 1,2-dithiolane-KLVFFAQ-NH2. (B) 1H-NMR, 3-(acetylthio) -2-(acetylthiomethyl) propanoic asit CDCl3 300 MHz. (C)13C-NMR 3-(acetylthio) -2-(acetylthiomethyl) propanoic asit CDCl3 , 75 MHz. lütfen buraya tıklayınız Bu rakam daha büyük bir sürümünü görüntülemek için.

Şekil 2. 1,2-dithiolane sentezi peptid değiştiren. (A) HPLC kromatografik 1,2-dithiolane - KLVFFAQ-NH2arıtma üzerinden. (B) 1,2-dithiolane-KLVFFAQ-NH2hesaplanan kütle HPLC arıtma (saklama süresi ~17.5 dk) içinde reflektron tarz DHB matrisi kullanarak ana ayında en yüksek MALDI-TOF Kütle spektrumu onaylar. Ortak adducts da tanımlanır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 3. Supramolecular 1,2-dithiolane karakterizasyonu peptid değiştiren. (A) FT-IR 1 mg/mL 1,2-dithiolane-KLVFFAQ-NH2 liflerinin CH3CN 10 mM HEPES, pH 7.5 %20 toplandı. 1627 cm-1 zirve peptitler β-yapraklık uyum içinde monte ile tutarlıdır. (B) 10 mM HEPES, pH 7.5 %20 CH3CN CD 1 mg/mL 1,2-dithiolane-KLVFFAQ-NH2 liflerinin toplandı. 218 en az ellipticity nm, β-yapraklık uyum içinde bir araya peptidler ile tutarlıdır. (C) görüntü tarafından TEM 1,2-dithiolane-KLVFFAQ-NH2 amiloid fiber (negatif leke % 2 uranyl asetat). Ölçek çubuğu olan 100 nm. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Bu makalede bir N-terminal 1,2-dithiolane değiştiren Self montaj peptid saflaştırılması ve karakterizasyonu elde edilen supramolecular yapıları ve hem sentezi ayrıntılarını anlatılır. Rapor burada 1,2-dithiolane peptid sentez 3-(acetylthio) -2 dithiolane habercisi üretmek için bir tek adımlı sentez de dahil olmak üzere avantajı vardır-(acetylthiomethyl) propanoic asit ve üzerinde reçine mikrodalga deprotection tepki Grup olarak toksik hidrazin deprotection için daha güvenli bir alternatif daha önce29rapor amonyum hidroksit kullanan oksitlenmiş 1,2-dithiolane yan verim korumak öncü thioacetate. 1,2-dithiolane peptid (Şekil 1A) genel olarak katı faz peptid sentez kolayca sıra uzunluğu ve kompozisyon Fmoc korunan doğal olmayan amino asit ve C-terminal reçine Kimya uygun kullanımı dahil olmak üzere, değiştirerek değiştirilebilir birçok farklı araştırma uygulama.
Nükleofilik yan zincirleri ile amino asitler veya grupları koruma ile amino asitler reaktif bölünme ürünleri karşın istenmeyen peptid yan ürünleri önlemek için ek leş yiyiciler için bölünme kokteyl20eklenmesi gerekir. Bir test bölünme (daha az % 10'dan toplam reçine) küçük bir bölümünün tepki kaplin yüksek bir verim sağlamak için reçine üzerinde mikrodalga deprotection adımdan önce gerçekleştirilebilir. HPLC koşul raporda açıklanan ve sütun kullanarak, thioacetate korumalı 1,2-dithiolane habercisi peptid tepe 5 dk sonra edilişi ücretsiz Amin peptid elutes. Ücretsiz Amin peptid önemli miktarda kalır eğer, başka bir bağlantı adım ile 3-(acetylthio) -2-(acetylthiomethyl) propanoic asit tavsiye edilir. İntramolecular 1,2-dithiolane disülfür bağ üzerinde HPLC 330 zayıf disülfür bağ absorbans izleyerek tespit nm. Oksitlenmiş 1,2-dithiolane karşılık gelen HPLC tepe 100 litre 100 mM tris(2-carboxyethyl)phosphine(TCEP) çalıştırmak bir ayrı HPLC peptid örnekte ekleyerek doğrulanır. Peptid içeren TCEP azaltılmış thiol oksitlenmiş disülfür peptid daha farklı saklama zamanınız olacak. Peptid içeren thiol sütun ve raporda tanımlanan koşullara kullanarak disülfür peptid'dan sonra yaklaşık 1 dk elutes. Peptidler için uygun bir alternatif maldı matris α-cyano-4-hydroxycinnamic asit (CHCA) ve 1 mL % 0,1 ile % 50 Asetonitril ekleyerek hazırlanmış TFA CHCA 5 mg için. Örnekleri C18 ZIP-bahşiş MALDI-TOF Kütle analiz önce tuz adduct (Na+ ve K+) doruklarına önemli ölçüde [M + H]+ tepe bastırmak, kullanarak desalted.
Bu çalışmalar için seçilen peptid sıra Alzheimer hastalığı30ile ilişkili Aβ-peptid Hollandalı mutant türetilir ve daha önce kendi kendine paralel β-yaprak16,17 amiloid liflerinin birleştirmek için gösterilen . Temsilcisi sonuçları Şekil 3A-C, gösterildiği gibi 1,2-dithiolane-KLVFFAQ-NH2 peptid amiloid lifleri de toplanır. 1627 cm-1 ve CD ellipticity 218 minimum merkezli ben germek FTIR Amid nm vardır spektroskopik imzalar ve β-yapraklık derlemeler25,26,27, karbonil CO streç 1676 cm-1 karşılık gelen sipariş glutamin yan zinciri etkileşimleri önermek peptidler paralel β-iplikçikleri16,31,32içinde düzenlenir.
% 2 uranyl asetat negatif leke, kullanarak transmisyon elektron mikroskobu görüntüleri göstermek yaklaşık 10 olan genişletilmiş ve büküm supramolecular lifleri nm genişliği. N-terminal acetylated peptid, Ac-KLVFFAQ-NH2, lifleri pürüzsüz ve düz, neredeyse 12 nm16biraz daha büyük bir genişliğe sahip. TEM ızgaralar hazırlama ve görüntüleri alma zaman yoğun işlem olduğu için hemen, peptid konsantrasyonları değişen aynı Meclisi örnek üzerinden birkaç TEM ızgaralar hazırlamak en iyisidir. Seyreltilmiş numune TEM (1:50 veya 1: 100) özgün derleme çözüm örnek hazır olun. Yüksek konsantrasyonlarda amiloid lifleri kümeleri veya düzeltme ekleri kılavuzuna uygun ve bireysel liflerinin görüntüleri elde etme zor olabilir. Genişlik ölçüleri bireysel liflerinin kenarları görmek önemlidir ve fiber helicity görselleştirme kez kalabalık örnekleri tarafından gizlenmiş.
Supramolecular Biyomalzeme kullanan diğer uygulamalar incelenmiştir gibi kendinden montajlı süreç içine kendi kendine montaj monomer için ortogonal potansiyel olarak reaktif fonksiyonel grupların tümleştirmek için gerek yoktur. Bu raporda açıklanan yöntemlerden bir reçine üzerinde yaklaşım 1,2-dithiolane değiştiren Self montaj peptid sentez ve supramolecular yapıları spektroskopik karakterizasyonu vurgulayın.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazarlar ifşa gerek yok.
Acknowledgments
Yazarlar TEM Connecticut Devlet kolej ve üniversite (CSCU) Merkezi nanoteknoloji ve Dr Ishita Mukerji Wesleyan Üniversitesi'nde için erişim için onu CD kullanarak yardım ve Dr. B. Ellen Scanley onun teknik eğitim için teşekkür etmek istiyorum Spektrofotometre. Raporlanan çalışma kısmen Bilim Enstitüsü Üniversitesi Fairfield, NASA Connecticut alan Grant Konsorsiyumu tarafından ve Ulusal Bilim Vakfı Hibe numarası CHE-1624774 altında tarafından desteklenmiştir.
Materials
| Name | Company | Catalog Number | Comments |
| Rink amide MBHA resin, high load | Gyros Protein Technologies | RAM-5-HL | Avoid contact with skin and eyes; do not inhale |
| N,N-Dimethylformamide | Fisher Scientific | D119-4 | Flammable liquid and vapor; irritating to eyes and skin; Use personal protective equipment; keep away from open flame |
| Fmoc-L-Val-OH | Gyros Protein Technologies | FLA-25-V | Wear personal protective equipment; do not inhale |
| Fmoc-L-Leu-OH | Gyros Protein Technologies | FLA-25-L | Wear personal protective equipment; do not inhale |
| Fmoc-L-Lys(Boc)-OH | Gyros Protein Technologies | FLA-25-KBC | Wear personal protective equipment; do not inhale |
| Fmoc-L-Phe-OH | Gyros Protein Technologies | FLA-25-F | Wear personal protective equipment; do not inhale |
| Fmoc-L-Ala-OH | Gyros Protein Technologies | FLA-25-A | Wear personal protective equipment; do not inhale |
| Fmoc-L-Gln(Trt)-OH | Gyros Protein Technologies | FLA-25-QT | Wear personal protective equipment; do not inhale |
| N,N,N′,N′-Tetramethyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate | Gyros Protein Technologies | 26432 | Causes skin, eye and respiratory irritation; do not inhale; use under hood or in well ventilated area |
| 0.4 M N-methylmorpholine in DMF | Gyros Protein Technologies | PS3-MM-L | highly flammable; wear personal protective equipment; keep away from heat and keep container tightly closed; do not inhale or swallow; wash skin thoroughly after handling |
| 20% piperidine in DMF | Gyros Protein Technologies | PS3-PPR-L | Causes severe eye and skin burns; Flammable Liquid and vapor; Do not inhale |
| dichloromethane | Fisher Scientific | D37-4 | May cause cancer; Do not inhale; Wear personal protective equipment; use under hood only; if contacted rise with water for at least 15 minutes and obtain medical attention |
| acetonitrile | Fisher Scientific | A998-4 | Flammable; irritating to eyes; Use personal protective equipment; Use only under a fume hood; keep away from open flame or hot surface; if contacted rinse wiith water for at least 15 minutes and obtain medical attention |
| trifluoroacetic acid | Fisher Scientific | A116-50 | Causes severe burns; do not inhale; harmful to aquatic life; use personal protective equipment; use only under fume hood; if contacted rinse with water for at least 15 minutes and obain immediate medical attention |
| 4% uranyl acetate | Electron Microscopy Sciences | 22400-4 | Do not inhale; harmful to aquatic life |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Acros Organics | AC172571000 | Do not inhale; use outdoors or in well-ventilated area |
| nitrogen Gas | TechAir | Contents under pressure, may explode if heated | |
| 3-bromo-2-(bromomethyl)propionic acid | Alfa Aesar | AAA1963014 | Do not inhale; causes irritation to skin and eyes; corrosive |
| sodium hydroxide | Fisher Scientific | S318-100 | Use personal protective equipment; use only under fume hood; if contact rinse area for at least 15 minutes and obtain medical attention |
| potassium thioacetate | Acros Organics | AC221300250 | Causes skin and eye irritation; do not inhale; use personal protective equipment |
| sulfuric acid | Fisher Scientific | SA213 | Causes burns; keep away from water; keep away from combustible material; do not inhale; use personal protective equipment; if contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform-d | Acros Organics | AC320690075 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| chloroform | Fisher Scientific | C298-4 | Possible cancer hazard; irritating to skin and eyes; do not inhale; Use personal protective equipment; use only under fume hood; If contact rinse area for at least 15 minutes and obtain medical attention |
| N,N-diisopropylethylamine | Acros Organics | AC367841000 | Highly flammable; harmful to aquatic life; wear personal protective equipment; do not swallow |
| ammonium hydroxide | Fisher Scientific | A669S-500 | Corrosive; do not inhale |
| methanol | Fisher Scientific | A452-4 | Flammable liquid and vapor; use personal protective equipment; do not inhale; If contact rinse area for at least 15 minutes and obtain medical attention |
| triisopropylsilane | Sigma Aldrich | 233781 | Flammable; use personal proctective safety equipment; keep container tightly closed |
| diethyl ether | Fisher Scientific | E138-1 | Extremely flammable; Irritating to skin and eyes; Use personal protective equipment |
| 2,5-dihydroxybenzoic acid | Sigma Aldrich | 39319-10x10MG-F | do not inhale; irritating to skin and eyes |
| alpha-cyano-4-hydroxycinnamic acid | Alfa Aesar | AAJ67635EXK | |
| c18 zip-tip | Millipore | ZTC18S096 | |
| tris(2-carboxyethyl) phospine hydrochloride | Thermo Scientific | PI20490 | |
| silica gel 60 F254 coated aluminum-backed TLC sheets | EMD Millipore | 1.05549.0001 | |
| Thin walled Precision NMR tubes | Bel-Art | 663000585 | 5mm O.D. |
| All-plastic Norm-Ject syringes | Air Tite | AL10 | |
| single-use needle | BD PrecisionGlide | BD 305185 | used needles get disposed on in sharps waste container |
| disposable fritted syringe | Torviq | SF1000LL | 10mL fritted syringes were used in the report, but larger syringes are avaibale if needed for larger scale synthesis. |
| carbon grid | Ted Pella, Inc. | CF200-CU | Make sure to prepare samples and staining on the carbon grid side, not the shiny copper side of grid |
| self-closing tweezers | Electron Microscopy Sciences | 78318-3X | very sharp tips, length: 120 mm |
| 0.1 mm short path length cell | Starna Cells, Inc. | 20/C-Q-0.1 | Fragile |
| 10mL Vessel Caps | CEM | 909210 | |
| 10mL Pressure Vessels | CEM | 908035 | |
| Aeris Semi-Prep HPLC column | Phenomenex | 00F-4632-N0 | 150 x 10mm |
| cell holder | Starna Cells, Inc. | CH-2049 | Needed when using short pathlength cells |
| PS3 peptide synthesizer | Gyros Protein Technologies | ||
| DiscoverSP Microwave Reactor | CEM | ||
| centrifuge | HERMLE | Z 206 A | used a fixed 6x50 mL rotor |
| HPLC | Shimadzu | UV Detector | |
| nuclear magnetic resonance spectrometer | Avance, Bruker | 300 MHz | |
| MALDI-TOF mass spectrometer | Axima Confidence, Shimadzu | ||
| lyophilizer | Millrock Technology | BT85A | |
| Fourier-Transform Infrared Spectrometer | Alpha Tensor, Bruker | ||
| Transmission Electron Microscope | Tecnai Spirit, FEI | Used with Gatan Orius Fiberoptic CCD digital camera. Accessed at CSCU Center for Nanotechnology | |
| Circular Dichroism Spectropolarimeter | J-810, JASCO | Used with a six-cell Peltier temperature controller. Accessed at Wesleyan University. |
References
- Wang, J., Liu, K., Xing, R., Yan, X. Peptide self-assembly: Thermodynamics and kinetics. Chemical Society Reviews. 45, 5589-5604 (2016).
- Dong, R., et al. Functional supramolecular polymers for biomedical applications. Advanced Materials. 27, 498-526 (2015).
- Edwards-Gayle, C. J. C., Hamley, I. W. Self-assembly of bioactive peptides, peptide conjugates, and peptide mimetic materials. Organic and Biomolecular Chemistry. 15, 5867-5876 (2017).
- Goor, O. J. G. M., Hendrikse, S. I. S., Dankers, P. Y. W., Meijer, E. W. From supramolecular polymers to multi-component biomaterials. Chemical Society Reviews. 46, 6621-6637 (2017).
- DiMaio, J. T. M., Doran, T. M., Ryan, D. M., Raymond, D. M., Nilsson, B. L. Modulating supramolecular peptide hydrogel viscoelasticity using biomolecular recognition. Biomacromolecules. 18, 3591-3599 (2017).
- DiMaio, J. T. M., Raymond, D. M., Nilsson, B. L. Display of functional proteins on supramolecular peptide nanofibrils using a split-protein strategy. Organic and Biomolecular Chemistry. 15, 5279-5283 (2017).
- Mahmoud, Z. N., Gunnoo, S. B., Thomson, A. R., Fletcher, J. M., Woolfson, D. N. Bioorthogonal dual functionalization of self-assembling peptide fibers. Biomaterials. 32, 3712-3720 (2011).
- Petkau-Milroy, K., Uhlenheuer, D. A., Spiering, A. J. H., Vekemans, J. A. J. M., Brunsveld, L. Dynamic and bio-orthogonal protein assembly along a supramolecular polymer. Chemical Science. 4, 2886-2891 (2013).
- Li, A., et al. Neurofibrillar tangle surrogates: Histone H1 binding to patterned phosphotyrosine peptide nanotubes. Biochemistry. 53, 4225-4227 (2014).
- Sadownik, A., Stefely, J., Regen, S. L. Polymerized liposomes formed under extremely mild conditions. Journal of the American Chemical Society. 108, 7789-7791 (1986).
- Zhang, N., et al. ATN-161 Peptide functionalized reversibly cross-linked polymersomes mediate targeted doxorubicin delivery into melanoma-bearing C57BL/6 mice. Molecular Pharmaceutics. 14, 2538-2547 (2017).
- Margulis, K., et al. Formation of polymeric nanocubes by self-assembly and crystallization of dithiolane-containing triblock copolymers. Angewandte Chemie International Edition. 56, 16357-16362 (2017).
- Zhang, X., Waymouth, R. 1,2-Dithiolane-Derived Dynamic, Covalent Materials: Cooperative Self-Assembly and Reversible Cross-Linking. Journal of the American Chemical Society. 139, 3822-3833 (2017).
- Sakia, N., Matile, S. Stack exchange strategies for the synthesis of covalent double-channel photosystems by self-organizing surface-initiated polymerization. Journal of the American Chemical Society. 133, 18542-18545 (2011).
- Uji, H., Morita, T., Kimura, S. Molecular direction dependence of single-molecule conductance of a helical peptide in molecular junction. Physical Chemistry Chemical Physics. 15, 757-760 (2013).
- Liang, C., Ni, R., Smith, J. E., Childers, W. S., Mehta, A. K., Lynn, D. G. Kinetic intermediates in amyloid assembly. Journal of the American Chemical Society. 136, 15116-15149 (2014).
- Smith, J. E., et al. Defining the dynamic conformational network of cross-β peptide assembly. Israel Journal of Chemistry. 55, 763-769 (2015).
- Black, S. P., Sanders, J. K. M., Stefankiewicz, A. R. Disulfide exchange: Exposing supramolecular reactivity through dynamic covalent chemistry. Chemical Society Reviews. 43, 1861-1872 (2014).
- Vendetti, A., et al. Dihydroasparagusic acid: Antioxidant and tyrosinase inhibitory activities and improved synthesis. Journal of Agricultural and Food Chemistry. 61, 6848-6855 (2013).
- Stawikowski, M., Fields, G. B. Introduction to peptide synthesis. Current Protocols in Protein Science. 26, (2002).
- Canadell, J., Goossens, H., Klumperman, B. Self-healing materials based on disulfide links. Macromolecules. 44, 2536-2541 (2011).
- Lafont, U., van Zeijl, H., van der Zwaag, S. Influence of cross-linkers on the cohesive and adhesive self-healing ability of polydisulfide-based thermosets. ACS Applied Materials and Interfaces. 4, 6280-6288 (2012).
- Komaromy, D., Stuart, M. C. A., Santiago, G. M., Tezcan, M., Krasnikov, V. V., Otto, S. Self-assembly can direct dynamic covalent bond formation toward diversity or specificity. Journal of the American Chemical Society. 139, 6234-6241 (2017).
- McAvery, K. M., Guan, B., Fortier, C. A., Tarr, M. A., Cole, R. B. Laser-induced oxidation of cholesterol observed during MALDI-TOF mass spectrometry. Journal of the American Society for Mass Spectrometry. 22, 659-669 (2011).
- Krimm, S., Bandekar, J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins. Advances in Protein Chemistry. 38, 181-364 (1986).
- Halverson, K. J., Sucholeiki, I., Ashburn, T. T., Lansbury, P. T. Location of β-sheet-forming sequences in amyloid proteins by FTIR. Journal of the American Chemical Society. 113, 6701-6703 (1991).
- Greenfield, N., Fasman, G. D. Computed circular dichroism spectra for the evaluation of protein confirmation. Biochemistry. 8, 4108-4116 (1969).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. Available from: https://imagej.nih.gov/ij (2016).
- Roy, S., Shinde, S., Hamilton, G. A., Hartnett, H. E., Jones, A. K. Artificial [FeFe]-hydrogenase: On resin modification of an amino acid to anchor a hexacarbonyldiiron cluster in a peptide framework. European Journal of Inorganic Chemistry. 2011, 1050-1055 (2011).
- Van Duinen, S. G., Castano, E. M., Prelli, F., Bots, G. T. A. B., Luyendijk, W., Frangione, B. Hereditary cerebral hemorrhage with amyloidosis in patients of Dutch origin is related to Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America. 84, 5991-5994 (1987).
- Barth, A. The infrared absorption of amino acid sidechains. Progress in Biophysics and Molecular Biology. 74, 141-173 (2000).
- Jayaraman, M., et al. Slow amyloid nucleation via α-helix-rich oligomeric intermediates in short polyglutamine-containing Huntingtin fragments. Journal of Molecular Biology. 415, 881-899 (2012).



