ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
वर्तमान अध्ययन मानव भ्रूण के गुणसूत्र स्क्रीनिंग के लिए एक प्रोटोकॉल की रिपोर्ट करता है जो खर्च किए गए संस्कृति माध्यम का उपयोग करता है, जो भ्रूण बायोप्सी से बचता है और एनजीएस का उपयोग करके गुणसूत्र गुणित पहचान को सक्षम बनाता है। वर्तमान लेख विस्तृत प्रक्रिया प्रस्तुत करता है, जिसमें संस्कृति माध्यम, संपूर्ण जीनोम प्रवर्धन (डब्ल्यूजीए), अगली पीढ़ी के अनुक्रमण (एनजीएस) पुस्तकालय की तैयारी और डेटा विश्लेषण शामिल हैं।
Abstract
नैदानिक इन विट्रो फर्टिलाइजेशन (आईवीएफ) में, पीजीटी-ए के लिए प्रचलित विधि को ट्रोफेक्टोडर्म (टीई) से कुछ कोशिकाओं की बायोप्सी की आवश्यकता होती है। यह वह वंश है जो प्लेसेंटा बनाता है। हालांकि, इस विधि के लिए विशेष कौशल की आवश्यकता होती है, आक्रामक है, और झूठे सकारात्मक और नकारात्मक से ग्रस्त है क्योंकि टीई और आंतरिक कोशिका द्रव्यमान (आईसीएम) में गुणसूत्र संख्या, जो भ्रूण में विकसित होती है, हमेशा समान नहीं होती है। एनआईसीएस, एक तकनीक जिसे डीएनए के अनुक्रमण की आवश्यकता होती है जो टीई और आईसीएम दोनों से संस्कृति माध्यम में जारी होती है, इन समस्याओं से बाहर निकलने का एक तरीका प्रदान कर सकती है लेकिन पहले सीमित प्रभावकारिता दिखाई गई है। वर्तमान अध्ययन एनआईसीएस के पूर्ण प्रोटोकॉल की रिपोर्ट करता है, जिसमें संस्कृति माध्यम नमूना करण विधियां, संपूर्ण जीनोम प्रवर्धन (डब्ल्यूजीए) और पुस्तकालय तैयार करना और विश्लेषण सॉफ्टवेयर द्वारा एनजीएस डेटा विश्लेषण शामिल है। विभिन्न भ्रूण प्रयोगशालाओं में अलग-अलग क्रायोप्रिजर्वेशन समय को ध्यान में रखते हुए, भ्रूणविज्ञानियों के पास भ्रूण संस्कृति माध्यम एकत्र करने के लिए दो तरीके हैं जिन्हें आईवीएफ प्रयोगशाला की वास्तविक स्थितियों के अनुसार चुना जा सकता है।
Introduction
बांझपन के उपचार के लिए सहायक प्रजनन प्रौद्योगिकियों (एआरटी) का तेजी से उपयोग किया गया है। हालांकि, आईवीएफ जैसे एआरटी की सफलता दर सीमित रही है, और गर्भावस्था की हानि दर सामान्य आबादी1 की तुलना में काफी अधिक है। इन समस्याओं का मुख्य कारण क्रोमोसोमल असामान्यताएं हैं, जो आमतौर पर प्रीइम्प्लांटेशन मानव भ्रूण2 में मौजूद होती हैं। पीजीटी-ए आरोपण 3,4 से पहले क्रोमोसोमल संतुलन के लिए भ्रूण की जांच का एक प्रभावी तरीका है। कुछ अध्ययनों ने साबित किया है कि पीजीटी-ए गर्भपात की दर को कम कर सकता है और गर्भावस्था की दर में 5,6,7,8में सुधार कर सकता है। हालांकि, पीजीटी-ए को जटिल तकनीकी विशेषज्ञता की आवश्यकता होती है जिसके लिए विशिष्ट प्रशिक्षण और अनुभव की आवश्यकता होती है। आक्रामक भ्रूण बायोप्सी प्रक्रिया भी संभावित रूप से भ्रूण को नुकसान पहुंचासकती है। अध्ययनों से पता चला है कि ब्लास्टोमेयर बायोप्सी बाद के विकास में बाधा डाल सकती है, और बायोप्सी टीई की संख्या आरोपण दर को प्रभावित कर सकतीहै10. यद्यपि भ्रूण बायोप्सी के दीर्घकालिक जैव सुरक्षा मुद्दे का अभी तक मनुष्यों में पूरी तरह से मूल्यांकन नहीं किया गया है, जानवरों के अध्ययन ने भ्रूण के विकास पर इसके नकारात्मक प्रभावदिखाए हैं 11,12,13.
पिछली रिपोर्टों से संकेत मिलता है कि भ्रूण के विकास के दौरान कल्चर माध्यम में डीएनए सामग्री की ट्रेस मात्रा का स्राव किया गया था, और खर्च किए गए भ्रूण संस्कृति माध्यम14,15,16,17,18 का उपयोग करके व्यापक गुणसूत्र स्क्रीनिंग (सीसीएस) करने के प्रयास किए गए हैं। हालांकि, पता लगाने की दर और परीक्षणों की सटीकता व्यापक नैदानिक उपयोग के लिए आवश्यकताओं को पूरा नहीं करती है। वर्तमान अध्ययन ने पहचान दर बढ़ाने के साथ-साथ एनआईसीएस परीक्षण19 की सटीकता के लिए एनआईसीएस परख में सुधार की सूचना दी। हाल के वर्षों में, ब्लास्टोकोले द्रव (बीएफ) का अध्ययन न्यूनतम इनवेसिव पीजीटी-ए के विश्लेषणात्मक नमूने के रूप में किया गया है। हालांकि, ब्लास्टोसिस्ट द्रव नमूनों में सफल जीनोम-व्यापी प्रवर्धन और पता लगाने योग्य डीएनए का अनुपात 34.8% से 82% 20,21,22 तक होता है। विभिन्न अध्ययनों में रिपोर्ट किए गए बीएफ की मात्रा 0.3 एनएल से 1 μL तक है। बीएफ में डीएनए की कम मात्रा को देखते हुए, सफलता दर और पहचान की स्थिरता में सुधार के लिए ब्लास्टोसिस्ट द्रव और संस्कृति माध्यम को मिलाकर सेल-मुक्त डीएनए की मात्रा में वृद्धि करना संभव है। कुज़नेत्सोव एट अल।23 और ली एट अल .24 ने जोना पेलुसीडा को लेजर के साथ इलाज किया और भ्रूण के डीएनए की कुल मात्रा में सुधार करने के लिए संस्कृति माध्यम में ब्लास्टोसिस्ट द्रव जारी किया, और डब्ल्यूजीए के बाद संयुक्त माध्यम / बीएफ नमूनों की प्रवर्धन दर क्रमशः 100% और 97.5% थी। जिओ एट अल .25 ने भी उसी विधि का उपयोग करके 100% प्रवर्धन सफलता दर प्राप्त की।
वर्तमान अध्ययन एक विस्तृत प्रोटोकॉल की रिपोर्ट करता है जिसमें खर्च किए गए मीडिया नमूना तैयारी, एनजीएस तैयारी और डेटा विश्लेषण शामिल हैं। अंडाणुओं से क्यूमुलस कोशिकाओं को सावधानीपूर्वक हटाकर, वर्तमान अध्ययन ने इंट्रासाइटोप्लाज्मिक एकल शुक्राणु इंजेक्शन (आईसीएसआई) और ब्लास्टोसिस्ट कल्चर का प्रदर्शन किया। डब्ल्यूजीए और एनजीएस लाइब्रेरी की तैयारी के लिए दिन 4-दिवसीय 5/दिन 6 खर्च माध्यम एकत्र किया गया था। एनआईसीएस प्रौद्योगिकी का उपयोग करके, वर्तमान अध्ययन ने लगभग 3 घंटे में डब्ल्यूजीए और एनजीएस लाइब्रेरी तैयारी चरणों को सुव्यवस्थित किया और लगभग 9 घंटे में सीसीएस परिणाम प्राप्त किए।
Subscription Required. Please recommend JoVE to your librarian.
Protocol
पेकिंग यूनिवर्सिटी थर्ड हॉस्पिटल की आचार समिति से नैतिक अनुमति प्राप्त की गई थी।
1. तैयारी
नोट: आवश्यक सामग्री और उपकरण सामग्री की तालिका में सूचीबद्ध हैं।
- अभिकर्मकों
- उपयोग से पहले रात भर ट्राई-गैस इनक्यूबेटर में 37 डिग्री सेल्सियस, 5% सीओ 2 और 5% ओ2 पर 20-30 μL युग्मक मध्यम/निषेचन माध्यम और क्लीवेज/ब्लास्टोस-स्टेज कल्चर माध्यम (खनिज तेल से ढका) और हायलूरोनिडेस (कसकर ढकी ट्यूब में) का 20-30 लें।
- फ्यूम हुड में काम करने वाली सतह पर 37 डिग्री सेल्सियस तक प्रीवार्म हाइलूरोनिडेज़।
- निर्माता के निर्देशों के अनुसार विटिफिकेशन बफर और नमूना संग्रह अभिकर्मक तैयार करें।
- औजार
- नमूना संग्रह और स्थानांतरण पिपेट (~ 200 से 250 μm का आंतरिक व्यास), डेंसेशन / स्ट्रिपर पिपेट (≥150 μm, ~ 130-140 μm, और ~ 120 μm का आंतरिक व्यास), और धोने के लिए पिपेट (~ 150 μm का आंतरिक व्यास) तैयार करें।
नोट: नमूना संग्रह / हस्तांतरण, विनाश और धोने के लिए उपयोग किए जाने वाले पिपेट सीधे खरीदे जा सकते हैं। होल्डिंग सुइयों और इंजेक्शन सुइयों को भी सीधे खरीदा जा सकता है।
- नमूना संग्रह और स्थानांतरण पिपेट (~ 200 से 250 μm का आंतरिक व्यास), डेंसेशन / स्ट्रिपर पिपेट (≥150 μm, ~ 130-140 μm, और ~ 120 μm का आंतरिक व्यास), और धोने के लिए पिपेट (~ 150 μm का आंतरिक व्यास) तैयार करें।
2. प्रोटोकॉल 1: नमूना संग्रह
- हाइलूरोनिडेज़ के साथ पाचन से पहले अंडाणु-कोरोना-क्यूमुलस कॉम्प्लेक्स (ओसीसी) का पूर्व-उपचार
- कूप उत्तेजक हार्मोन (एफएसएच) और मानव रजोनिवृत्ति गोनाडोट्रोपिन (एचएमजी) तैयारी दोनों के साथ डिम्बग्रंथि उत्तेजना प्राप्त करें। जब लीड फॉलिकल >18 मिमी है, तो अंतिम अंडाणु परिपक्वता के लिए कोरियोनिक गोनाडोट्रोपिन (एचसीजी) के 10,000 आईयू का उपयोग करें।
- ट्रिगर शॉट के 36 घंटे बाद अंडाणु पुनर्प्राप्ति करें। खनिज तेल से ढके 2.5 मिलीलीटर प्रीवार्म्ड एम-एचटीएफ के साथ टिशू कल्चर व्यंजनों में अंडाणुओं को उठाएं और स्थानांतरित करें।
- ओसीसी को ट्रांसफर पिपेट का उपयोग करके 1 एमएल फर्टिलाइजेशन माध्यम युक्त एक अंग संवर्धन डिश के केंद्रीय कुएं में तेजी से स्थानांतरित करें और फिर 2-4 घंटे के लिए 5% सीओ 2 और 5% ओ2 इनक्यूबेटर में 37 डिग्री सेल्सियस पर अंडाणुओं के साथ इनक्यूबेट करें।
- ओसीसी युक्त अंग संस्कृति डिश के केंद्रीय कुएं में 1 एमएल 37 डिग्री सेल्सियस प्रीवार्म्ड हाइलूरोनिडेज़ (80 आईयू / एमएल) जोड़कर हायलूरोनिडेज़ के साथ ओसीसी को डाइजेस्ट करें (चरण 2.1.3)। हायलूरोनिडेज़ की अंतिम एकाग्रता 40 आईयू / एमएल पर रखें और अच्छी तरह मिलाएं।
- 2 मिनट के लिए 37 डिग्री सेल्सियस थर्मल प्लेटफॉर्म पर ओसीसी को इनक्यूबेट करें। हर 30 सेकंड में एक माइक्रोस्कोप के तहत परिवर्तनों का निरीक्षण करें जब तक कि ग्रैनुलोसा कोशिकाओं की केवल 1-2 परतें न रह जाएं।
- ग्रैनुलोसा कोशिकाओं का विघटन।
- ओओसाइट हैंडलिंग के लिए कल्चर डिश में पचे हुए ओसीसी को तेजी से स्थानांतरित करें और प्रत्येक कुएं में खनिज तेल के साथ कवर करें।
- एक माइक्रोस्कोप के तहत अलग ग्रैनुलोसा कोशिकाओं का निरीक्षण करें। अंडाणुओं के चारों ओर अवशिष्ट ग्रैनुलोसा कोशिकाओं को हटाने के लिए अंडाणुओं को धीरे-धीरे 5 बार एस्पिरेट और रिलीज करें।
- ग्रैनुलोसा कोशिकाओं को पूरी तरह से हटाने के लिए शेष 3 कुओं में पिछले चरण को दोहराएं।
नोट: उपरोक्त चरण (2.1-2.3) प्रत्येक प्रयोगशाला के नियमित संचालन के अनुसार किया जा सकता है।
- अंडाणु का मूल्यांकन
- माइक्रोस्कोप का उपयोग करके ग्रैनुलोसा सेल हटाने की पूर्णता का मूल्यांकन करें। यदि कोशिकाओं को पूरी तरह से हटाया नहीं जा सकता है, तो इस समय 5 या उससे कम ग्रैनुलोसा कोशिकाओं का प्रतिधारण स्वीकार्य है।
नोट: यदि क्यूमुलस कोशिकाएं अभी भी अंडाणु से जुड़ी हुई हैं, तो भ्रूण को दरार-चरण संस्कृति माध्यम से ब्लास्टोसिस्ट-स्टेज कल्चर माध्यम में स्थानांतरित करने से पहले अवशेष को बाद में दिन 3 पर हटाया जा सकता है।
- माइक्रोस्कोप का उपयोग करके ग्रैनुलोसा सेल हटाने की पूर्णता का मूल्यांकन करें। यदि कोशिकाओं को पूरी तरह से हटाया नहीं जा सकता है, तो इस समय 5 या उससे कम ग्रैनुलोसा कोशिकाओं का प्रतिधारण स्वीकार्य है।
- इंट्रासाइटोप्लाज्मिक स्पर्म इंजेक्शन (आईसीएसआई) 26 करने के बाद, ट्रांसफर पिपेट का उपयोग करके अंडाणुओं को 20-30 μL क्लीवेज भ्रूण कल्चर मीडियम माइक्रोड्रॉपलेट्स (एक अंडाणु एक माइक्रोड्रॉपलेट से मेल खाती है) में स्थानांतरित करें और 37 डिग्री सेल्सियस, 5% सीओ 2 और 5% ओ2 इनक्यूबेटर में इनक्यूबेट करें।
- आईसीएसआई के दिन को दिन 0 के रूप में रिकॉर्ड करें। भ्रूण क्लीवेज27 के लिए निषेचन (लगभग 18 घंटे), दिन 2 (लगभग 45 घंटे) और दिन 3 (लगभग 68 घंटे) के भ्रूण मूल्यांकन पर इस्तांबुल आम सहमति कार्यशाला के अनुसार भ्रूण की जांच करें और स्कोर करें।
- भ्रूण धोना
- 37 डिग्री सेल्सियस, 5% सीओ 2 और 5% ओ 2 इनक्यूबेटर में दिन2 पर टिशू कल्चर व्यंजनों में खनिज तेल से ढके प्रत्येक भ्रूण के लिए ब्लास्टोसिस्ट कल्चर मध्यम माइक्रोड्रॉपलेट्स के 20-30 μL तैयार करें।
- खनिज तेल से ढके एक और तीन माइक्रोड्रॉपलेट्स तैयार करें, और नंबर 1-3 धोने के लिए नए टिशू कल्चर व्यंजनों को लेबल करें।
- दिन 3 भ्रूण को धोने वाले माइक्रोड्रॉपलेट्स में स्थानांतरित करें। धीरे-धीरे भ्रूण को एस्पिरेट करें और डेंसेशन पिपेट का उपयोग करके प्रत्येक बूंद में 3 बार छोड़ें।
नोट: यह प्रक्रिया भ्रूण से जुड़ी अवशिष्ट दानेदार कोशिकाओं को हटाने में भी मदद कर सकती है। - मॉर्फोलॉजिकल स्कोरिंग के लिए क्लीवेज-स्टेज कल्चर माध्यम से ब्लास्टोसिस्ट कल्चर माध्यम में माध्यम को बदलने से पहले दिन 3 पर माइक्रोस्कोप के तहत भ्रूण का निरीक्षण और मूल्यांकन करें। यदि क्यूमुलस कोशिकाएं अभी भी भ्रूण से जुड़ी हुई थीं, तो उचित रूप से एक स्ट्रिपर पिपेट के साथ खनिज तेल से ढकी एक अन्य गर्म और समतुल्य ब्लास्टोसिस्ट कल्चर मध्यम बूंद में ऊपर और नीचे पिपेट करें जब तक कि क्यूमुलस कोशिकाओं को पूरी तरह से हटा नहीं दिया गया।
नोट: भ्रूण को क्लीवेज-स्टेज कल्चर मीडियम प्लेट से ब्लास्टोसिस्ट-स्टेज कल्चर मीडियम प्लेट में स्थानांतरित करने से पहले सभी संलग्न क्यूमुलस कोशिकाओं को दिन 3 पर पूरी तरह से हटा दिया जाना था। कोई भी शेष क्यूमुलस कोशिकाएं अंतिम विश्लेषण में हस्तक्षेप करेंगी और झूठे नकारात्मक परिणाम देंगी।
- संस्कृति माध्यम संग्रह के लिए दो विकल्प
नोट: आईवीएफ केंद्र केंद्र के संसाधनों, मांगों और वरीयताओं के आधार पर संस्कृति माध्यम संग्रह के लिए दो तरीकों में से एक चुन सकता है।- विकल्प 1: भ्रूण धोने और संस्कृति
नोट: यह विकल्प आईवीएफ प्रयोगशालाओं के लिए है जो 5 वें दिन की सुबह विट्रीफिकेशन करते हैं।- भ्रूण को कल्चर माध्यम के प्रीवार्म्ड (37 डिग्री सेल्सियस) माइक्रोड्रॉपलेट्स में स्थानांतरित करें, और धीरे-धीरे प्रत्येक भ्रूण को 4 दिन की दोपहर में पाइपिंग द्वारा 3 माइक्रोड्रॉपलेट्स में क्रमिक रूप से धोएं।
- नमूना संग्रह के लिए प्रत्येक भ्रूण को कल्चर माध्यम के एक अद्वितीय प्रीवार्म्ड (37 डिग्री सेल्सियस) एकल माइक्रोड्रॉपलेट में स्थानांतरित करें। कल्चर माध्यम की एक बूंद की मात्रा 25 μL से अधिक नहीं हो सकती है।
- ब्लास्टोसिस्ट भ्रूण संस्कृति दिन 5 / दिन 6 पर 37 डिग्री सेल्सियस, 5% सीओ 2, और 5% ओ2 पर करें।
- विकल्प 2: भ्रूण धोने और संस्कृति
नोट: यह विकल्प आईवीएफ प्रयोगशालाओं के लिए है जो दिन 5 दोपहर या दिन 6 पर विट्रीफिकेशन करते हैं।- भ्रूण को 10-15 μL कल्चर माध्यम के प्रीवार्म्ड (37 °C) माइक्रोड्रॉपलेट्स में स्थानांतरित करें, और धीरे-धीरे 5 वें दिन पाइपटिंग द्वारा प्रत्येक भ्रूण को 3 माइक्रोड्रॉपलेट्स में क्रमिक रूप से धोएं।
- नमूना संग्रह के लिए प्रत्येक भ्रूण को कल्चर माध्यम के एक अद्वितीय प्रीवार्म्ड (37 डिग्री सेल्सियस) एकल माइक्रोड्रॉपलेट में स्थानांतरित करें। संस्कृति माध्यम की एक बूंद की मात्रा 15 μL से अधिक नहीं हो सकती है।
- ब्लास्टोसिस्ट भ्रूण संस्कृति दिन 5/दिन 6 पर 37 डिग्री सेल्सियस और 5% सीओ2 पर करें।
- विकल्प 1: भ्रूण धोने और संस्कृति
- नमूना संग्रह
- लेजर बीम के लक्षित बिंदु से काफी दूरी पर आईसीएम को धीरे से समायोजित करें, जो ब्लास्टोकोल गुहा से तरल पदार्थ को छोड़ने के लिए ट्रोफेक्टोडर्म में एक छोटा छेद उत्पन्न करने के लिए ट्रोफेक्टोडर्म के सेल जंक्शन पर केंद्रित है। फिर भ्रूण को पारंपरिक प्रक्रिया के अनुसार क्रायोप्रिजर्वेशन के लिए ठंड समाधान में ले जाया जाता है।
- प्रत्येक सुसंस्कृत भ्रूण से संस्कृति माध्यम को एक RNase / DNase-मुक्त पीसीआर ट्यूब में स्थानांतरित करें जिसमें 5 μL सेल लाइसिस बफर होता है।
- नकारात्मक नियंत्रण के रूप में भ्रूण संस्कृति के लिए उपयोग किए बिना संस्कृति माध्यम की समान मात्रा एकत्र करें। तरल नाइट्रोजन में तुरंत सभी एकत्र किए गए नमूनों को फ्रीज करें और फिर एनआईसीएस परख के अधीन होने तक एकत्र होने के बाद -80 डिग्री सेल्सियस पर स्टोर करें।
- प्रोटोकॉल में वर्णित के रूप में विट्रीफिकेशन करें।
3. प्रोटोकॉल 2: पुस्तकालय निर्माण
- संस्कृति माध्यम लाइसिस;
- 199 μL ताजा संस्कृति माध्यम के साथ सकारात्मक नियंत्रण (10 ng मानव gDNA) के 1 μL पतला करें। अच्छी तरह से मिलाएं और ट्यूब को संक्षेप में सेंट्रीफ्यूज करें (5 सेकंड के लिए 200 x g )।
- दिन 5-दिवसीय 6 ब्लास्टोसिस्ट कल्चर माध्यम के 10 μL, पतला सकारात्मक नियंत्रण, और ताजा संस्कृति माध्यम को नए 0.2 एमएल पीसीआर ट्यूबों में स्थानांतरित करें।
- प्रत्येक पीसीआर ट्यूब में एमटी एंजाइम मिक्स के 1 μL जोड़ें और 200 x g पर 2-3 सेकंड के लिए तुरंत पाइपिंग और सेंट्रीफ्यूज द्वारा अच्छी तरह मिलाएं।
- प्रीहीट एनआईसीएस सैंपल प्रेप स्टेशन में चरण 3.1.3 से पीसीआर ट्यूब (ओं) को रखें और लाइसिस प्रोग्राम को निम्नानुसार चलाएं: 75 डिग्री सेल्सियस पर 10 मिनट; 95 डिग्री सेल्सियस पर 4 मिनट; 22 डिग्री सेल्सियस पर पकड़ो।
नोट: नमूना तैयारी स्टेशन एक मानक पीसीआर मशीन के बराबर है।- सेटअप स्क्रीन में प्रवेश करने के लिए लाइसिस आइकन पर क्लिक करें।
- नियंत्रण मोड के लिए ट्यूब का चयन करें; नमूना मात्रा के लिए इनपुट 10 μL; हॉटलिड नियंत्रण के लिए चुनें और तापमान के लिए 105 डिग्री सेल्सियस दर्ज करें। पहले सेग पर विराम के लिए नहीं का चयन करें। आगे बढ़ने के लिए ठीक क्लिक करें.
- बने रहने का समय शो तक प्रतीक्षा करें ---, जो प्रोग्राम के अंत को इंगित करता है, और फिर प्रोग्राम को समाप्त करने के लिए रोकें पर क्लिक करें।
- प्रक्रिया पूरी होने के बाद प्रोग्राम को रोक दें। तुरंत अगले चरण पर जाएं।
- पुस्तकालय पूर्व तैयारी
- प्री-लिब बफर को आरटी में पिघलाएं। 200 x g पर 2-3 सेकंड के लिए तुरंत पाइपटिंग और सेंट्रीफ्यूज द्वारा अच्छी तरह से मिलाएं।
- प्रीलाइब्रेरी प्रतिक्रिया के लिए एक मास्टर मिश्रण निम्नानुसार तैयार करें: प्री-लिब बफर के 60 μL में 2 μL प्री-लिब एंजाइम मिक्स जोड़ें, प्रतिक्रिया को अच्छी तरह से मिलाएं और संक्षेप में सेंट्रीफ्यूज करें।
- पिछले चरण से प्रत्येक प्रीट्रीटेड माध्यम नमूने में 60 μL प्रीलाइब्रेरी प्रतिक्रिया मिश्रण जोड़ें। 200 x g पर 2-3 सेकंड के लिए तुरंत पाइपटिंग और सेंट्रीफ्यूज द्वारा अच्छी तरह मिलाएं।
- नमूना प्रेप स्टेशन में चरण 3.2.3 से पीसीआर ट्यूब (ओं) को रखें और प्रीलाइब्रेरी प्रोग्राम को निम्नानुसार चलाएं: 2 मिनट के लिए 95 डिग्री सेल्सियस; 40 सेकंड के लिए 15 डिग्री सेल्सियस के 12 चक्र, 40 सेकंड के लिए 22 डिग्री सेल्सियस, 30 सेकंड के लिए 33 डिग्री सेल्सियस, 30 सेकंड के लिए 65 डिग्री सेल्सियस, 40 सेकंड के लिए 72 डिग्री सेल्सियस, 10 सेकंड के लिए 95 डिग्री सेल्सियस और 10 सेकंड के लिए 63 डिग्री सेल्सियस; और 4 डिग्री सेल्सियस पर पकड़ो।
- सेटअप स्क्रीन दर्ज करने के लिए Pre_Lib चिह्न क्लिक करें।
- नियंत्रण मोड के लिए ट्यूब का चयन करें; नमूना मात्रा के लिए इनपुट 70 μL; गर्म ढक्कन नियंत्रण के लिए चुनें और तापमान के लिए 105 डिग्री सेल्सियस दर्ज करें। पहले सेग पर विराम के लिए नहीं का चयन करें। आगे बढ़ने के लिए ठीक क्लिक करें.
- बने रहने का समय शो तक प्रतीक्षा करें ---, जो प्रोग्राम के अंत को इंगित करता है, और प्रोग्राम को समाप्त करने के लिए स्टॉप पर क्लिक करें।
- प्रक्रिया पूरी होने पर प्रोग्राम को रोक दें। तुरंत अगले चरण पर जाएं।
- पुस्तकालय की तैयारी
- लाइब्रेरी बफर को आरटी में पिघलाएं। पाइपिंग और सेंट्रीफ्यूज द्वारा अच्छी तरह से मिलाएं और 200 x g पर 2-3 सेकंड के लिए तुरंत सेंट्रीफ्यूज करें।
- लाइब्रेरी प्रतिक्रिया के लिए एक मास्टर मिश्रण निम्नानुसार तैयार करें: लाइब्रेरी बफर के 60 μL में लाइब्रेरी एंजाइम मिक्स के 1.6 μL जोड़ें, प्रतिक्रिया को अच्छी तरह से मिलाएं और संक्षेप में सेंट्रीफ्यूज करें।
- चरण 3.2.3 से प्रत्येक प्रीलाइब्रेरी उत्पाद में 60 μL लाइब्रेरी प्रतिक्रिया मिश्रण और 2 μL बारकोड प्राइमर जोड़ें। प्रतिक्रिया को अच्छी तरह से मिलाएं और संक्षेप में सेंट्रीफ्यूज करें।
- थर्मल साइकलर में चरण 3.2.3 से पीसीआर ट्यूब (ओं) को रखें और लाइब्रेरी तैयारी कार्यक्रम निम्नानुसार चलाएं: 30 सेकंड के लिए 94 डिग्री सेल्सियस; 25 सेकंड के लिए 94 डिग्री सेल्सियस के 17 चक्र, 30 सेकंड के लिए 62 डिग्री सेल्सियस और 45 सेकंड के लिए 72 डिग्री सेल्सियस; और फिर 4 डिग्री सेल्सियस पर पकड़ो।
- सेटअप स्क्रीन दर्ज करने के लिए Lib_Prep चिह्न क्लिक करें।
- नियंत्रण मोड के लिए ट्यूब का चयन करें; नमूना मात्रा के लिए इनपुट 130 μL; हॉटलिड नियंत्रण के लिए चुनें और संबंधित तापमान के लिए 105 डिग्री सेल्सियस दर्ज करें। पहले सेग पर विराम के लिए नहीं का चयन करें। आगे बढ़ने के लिए ठीक क्लिक करें.
- बने रहने का समय शो तक प्रतीक्षा करें ---, जो प्रोग्राम के अंत को इंगित करता है, और प्रोग्राम को समाप्त करने के लिए स्टॉप पर क्लिक करें।
- पुस्तकालय शुद्धिकरण
- शुद्धिकरण चरण से पहले कम से कम 20 मिनट के लिए 2-8 डिग्री सेल्सियस पर भंडारण से मैग्बीड्स को हटा दें। भंवर करें और 20 सेकंड के लिए मैग्बीड्स को मिलाएं। शुद्धिकरण चरण के लिए पर्याप्त मोती एक नए 1.5 एमएल माइक्रोसेंट्रीफ्यूज ट्यूब में डालें और आरटी के लिए गर्म मोती डालें।
- प्रत्येक लाइब्रेरी में 1x Magbeds जोड़ें। ऊपर और नीचे ≥10 बार पाइप करके मिलाएं और 5 मिनट के लिए आरटी पर इनक्यूबेट करें।
नोट: उदाहरण के लिए, 100 μL लाइब्रेरी नमूने में 100 μL Magbeads जोड़ें। - इनक्यूबेशन के बाद, ट्यूब को संक्षेप में सेंट्रीफ्यूज करें और एक चुंबकीय स्टैंड पर रखें।
- समाधान स्पष्ट होने तक लगभग 5 मिनट तक प्रतीक्षा करें। ट्यूब को चुंबकीय स्टैंड पर रखते समय, घोल को ध्यान से एस्पिरेट करें और फेंक दें।
- ट्यूब में ताजा तैयार 80% इथेनॉल के 200 μL जोड़ें। 30 सेकंड के लिए आरटी पर इनक्यूबेट करें और सुपरनैटेंट को सावधानीपूर्वक हटा दें। एक बार और दोहराएं।
- इथेनॉल को यथासंभव पूरी तरह से हटा दें। आरटी पर लगभग 5-10 मिनट के लिए चुंबकीय स्टैंड पर मोतियों को हवा में सुखाएं।
- चुंबकीय स्टैंड से ट्यूब को हटा दें, 17.5 μL क्षालन बफर जोड़ें, और मोतियों को फिर से निलंबित करने के लिए ट्यूब को भंवर करें। ट्यूब को संक्षेप में सेंट्रीफ्यूज करें और 5 मिनट के लिए आरटी पर इनक्यूबेट करें।
- ट्यूब को चुंबकीय स्टैंड पर रखें और समाधान स्पष्ट होने तक प्रतीक्षा करें। ध्यान से 15 μL सुपरनैटेंट को एक नई ट्यूब में स्थानांतरित करें।
- पुस्तकालय का परिमाणीकरण
- क्यूबिट डीएसडीएनए एचएस परख किट28 के उपयोगकर्ता गाइड के अनुसार फ्लोरोमीटर का उपयोग करके शुद्ध पुस्तकालयों की मात्रा निर्धारित करें। पुस्तकालयों की उपज ~ 15 से 300 एनजी तक होती है।
- लाइब्रेरी पूलिंग
- पूलिंग के लिए प्रत्येक पुस्तकालय नमूने के 10 नैनोग्राम का उपयोग करें।
- अनुक्रमण
- अनुक्रमण उपयोगकर्ता गाइड (15027617 v01)29 देखें।
- प्लेटफ़ॉर्म पर एक छोर पर 50 बीपी के शुद्ध पुस्तकालय अनुक्रमों ने प्रत्येक नमूने के लिए लगभग 2 मिलियन रीड प्राप्त किए, और 0.03 × अनुक्रमण गहराई की सिफारिश की गई।
- डेटा विश्लेषण
- लॉगिन पृष्ठ में उपयोगकर्ता ओं का नाम और पासवर्ड दर्ज करें
- सिस्टम में लॉग इन करने के बाद, विश्लेषण पर क्लिक करें और एक नया पृष्ठ दिखाई देगा। NICS-A टैब के अंतर्गत सबमिशन बनाएँ क्लिक करें. फिर, प्लेटफ़ॉर्म के लिए एनजीएस चुनें, निगम का चयन करें, अभिकर्मक के लिए एनआईसी एसआईंस्ट चुनें, प्रोजेक्ट आईडी के तहत बॉक्स में प्रोजेक्ट जानकारी दर्ज करें, विश्लेषण प्राथमिकताएं सेट करें और फाइलें अपलोड करें। एक बार सभी अनुक्रमण फ़ाइलें सफलतापूर्वक अपलोड हो जाने के बाद, विश्लेषण प्रारंभ करने के लिए सबमिट करें क्लिक करें (चित्रा 3A).
- सबमिट की गई परियोजनाओं की सूची दिखाने के लिए सबमिशन देखें क्लिक करें. एक बार विश्लेषण पूरा हो जाने के बाद, एक प्रोजेक्ट की स्थिति पूरी हो जाएगी और रिपोर्ट फ़ील्ड में एक शो बटन दिखाई देगा। NICS विश्लेषण की सारांश तालिका देखने के लिए दिखाएँ बटन क्लिक करें (चित्रा 3B).
- रिपोर्ट सहेजने के लिए रिपोर्ट निर्यात करें बटन क्लिक करें (चित्र 3C).
नोट: प्रत्येक विश्लेषण के लिए तीन प्रकार की फ़ाइलों का निर्यात किया जाएगा। एक ग्राफिक फ़ाइल जिसमें प्रत्येक गुणसूत्र और पूरे जीनोम के लिए सभी कॉपी नंबर वेरिएशन (सीएनवी) प्लॉट शामिल हैं, जिसे "ग्राफ" फ़ोल्डर के तहत संग्रहीत किया जाएगा; एक स्प्रेडशीट जिसमें इस विश्लेषण रन का नमूना क्यूसी विवरण शामिल है; एक दस्तावेज़ फ़ाइल जिसमें उपयोगकर्ता द्वारा अनुकूलित NICS रिपोर्ट शामिल हैं; और एक स्प्रेडशीट जिसमें इस विश्लेषण की नमूना सारांश जानकारी शामिल है।
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
वर्तमान अध्ययन ने एक रोगी के लिए प्रस्तावित विधि को लागू किया। एनआईसीएस विश्लेषण के आवेदन से पहले आईआरबी अनुमोदन और सूचित सहमति प्राप्त की गई थी। वर्तमान अध्ययन ने रोगियों से 6 ब्लास्टोसिस्ट प्राप्त किए और दिन 4 से दिन 5 मध्यम पर सभी 6 भ्रूणों पर एनआईसीएस का प्रदर्शन किया। माता-पिता के संतुलित स्थानांतरण के कारण क्रोमोसोम असामान्यताओं का पता एनआईसीएस परख के साथ पांच गुणसूत्रों में लगाया गया था; इसलिए, उन्हें स्थानांतरण के लिए उपयोग नहीं किया जा सकता है (चित्रा 4 ए-ई)। दो भ्रूणों के एनआईसीएस परिणामों ने एक ही कैरियोटाइप 45 दिखाया, और एक्सएन और -18 (×1) दोनों क्रोमोसोम 18 विलोपन (चित्रा 4 ए, बी) थे। कैरियोटाइप 46, एक्सएन, -1 पी (पीटीईआर→पी 21.1, ×1) क्रोमोसोम 1 पीटीईआर→पी 21.1 क्षेत्र विलोपन (चित्रा 4 डी) का केवल छोटा हाथ है।
एनआईसीएस के परिणामों ने कैरियोटाइप 46, एक्सएन, +1पी (पीटर→पी21.2, ×3), और -18 (क्यू21.32→क्यूटर, ×1) दिखाया, जो दर्शाता है कि क्रोमोसोम 18 क्यू 21.32→क्यूटर क्षेत्र विलोपन और क्रोमोसोम 1 पीटीईआर→पी 21.2 क्षेत्र की छोटी बांह दोनों डुप्लिकेट थे (चित्रा 4 ई)। यद्यपि कैरियोटाइप 46, एक्सएन, +5 क्यू (×4), और -8 (×1, एमओएस) क्रोमोसोम 5 दोहराव हैं और 8 मोज़ेक अंतर दिखाते हैं, एनआईसीएस परख एन्यूप्लोइडी के लिए सभी 24 गुणसूत्रों को स्क्रीन कर सकती है। यह प्रक्रिया एकल सामान्य कैरियोटाइप ब्लास्टोसिस्ट को स्थानांतरित करने के लिए एक नई विधि प्रदान करती है।

चित्र 1. क्यूमुलस कोशिकाओं को हटाने की पूर्णता। (ए) क्यूमुलस कोशिकाओं के साथ अंडाणु। (बी) क्यूमुलस कोशिकाओं के बिना अंडाणु। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.

चित्र 2. बीएम में स्थानांतरित होने से पहले डी 3 पर एक भ्रूण से क्यूमुलस कोशिकाओं को हटा दिया जाता है। प्रारंभिक दरार भ्रूण कल्चर मीडियम प्लेट से ब्लास्टोसिस्ट कल्चर मीडियम प्लेट में माध्यम परिवर्तन से पहले सभी संलग्न क्यूमुलस कोशिकाओं को हटा दिया जाना चाहिए, जो भ्रूण के 8-सेल चरण तक पहुंचने के बाद दिन 3 पर होता है। कोई भी क्यूमुलस कोशिकाएं जिन्हें हटाया नहीं जाता है, वे गलत नकारात्मक परिणाम देने वाले अंतिम विश्लेषण में हस्तक्षेप करेंगी। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.

चित्र 3. डेटा विश्लेषण. (ए) उपयोगकर्ता एप्लिकेशन के लिए विभिन्न विकल्प हैं। अनुक्रमण मंच निगम के लिए, उपयोगकर्ता इलुमिना, आयन टोरेंट या एमजीआई चुन सकते हैं। उपयोगकर्ता चुन सकते हैं कि लिंग जानकारी रिपोर्ट की गई है या नहीं। उपरोक्त पैरामीटर सेटिंग समाप्त हो गई, फ़ाइल अपलोड के तहत बॉक्स पर क्लिक करें और अपलोड करने के लिए उपयुक्त अनुक्रमण फ़ाइलें चुनें। Illumina के लिए, fastq.gz के एक्सटेंशन के साथ फ़ाइलें चुनें। सफलतापूर्वक अपलोड करने के बाद विश्लेषण प्रारंभ करने के लिए सबमिट करें क्लिक करें. (बी) सारांश तालिका का दृश्य। सारांश तालिका में निम्नलिखित जानकारी होती है: नमूना नाम: प्रत्येक NICS नमूने का नाम सूचीबद्ध है; डेटा क्यूसी: इंगित करता है कि अनुक्रमण फ़ाइल एनआईसीएस विश्लेषण के लिए क्यूसी पास करती है या नहीं; एआई रेटिंग: प्रत्येक एनआईसीएस नमूने के लिए रेटिंग (ए, बी या सी); AI_Rating व्याख्या: भ्रूण आरोपण क्षमता का मूल्यांकन; एआई ग्रेडिंग: प्रत्येक एनआईसीएस नमूने के लिए स्कोर; सीएनवी प्लॉट (संपूर्ण जीनोम): सभी गुणसूत्रों के सीएनवी प्रोफाइल देखें; (ग) रिपोर्ट सहेजें पृष्ठ. परिणामों के सारांश के बगल में रिपोर्ट निर्यात करें बटन क्लिक करें. उस जानकारी का चयन करें जिसे आप अंतिम रिपोर्ट पर दिखाना चाहते हैं और निर्यात करें क्लिक करें. रिपोर्ट्स आपके कंप्यूटर के डाउनलोड फ़ोल्डर में सहेजी जाएँगी. कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.

चित्र 4. एक रोगी से एनआईसीएस का उपयोग करके भ्रूण स्क्रीनिंग और चयन। ब्लास्टोसिस्ट चरण में कुल छह भ्रूण सफलतापूर्वक विकसित किए गए, और प्रत्येक भ्रूण से डे 4-डे 5 कल्चर माध्यम एनआईसीएस परख के लिए एकत्र किया गया था। (ए) और (बी) दो ब्लास्टोसिस्ट भ्रूणों के एनआईसीएस परिणाम हैं जो एक ही कैरियोटाइप 45, एक्सएन, -18 (×1) दोनों क्रोमोसोम 18 विलोपन हैं। (सी) ने दिखाया कि कैरियोटाइप 46, एक्सएन, +5 क्यू (×4), -8 (×1, एमओएस) क्रोमोसोम 5 दोहराव और 8 मोज़ेक है। (डी) ने दिखाया कि कैरियोटाइप 46, एक्सएन, -1 पी (पीटर→पी 21.1, ×1) क्रोमोसोम 1 पीटीईआर→पी 21.1 क्षेत्र विलोपन की केवल छोटी भुजा है, जबकि (ई) ने कैरियोटाइप 46, एक्सएन, +1 पी (पीटी→पी 21.2, ×3), -18 (क्यू 21.32→क्यूटर, ×1) क्रोमोसोम 1 की छोटी भुजा →→ है। x अक्ष का अर्थ है लाल और नीले रंग में 22 ऑटोसोम, y अक्ष प्रत्येक ऑटोसोम की प्रतिलिपि संख्या को इंगित करता है। ग्रे डॉट्स कॉपी नंबर प्रतिक्रिया का शासक पैमाना है, प्रत्येक बिन विंडो और कॉपी नंबर का सामान्य कैरियोटाइप 2 होना चाहिए। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
तालिका एस 1। डीएनए डिटेक्शन विकल्प 1 और विकल्प 2 की सफलता दर। कृपया इस तालिका को डाउनलोड करने के लिए यहाँ क्लिक करें।
तालिका S2. विभिन्न विकल्पों में एनआईसीएस और पीजीटी-ए के बीच सामंजस्य। कृपया इस तालिका को डाउनलोड करने के लिए यहाँ क्लिक करें।
Subscription Required. Please recommend JoVE to your librarian.
Discussion
संशोधन और समस्या निवारण
यदि एनआईसीएस के परिणाम माता-पिता की आनुवंशिक सामग्री से दूषित हैं, तो सुनिश्चित करें कि सभी क्यूमुलस-कोरोना रेडिएटा कोशिकाओं को हटा दिया गया है और सुनिश्चित करें कि निषेचन के लिए आईसीएसआई किया जाता है। अनुचित माध्यम भंडारण या टेम्पलेट तैयारी प्रक्रियाओं से बचा जाता है, जो डीएनए को नीचा दिखा सकता है। काम करने की जगह को DNase और RNase परिशोधन अभिकर्मकों के साथ अच्छी तरह से शुद्ध किया गया था। अन्य भ्रूणों से संदूषण से बचने के लिए, एक भ्रूण को हमेशा माध्यम की एक बूंद में सुसंस्कृत किया जाता था ताकि 4 दिन से शुरू होने वाले क्रॉस-संदूषण से बचा जा सके। संदूषण की घटना को कम किया जाता है जब अंतिम संस्कृति में भ्रूण के प्लेसमेंट में देरी होती है30,31,32,33। मातृ संदूषण को कम करने के लिए, कुज्नेत्सोव34 ने भ्रूण संवर्धन प्रक्रियाओं को दिन 0 से दिन 4 तक संशोधित किया, जिसमें पाइपिंग और फ्लशिंग द्वारा अवशिष्ट कोरोना कोशिकाओं को सावधानीपूर्वक हटाना शामिल था।
लेन एट अल .30 से पता चलता है कि जब भ्रूण संस्कृति माध्यम को दिन 4 से दिन 5 तक लिया जाता है, तो यूप्लोइडी का पता लगाने की सटीकता में सुधार होता है, भ्रूण प्लोइडी स्थिरता 95% से अधिक होती है, और सेक्स क्रोमोसोम की स्थिरता 100% तक पहुंच जाती है। लेडो एट अल .33 ने पाया कि दिन 3-दिवसीय 5 संस्कृति माध्यम और टीई नमूनों के बीच संयोग दर 74.6% और 92.0% थी जब भ्रूण को दिन 4 से दिन 6 तक संवर्धित किया गया था।
हमारा आंतरिक डेटा भी इस निष्कर्ष का समर्थन करता है, जैसा कि तालिका एस 1 में दिखाया गया है। पारंपरिक दिन 3-दिवसीय 5 संस्कृति विधि की तुलना में, ग्रैनुलोसा कोशिकाओं को दिन 4 या दिन 5 पर संस्कृति माध्यम में एक और बदलाव के कारण हटा दिया गया था। हम आंतरिक डेटा (तालिका एस 1) प्रदान करते हैं जो दिखाते हैं कि हमारे दो तरीकों (विकल्प 1 और विकल्प 2) में पीजीटी-ए की तुलना में अच्छी स्थिरता है, जो सीसी को पूरी तरह से हटाने के बिना नमूना विधि से बेहतर है।
आईएफ-प्रवर्धित उत्पाद नकारात्मक नियंत्रण में दिखाई दिए, और बाहरी डीएनए सामग्री ने अभिकर्मक या कार्य स्थान को दूषित कर दिया होगा। कार्यक्षेत्र को डीएनए / आरएनए हटाने वाले अभिकर्मकों द्वारा साफ किया जाना चाहिए, न्यूक्लियस-मुक्त सामग्री का उपयोग किया जाना चाहिए, और अभिकर्मकों को पहले उपयोग के बाद अलाइकोट किया जाना चाहिए।
विकल्प 1 और विकल्प 2 के बीच सफलता दर में अंतर तालिका एस 1 और तालिका एस 2 में चर्चा की गई है।
एनआईसीएस परख की सीमाएं
एनआईसीएस की दो मुख्य सीमाएं हैं। 1) आईसीएसआई से पहले, सभी क्यूमुलस कोशिकाओं (आमतौर पर मातृ उत्पत्ति, आमतौर पर सामान्य गुणसूत्र संरचना) को हटा दिया जाना चाहिए। यदि निष्कासन अधूरा है, तो क्यूमुलस कोशिकाएं भ्रूण के विकास के दौरान डीएनए जारी कर सकती हैं और बाहरी डीएनए प्रवर्धित होता है, जो गलत नकारात्मक पहचान का कारण हो सकता है। 2) ज़ोना पेलुसीडा से जुड़े शुक्राणु को निकालना मुश्किल है, और एनआईसीएस प्रक्रिया को आईसीएसआई के साथ करने की अत्यधिक सिफारिश की जाती है। हालांकि तीसरे दिन क्लीवेज मीडिया के नियमित प्रतिस्थापन से क्यूमुलस कोशिकाओं और अनावश्यक शुक्राणु के कारण संदूषण की संभावना कम हो सकती है, लेकिन यदि एनआईसीएस का उपयोग नैदानिक आईवीएफ में किया जाता है तो इस संदूषण को कम किया जाना चाहिए। हालांकि, आईवीएफ भ्रूण में एनआईसीएस का पता लगाने के लिए एक विधि विकसित की गई है, जिसमें बहिर्जात डीएनए को पहचानने का कार्य शामिल है, जिसे निकट भविष्य में प्रदर्शित किया जाएगा।
इस अध्ययन ने विभिन्न मीडिया के बीच अंतर की तुलना नहीं की क्योंकि बड़े पैमाने पर नैदानिक परीक्षणों ने संस्कृति मीडिया की तुलना की है। आठ केंद्रों ने 4 अलग-अलग संस्कृति मीडिया, अनुक्रमिक और निरंतर, और एल्बुमिन पूरकता के 2 अलग-अलग प्रतिशत (5% और 10%) का उपयोग किया, और इन अंतरों का भ्रूण सीएफडीएनएपरिणामों की सटीकता पर महत्वपूर्ण प्रभाव नहीं पड़ा। ये निष्कर्ष विशिष्ट प्रोटोकॉल के तहत काम करते समय प्रत्येक आईवीएफ प्रयोगशाला में भ्रूण सीएफडीएनए विश्लेषण की संभावित प्रयोज्यता का समर्थन करते हैं।
मौजूदा विधियों के संबंध में महत्व
एनआईसीएस विधि भ्रूण बायोप्सी से बचती है और इस प्रकार उपयोग की सुरक्षा में काफी सुधार करती है। ब्लास्टोसिस्ट की तुलना में, एनआईसीएस एक सरल, समय की बचत, संवेदनशील और प्रतिलिपि प्रस्तुत करने योग्य प्रीइम्प्लांटेशन स्क्रीनिंग तकनीक है जो एन्यूप्लोइडी की उच्च संभावना के साथ सहायक प्रजनन आबादी के लिए उपयुक्त है। इनवेसिव बायोप्सी के विपरीत, जिसे ब्लास्टोसिस्ट बायोप्सी प्रक्रिया के लिए काफी और पेशेवर ज्ञान की आवश्यकता होती है, एनआईसीएस को बड़े पैमाने पर लागू किया जा सकता है क्योंकि खर्च किए गए माध्यम का इसका सरल संग्रह केवल आईवीएफ19 के नियमित संचालन का पालन करता है और इसे कुछ देशों में पीजीएस / पीजीडी योग्यता की आवश्यकता नहीं होती है।
भविष्य के अनुप्रयोग
एनआईसीएस में नैदानिक आईवीएफ में क्रोमोसोम स्क्रीनिंग के लिए व्यापक प्रयोज्यता की क्षमता है, न केवल आईसीएसआई के लिए बल्कि आईवीएफ भ्रूण के लिए भी। यद्यपि आईसीएसआई की अत्यधिक सिफारिश की जाती है, शुक्राणु के प्रभाव को रोकने के लिए ज़ोना पेलुसीडा से जुड़े शुक्राणु को हटाने के तरीकों की आवश्यकता होती है।
रूपात्मक मूल्यांकन भ्रूण मूल्यांकन के लिए एक पारंपरिक विधि है, लेकिन ज्यादातर मामलों में, क्रोमोसोमल रूप से असामान्य भ्रूण क्रोमोसोमल रूप से सामान्य (यूप्लोइड) भ्रूण के समान रूपात्मक रूप से दिखाई दे सकते हैं। गर्भाशय में अच्छी आकृति विज्ञान के साथ प्लॉइड भ्रूण को स्थानांतरित करते समय एनआईसीएस परख के साथ रूपात्मक मूल्यांकन के संयोजन से चल रही गर्भावस्था दर और जीवित जन्म दर में सुधार हो सकता है। एनआईसीएस प्रौद्योगिकी का उपयोग करके एकल भ्रूण हस्तांतरण की नैदानिक प्रभावकारिता का मूल्यांकन करने के लिए एक यादृच्छिक नैदानिक परीक्षण आयोजित किया जाएगा।
प्रोटोकॉल में महत्वपूर्ण कदम
निषेचन से पहले सभी क्यूमुलस-कोरोना रेडिएटा कोशिकाओं को अंडाणुओं से हटा दिया जाना चाहिए। अंडाणुओं को इंट्रासाइटोप्लाज्मिक स्पर्म इंजेक्शन (आईसीएसआई) द्वारा निषेचित किया गया था। संस्कृति माध्यम में मानव-व्युत्पन्न प्रोटीन / पूरक जोड़ने से बचा गया था। कल्चर माध्यम को 4 वें दिन बदल दिया गया था और 5-दिन 6 पर एकत्र किया गया था जब ब्लास्टोसिस्ट पूरी तरह से विस्तारित हो गए थे। भ्रूण को चौथे दिन से शुरू होने वाले संस्कृति माध्यम की व्यक्तिगत बूंदों में सुसंस्कृत किया गया था। संस्कृति माध्यम एकत्र करते समय, संदूषण से बचने के लिए नमूनों के बीच स्थानांतरण पिपेट बदल दिए गए थे।
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
याक्सिन याओ, जिलियांग मा, जिंग वांग और सिजिया लू यिकॉन जीनोमिक्स कं, लिमिटेड के कर्मचारी हैं।
Acknowledgments
लेखक एनजीएस डेटा विश्लेषण में उनकी सहायता के लिए शिपिंग बो और शुजी मा को धन्यवाद देना चाहते हैं। फंडिंग: यह काम राष्ट्रीय कुंजी अनुसंधान और विकास कार्यक्रम (अनुदान संख्या 2018वाईएफसी 1003100) द्वारा समर्थित था।
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL EP tube, 0.2 mL PCR tube | Axygen | MCT-150-C, PCR-02-C | DNase/RNase free, Low Binding PCR tubes and 1.5 mL micro-centrifuge tubes are recommended. |
| 10 µL, 200 µL, 1000 µL DNase /RNase Free Tips | Axygen | T-300-R-S, T-200-Y-R-S, T-1000-B-R-S | This can be replaced by other brand/For sample transfer |
| 100 % ethanol | Sinopharm Chemical | 10009218 | This can be replaced by other brand/For DNA library purification |
| Barcode Primer1-48 | Yikon Genomics | Reagent in NICSInst library preparation kit | For library amplificaton |
| BD Falcon Organ Culture Dish, Sterile | BD Bioscience | 363037 | This can be replaced by other brand/For embryo culture |
| BD Falcon Tissue culture Dishes (Easy Grip) , Sterile | BD Bioscience | 353001 | This can be replaced by other brand/For embryo culture |
| BD Falcon Tissue culture Dishes, Sterile | BD Bioscience | 353002 | This can be replaced by other brand/For embryo culture |
| Cell Lysis Buffer | Yikon Genomics | Reagent in NICSInst library preparation kit | For culture medium pre-treatment |
| Cell Lysis Enzyme | Yikon Genomics | Reagent in NICSInst library preparation kit | For culture medium pre-treatment |
| ChromGo software | Yikon Genomics | Data analysis | |
| CMPure Magbeads | Yikon Genomics | Reagent in NICSInst library preparation kit | For library purification |
| Cryotop open systerm | KITAZATO BioPharma | 81110 | This can be replaced by other brand/For embryo vitrification |
| Distill water | Yikon Genomics | Reagent in NICSInst library preparation kit | To dissolve DNA |
| ES (Vitrification kit) | KITAZATO BioPharma | Reagent inVitrification kit | This can be replaced by other brand/For embryo vitrification |
| HOLDNIG | ORIGIO | MPH-MED-35 | This can be replaced by other brand/For ICSI |
| Hyaluronidase solution, 80 U/mL | SAGE | ART4007-A | This can be replaced by other brand/Digest oocyte-corona-cumulus complex |
| ICSI | ORIGIO | MPH-35-35 | This can be replaced by other brand/For ICSI |
| Illumina MiSeq® System | Illumina | SY-410-1001 | For library sequencing |
| Incubator | Labotect | Inkubator C16 | This can be replaced by other brand/For embryo culture |
| Library buffer | Yikon Genomics | Reagent in NICSInst library preparation kit | For library amplificaton |
| Library Enzyme Mix | Yikon Genomics | Reagent in NICSInst library preparation kit | For library amplificaton |
| Magnetic Stand | DynaMagTM-2 | 12321D | For library purification |
| Microscope | OLYMPUS | 1X71 | This can be replaced by other brand/For embryo observation |
| Mini-centrifuge | ESSENSCIEN | ELF6 | For separation |
| MT Enzyme Mix | Yikon Genomics | Reagent in NICSInst library preparation kit | For culture medium pre-treatment |
| NICSInst library preparation kit | Yikon Genomics | KT1000800324 | Whole genome amplification and library construction |
| NICSInst Sample Prep Station | Yikon Genomics | ME1001003 | Amplificate DNA |
| Nunc IVF 4-Well Dish | Thermo Scientific | 144444 | This can be replaced by other brand/For embryo washing and blastocyst culture |
| Pasteur Pipette | Oirgio | MXL3-IND-135 | This can be replaced by other brand/For embryo tansfer |
| Pasteur pipettes | ORIGIO | PP-9-1000 | This can be replaced by other brand/For IVF laboratory |
| Pre-Lib Buffer | Yikon Genomics | Reagent in NICSInst library preparation kit | Pre-library preparation |
| Pre-Lib Enzyme | Yikon Genomics | Reagent in NICSInst library preparation kit | Pre-library preparation |
| Qubit® 3.0 Fluorometer | Thermo Scientific | Q33216 | For library quantification |
| Quinn's Advantage Blastocyst Medium | SAGE | ART-1029 | For embryo blastocyst stage culture |
| Quinn's Advantage Cleavage Medium | SAGE | ART-1026 | This can be replaced by other brand/For embryo cleavage stage culture |
| Quinn's Advantage Fertilization Medium | SAGE | ART-1020 | This can be replaced by other brand/For oocyte and sperm fertilization |
| Quinn's Advantage m-HTF Medium with HEPES | SAGE | ART-1023 | This can be replaced by other brand/For embryo clutrure |
| Quinn's Advantage SPS Serum protein Substitute Kit | SAGE | ART-3010 | This can be replaced by other brand/To denude the oocyte |
| Quinn's Advantage Tissue culture mineral oil | SAGE | ART-4008P | This can be replaced by other brand/To cover the culture medium |
| STRIPPER TIPS | ORIGIO | MXL3-IND-135 | This can be replaced by other brand/For denudating granulosa cells |
| Vitrification Cryotop Open systerm | KIZTAZATO | 81111 | This can be replaced by other brand/For embryo vitrification |
| Vitrification kit | KITAZATO BioPharma | VT101 | This can be replaced by other brand/For embryo vitrification |
| Vortexer | Qilinbeier | DNYS8 | Sample mix |
| VS (Vitrification kit) | KITAZATO BioPharma | Reagent inVitrification kit | This can be replaced by other brand/For embryo vitrification |
| ZILOS-tk Laser System | Hamilton Thorne | CLASS 1 laser | This can be replaced by other brand/For artificial blastocoele collapse |
References
- Barlow, P. Early pregnancy loss and obstetrical risk after in-vitro fertilization and embryo replacement. Human Reproduction. 3 (5), 671-675 (1988).
- Munne, S. Chromosome abnormalities and their relationship to morphology and development of human embryos. Reproductive BioMedicine Online. 12 (2), 234-253 (2006).
- Harton, G. L. Diminished effect of maternal age on implantation after preimplantation genetic diagnosis with array comparative genomic hybridization. Fertility and Sterility. 100 (6), 1695-1703 (2013).
- Hodes-Wertz, B. Idiopathic recurrent miscarriage is caused mostly by aneuploid embryos. Fertility and Sterility. 98 (3), 675-680 (2012).
- Keltz, M. D. Preimplantation genetic screening (PGS) with Comparative genomic hybridization (CGH) following day 3 single cell blastomere biopsy markedly improves IVF outcomes while lowering multiple pregnancies and miscarriages. Journal of Assisted Reproduction and Genetics. 30 (10), 1333-1339 (2013).
- Scott, R. T. Jr Blastocyst biopsy with comprehensive chromosome screening and fresh embryo transfer significantly increases in vitro fertilization implantation and delivery rates: a randomized controlled trial. Fertility and Sterility. 100 (3), 697-703 (2013).
- Forman, E. J. In vitro fertilization with single euploid blastocyst transfer: a randomized controlled trial. Fertility and Sterility. 100 (1), 100-107 (2013).
- Yang, Z. Selection of single blastocysts for fresh transfer via standard morphology assessment alone and with array CGH for good prognosis IVF patients: results from a randomized pilot study. Molecular Cytogenetics. 5 (1), 24 (2012).
- Cimadomo, D. The Impact of Biopsy on Human Embryo Developmental Potential during Preimplantation Genetic Diagnosis. BioMed Research International. 2016, 7193075 (2016).
- Scott, R. T. Jr, Upham, K. M., Forman, E. J., Zhao, T., Treff, N. R. Cleavage-stage biopsy significantly impairs human embryonic implantation potential while blastocyst biopsy does not: a randomized and paired clinical trial. Fertility and Sterility. 100 (3), 624-630 (2013).
- Wu, Y. Blastomere biopsy influences epigenetic reprogramming during early embryo development, which impacts neural development and function in resulting mice. Cellular and Molecular Life Sciences. 71 (9), 1761-1774 (2014).
- Zhao, H. C. Aberrant epigenetic modification in murine brain tissues of offspring from preimplantation genetic diagnosis blastomere biopsies. Biology of Reproduction. 89 (5), 117 (2013).
- Zeng, Y. Preimplantation genetic diagnosis (PGD) influences adrenal development and response to cold stress in resulting mice. Cell and Tissue Research. 354 (3), 729-741 (2013).
- Palini, S. Genomic DNA in human blastocoele fluid. Reproductive BioMedicine Online. 26 (6), 603-610 (2013).
- Gianaroli, L. Blastocentesis: a source of DNA for preimplantation genetic testing. Results from a pilot study. Fertility and Sterility. 102 (6), 1692-1699 (2014).
- Stigliani, S., Anserini, P., Venturini, P. L., Scaruffi, P. Mitochondrial DNA content in embryo culture medium is significantly associated with human embryo fragmentation. Human Reproduction. 28 (10), 2652-2660 (2013).
- Stigliani, S. Mitochondrial DNA in Day 3 embryo culture medium is a novel, non-invasive biomarker of blastocyst potential and implantation outcome. Molecular Human Reproduction. 20 (12), 1238-1246 (2014).
- Wu, H. Medium-Based Noninvasive Preimplantation Genetic Diagnosis for Human α-Thalassemias-SEA. Medicine. 94 (12), e669 (2015).
- Xu, J. Noninvasive chromosome screening of human embryos by genome sequencing of embryo culture medium for in vitro fertilization. Proceedings of the National Academy of Sciences. 113 (42), 11907-11912 (2016).
- Capalbo, A. Diagnostic efficacy of blastocoel fluid and spent media as sources of DNA for preimplantation genetic testing in standard clinical conditions. Fertility and Sterility. 110 (5), 870-879 (2018).
- Tobler, K. J. Blastocoel fluid from differentiated blastocysts harbors embryonic genomic material capable of a whole-genome deoxyribonucleic acid amplification and comprehensive chromosome microarray analysis. Fertility and Sterility. 104 (2), 418-425 (2015).
- Magli, M. C. Preimplantation genetic testing: polar bodies, blastomeres, trophectoderm cells, or blastocoelic fluid? Fertility and Sterility. 105 (3), 676-683 (2016).
- Kuznyetsov, V. Evaluation of a novel non-invasive preimplantation genetic screening approach. PLoS One. 13 (5), e0197262 (2018).
- Li, P. Preimplantation Genetic Screening with Spent Culture Medium/Blastocoel Fluid for in Vitro Fertilization. Scientific Reports. 8 (1), 9275 (2018).
- Jiao, J. Minimally invasive preimplantation genetic testing using blastocyst culture medium. Human Reproduction. 34 (7), 1369-1379 (2019).
- Palermo, G. D. Births after intracytoplasmic injection of sperm obtained by testicular extraction from men with nonmosaic Klinefelter's syndrome. New England Journal of Medicine. 338 (9), 588-590 (1998).
- Alpha Scientists in Reproductive, M., & Embryology, E. S. I. G. o. The Istanbul consensus workshop on embryo assessment: proceedings of an expert meeting. Human Reproduction. 26 (6), 1270-1283 (2011).
- Thermo Fisher Scientific. Qubit dsDNA HS Assay Kit. , Available from: https://www.thermofisher.com/order/catalog/product/Q32851?ICID=search-product (2015).
- Miseq system use guide. , Available from: https://support.illumina.com/downloads/miseq_system user _ guide 15027617.html (2016).
- Lane, M. Ability to detect aneuploidy from cell free DNA collected from media is dependent on the stage of development of the embryo. Fertility and Sterility. 108 (3), (2017).
- Rubio, C. Multicenter prospective study of concordance between embryonic cell-free DNA and trophectoderm biopsies from 1301 human blastocysts. American Journal of Obstetrics and Gynecology. 223 (5), 751-751 (2020).
- Rubio, C. Embryonic cell-free DNA versus trophectoderm biopsy for aneuploidy testing: concordance rate and clinical implications. Fertility and Sterility. 112 (3), 510-519 (2019).
- Lledo, B. Consistent results of non-invasive PGT-A of human embryos using two different techniques for chromosomal analysis. Reproductive BioMedicine Online. 42 (3), 555-563 (2021).
- Kuznyetsov, V. Minimally Invasive Cell-Free Human Embryo Aneuploidy Testing (miPGT-A) Utilizing Combined Spent Embryo Culture Medium and Blastocoel Fluid -Towards Development of a Clinical Assay. Scientific Reports. 10 (1), 7244 (2020).
Tags
क्रोमोसोम स्क्रीनिंग मानव प्रीइम्प्लांटेशन भ्रूण खर्च कल्चर माध्यम नमूना संग्रह क्रोमोसोमल प्लोइडी विश्लेषण इन विट्रो फर्टिलाइजेशन (आईवीएफ) एन्यूप्लोइडी (पीजीटी-ए) ट्रोफेक्टोडर्म (टीई) इनर सेल मास (आईसीएम) फॉल्स पॉजिटिव और नेगेटिव एनआईसीएस टेक्नोलॉजी डीएनए अनुक्रमण कल्चर मीडियम सैंपलिंग होल जीनोम एम्प्लीफिकेशन (डब्ल्यूजीए) लाइब्रेरी तैयार करना एनजीएस डेटा विश्लेषण क्रायोप्रिजर्वेशन आईवीएफ प्रयोगशाला के लिए प्रीइंप्लांटेशन जेनेटिक टेस्टिंग।Erratum
Formal Correction: Erratum: Chromosome Screening of Human Preimplantation Embryos by Using Spent Culture Medium: Sample Collection and Chromosomal Ploidy Analysis
Posted by JoVE Editors on 10/01/2021.
Citeable Link.
An erratum was issued for: Chromosome Screening of Human Preimplantation Embryos by Using Spent Culture Medium: Sample Collection and Chromosomal Ploidy Analysis. The Protocol and Representaive Results sections were updated.
In the Protocol, step 3.8.2 was updated from:
After logging into the system, click Create Submission under the NICS tab. Then, select the sequencing platform, choose ChromInst for the reagent, enter the project information in the box under Project ID, set the analysis preferences and upload the files. Once all sequencing files are successfully uploaded, click Submit to start the analysis (Figure 3A).
to:
After logging into the system, click Create Submission under the NICS-A tab. Then, choose NGS for the platform, select corporation, choose ChromInst for the reagent, enter the project information in the box under Project ID, set the analysis preferences and upload the files. Once all sequencing files are successfully uploaded, click Submit to start the analysis (Figure 3A).
In the Representative Results, Figure 3 was updated from:
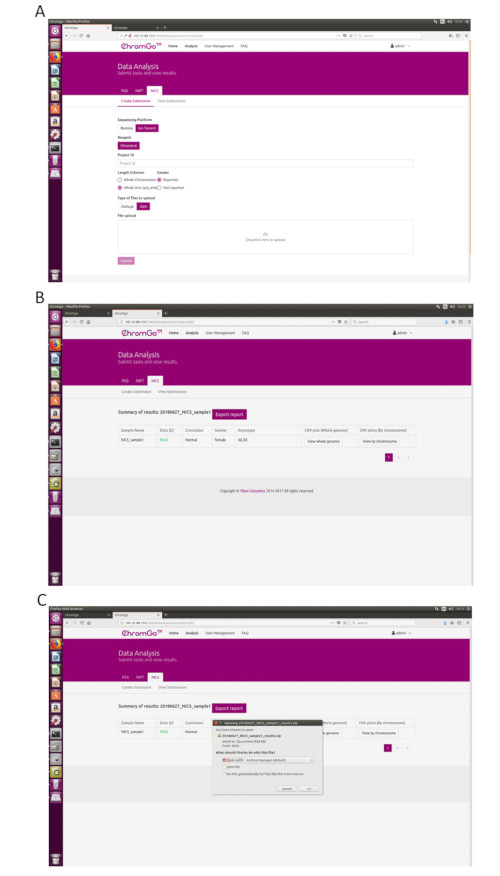
Figure 3. Data Analysis. (A) The page of Create Submission. There are different options for the user application. For sequencing platform, users can choose Illumina or Ion Torrent. For analysis criterion, there are two length detection resolution for selection, the whole chromosome and whole arm level. The users also can choose whether the mosaicism or gender information is reported. Finished the above parameter setting,click on the box under File upload and choose the appropriate sequencing files to upload. For Illumina, choose the files with an extension of fastq.gz. For Ion Torrent platform, choose files with an extension of bam. Click Submit to start the analysis after successfully upload. (B) The view of summary table. The summary table consists of following information: Sample Name: The name of each NICS sample is listed; Data QC: Indicates whether the sequencing file passes the QC for NICS analysis; Conclusion: Indicates whether the NICS analysis is normal or abnormal, "N/A" indicates no conclusive result is available; Gender: If the user chooses to report the sex information, this column will appear in the summary table; Karyotype: Shows the analysis results; CNV plot (Whole Genome): View the CNV profiles of all chromosomes; CNV plot (By Chromosome): View the CNV profiles of each chromosome. (C) The Save Report Page. Click Export report button next to the Summary of Results. Select the information you want to show on the final report and click Export. Select Save File in the appearing dialog window and then click OK. The reports will be saved to the Download folder of the computer. Please click here to view a larger version of this figure.
to:
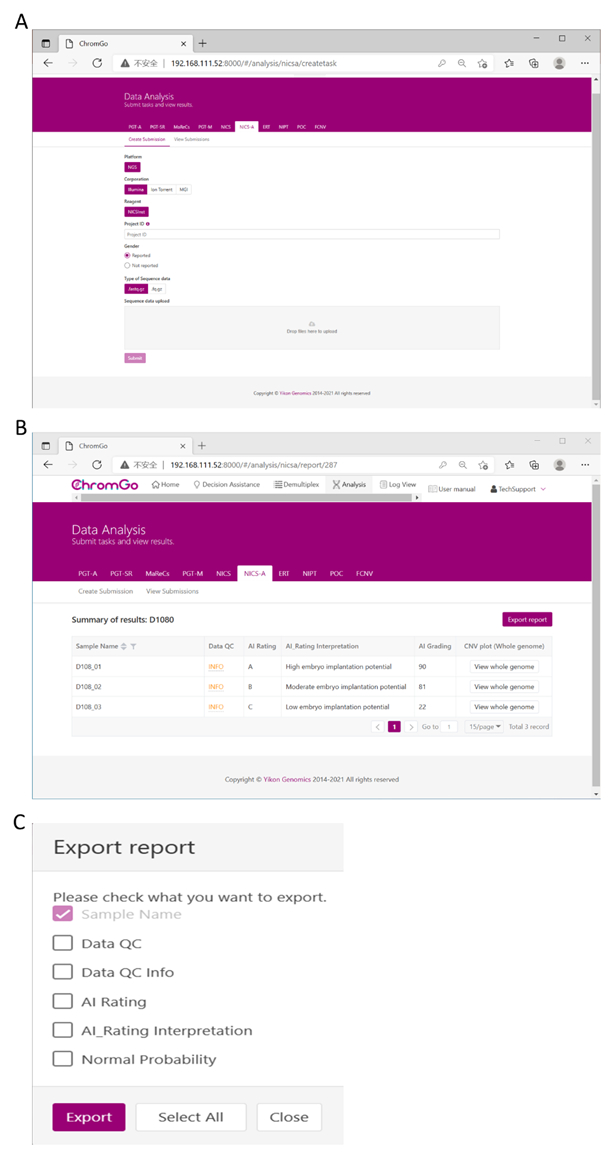
Figure 3. Data Analysis. (A) There are different options for the user application. For sequencing platform corporation, users can choose Illumina, Ion Torrent or MGI. The users can choose whether the gender information is reported. Finished the above parameter setting, click on the box under File upload and choose the appropriate sequencing files to upload. For Illumina, choose the files with an extension of fastq.gz. Click Submit to start the analysis after successfully upload. (B) The view of summary table. The summary table consists of following information: Sample Name: The name of each NICS sample is listed; Data QC: Indicates whether the sequencing file passes the QC for NICS analysis; AI Rating: The rating (A, B or C) for each NICS sample; AI_Rating Interpretation: Evaluation of embryo implantation potential; AI Grading: The score for each NICS sample; CNV plot (Whole Genome): View the CNV profiles of all chromosomes; (C) The Save Report Page. Click Export report button next to the Summary of Results. Select the information you want to show on the final report and click Export. The reports will be saved to the Download folder of your computer. Please click here to view a larger version of this figure.



