ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Bu çalışma, embriyo biyopsisini önleyen ve NGS kullanılarak kromozom ploidi tanımlamasını sağlayan, harcanan kültür ortamını kullanan insan embriyolarının kromozom taraması için bir protokol bildirmektedir. Bu makale, kültür ortamının hazırlanması, tüm genom amplifikasyonu (WGA), yeni nesil dizileme (NGS) kütüphanesinin hazırlanması ve veri analizi dahil olmak üzere ayrıntılı prosedürü sunmaktadır.
Abstract
Klinik in vitro fertilizasyonda (IVF), PGT-A için geçerli yöntem, trofektodermden (TE) birkaç hücrenin biyopsisini gerektirir. Bu, plasentayı oluşturan soydur. Bununla birlikte, bu yöntem özel beceriler gerektirir, invazivdir ve yanlış pozitiflerden ve negatiflerden muzdariptir, çünkü TE'deki kromozom sayıları ve fetüse dönüşen iç hücre kütlesi (ICM) her zaman aynı değildir. Hem TE hem de ICM'den kültür ortamına salınan DNA'nın dizilenmesini gerektiren bir teknoloji olan NICS, bu sorunlara bir çıkış yolu sunabilir, ancak daha önce sınırlı etkinliğe sahip olduğu gösterilmiştir. Bu çalışma, kültür ortamı örnekleme yöntemlerini, tüm genom amplifikasyonunu (WGA) ve kütüphane hazırlığını ve analiz yazılımı ile NGS veri analizini içeren NICS'nin tam protokolünü bildirmektedir. Farklı embriyo laboratuvarlarındaki farklı kriyoprezervasyon süreleri göz önüne alındığında, embriyologların IVF laboratuvarının gerçek koşullarına göre seçilebilecek embriyo kültürü ortamını toplamak için iki yöntemi vardır.
Introduction
Yardımcı üreme teknolojileri (ART'ler) infertilite tedavisinde giderek daha fazla kullanılmaktadır. Bununla birlikte, IVF gibi ART'nin başarı oranı sınırlı kalmıştır ve gebelik kaybı oranı normal popülasyondan önemli ölçüde daha yüksektir1. Bu sorunların ana nedeni, preimplantasyon insan embriyolarında yaygın olarak bulunan kromozomal anormalliklerdir2. PGT-A, implantasyondan önce embriyoları kromozomal denge açısından taramak için etkili bir yöntemdir 3,4. Bazı çalışmalar PGT-A'nın düşük oranını azaltabileceğini ve gebelik oranını artırabileceğini kanıtlamıştır 5,6,7,8. Bununla birlikte, PGT-A, özel eğitim ve deneyim gerektiren karmaşık teknik uzmanlık gerektirir. İnvaziv embriyo biyopsisi prosedürü de potansiyel olarak embriyolara zarar verebilir9. Çalışmalar, blastomer biyopsisinin sonraki gelişimi engelleyebileceğini ve biyopsi yapılan TE'lerin sayısının implantasyon oranlarını etkileyebileceğini göstermiştir10. Embriyo biyopsisinin uzun dönem biyogüvenlik konusu insanlarda henüz tam olarak değerlendirilmemiş olsa da, hayvanlar üzerinde yapılan çalışmalar embriyo gelişimi üzerindeki olumsuz etkilerini göstermiştir11,12,13.
Önceki raporlar, embriyo gelişimi sırasında kültür ortamına eser miktarda DNA materyali salgılandığını ve kullanılmış embriyo kültür ortamı 14,15,16,17,18 kullanılarak kapsamlı kromozom taraması (CCS) yapmak için çaba gösterildiğini göstermiştir. Bununla birlikte, tespit oranları ve testlerin doğruluğu, kapsamlı klinik kullanım gereksinimlerini karşılamamıştır. Bu çalışma, NICS testinin doğruluğunun yanı sıra tespit oranlarını artırmak için NICS testinde bir iyileşme olduğunu bildirmiştir19. Son yıllarda, blastokoele sıvısı (BF), minimal invaziv PGT-A'nın analitik bir örneği olarak incelenmiştir. Bununla birlikte, blastosist sıvısı örneklerinde başarılı genom çapında amplifikasyon ve saptanabilir DNA oranı %34,8 ile %82 arasında değişmektedir20,21,22. Çeşitli çalışmalarda bildirilen BF hacmi 0.3 nL ila 1 μL arasında değişmektedir. BF'deki düşük DNA miktarı göz önüne alındığında, tespitin başarı oranını ve tutarlılığını artırmak için blastosist sıvısı ve kültür ortamını karıştırarak hücresiz DNA miktarını artırmak mümkündür. Kuznyetsov ve ark.23 ve Li ve ark.24, zona pellucida'yı bir lazerle tedavi etti ve toplam embriyonik DNA miktarını iyileştirmek için blastosist sıvısını kültür ortamına saldı ve WGA'dan sonra kombine ortam/BF örneklerinin amplifikasyon oranı sırasıyla %100 ve %97.5 idi. Jiao ve ark.25 de aynı yöntemi kullanarak %100 amplifikasyon başarı oranı elde etmiştir.
Bu çalışma, harcanan ortam örneği hazırlama, NGS hazırlama ve veri analizini içeren ayrıntılı bir protokol bildirmektedir. Bu çalışmada oositlerden kümülüs hücreleri dikkatlice çıkarılarak intrasitoplazmik tek sperm enjeksiyonu (ICSI) ve blastosist kültürü uygulandı. 4. gün 5/6. gün WGA ve NGS kütüphane hazırlığı için orta toplandı. Bu çalışmada NICS teknolojisi kullanılarak WGA ve NGS kütüphanesi hazırlama adımları yaklaşık 3 saatte kolaylaştırılmış ve CCS sonuçları yaklaşık 9 saat içinde noninvaziv olarak elde edilmiştir.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Pekin Üniversitesi Üçüncü Hastanesi Etik Kurulu'ndan etik izin alınmıştır.
1. Hazırlık
NOT: Gerekli malzeme ve ekipmanlar Malzeme Tablosunda listelenmiştir.
- Reaktif
- 20-30 μL gamet ortamı/döllenme ortamı ve bölünme/blastosist aşaması kültür ortamı (mineral yağ ile kaplı) ve hyaluronidaz (sıkıca kapatılmış bir tüp içinde) 37 °C'de, %5 CO2 ve% 5 O2'de önceden ısıtın ve dengeleyin (dengeli) kullanımdan önce bir Tri-gaz inkübatörde gece boyunca.
- Hyaluronidazı çeker ocakta bir çalışma yüzeyinde 37 °C'ye ısıtın.
- Vitrifikasyon tamponu ve numune toplama reaktiflerini üreticinin talimatlarına göre hazırlayın.
- Araçları
- Ateşle parlatılmış açık ince uçlar oluşturmak için cam Pasteur pipetlerini çekerek numune toplama ve transfer pipetlerini (iç çap ~200 ila 250 μm), denudasyon/sıyırıcı pipetleri (iç çap ≥150 μm, ~130-140 μm ve ~120 μm) ve yıkama için pipetleri (~150 μm iç çap) hazırlayın.
NOT: Numune toplama/aktarma, ayırma ve yıkama için kullanılan pipetler doğrudan satın alınabilir. Tutma iğneleri ve enjeksiyon iğneleri de doğrudan satın alınabilir.
- Ateşle parlatılmış açık ince uçlar oluşturmak için cam Pasteur pipetlerini çekerek numune toplama ve transfer pipetlerini (iç çap ~200 ila 250 μm), denudasyon/sıyırıcı pipetleri (iç çap ≥150 μm, ~130-140 μm ve ~120 μm) ve yıkama için pipetleri (~150 μm iç çap) hazırlayın.
2. Protokol 1: Numune toplama
- Hyaluronidaz ile sindirimden önce oosit-korona-kümülüs kompleksinin (OCCC'ler) ön tedavisi
- Hem folikül uyarıcı hormon (FSH) hem de insan menopozal gonadotropin (hMG) preparatları ile yumurtalık stimülasyonu elde edin. Kurşun folikül >18 mm olduğunda, son oosit olgunlaşması için 10.000 IU koryonik gonadotropin (hCG) kullanın.
- Tetik atışından 36 saat sonra oosit alımı yapın. Oositleri alın ve mineral yağ ile kaplanmış 2,5 mL önceden ısıtılmış m-HTF ile doku kültürü kaplarına aktarın.
- OCCC'leri, bir transfer pipeti kullanarak 1 mL Döllenme Ortamı içeren bir organ kültürü kabının merkezi kuyucuğuna hızla aktarın ve ardından oositlerle 37 °C'de %5 CO 2 ve% 5 O 2 inkübatörde2-4 saat inkübe edin.
- OCCC'leri içeren bir organ kültürü kabının merkezi kuyucuğuna 1 mL 37 °C önceden ısıtılmış hyaluronidaz (80 IU / mL) ekleyerek OCCC'leri hyaluronidaz ile sindirin (adım 2.1.3). Son hyaluronidaz konsantrasyonunu 40 IU / mL'de tutun ve iyice karıştırın.
- OCCC'leri 37 °C'lik bir termal platformda 2 dakika inkübe edin. Sadece 1-2 kat granüloza hücresi kalana kadar her 30 saniyede bir mikroskop altında değişiklikleri gözlemleyin.
- Granüloza hücrelerinin denudasyonu
- Oosit kullanımı için sindirilmiş OCCC'leri kültür kabına hızla aktarın ve her kuyucuğu mineral yağ ile kaplayın.
- Ayrılan granüloza hücrelerini mikroskop altında gözlemleyin. Oositlerin etrafındaki kalıntı granüloza hücrelerini çıkarmak için oositleri 5 kez nazikçe aspire edin ve serbest bırakın.
- Granüloza hücrelerini tamamen çıkarmak için kalan 3 kuyucukta önceki adımı tekrarlayın.
NOT: Yukarıdaki adımlar (2.1-2.3) her laboratuvarın rutin işleyişine göre gerçekleştirilebilir.
- Oositin değerlendirilmesi
- Bir mikroskop kullanarak granüloza hücresi çıkarılmasının eksiksizliğini değerlendirin. Hücreler tamamen çıkarılamazsa, şu anda 5 veya daha az granüloza hücresinin tutulması kabul edilebilir.
NOT: Kümülüs hücreleri hala oosit ile bağlıysa, embriyo bölünme evresi kültür ortamından blastosist aşaması kültür ortamına aktarılmadan önce kalıntı 3. günde çıkarılabilir.
- Bir mikroskop kullanarak granüloza hücresi çıkarılmasının eksiksizliğini değerlendirin. Hücreler tamamen çıkarılamazsa, şu anda 5 veya daha az granüloza hücresinin tutulması kabul edilebilir.
- İntrasitoplazmik sperm enjeksiyonu (ICSI)26 gerçekleştirdikten sonra, oositleri transfer pipetleri kullanarak 20-30 μL bölünme embriyo kültürü ortamı mikrodamlacıklarına (bir oosit bir mikrodamlacığa karşılık gelir) aktarın ve 37 °C, %5 CO2 ve %5O2 inkübatörde inkübe edin.
- ICSI gününü 0. gün olarak kaydedin. Döllenme için 1. gün (yaklaşık 18 saat), embriyo bölünmesi için 2. gün (yaklaşık 45 saat) ve embriyo bölünmesi için 3. gün (yaklaşık 68 saat) embriyo değerlendirmesine ilişkin İstanbul konsensüs çalıştayına göre embriyoları kontrol edin ve puanlayın27.
- Embriyo yıkama
- 37 °C, %5 CO2 ve %5O2 inkübatörde 2. günde doku kültürü kaplarında mineral yağ ile kaplanmış her embriyo için 20-30 μL blastosist kültürü ortamı mikrodamlacıkları hazırlayın.
- Mineral yağ ile kaplanmış üç mikro damlacık daha hazırlayın ve 1-3 numaralı yıkama için yeni doku kültürü kaplarını etiketleyin.
- 3. gün embriyolarını yıkama mikro damlacıklarına aktarın. Denudasyon pipetleri kullanarak embriyoları her damlacıkta 3 kez nazikçe aspire edin ve serbest bırakın.
NOT: Bu prosedür aynı zamanda embriyoya bağlı kalan granüler hücrelerin çıkarılmasına da yardımcı olabilir. - Morfolojik puanlama için ortam bölünme aşaması kültür ortamından blastosist kültür ortamına değiştirilmeden önce 3. günde embriyoları mikroskop altında gözlemleyin ve değerlendirin. Kümülüs hücreleri hala embriyoya bağlıysa, kümülüs hücreleri tamamen çıkarılana kadar bir sıyırıcı pipet ile mineral yağ ile kaplanmış önceden ısıtılmış ve dengelenmiş başka bir blastosist kültürü ortamı damlacığında uygun şekilde yukarı ve aşağı pipetleyin.
NOT: Embriyo bölünme evresi kültür ortamı plakasından blastosist aşaması kültür ortamı plakasına transfer edilmeden önce tüm bağlı kümülüs hücrelerinin 3. günde tamamen çıkarılması gerekiyordu. Kalan kümülüs hücreleri son analize müdahale edecek ve yanlış negatif sonuçlar verecektir.
- Kültür ortamı toplama için iki seçenek
NOT: Tüp bebek merkezi, merkezin kaynaklarına, taleplerine ve tercihlerine bağlı olarak kültür ortamı toplama için iki yöntemden birini seçebilir.- Seçenek 1: Embriyo yıkama ve kültür
NOT: Bu seçenek, 5. günün sabahı vitrifikasyon yapan IVF laboratuvarları içindir.- Embriyoyu önceden ısıtılmış (37 ° C) kültür ortamının mikro damlacıklarına aktarın ve her embriyoyu 4. gün öğleden sonra pipetleyerek 3 mikro damlacıkta seri olarak yıkayın.
- Numune toplama için her embriyoyu önceden ısıtılmış (37 °C) tek bir mikro damlacık kültür ortamına aktarın. Tek bir kültür ortamı damlacığının hacmi 25 μL'yi geçemez.
- Blastosist embriyo kültürünü 5/gün 6'da 37 °C, %5 CO2 ve% 5 O2'de gerçekleştirin.
- Seçenek 2: Embriyo yıkama ve kültür
NOT: Bu seçenek, 5. gün öğleden sonra veya 6. günde vitrifikasyon yapan IVF laboratuvarları içindir.- Embriyoyu önceden ısıtılmış (37 °C) 10-15 μL kültür ortamındaki mikrodamlacıklara aktarın ve 5. günde pipetleyerek her embriyoyu 3 mikrodamlacıkta seri olarak nazikçe yıkayın.
- Numune toplama için her embriyoyu önceden ısıtılmış (37 °C) tek bir mikro damlacık kültür ortamına aktarın. Tek bir kültür ortamı damlacığının hacmi 15 μL'yi geçemez.
- Blastosist embriyo kültürünü 5. günde 6. günde 37 ° C ve% 5 CO2'de gerçekleştirin.
- Seçenek 1: Embriyo yıkama ve kültür
- Numune Koleksiyonu
- ICM'yi, sıvıyı blastocoel boşluğundan serbest bırakmak için trofektodermde küçük bir delik oluşturmak için trofektodermin hücre bağlantısına odaklanan lazer ışınının hedeflenen noktasından önemli bir mesafede nazikçe ayarlayın. Daha sonra embriyolar, geleneksel işleme göre kriyoprezervasyon için dondurma çözeltisine taşınır.
- Her kültürlenmiş embriyodan kültür ortamını 5 μL hücre lizis tamponu içeren bir RNase / DNaz içermeyen PCR tüpüne aktarın.
- Negatif kontrol olarak embriyo kültürü için kullanılmadan aynı miktarda kültür ortamı toplayın. Toplanan tüm numuneleri hemen sıvı nitrojen içinde dondurun ve toplandıktan sonra NICS testine tabi tutulana kadar -80 °C'de saklayın.
- Protokolde açıklandığı gibi vitrifikasyon gerçekleştirin.
3. Protokol 2: Kütüphane İnşaatı
- Kültür ortamı lizisi
- 1 μL pozitif kontrolü (10 ng insan gDNA'sı) 199 μL taze kültür ortamı ile seyreltin. İyice karıştırın ve tüpü kısaca santrifüjleyin (5 saniye boyunca 200 x g ).
- 10 μL 5 günlük 6 blastosist kültür ortamı, seyreltilmiş pozitif kontrol ve taze kültür ortamını yeni 0.2 mL PCR tüplerine aktarın.
- Her bir PCR tüpüne 1 μL MT Enzim Karışımı ekleyin ve pipetleyerek iyice karıştırın ve hemen 200 x g'da 2-3 saniye santrifüjleyin.
- Adım 3.1.3'teki PCR tüp(ler)ini önceden ısıtılmış bir NICS Numune Hazırlama İstasyonuna koyun ve lizis programını aşağıdaki gibi çalıştırın: 75 °C'de 10 dakika; 95 °C'de 4 dakika; 22 °C'de tutun.
NOT: Numune hazırlama istasyonu, standart bir PCR makinesiyle karşılaştırılabilir.- Kurulum ekranına girmek için Lysis simgesine tıklayın.
- Kontrol modu için Tüp'ü seçin; Numune hacmi için 10 μL giriş; Hotlid kontrolü için Açık'ı seçin ve sıcaklık için 105 °C girin. İlk adımda Duraklat için Hayır'ı seçin. Devam etmek için Tamam'a tıklayın.
- Kalan süre, programın sonunu gösteren --:--:-- görünene kadar bekleyin ve ardından programı sonlandırmak için Durdur'u tıklatın.
- İşlem tamamlandıktan sonra programı durdurun. Hemen bir sonraki adıma geçin.
- Kütüphane Öncesi Hazırlık
- Pre-Lib arabelleğini RT'ye çözün. Pipetleyerek iyice karıştırın ve hemen 200 x g'da 2-3 saniye santrifüjleyin.
- Kütüphane öncesi reaksiyon için aşağıdaki gibi bir ana karışım hazırlayın: 60 μL Pre-Lib Tamponuna 2 μL Pre-Lib Enzim Karışımı ekleyin, reaksiyonu iyice karıştırın ve kısaca santrifüjleyin.
- Önceki adımdan her bir ön işlem görmüş ortam örneğine 60 μL kütüphane öncesi reaksiyon karışımı ekleyin. Pipetleyerek iyice karıştırın ve hemen 200 x g'da 2-3 saniye santrifüjleyin.
- Adım 3.2.3'teki PCR tüp(ler)ini Numune Hazırlama İstasyonuna yerleştirin ve ön kütüphane programını aşağıdaki gibi çalıştırın: 95 dakika boyunca 2 °C; 40 sn için 15 °C, 40 sn için 22 °C, 30 sn için 33 °C, 30 sn için 65 °C, 40 sn için 72 °C, 10 sn için 95 °C ve 10 sn için 63 °C olmak üzere 12 döngü; ve 4 °C'de tutun.
- Kurulum ekranına girmek için Pre_Lib simgesine tıklayın.
- Kontrol modu için Tüp'ü seçin; Numune hacmi için 70 μL giriş; Sıcak kapak kontrolü için Açık öğesini seçin ve sıcaklık için 105 °C girin. İlk adımda Duraklat için Hayır'ı seçin. Devam etmek için Tamam'a tıklayın.
- Kalan süre, programın sonunu gösteren --:--:-- gösterene kadar bekleyin ve programı sonlandırmak için Durdur'a tıklayın.
- İşlem tamamlandığında programı durdurun. Hemen bir sonraki adıma geçin.
- Kütüphane Hazırlığı
- Kitaplık Tamponunu RT'ye çözün. Pipetleyerek iyice karıştırın ve hemen 200 x g'da 2-3 saniye santrifüjleyin.
- Kütüphane reaksiyonu için aşağıdaki gibi bir ana karışım hazırlayın: 60 μL Kütüphane Tamponuna 1.6 μL Kütüphane Enzim Karışımı ekleyin, reaksiyonu iyice karıştırın ve kısaca santrifüjleyin.
- Adım 3.2.3'ten itibaren her bir kütüphane öncesi ürüne 60 μL kütüphane reaksiyon karışımı ve 2 μL Barkod Astarı ekleyin. Reaksiyonu iyice karıştırın ve kısa bir süre santrifüjleyin.
- Adım 3.2.3'teki PCR tüp(ler)ini termal döngüleyiciye yerleştirin ve kitaplık hazırlama programını aşağıdaki gibi çalıştırın: 30 saniye boyunca 94 °C; 25 sn boyunca 94 °C, 30 sn için 62 °C ve 45 sn için 72 °C'lik 17 döngü); ve ardından 4 °C'de tutun.
- Kurulum ekranına girmek için Lib_Prep simgesine tıklayın.
- Kontrol modu için Tüp'ü seçin; Giriş 130 μL Örnek hacim için; Hotlid kontrolü için Açık'ı seçin ve ilgili sıcaklık için 105 °C girin. İlk adımda Duraklat için Hayır'ı seçin. Devam etmek için Tamam'a tıklayın.
- Kalan süre, programın sonunu gösteren --:--:-- gösterene kadar bekleyin ve programı sonlandırmak için Durdur'a tıklayın.
- Kütüphane Arıtma
- Magbeads'i saflaştırma adımından önce en az 2-8 °C'de en az 20 dakika depodan çıkarın. Magbeads'i 20 saniye boyunca vorteksleyin ve karıştırın. Saflaştırma adımı için yeterli sayıda boncuğu yeni bir 1.5 mL mikrosantrifüj tüpüne ve sıcak boncukları RT'ye dağıtın.
- Her kitaplığa 1x Magbeads ekleyin. ≥10 kez yukarı ve aşağı pipetleyerek karıştırın ve RT'de 5 dakika inkübe edin.
NOT: Örneğin, 100 μL kitaplık örneğine 100 μL Magbeads ekleyin. - İnkübasyondan sonra, tüpü kısa bir süre santrifüjleyin ve manyetik bir stand üzerine yerleştirin.
- Çözelti berraklaşana kadar yaklaşık 5 dakika bekleyin. Tüpü manyetik stand üzerinde tutarken, çözeltiyi dikkatlice aspire edin ve atın.
- Tüpe 200 μL taze hazırlanmış% 80 etanol ekleyin. RT'de 30 saniye inkübe edin ve süpernatanı dikkatlice çıkarın. Bir kez daha tekrarlayın.
- Etanolü mümkün olduğunca tamamen çıkarın. Manyetik stand üzerindeki boncukları RT'de yaklaşık 5-10 dakika havayla kurutun.
- Tüpü manyetik standdan çıkarın, 17.5 μL elüsyon tamponu ekleyin ve boncukları yeniden süspanse etmek için tüpü vorteksleyin. Tüpü kısa bir süre santrifüjleyin ve RT'de 5 dakika inkübe edin.
- Tüpü manyetik standın üzerine yerleştirin ve çözelti berraklaşana kadar bekleyin. 15 μL süpernatanı dikkatlice yeni bir tüpe aktarın.
- Kütüphane nicelemesi
- Kübit dsDNA HS Test kitlerinin kullanım kılavuzuna göre florometreyi kullanarak saflaştırılmış kitaplıklarıölçün 28. Kütüphanelerin verimi ~15 ila 300 ng arasında değişmektedir.
- Kütüphane Havuzu
- Havuzlama için her kitaplık örneğinin 10 nanogramını kullanın.
- Sıralama
- Sıralama kullanıcı kılavuzuna bakın (15027617 v01)29.
- Platformda tek bir uçta 50 bp'lik saflaştırılmış kütüphane dizileri, her örnek için yaklaşık 2 milyon okuma sağladı ve 0,03 × dizileme derinliği önerildi.
- Veri analizi
- Oturum açma sayfasında kullanıcıların Adını ve Parolasını girin
- Sisteme giriş yaptıktan sonra Analiz tıklayınız ve karşınıza yeni bir sayfa çıkacaktır. NICS-A sekmesi altındaki Form Gönderimi Oluştur'a tıklayın. Ardından, platform için NGS'yi seçin, şirketi seçin, reaktif için NICSInst'i seçin, Proje Kimliği altındaki kutuya proje bilgilerini girin, analiz tercihlerini ayarlayın ve dosyaları yükleyin. Tüm sıralama dosyaları başarıyla yüklendikten sonra, analizi başlatmak için Gönder'e tıklayın (Şekil 3A).
- Gönderilen projelerin listesini görmek için Gönderimleri Görüntüle'ye tıklayın. Analiz tamamlandıktan sonra, projenin durumu Tamamlandı olur ve rapor alanında bir Göster düğmesi görünür. NICS analizinin özet tablosunu görüntülemek için Göster düğmesine tıklayın (Şekil 3B).
- Raporları kaydetmek için Raporu dışa aktar düğmesine tıklayın (Şekil 3C).
NOT: Her analiz için üç tür dosya dışa aktarılacaktır. Her kromozom ve tüm genom için tüm kopya sayısı varyasyonu (CNV) grafiklerini içeren ve "grafik" klasörü altında saklanacak bir grafik dosyası; bu analiz çalışmasının örnek kalite kontrol ayrıntılarını içeren bir elektronik tablo; kullanıcı tarafından özelleştirilen NICS raporlarını içeren bir belge dosyası; ve bu analiz çalışmasının örnek özet bilgilerini içeren bir elektronik tablo.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Bu çalışmada önerilen yöntem bir hastaya uygulanmıştır. NICS analizi uygulanmadan önce KİB onayı ve bilgilendirilmiş onam alınmıştır. Bu çalışmada hastalardan 6 blastosist elde edildi ve 6 embriyonun hepsinde 4. günden 5. güne kadar NICS uygulandı. Ebeveynlerin dengeli translokasyonunun neden olduğu kromozom anormallikleri, NICS testi ile kromozomların beşinde tespit edildi; bu nedenle transfer için kullanılamazlar (Şekil 4A-E). İki embriyonun NICS sonuçları aynı karyotip 45'i gösterdi ve XN ve -18 (×1) her ikisi de kromozom 18 delesyonu idi (Şekil 4A, B). Karyotip 46, XN, -1p (pter→p21.1, ×1) kromozom 1 pter→p21.1 bölge delesyonunun sadece kısa koludur (Şekil 4D).
NICS sonuçları, kromozom 18 q21.32→qter bölgesi delesyonu ve kromozom 1 pter→p21.21.2 bölgesinin kısa kolunun ×1) kromozomunun hem uzun kolunun hem de 18→qter, ×3) ve -18 (q21.32→qter, 1) karyotip gösterdi (Şekil 4E). Karyotipler 46, XN, +5q (×4) ve -8 (×1, mos) kromozom 5 duplikasyonları olmasına ve 8 mozaik farklılık göstermesine rağmen, NICS testi 24 kromozomun tümünü anöploidi açısından tarayabilir. Bu işlem, tek normal karyotip blastosistlerin transferi için yeni bir yöntem sağlar.

Şekil 1. Kümülüs hücrelerinin çıkarılması tamlığı. (A) Kümülüs hücreli oositler. (B) Kümülüs hücreleri bağlı olmayan oositler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2. Kümülüs hücreleri, BM'ye transfer edilmeden önce D3'teki bir embriyodan çıkarılır. Bağlı tüm kümülüs hücreleri, ilk bölünme embriyo kültürü ortam plakasından, embriyolar 8 hücreli aşamaya ulaştıktan sonraki 3. günde olan blastosist kültürü ortam plakasına geçmeden önce çıkarılmalıdır. Çıkarılmayan herhangi bir kümülüs hücresi, yanlış negatif sonuçlar vererek son analize müdahale edecektir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3. Veri analizi. (A) Kullanıcı uygulaması için farklı seçenekler vardır. Sıralama platformu şirketi için kullanıcılar Illumina, Ion Torrent veya MGI'yi seçebilir. Kullanıcılar cinsiyet bilgilerinin raporlanıp bildirilmeyeceğini seçebilirler. Yukarıdaki parametre ayarını bitirdikten sonra, Dosya yükleme altındaki kutuya tıklayın ve yüklenecek uygun sıralama dosyalarını seçin. Illumina için fastq.gz uzantılı dosyaları seçin. Başarılı bir şekilde yükledikten sonra analizi başlatmak için Gönder'i tıklayın. (B) Özet tablonun görünümü. Özet tablosu aşağıdaki bilgilerden oluşur: Örnek Adı: Her NICS örneğinin adı listelenir; Veri QC: Sıralama dosyasının NICS analizi için QC'yi geçip geçmediğini gösterir; AI Derecelendirmesi: Her NICS örneği için derecelendirme (A, B veya C); AI_Rating Yorum: Embriyo implantasyon potansiyelinin değerlendirilmesi; AI Derecelendirme: Her NICS örneği için puan; CNV grafiği (Tüm Genom): Tüm kromozomların CNV profillerini görüntüleyin; (C) Raporu Kaydet sayfası. Sonuç Özeti'nin yanındaki Raporu dışa aktar düğmesini tıklayın. Son raporda gösterilmesini istediğiniz bilgileri seçin ve Dışa Aktar'ı tıklatın. Raporlar, bilgisayarınızın İndirme klasörüne kaydedilecektir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4. Bir hastadan NICS kullanarak embriyo taraması ve seçimi. Blastosist aşamasına kadar başarılı bir şekilde toplam altı embriyo geliştirildi ve NICS testi için her embriyodan Day4-Day5 kültür ortamı toplandı. (A) ve (B) aynı karyotip 45, XN, -18(×1)'in her ikisinin de kromozom 18 delesyonu olduğunu gösteren iki blastosist embriyosunun NICS sonuçlarıdır. (C) karyotip 46, XN, +5q (×4), -8(×1, mos) kromozom 5 duplikasyonu ve 8 mozaik gösterdi. (D) 46, XN, -1p karyotipi (pter→p21.1, ×1) kromozom 1 pter→p21.1 bölge delesyonu kısa kolu iken, (E) karyotip 46, XN, +1p (pter→p21.2, ×3), -18(q21.32→qter, ×1) kromozom 1 pter→p21.2 bölgesinin kısa kolu ve kromozom 18 q21.32'nin uzun kolu q21.32 → qter bölgesi (F) dengeli kromozomal kompozisyon gösterdi. X ekseni kırmızı ve mavi renkte 22 otozom anlamına gelir, y ekseni her otozomun kopya numarasını gösterir. Gri noktalar, kopya numarası yanıtının cetvel ölçeğidir, her bölme penceresi ve kopya numarasının normal karyotipi 2 olmalıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo S1. DNA tespitinin başarı oranları Seçenek 1 ve Seçenek 2. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo S2. Farklı seçeneklerde NICS ve PGT-A arasındaki uyum. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Değişiklikler ve sorun giderme
NICS sonuçları ebeveyn genetik materyalleri ile kontamine olmuşsa, tüm kümülüs-korona radiata hücrelerinin çıkarıldığından emin olun ve döllenme için ICSI yapıldığından emin olun. DNA'yı bozabilecek uygun olmayan ortam depolama veya şablon hazırlama işlemlerinden kaçınılır. Çalışma alanı DNase ve RNase dekontaminasyon reaktifleri ile iyice saflaştırıldı. Diğer embriyolardan kontaminasyonu önlemek için, 4. günden itibaren çapraz kontaminasyonu önlemek için bir embriyo her zaman tek bir damlacık ortamında kültürlendi. Embriyoların son kültür damlasına yerleştirilmesi geciktirilirken kontaminasyon olgusu en aza indirilir30,31,32,33. Maternal kontaminasyonu en aza indirmek için Kuznyetsov34, artık korona hücrelerinin pipetleme ve yıkama yoluyla dikkatli bir şekilde çıkarılması da dahil olmak üzere embriyo kültürü prosedürlerini 0. günden 4. güne kadar değiştirdi.
Lane ve ark.30 , embriyo kültürü ortamını 4. günden 5. güne alırken, öploidi tespitinin doğruluğunun arttığını, embriyo ploidi tutarlılığının %95'ten fazla olduğunu ve cinsiyet kromozomunun tutarlılığının %100'e ulaştığını göstermektedir. Lledo ve ark.33 , 3. gün 5. kültür ortamı ile TE örnekleri arasındaki tesadüf oranının, embriyolar 4. günden 6. güne kadar kültürlendiğinde %74.6 ve %92.0 olduğunu bulmuşlardır.
Dahili verilerimiz de Tablo S1'de gösterildiği gibi bu sonucu desteklemektedir. Konvansiyonel 3. gün 5. kültür yöntemiyle karşılaştırıldığında, granüloza hücreleri, 4. veya 5. günde kültür ortamındaki bir değişiklik nedeniyle daha da çıkarıldı. İki yöntemimizin (seçenek 1 ve seçenek 2) PGT-A ile karşılaştırıldığında iyi bir tutarlılığa sahip olduğunu gösteren dahili veriler (Tablo S1) sağlıyoruz, bu da CC'nin tamamen kaldırılması olmadan örnekleme yönteminden daha iyidir.
Negatif kontrolde IF ile güçlendirilmiş ürünler ortaya çıktı ve harici DNA materyalleri reaktifi veya çalışma alanını kirletmiş olabilir. Çalışma alanı DNA/RNA çıkarıcı reaktifler ile temizlenmeli, nükleaz içermeyen malzemeler kullanılmalı ve reaktifler ilk kullanımdan sonra alıkonulmalıdır.
Seçenek 1 ve Seçenek 2 arasındaki başarı oranlarındaki farklılıklar Tablo S1 ve Tablo S2'de tartışılmaktadır.
NICS testinin sınırlamaları
NICS'nin iki ana sınırlaması vardır. 1) ICSI'den önce, tüm kümülüs hücreleri (genellikle maternal kökenli, genellikle normal kromozom kompozisyonu) çıkarılmalıdır. Çıkarma işlemi tamamlanmazsa, kümülüs hücreleri embriyo gelişimi sırasında DNA'yı serbest bırakabilir ve dış DNA amplifiye edilir, bu da yanlış negatif tespitin nedeni olabilir. 2) Zona pellucida'ya bağlı spermin çıkarılması zordur ve NICS prosedürünün ICSI ile yapılması şiddetle tavsiye edilir. 3. günde dekolte ortamının düzenli olarak değiştirilmesi, kümülüs hücreleri ve fazla spermlere bağlı kontaminasyon olasılığını azaltabilse de, klinik IVF'de NICS kullanılıyorsa bu kontaminasyon en aza indirilmelidir. Bununla birlikte, yakın gelecekte gösterilecek olan eksojen DNA'yı tanıma işlevi de dahil olmak üzere, IVF embriyolarında NICS'yi tespit etmek için bir yöntem geliştirilmiştir.
Bu çalışma, büyük ölçekli klinik çalışmalar kültür ortamlarını karşılaştırdığından, farklı ortamlar arasındaki farklılıkları karşılaştırmamıştır. Sekiz merkez, ardışık ve sürekli olmak üzere 4 farklı kültür ortamı ve 2 farklı oranda albümin takviyesi (%5 ve %10) kullanmış ve bu farklılıkların embriyonik cfDNA sonuçlarının doğruluğu üzerinde önemli bir etkisi olmamıştır31. Bu bulgular, spesifik protokol altında çalışırken embriyonik cfDNA analizinin her IVF laboratuvarına potansiyel uygulanabilirliğini desteklemektedir.
Mevcut yöntemlere göre önemi
NICS yöntemi embriyo biyopsisini önler ve böylece kullanım güvenliğini büyük ölçüde artırır. Blastosistlerle karşılaştırıldığında, NICS, anöploidi olasılığı yüksek olan yardımcı üreme popülasyonları için uygun, basit, zaman kazandıran, hassas ve tekrarlanabilir bir preimplantasyon tarama tekniğidir. Blastosist biyopsi prosedürü için önemli ve profesyonel bilgi gerektiren invaziv biyopsinin aksine, NICS, harcanan ortamın basit bir şekilde toplanması yalnızca IVF19'un düzenli çalışmasını takip ettiğinden ve bazı ülkelerde PGS/PGD yeterliliği gerektirmediğinden yaygın olarak uygulanabilir.
Gelecekteki uygulamalar
NICS, sadece ICSI için değil, aynı zamanda IVF embriyoları için de klinik IVF'de kromozom taraması için geniş uygulanabilirlik potansiyeline sahiptir. ICSI şiddetle tavsiye edilse de, spermin etkisini önlemek için zona pellucida'ya bağlı spermin çıkarılması yöntemleri gereklidir.
Morfolojik değerlendirme, embriyo değerlendirmesi için geleneksel bir yöntemdir, ancak çoğu durumda, kromozomal olarak anormal embriyolar, kromozomal olarak normal (euploid) embriyolara morfolojik olarak benzer görünebilir. İyi morfolojiye sahip ploid embriyoların uterusa transferinde morfolojik değerlendirmeyi NICS testi ile birleştirmek, devam eden gebelik oranlarını ve canlı doğum oranını iyileştirebilir. NICS teknolojisi kullanılarak tek embriyo transferinin klinik etkinliğini değerlendirmek için randomize bir klinik çalışma yapılacaktır.
Protokoldeki kritik adımlar
Tüm kümülüs-korona radiata hücreleri döllenmeden önce oositlerden çıkarılmalıdır. Oositler intrasitoplazmik sperm enjeksiyonu (ICSI) ile döllendi. Kültür ortamına insan kaynaklı proteinlerin/takviyelerin eklenmesinden kaçınıldı. Kültür ortamı 4. günde değiştirildi ve blastokistlerin tamamen genişlediği 5. gün-6. günde toplandı. Embriyolar, 4. günden itibaren ayrı ayrı kültür ortamı damlacıklarında kültürlendi. Kültür ortamı toplanırken, kontaminasyonu önlemek için numuneler arasındaki transfer pipetleri değiştirildi.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yaxin Yao, Jieliang Ma, Jing Wang ve Sijia Lu, Yikon Genomics Co., Ltd.'nin çalışanlarıdır.
Acknowledgments
Yazarlar, NGS veri analizindeki yardımları için Shiping Bo ve Shujie Ma'ya teşekkür eder. Finansman: Bu çalışma Ulusal Anahtar Araştırma ve Geliştirme Programı (Hibe No. 2018YFC1003100) tarafından desteklenmiştir.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL EP tube, 0.2 mL PCR tube | Axygen | MCT-150-C, PCR-02-C | DNase/RNase free, Low Binding PCR tubes and 1.5 mL micro-centrifuge tubes are recommended. |
| 10 µL, 200 µL, 1000 µL DNase /RNase Free Tips | Axygen | T-300-R-S, T-200-Y-R-S, T-1000-B-R-S | This can be replaced by other brand/For sample transfer |
| 100 % ethanol | Sinopharm Chemical | 10009218 | This can be replaced by other brand/For DNA library purification |
| Barcode Primer1-48 | Yikon Genomics | Reagent in NICSInst library preparation kit | For library amplificaton |
| BD Falcon Organ Culture Dish, Sterile | BD Bioscience | 363037 | This can be replaced by other brand/For embryo culture |
| BD Falcon Tissue culture Dishes (Easy Grip) , Sterile | BD Bioscience | 353001 | This can be replaced by other brand/For embryo culture |
| BD Falcon Tissue culture Dishes, Sterile | BD Bioscience | 353002 | This can be replaced by other brand/For embryo culture |
| Cell Lysis Buffer | Yikon Genomics | Reagent in NICSInst library preparation kit | For culture medium pre-treatment |
| Cell Lysis Enzyme | Yikon Genomics | Reagent in NICSInst library preparation kit | For culture medium pre-treatment |
| ChromGo software | Yikon Genomics | Data analysis | |
| CMPure Magbeads | Yikon Genomics | Reagent in NICSInst library preparation kit | For library purification |
| Cryotop open systerm | KITAZATO BioPharma | 81110 | This can be replaced by other brand/For embryo vitrification |
| Distill water | Yikon Genomics | Reagent in NICSInst library preparation kit | To dissolve DNA |
| ES (Vitrification kit) | KITAZATO BioPharma | Reagent inVitrification kit | This can be replaced by other brand/For embryo vitrification |
| HOLDNIG | ORIGIO | MPH-MED-35 | This can be replaced by other brand/For ICSI |
| Hyaluronidase solution, 80 U/mL | SAGE | ART4007-A | This can be replaced by other brand/Digest oocyte-corona-cumulus complex |
| ICSI | ORIGIO | MPH-35-35 | This can be replaced by other brand/For ICSI |
| Illumina MiSeq® System | Illumina | SY-410-1001 | For library sequencing |
| Incubator | Labotect | Inkubator C16 | This can be replaced by other brand/For embryo culture |
| Library buffer | Yikon Genomics | Reagent in NICSInst library preparation kit | For library amplificaton |
| Library Enzyme Mix | Yikon Genomics | Reagent in NICSInst library preparation kit | For library amplificaton |
| Magnetic Stand | DynaMagTM-2 | 12321D | For library purification |
| Microscope | OLYMPUS | 1X71 | This can be replaced by other brand/For embryo observation |
| Mini-centrifuge | ESSENSCIEN | ELF6 | For separation |
| MT Enzyme Mix | Yikon Genomics | Reagent in NICSInst library preparation kit | For culture medium pre-treatment |
| NICSInst library preparation kit | Yikon Genomics | KT1000800324 | Whole genome amplification and library construction |
| NICSInst Sample Prep Station | Yikon Genomics | ME1001003 | Amplificate DNA |
| Nunc IVF 4-Well Dish | Thermo Scientific | 144444 | This can be replaced by other brand/For embryo washing and blastocyst culture |
| Pasteur Pipette | Oirgio | MXL3-IND-135 | This can be replaced by other brand/For embryo tansfer |
| Pasteur pipettes | ORIGIO | PP-9-1000 | This can be replaced by other brand/For IVF laboratory |
| Pre-Lib Buffer | Yikon Genomics | Reagent in NICSInst library preparation kit | Pre-library preparation |
| Pre-Lib Enzyme | Yikon Genomics | Reagent in NICSInst library preparation kit | Pre-library preparation |
| Qubit® 3.0 Fluorometer | Thermo Scientific | Q33216 | For library quantification |
| Quinn's Advantage Blastocyst Medium | SAGE | ART-1029 | For embryo blastocyst stage culture |
| Quinn's Advantage Cleavage Medium | SAGE | ART-1026 | This can be replaced by other brand/For embryo cleavage stage culture |
| Quinn's Advantage Fertilization Medium | SAGE | ART-1020 | This can be replaced by other brand/For oocyte and sperm fertilization |
| Quinn's Advantage m-HTF Medium with HEPES | SAGE | ART-1023 | This can be replaced by other brand/For embryo clutrure |
| Quinn's Advantage SPS Serum protein Substitute Kit | SAGE | ART-3010 | This can be replaced by other brand/To denude the oocyte |
| Quinn's Advantage Tissue culture mineral oil | SAGE | ART-4008P | This can be replaced by other brand/To cover the culture medium |
| STRIPPER TIPS | ORIGIO | MXL3-IND-135 | This can be replaced by other brand/For denudating granulosa cells |
| Vitrification Cryotop Open systerm | KIZTAZATO | 81111 | This can be replaced by other brand/For embryo vitrification |
| Vitrification kit | KITAZATO BioPharma | VT101 | This can be replaced by other brand/For embryo vitrification |
| Vortexer | Qilinbeier | DNYS8 | Sample mix |
| VS (Vitrification kit) | KITAZATO BioPharma | Reagent inVitrification kit | This can be replaced by other brand/For embryo vitrification |
| ZILOS-tk Laser System | Hamilton Thorne | CLASS 1 laser | This can be replaced by other brand/For artificial blastocoele collapse |
References
- Barlow, P. Early pregnancy loss and obstetrical risk after in-vitro fertilization and embryo replacement. Human Reproduction. 3 (5), 671-675 (1988).
- Munne, S. Chromosome abnormalities and their relationship to morphology and development of human embryos. Reproductive BioMedicine Online. 12 (2), 234-253 (2006).
- Harton, G. L. Diminished effect of maternal age on implantation after preimplantation genetic diagnosis with array comparative genomic hybridization. Fertility and Sterility. 100 (6), 1695-1703 (2013).
- Hodes-Wertz, B. Idiopathic recurrent miscarriage is caused mostly by aneuploid embryos. Fertility and Sterility. 98 (3), 675-680 (2012).
- Keltz, M. D. Preimplantation genetic screening (PGS) with Comparative genomic hybridization (CGH) following day 3 single cell blastomere biopsy markedly improves IVF outcomes while lowering multiple pregnancies and miscarriages. Journal of Assisted Reproduction and Genetics. 30 (10), 1333-1339 (2013).
- Scott, R. T. Jr Blastocyst biopsy with comprehensive chromosome screening and fresh embryo transfer significantly increases in vitro fertilization implantation and delivery rates: a randomized controlled trial. Fertility and Sterility. 100 (3), 697-703 (2013).
- Forman, E. J. In vitro fertilization with single euploid blastocyst transfer: a randomized controlled trial. Fertility and Sterility. 100 (1), 100-107 (2013).
- Yang, Z. Selection of single blastocysts for fresh transfer via standard morphology assessment alone and with array CGH for good prognosis IVF patients: results from a randomized pilot study. Molecular Cytogenetics. 5 (1), 24 (2012).
- Cimadomo, D. The Impact of Biopsy on Human Embryo Developmental Potential during Preimplantation Genetic Diagnosis. BioMed Research International. 2016, 7193075 (2016).
- Scott, R. T. Jr, Upham, K. M., Forman, E. J., Zhao, T., Treff, N. R. Cleavage-stage biopsy significantly impairs human embryonic implantation potential while blastocyst biopsy does not: a randomized and paired clinical trial. Fertility and Sterility. 100 (3), 624-630 (2013).
- Wu, Y. Blastomere biopsy influences epigenetic reprogramming during early embryo development, which impacts neural development and function in resulting mice. Cellular and Molecular Life Sciences. 71 (9), 1761-1774 (2014).
- Zhao, H. C. Aberrant epigenetic modification in murine brain tissues of offspring from preimplantation genetic diagnosis blastomere biopsies. Biology of Reproduction. 89 (5), 117 (2013).
- Zeng, Y. Preimplantation genetic diagnosis (PGD) influences adrenal development and response to cold stress in resulting mice. Cell and Tissue Research. 354 (3), 729-741 (2013).
- Palini, S. Genomic DNA in human blastocoele fluid. Reproductive BioMedicine Online. 26 (6), 603-610 (2013).
- Gianaroli, L. Blastocentesis: a source of DNA for preimplantation genetic testing. Results from a pilot study. Fertility and Sterility. 102 (6), 1692-1699 (2014).
- Stigliani, S., Anserini, P., Venturini, P. L., Scaruffi, P. Mitochondrial DNA content in embryo culture medium is significantly associated with human embryo fragmentation. Human Reproduction. 28 (10), 2652-2660 (2013).
- Stigliani, S. Mitochondrial DNA in Day 3 embryo culture medium is a novel, non-invasive biomarker of blastocyst potential and implantation outcome. Molecular Human Reproduction. 20 (12), 1238-1246 (2014).
- Wu, H. Medium-Based Noninvasive Preimplantation Genetic Diagnosis for Human α-Thalassemias-SEA. Medicine. 94 (12), e669 (2015).
- Xu, J. Noninvasive chromosome screening of human embryos by genome sequencing of embryo culture medium for in vitro fertilization. Proceedings of the National Academy of Sciences. 113 (42), 11907-11912 (2016).
- Capalbo, A. Diagnostic efficacy of blastocoel fluid and spent media as sources of DNA for preimplantation genetic testing in standard clinical conditions. Fertility and Sterility. 110 (5), 870-879 (2018).
- Tobler, K. J. Blastocoel fluid from differentiated blastocysts harbors embryonic genomic material capable of a whole-genome deoxyribonucleic acid amplification and comprehensive chromosome microarray analysis. Fertility and Sterility. 104 (2), 418-425 (2015).
- Magli, M. C. Preimplantation genetic testing: polar bodies, blastomeres, trophectoderm cells, or blastocoelic fluid? Fertility and Sterility. 105 (3), 676-683 (2016).
- Kuznyetsov, V. Evaluation of a novel non-invasive preimplantation genetic screening approach. PLoS One. 13 (5), e0197262 (2018).
- Li, P. Preimplantation Genetic Screening with Spent Culture Medium/Blastocoel Fluid for in Vitro Fertilization. Scientific Reports. 8 (1), 9275 (2018).
- Jiao, J. Minimally invasive preimplantation genetic testing using blastocyst culture medium. Human Reproduction. 34 (7), 1369-1379 (2019).
- Palermo, G. D. Births after intracytoplasmic injection of sperm obtained by testicular extraction from men with nonmosaic Klinefelter's syndrome. New England Journal of Medicine. 338 (9), 588-590 (1998).
- Alpha Scientists in Reproductive, M., & Embryology, E. S. I. G. o. The Istanbul consensus workshop on embryo assessment: proceedings of an expert meeting. Human Reproduction. 26 (6), 1270-1283 (2011).
- Thermo Fisher Scientific. Qubit dsDNA HS Assay Kit. , Available from: https://www.thermofisher.com/order/catalog/product/Q32851?ICID=search-product (2015).
- Miseq system use guide. , Available from: https://support.illumina.com/downloads/miseq_system user _ guide 15027617.html (2016).
- Lane, M. Ability to detect aneuploidy from cell free DNA collected from media is dependent on the stage of development of the embryo. Fertility and Sterility. 108 (3), (2017).
- Rubio, C. Multicenter prospective study of concordance between embryonic cell-free DNA and trophectoderm biopsies from 1301 human blastocysts. American Journal of Obstetrics and Gynecology. 223 (5), 751-751 (2020).
- Rubio, C. Embryonic cell-free DNA versus trophectoderm biopsy for aneuploidy testing: concordance rate and clinical implications. Fertility and Sterility. 112 (3), 510-519 (2019).
- Lledo, B. Consistent results of non-invasive PGT-A of human embryos using two different techniques for chromosomal analysis. Reproductive BioMedicine Online. 42 (3), 555-563 (2021).
- Kuznyetsov, V. Minimally Invasive Cell-Free Human Embryo Aneuploidy Testing (miPGT-A) Utilizing Combined Spent Embryo Culture Medium and Blastocoel Fluid -Towards Development of a Clinical Assay. Scientific Reports. 10 (1), 7244 (2020).
Tags
Kromozom Taraması İnsan Preimplantasyon Embriyoları Harcanan Kültür Ortamı Örnek Toplama Kromozomal Ploidi Analizi In Vitro Fertilizasyon (IVF) Anöploidi (PGT-A) Trofektoderm (TE) İç Hücre Kütlesi (ICM) Yanlış Pozitifler ve Negatifler NICS Teknolojisi DNA Dizileme Kültür Ortamı Örneklemesi Tüm Genom Amplifikasyonu (WGA) Kütüphane Hazırlama NGS Veri Analizi Kriyoprezervasyon Tüp Bebek LaboratuvarıErratum
Formal Correction: Erratum: Chromosome Screening of Human Preimplantation Embryos by Using Spent Culture Medium: Sample Collection and Chromosomal Ploidy Analysis
Posted by JoVE Editors on 10/01/2021.
Citeable Link.
An erratum was issued for: Chromosome Screening of Human Preimplantation Embryos by Using Spent Culture Medium: Sample Collection and Chromosomal Ploidy Analysis. The Protocol and Representaive Results sections were updated.
In the Protocol, step 3.8.2 was updated from:
After logging into the system, click Create Submission under the NICS tab. Then, select the sequencing platform, choose ChromInst for the reagent, enter the project information in the box under Project ID, set the analysis preferences and upload the files. Once all sequencing files are successfully uploaded, click Submit to start the analysis (Figure 3A).
to:
After logging into the system, click Create Submission under the NICS-A tab. Then, choose NGS for the platform, select corporation, choose ChromInst for the reagent, enter the project information in the box under Project ID, set the analysis preferences and upload the files. Once all sequencing files are successfully uploaded, click Submit to start the analysis (Figure 3A).
In the Representative Results, Figure 3 was updated from:
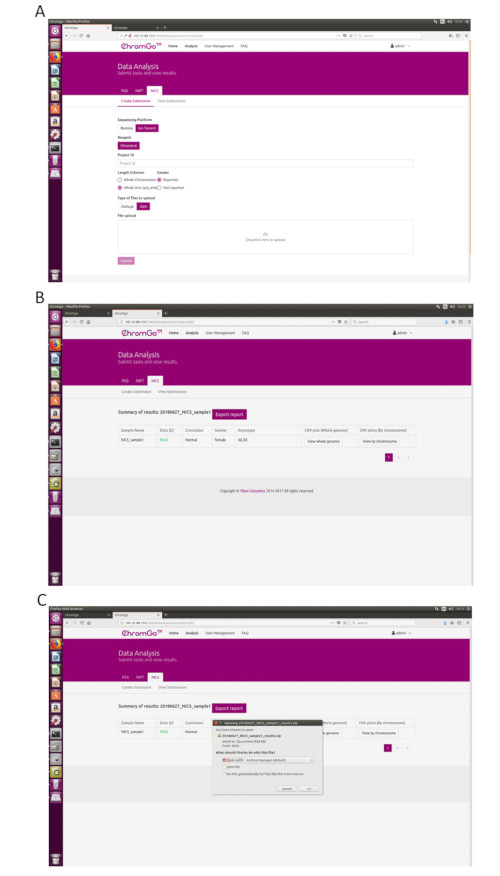
Figure 3. Data Analysis. (A) The page of Create Submission. There are different options for the user application. For sequencing platform, users can choose Illumina or Ion Torrent. For analysis criterion, there are two length detection resolution for selection, the whole chromosome and whole arm level. The users also can choose whether the mosaicism or gender information is reported. Finished the above parameter setting,click on the box under File upload and choose the appropriate sequencing files to upload. For Illumina, choose the files with an extension of fastq.gz. For Ion Torrent platform, choose files with an extension of bam. Click Submit to start the analysis after successfully upload. (B) The view of summary table. The summary table consists of following information: Sample Name: The name of each NICS sample is listed; Data QC: Indicates whether the sequencing file passes the QC for NICS analysis; Conclusion: Indicates whether the NICS analysis is normal or abnormal, "N/A" indicates no conclusive result is available; Gender: If the user chooses to report the sex information, this column will appear in the summary table; Karyotype: Shows the analysis results; CNV plot (Whole Genome): View the CNV profiles of all chromosomes; CNV plot (By Chromosome): View the CNV profiles of each chromosome. (C) The Save Report Page. Click Export report button next to the Summary of Results. Select the information you want to show on the final report and click Export. Select Save File in the appearing dialog window and then click OK. The reports will be saved to the Download folder of the computer. Please click here to view a larger version of this figure.
to:
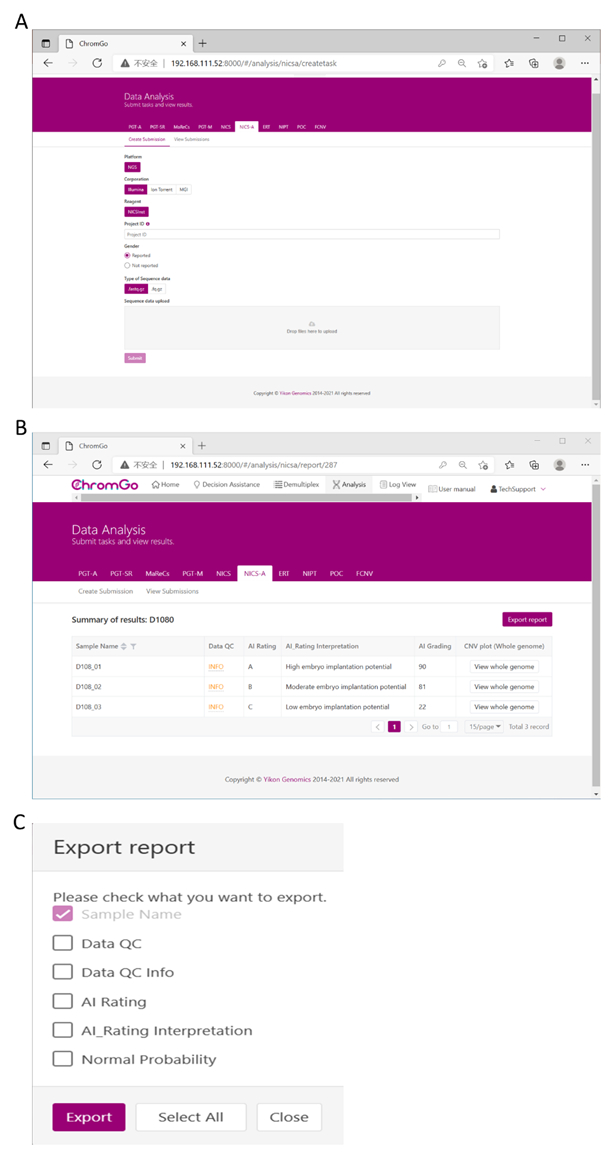
Figure 3. Data Analysis. (A) There are different options for the user application. For sequencing platform corporation, users can choose Illumina, Ion Torrent or MGI. The users can choose whether the gender information is reported. Finished the above parameter setting, click on the box under File upload and choose the appropriate sequencing files to upload. For Illumina, choose the files with an extension of fastq.gz. Click Submit to start the analysis after successfully upload. (B) The view of summary table. The summary table consists of following information: Sample Name: The name of each NICS sample is listed; Data QC: Indicates whether the sequencing file passes the QC for NICS analysis; AI Rating: The rating (A, B or C) for each NICS sample; AI_Rating Interpretation: Evaluation of embryo implantation potential; AI Grading: The score for each NICS sample; CNV plot (Whole Genome): View the CNV profiles of all chromosomes; (C) The Save Report Page. Click Export report button next to the Summary of Results. Select the information you want to show on the final report and click Export. The reports will be saved to the Download folder of your computer. Please click here to view a larger version of this figure.



