適応塩化カルシウム手順を用いて大腸菌細胞の形質転換
English
Share
Overview
ソース: ナタリア・マーティン1, アンドリュー・J・ヴァン・アルスト1, リアノン・M・ルヴェーク1, ビクター・J・ディリタ1
1ミシガン州立大学微生物学・分子遺伝学専攻
細菌は、水平遺伝子導入として知られているプロセスで遺伝物質(デオキシリボヌクレイン酸、DNA)を交換する能力を有する。外因性DNAを組み込むことは、細菌が自然の生息地に見られる抗生物質や抗体(1)または分子の存在など、変化する環境条件に適応することを可能にする新しい遺伝的形質を獲得できるメカニズムを提供する。(2)水平遺伝子導入には、形質転換、経転移、共役の3つのメカニズムがある(3)ここでは、環境から自由なDNAを取り込む細菌の能力、形質転換に焦点を当てます。実験室では、形質転換プロセスには、4つの一般的なステップがあります:1)有能な細胞の調製、2)DNAを用いて有能な細胞のインキュベーション、3)細胞の回収、および4)形質転換剤の増殖のための細胞のめっき(図1)。
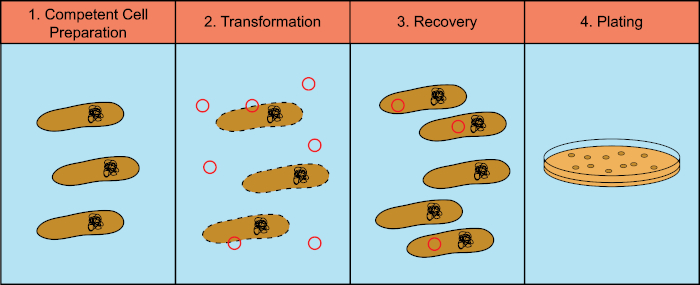
図 1: 変換プロセスの一般的な手順。形質転換プロセスには、4つの一般的なステップがあります:1)有能な細胞の調製、2)DNAによるインキュベーション、3)細胞の回収、4)形質転換剤の増殖のためのめっき細胞。
変換が起こるには、レシピエント細菌が能力と呼ばれる状態である必要があります。一部の細菌は、特定の環境条件に応じて自然に有能になる能力を持っています。しかし、他の多くの細菌は自然に有能にならないか、またはこのプロセスの条件はまだ不明です。DNAを細菌に導入する能力は、目的とするDNA分子の複数のコピーを生成し、大量のタンパク質を発現させる、クローニング手順の構成要素として、他の研究用途の範囲を持っています。分子生物学への変換の価値のために、自然な能力のための条件が不明な場合に細胞を人工的に有能にすることを目的としたいくつかのプロトコルがあります。人工的に有能な細胞を調造するには、1)細胞の化学処理を通じて、2)細胞を電気パルス(エレクトロポレーション)にさらす2つの主な方法が使用されます。前者は、DNAと細胞表面の間に引力を生み出す手順に応じて異なる化学物質を使用し、後者は電界を使用してDNA分子が入り込むことができる細菌細胞膜の細孔を生成します。化学的能力のための最も効率的なアプローチは、二価陽イオンを用いてインキュベーションであり、最も顕著なカルシウム(Ca2+)(4,5)カルシウム誘発能力は、ここで説明する手順である(6)。この方法は、主にグラム陰性細菌の形質転換に使用され、それはこのプロトコルの焦点になります。
化学的変換の手順は、細胞が化学的能力を誘発するために陽イオンにさらされる一連のステップを伴う。これらのステップは、その後、温度変化-ヒートショック-有能な細胞による外来DNAの取り込みを支持する(7)。細菌細胞の封筒は負の帯電である。大腸菌のようなグラム陰性菌では、外膜はリポ多糖(LPS)の存在により負の帯電(8)である。これにより、同様に負電荷を帯んだDNA分子の反発が生じる。化学的能力誘導において、正に帯電したカルシウムイオンは、この電荷反発を中和し、細胞表面へのDNA吸光を可能にする(9)。DNAによるカルシウム処理とインキュベーションは氷上で行われます。続いて、より高い温度(42°C)でのインキュベーション、ヒートショックが行われる。この温度の不均衡は、DNAの取り込みをさらに有利にします。細菌細胞は、ヒートショック治療に耐えるために、中指数成長期である必要があります。他の成長段階では、細菌細胞は熱に敏感になりすぎて、変換効率が大幅に低下する生存率の損失をもたらす。
異なるDNA源を変換に使用できます。典型的には、プラスミドは、小さな円形、二本鎖DNA分子、大腸菌におけるほとんどの実験室手順における形質転換に使用される。プラスミドを形質転換後に細菌細胞に維持するには、複製の起源を含む必要があります。これにより、細菌染色体とは独立して細菌細胞内で複製することができる。すべての細菌細胞が形質転換手順中に変換されるわけではありません。したがって、形質転換は、形質転換された細胞と非形質化された細胞の混合物をもたらす。これら2つの集団を区別するために、プラスミドを獲得した細胞を同定する選択方法が用いられる。プラスミドは通常、選択可能なマーカーを含み、これは成長の利点を与える形質をコードする遺伝子である(すなわち、抗生物質または化学的または成長性の補助性からの救助に対する耐性)。形質転換後、細菌細胞は選択的培地上にめっきされ、形質転換細胞の増殖のみが可能となる。所定の抗生物質に対する耐性を与えるプラスミドで形質転換した細胞の場合、選択的培養剤はその抗生物質を含む増殖培養剤となる。選択的培養剤中に成長したコロニーが形質転換体であることを確認するためにいくつかの異なる方法を使用することができます(すなわち、プラスミドを組み込んだ)。例えば、プラスミドはプラスミド調製法(10)を用いてこれらの細胞から回収し、プラスミドサイズを確認するために消化することができる。あるいは、コロニーPCRは、目的のプラスミド(11)の存在を確認するために使用することができる。
この実験の目的は、塩化カルシウム手順(12)の適応を用いて大腸菌DH5α化学的に有能な細胞を調作し、プラスミドpUC19でそれらを変換して変換効率を決定することである。大腸菌株DH5αは、分子生物学アプリケーションで一般的に使用される株です。その遺伝子型、特にrecA1およびendA1のために、この株は挿入安定性を高め、その後の調製におけるプラスミドDNAの質を改善することを可能にする。DNAのサイズが大きくなると形質転換効率が低下するため、プラスミドpUC19はサイズが小さい(2686 bp)のでこのプロトコルで使用された(https://www.mobitec.com/cms/products/bio/04_vector_sys/standard_cloning_vectors.html参照ベクトルマップ)。pUC19はアンピシリンに対する耐性を付与し、したがって、これは選択に使用される抗生物質であった。
Procedure
Results
Although TE is dependent on many factors, non-commercial competent cell preparations, like this one, normally yield 106 to 107 transformants per microgram of plasmid. Therefore, this preparation, with a TE = 2.46 x 108 cfu/µg, yielded a TE well beyond the expected range. Additional protocols are available for making supercompetent cells when higher transformation efficiencies are required for a given application (13).
Analysis of the digestion of the plasmid DNA recovered from the transformed cells indicated that this plasmid has the expected size of pUC19 DNA (2686 bp).
Applications and Summary
Transformation is a powerful method for introducing exogenous DNA into bacterial cells that is key to many molecular biology applications in the laboratory. Additionally, it plays a major role in nature by allowing bacterial cells to exchange genetic material that could result in increased genetic variation and allow for acquisition of different beneficial traits for survival under a wide range of conditions. Many bacterial strains encode the genes required for natural competence. However, the conditions in which these genes are induced are still unknown. Further research is required to determine these conditions.
References
- Croucher, N. J. et al. Rapid pneumococcal evolution in response to clinical interventions. Science. 331 (6016):430-434. (2011)
- Borgeaud, S. et al. The type VI secretion system of Vibrio cholerae fosters horizontal gene transfer. Science. 347(6217):63-67. (2015)
- Burmeister, A. R. Horizontal Gene Transfer. Evol Med Public Health. 2015 (1):193-194. (2015)
- Weston A, Brown MG, Perkins HR, Saunders JR, Humphreys GO. Transformation of Escherichia coli with plasmid deoxyribonucleic acid: calcium-induced binding of deoxyribonucleic acid to whole cells and to isolated membrane fractions. J Bacteriol. 145 (2):780-7. (1981)
- Dagert M, Ehrlich SD. Prolonged incubation in calcium chloride improves the competence of Escherichia coli cells. Gene. 6 (1):23-8. (1979)
- Asif A, Mohsin H, Tanvir R, and Rehman Y. Revisiting the Mechanisms Involved in Calcium Chloride Induced Bacterial Transformation. Front Microbiol. 8:2169. (2017)
- Panja S, Aich P, Jana B, Basu T. How does plasmid DNA penetrate cell membranes in artificial transformation process of Escherichia coli? Mol Membr Biol. 25 (5):411-22. (2008)
- Silhavy, TJ, Kahne D, Walker S. The Bacterial Cell Envelope. Cold Spring Harb Perspect Biol. 2 (5): a000414. (2010)
- Panja S, Aich P, Jana B, Basu T. (2008) Plasmid DNA binds to the core oligosaccharide domain of LPS molecules of E. coli cell surface in the CaCl2-mediated transformation process. Biomacromolecules. 9 (9):2501-9.
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Plasmid Purification. JoVE, Cambridge, MA. (2018)
- Bergkessel M and Guthrie C. Colony PCR. Methods in Enzymology. 529: 299-309. (2013)
- Sambrook J and Russell DW. Molecular Cloning A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY.Protocol 25 (1.116-118). (2001)
- Wirth R, Friesenegger A, Fiedler S. Transformation of various species of gram-negative bacteria belonging to 11 different genera by electroporation. Molecular & General Genetics. 216 (1): 175-7. (1989)
Transcript
Bacteria are remarkably adaptable and one mechanism which facilitates this adaptation is their ability to take in external DNA molecules. One type of DNA that bacteria can uptake is called a plasmid, a circular piece of DNA that frequently contains useful information, such as antibiotic resistance genes. The process of bacteria being modified by new genetic information incorporated from an external source is referred to as transformation. Transformation can easily be performed in the laboratory using Escherichia coli, or E. coli.
In order to be transformed, E. coli cells must first be made competent, which means capable of taking in DNA molecules from their environment. The protocol for accomplishing this is surprisingly simple, a short incubation of the cells in a calcium chloride solution. This incubation causes the cells to become permeable to DNA molecules. After the cells are pelleted by centrifugation, the supernatant is removed. The plasmid DNA is now added to the competent cells. After incubating the cells with DNA, the mix is briefly heated to 42 degrees Celsius, followed by rapid cooling on ice. This heat shock causes the DNA to be transferred across the cell’s wall and membranes. The cells are then incubated in fresh media. Then, the bacteria are placed at 37 degrees to allow them to reseal their membranes and express resistant proteins.
Those cells which have taken in the plasmids will faithfully copy the DNA and pass it to their progeny and express any proteins that might be encoded by it, including antibiotic resistance mediators. Those resistance genes can be used as selectable markers to identify bacteria which have been successfully transformed because cells that have not taken up the plasmid will not express the resistance gene product. This means that when the cells are plated on a solid medium which contains the appropriate antibiotic, only cells that have taken up the plasmid will grow. Transformation of the cells in a growing colony can be further confirmed by culturing those cells in liquid media overnight to increase the yield before extracting the DNA from the sample. Once the DNA is isolated, a diagnostic restriction enzyme digest can be carried out. Because restriction enzymes cut DNA in predictable locations, running these digests on a gel should show a predictable pattern if the desired plasmid was successfully transformed. For example, if pUC19 is prepared and cut with the restriction enzyme HindIII, a single band of 2686 nucleotides should be seen on the gel.
In this lab, you will transform E. coli strain DH-5 Alpha with pUC19, and then confirm the successful transformation by DNA gel electrophoresis.
Before starting the procedure, put on the appropriate personal protective equipment, including a lab coat and gloves. Next, sterilize the workspace with 70% ethanol.
Now, prepare chemically competent cells by depositing a loopfull of bacteria onto a sterile LB agar plate and streaking the bacteria with a new loop. Then, incubate the plate at 37 degrees Celsius overnight. The next day, sterilize the bench top with 70% ethanol again, and remove the plate from the incubator.
Inoculate a single, well-isolated colony into 3 milliliters of LB broth in a tube with a sterile loop. Then, grow the culture at 37 degrees Celsius overnight, with shaking at 210 RPM. The next day, measure the optical density of the overnight culture with a spectrophotometer. Then, add 100 milliliters of LB broth to a one-liter flask, and inoculate it with the overnight culture at an optical density of 0. 01. Now, incubate the culture at 37 degrees Celsius with shaking, and check the OD600 every 15 to 20 minutes until the culture reaches mid-exponential growth phase.
After approximately three hours, transfer 50 milliliters of the culture to two ice-cold polypropylene bottles. Then, place the bottles back on ice for 20 minutes to cool. Next, recover the cells via centrifugation. Discard the supernatants and place the bottles upside down on a paper towel. Next, resuspend the bacterial pellet in five milliliters of ice-cold calcium chloride magnesium chloride solution and swirl carefully until the pellet has dissolved completely. Then, add another 25 milliliters of the solution to the dissolved bacterial pellet. Resuspend the other bacterial pellet as previously demonstrated. After this, repeat the centrifugation, and remove the supernatants.
If the competent cells are going to be directly transformed, resuspend each bacterial pellet in two milliliters of an ice-cold 0.1 molar calcium chloride solution by swirling the tubes carefully. To begin the transformation procedure, transfer 50 microliters of competent cells to two labeled 1.5 milliliter polypropylene tubes. Then, add one microliter of pUC19 plasmid DNA to one of the tubes. Mix gently, avoiding bubble formation, and incubate both tubes for 30 minutes on ice. After incubation, transfer the tubes to a heat block and incubate at 42 degrees Celsius for 45 seconds. Immediately transfer the tubes to ice, and incubate for two minutes. Now, add 950 microliters of SOC media to each tube and incubate them for one hour at 37 degrees Celsius to allow the bacteria to recover, and express the antibiotic resistant marker encoded in the plasmid.
To make a 1 to 100 dilution, add 990 microliters of SOC media and 10 microliters of cell suspension to a 1.5 milliliter tube. Then, make a 1 to 10 dilution by adding 900 microliters of SOC media and 100 microliters of cell suspension to a 1.5 milliliter tube. Next, plate 100 microliters of the diluted cell suspensions and 100 microliters of the negative control, onto separate selective plates containing ampicillin using a spreader and incubate the plates at 37 degrees Celsius for 12 to 16 hours. After incubation, count the colony-forming units, or CFUs, per plate, obtained through transformation, and record these data. To verify that the transformants have the pUC19 plasmid, pick a single, well-isolated colony from a plate with a sterile loop, and introduce it to a tube containing 3 milliliters of LB broth. Then, incubate the culture at 37 degrees Celsius with shaking, overnight. The next day, use a DNA mini prep kit to isolate DNA from 3 milliliters of the culture, according to the manufacturer’s instructions. After completing the DNA mini prep, digest the 1 microgram of purified pUC19 with a restriction enzyme at 37 degrees Celsius for 1 hour. Now, load 20 microliters of a molecular weight ladder, 1 microgram of digested plasmid DNA, and 1 microgram of undigested plasmid DNA into consecutive wells of a 1% agarose gel containing 1 microgram per milliliter ethidium bromide. Then, run the gel for 1 hour at 95 volts. Finally, visualize the gel with a UV illuminator.
In this experiment, E. coli DH5 Alpha chemically competent cells were prepared using an adaptation of the calcium chloride procedure, and then transformed with the plasmid pUC19 to determine transformation efficiency. To calculate the transformation efficiency, use the recorded CFU counts for the 1 in 100 and 1 in 10 dilutions, and any other dilutions with CFU counts between 30 and 300. First, the recorded CFU count, 246 in this example, is divided by the amount of DNA, .0001 micrograms here, that was plated. Then, this number is divided by the dilution factor used to give the transformation efficiency in CFUs per microgram. In this example, a 1 to 10 dilution was used and 100 microliters of a 1 milliliter solution was plated, giving a final dilution factor of 0.01. In the undigested plasmid lane, the circular DNA may appear as two or three different bands of varying brightness. This is because the circular, uncut DNA may exist in several different conformation states, such as supercoiled, open circle, or more linear, and each of these move through the gel at different rates. Analysis of the recovered plasmid DNA digestion indicated that the plasmid used has an expected size of pUC19 DNA, 2,686 base pairs.
