18.10:
التحليل الكهربائي
18.10:
التحليل الكهربائي
في الخلية الجلفانية، يتم تنفيذ العمل الكهربائي بواسطة نظام الأكسدة والاختزال في المناطق المحيطة بها حيث يتم نقل الإلكترونات الناتجة عن تفاعلات الأكسدة والاختزال العفوية عبر دائرة خارجية. بدلاً من ذلك، تعمل الدائرة الخارجية على نظام الأكسدة والاختزال من خلال فرض جهد كافي لدفع تفاعل غير تلقائي في عملية تعرف باسم التحليل الكهربائي. على سبيل المثال، تتضمن إعادة شحن البطارية استخدام مصدر طاقة خارجي لدفع تفاعل الخلية العفوي (التفريغ) في الاتجاه العكسي، واستعادة إلى حد ما تكوين نصف الخلايا والجهد الكهربائي للبطارية. تشمل الأمثلة الأخرى استخدام التحليل الكهربائي في تنقية الخامات المعدنية، وتصنيع المواد الكيميائية السلعية، والطلاء الكهربائي للطلاء المعدني على الأواني، والمجوهرات، وما إلى ذلك.
توقع منتج التحليل الكهربائي
يستخدم التحليل الكهربائي لكلوريد الصوديوم المصهور، NaCl (l)، في الإنتاج الصناعي للصوديوم المعدني، والصوديوم، وغاز الكلور، Cl2. يتم اختزال أيونات الصوديوم (Na+) إلى ذرات عند الكاثود، بينما تتأكسد أيونات الكلوريد (Cl−) إلى غاز الكلور، Cl2، عند الأنود. تفاعلات الأكسدة والاختزال هي:
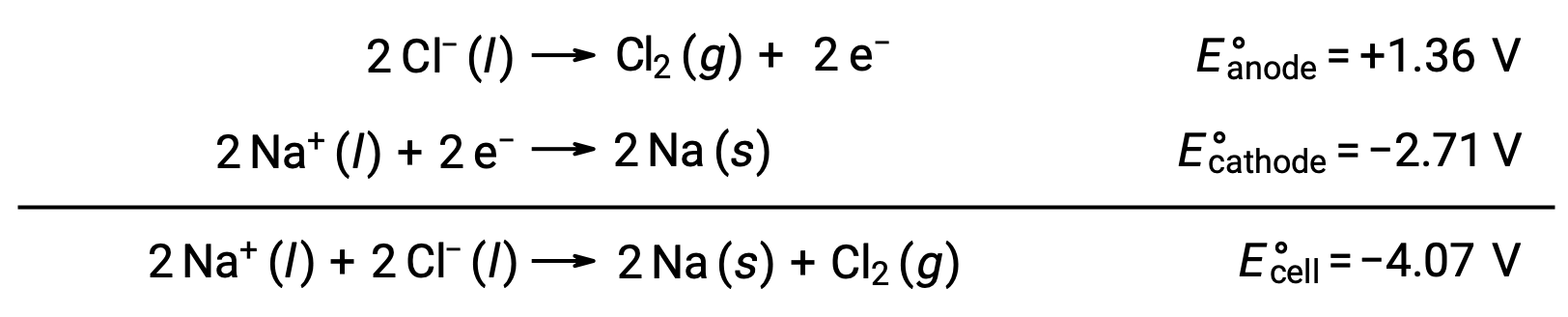
تشير استطاعة الخلية السالبة إلى تفاعل غير تلقائي يجب أن يكون مدفوعاً بفرض جهد موجب أكبر من −4.07 فولت. يتم إجراء التحليل الكهربائي لكلوريد الصوديوم المنصهر عند درجة حرارة عالية تبلغ 801 °C. كما تذوب المواد الصلبة الأيونية في درجات حرارة عالية.
ينتج عن التحليل الكهربائي للماء كميات متكافئة من غاز الأكسجين عند القطب الموجب والهيدروجين عند القطب السالب. لتحسين التوصيل الكهربائي، يتم زيادة تركيز أيون الهيدروجين في الماء بإضافة حمض قوي. تفاعلات الأكسدة والاختزال المصاحبة هي:
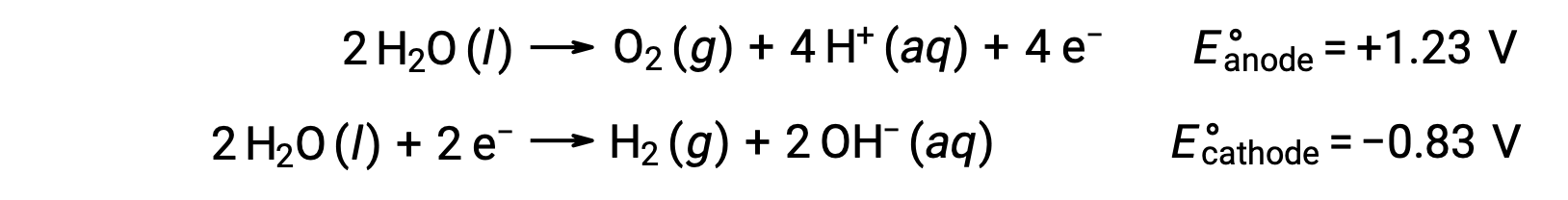
قد يتضمن التحليل الكهربائي لمحاليل المركبات الأيونية مثل كلوريد الصوديوم المائي التحليل الكهربائي لأي نوع من أنواع المياه (H2O, H+, OH–) أو أنواع مذابة (كاتيونات وأنيونات المركب) عند الأنود والكاثود.
يمكن أن يشتمل التحليل الكهربائي لكلوريد الصوديوم المائي على أي من هذين التفاعلين الموجودين:
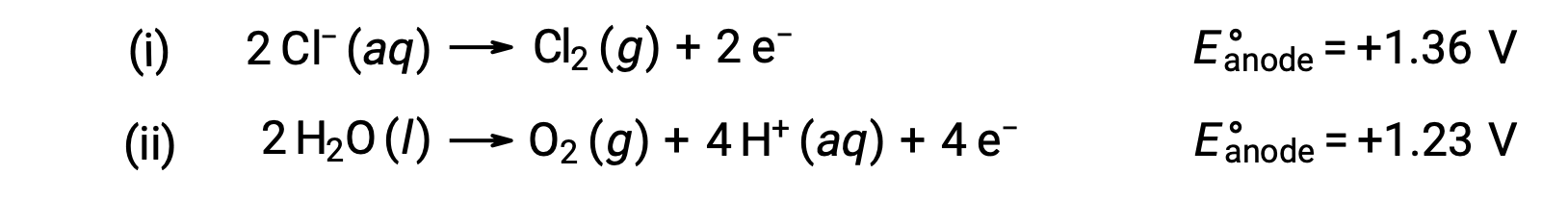
من الناحية الديناميكية الحرارية، سيكون الماء أكثر تأكسداً؛ ومع ذلك، من الناحية العملية، يتم إنتاج غاز الكلور. تتطلب عملية أكسدة الماء جهداً أكبر بكثير للبدء. للتغلب على هذا الجهد الزائد، يتم اختيار الأقطاب الكهربائية ومراقبة إمكانات الخلية بعناية لضمان أكسدة أيونات الكلوريد عند الأنود.
وبالمثل، فإن تفاعلات الاختزال المحتملة عند الكاثود هي:
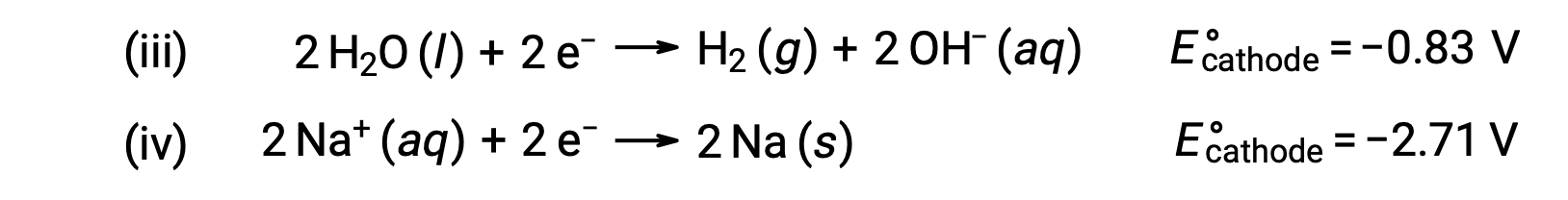
تشير مقارنة إمكانات نصف التفاعل المعيارية إلى أن اختزال الماء مفضل من الناحية الديناميكية الحرارية. ثم يكون تفاعل الخلية النهائي في هذه الحالة هو:
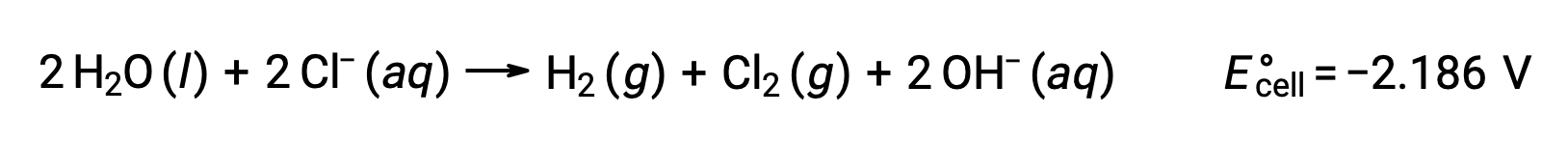
الجوانب الكمية للتحليل الكهربائي
التيار الكهربائي هو معدل تدفق الإلكترونات ويقاس بوحدة الأمبير، كولوم واحد في الثانية A = 1 كولوم/ثانية). الشحنة المنقولة، Q، بمرور تيار ثابت، I، خلال فترة زمنية محددة، t، تعطى بواسطة
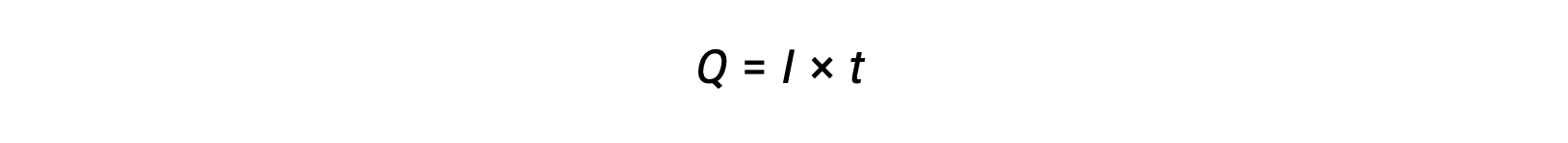
عندما يتم نقل الإلكترونات أثناء عملية الأكسدة والاختزال، يمكن استخدام القياس المتكافئ للتفاعل لاشتقاق الكمية الإجمالية للشحنة (الإلكترونية) المعنية. على سبيل المثال، عملية الاختزال العامة،
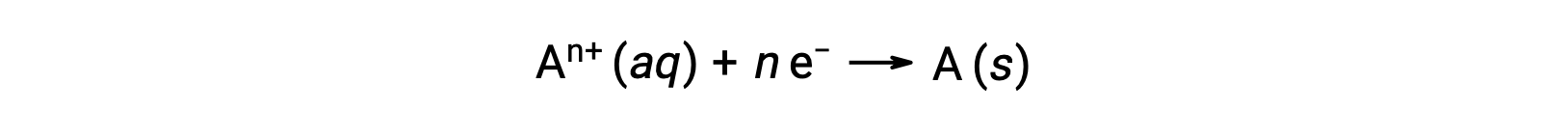
يتضمن نقل n مول من الإلكترونات. وبالتالي، فإن الشحنات المحولة هي
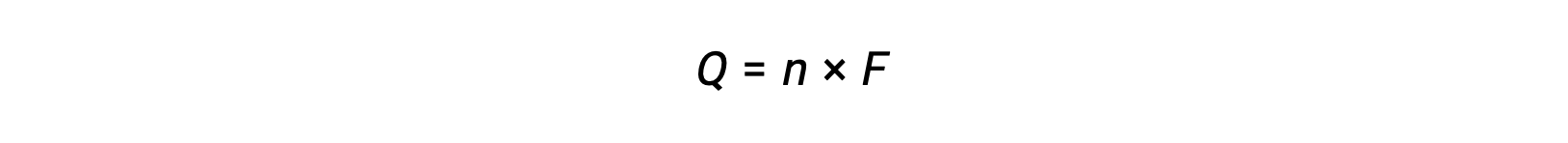
حيث F هو ثابت فاراداي، الشحنة في كولوم لمول واحد من الإلكترونات. بالنسبة للخلية الكهروكيميائية، يتم قياس التدفق الحالي ويمكن استخدامه في الحسابات المتكافئة المتعلقة بتفاعل الخلية.
هذا النص مقتبس من OpenStax, Chemistry 2e, Section 17.7: Electrolysis.
