18.10:
电解
18.10:
电解
在原电池(伽凡尼电池)中,由于自发氧化还原反应产生的电子通过外部电路传输,氧化还原系统在其周围完成电气工作。 或者,外部电路确实可以在氧化还原系统上工作,方法是施加足够的电压,以在称为电解的过程中驱动非自发反应。 例如,为电池充电需要使用外部电源以反向驱动自发 (放电) 电池反应,从而在一定程度上恢复半电池的成分和电池的电压。 其他例子包括在金属矿石的精炼中使用电解,制造商品化学品以及在器皿,珠宝等上对金属涂层进行电镀
预测电解的生成物
熔融氯化钠 NaCl (l) 的电解用于金属钠,钠和氯气 Cl2 的工业生产。 钠离子 (Na+) 在阴极被还原为原子,而氯化离子 (CL−) 离子在阳极被氧化成氯气 (Cl2)。 氧化还原反应如下:
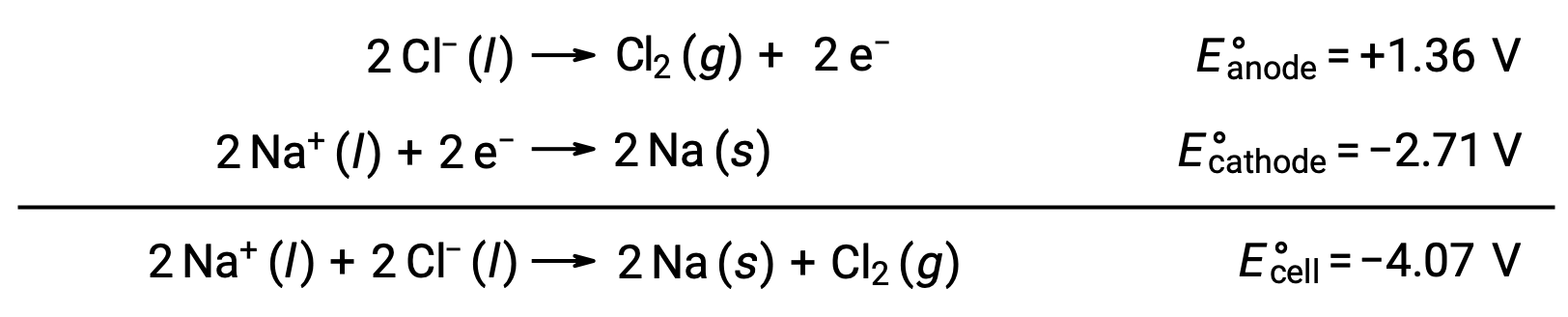
负电池电势表示非自发反应,必须通过施加大于 −4.07 V 的正电位来驱动。 当离子晶体在高温下熔化时,在 801 °C 的高温下进行熔融氯化钠电解。
水的电解产生阳极的氧气和阴极的氢气的化学量。 为了提高电导率,通过添加一个强酸来增加水的氢离子浓度。 相关的氧化还原反应如下:
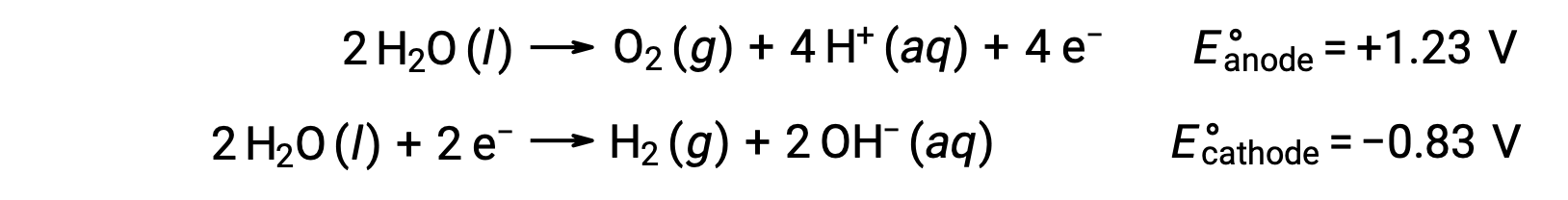
氯化水钠等离子化合物的溶液电解可能涉及阳极和阴极的水种 (H2O , H+ , OH -) 或溶质物种 (化合物的阳离子和阴离子) 电解。
氯化水钠的电解可能涉及以下两种阳极反应之一:
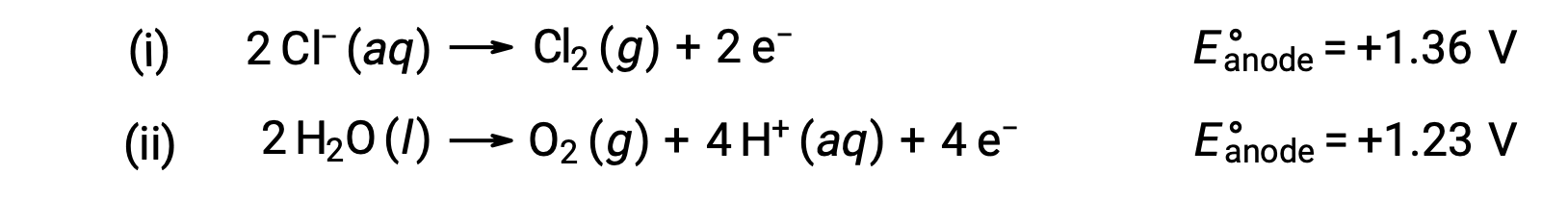
在热动力学方面,水会更容易氧化;但是,在实践中,会产生氯气。 水氧化需要更大的电压才能启动。 为了克服这种过电压,选择了电极,并仔细监测电池的电位,以确保阳极处氯化离子氧化。
同样,阴极可能发生的降噪反应包括:
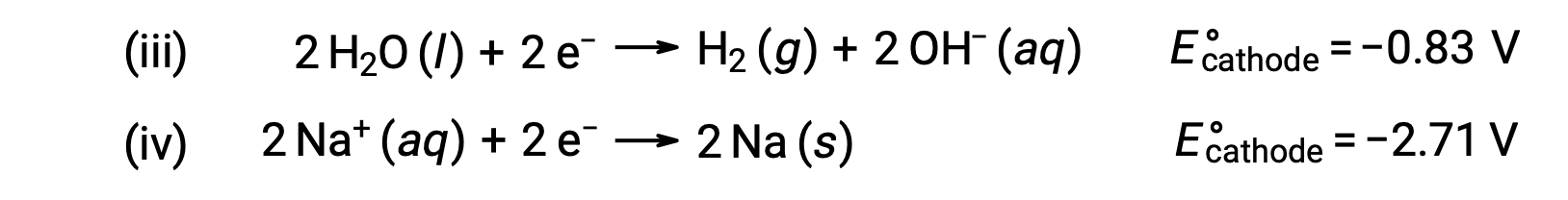
比较这些标准半反应电位表明,水的减少在热动力学上是受欢迎的。 在这种情况下, Net 电池反应是:
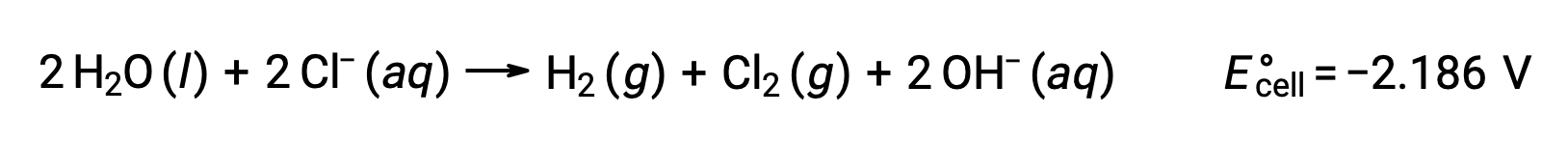
电解的定量的方面
电流是电子流的率值,以安培计量,每秒一个库伦 (A = 1 C/s)。 在指定的时间间隔内,通过恒定电流 i 的通道转移的电荷 Q 是由提供的
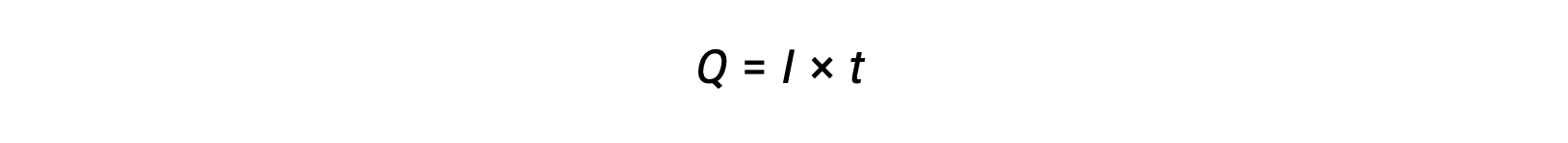
当电子在氧化还原过程过程中被传输时,反应的化学测量可用于得出所涉及的 (电子) 电荷的总数量。 例如,通用还原过程,
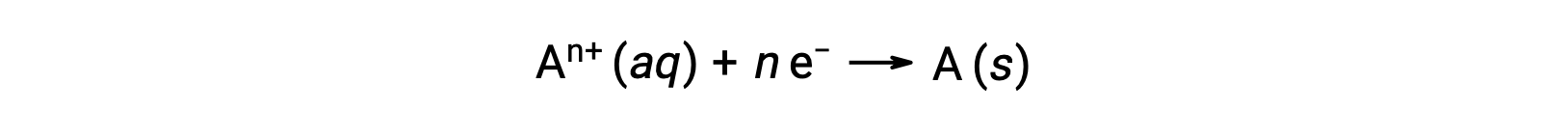
涉及电子的 n 摩尔传输。 因此,转移的电荷
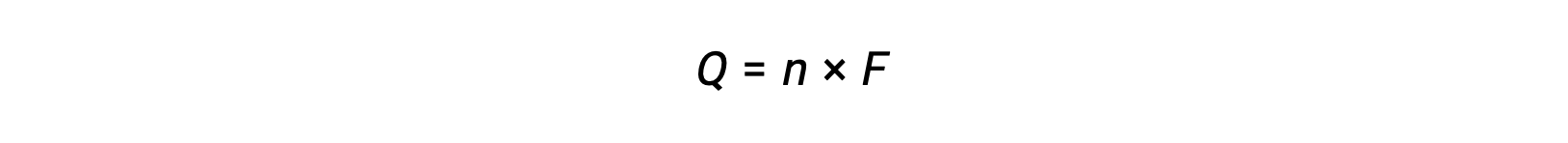
其中 F 为法拉第常数,电荷为库伦一摩尔电子。 对于电化学电池,测量电流,并可用于与电池反应相关的化学化学当量计算。
本文改编自 OpenStax, 化学 2e, 第17.7节: 电解。
