18.10:
전기분해
18.10:
전기분해
갈바닉 셀에서, 전기 작업은 자발적인 레독반응에 의해 생성된 전자가 외부 회로를 통해 전달됨에 따라 주변의 레독스 시스템에 의해 수행된다. 또는 외부 회로는 전기 분해로 알려진 공정에서 그렇지 않으면 비자발적 반응을 구동하기에 충분한 전압을 부과하여 레독스 시스템에서 작동합니다. 예를 들어, 배터리를 충전하는 것은 외부 전원의 사용을 사용하여 역방향으로 자발적인 (방전) 셀 반응을 구동하여 하프 셀의 조성 및 배터리 전압을 어느 정도 복원하는 것을 포함한다. 다른 예로는 금속 광의 정제에 전분해 사용, 상품 화학 물질의 제조 및 금속 코팅의 전자 도금 등이 있습니다.
전기 분해 제품 예측
용융 나트륨염화, NaCl(l)의전동 분해는 금속 나트륨, Na 및 염소 가스, Cl2의산업 생산에 사용된다. 나트륨 이온(Na+)은음극에서 원자로 감소되고, 염화물 이온(Cl−) 이온은 양극에서 염소 가스, Cl2로산화된다. 레독스 반응은 다음과 같습니다.
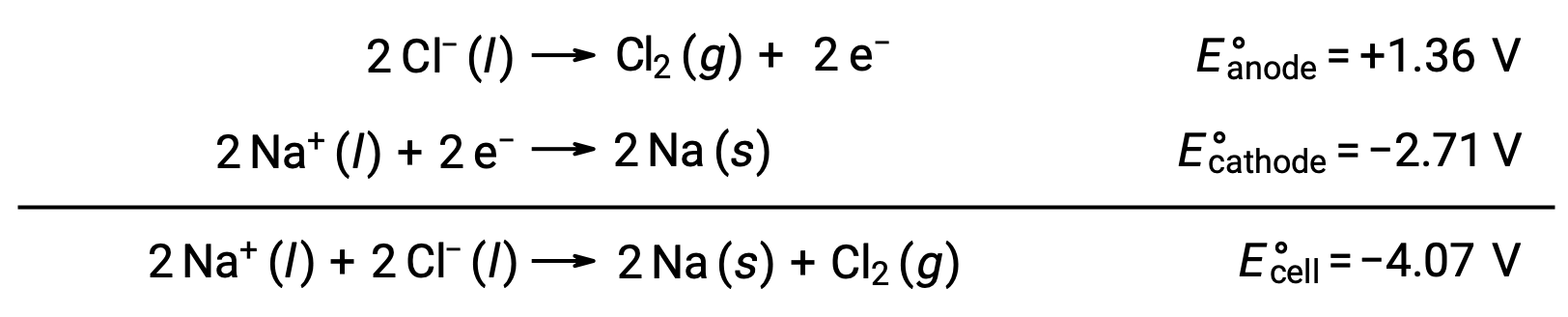
음의 세포 전위는 -4.07 V. 염화나트륨의 전분해보다 큰 크기의 양전성을 부과하여 구동되어야 하는 비자발적 반응을 나타내며, 이온 고체가 고온에서 녹으면서 801°C의 고온에서 수행된다.
물의 전동 분해는 음극에서 양극과 수소에 산소 가스의 stoichiometric 양을 생성합니다. 전기 전도도를 향상시키기 위해 강한 산을 첨가하여 물의 수소 이온 농도가 증가합니다. 관련 레독스 반응은 다음과 같습니다.
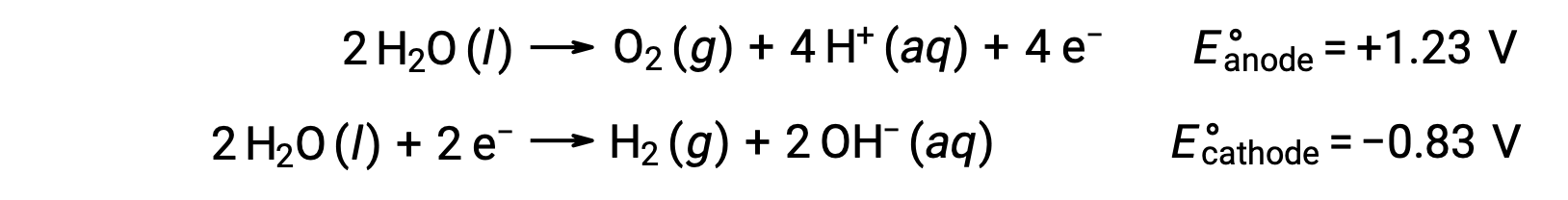
염화나트륨과 같은 이온 화합물의 용액의 전분해는 양극 및 음극에서 물 종(H2O, H+OH)또는 솔루트 종(화합물의 양이온 및 음이온)의 전분해를 수반할 수 있다.
수성 염화나트륨의 전분해는 이 두 양극 반응 중 하나를 포함할 수 있습니다:
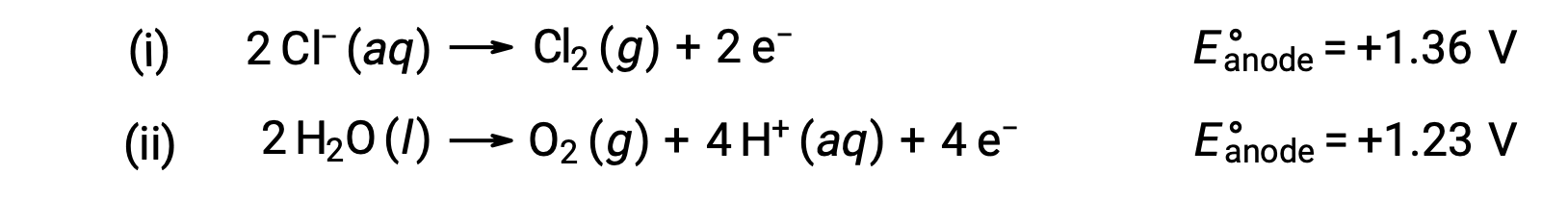
열역학적으로, 물은 더 쉽게 산화될 것입니다; 그러나 실제로 염소 가스가 생산됩니다. 물을 산화하려면 훨씬 더 큰 전압이 필요합니다. 이 과전압을 극복하기 위해 전극이 선택되고 세포의 전위가 신중하게 모니터링되어 양극에서 염화물 이온의 산화가 보장됩니다.
마찬가지로 음극에서 가능한 감소 반응은 다음과 같습니다.
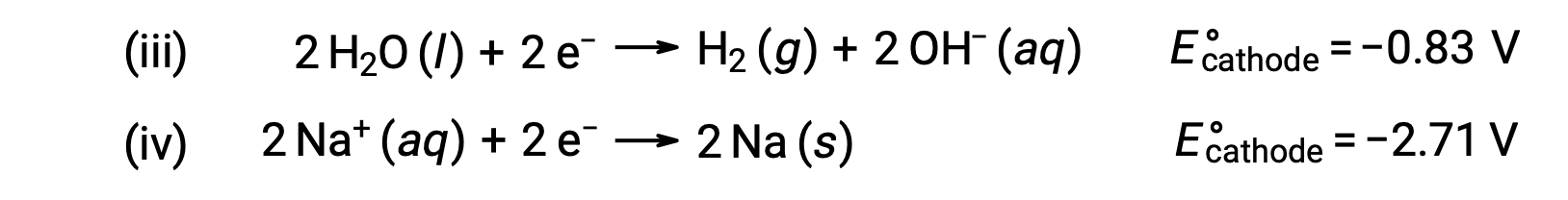
이러한 표준 반반응 잠재력을 비교하면 물의 감소가 열역학적으로 선호된다는 것을 알 수 있습니다. 이 경우 순 세포 반응은 다음과 같은 것입니다.
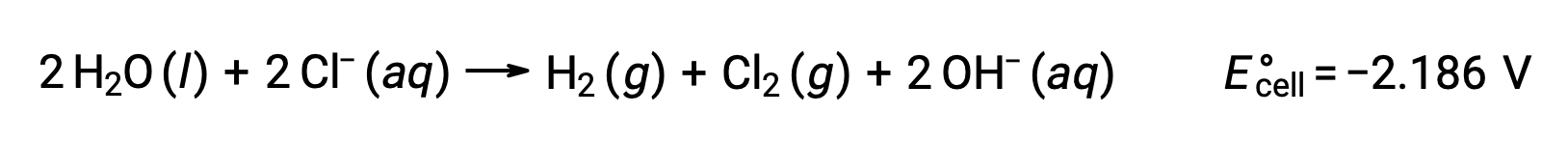
전기 분해의 정량적 측면
전류는 전자의 흐름 속도이며 초당 하나의 coulomb(A = 1 C/s)에서 암페어로 측정됩니다. 전송된 전하, Q,일정한 전류의 통과에 의해, 나는지정된 시간 간격을 통해, t,
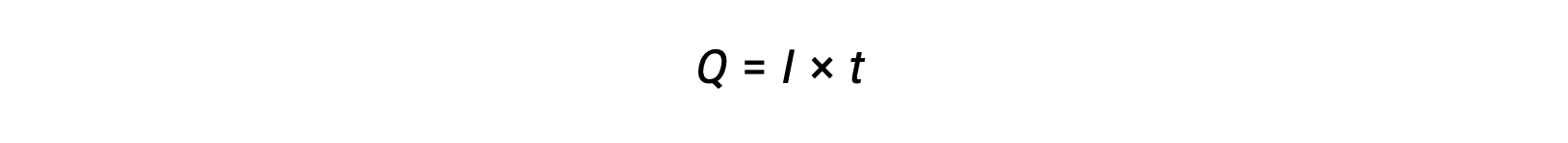
전자가 레독스 과정에서 전염될 때, 반응의 stoichiometry는 관련된 총 (전자) 전하의 양을 유도하는 데 사용될 수 있다. 예를 들어, 제네릭 감소 프로세스는
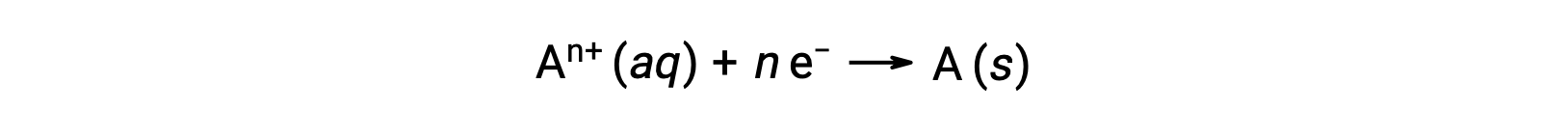
전자의 n 두더지의 전송을 포함한다. 따라서 전송된 요금은
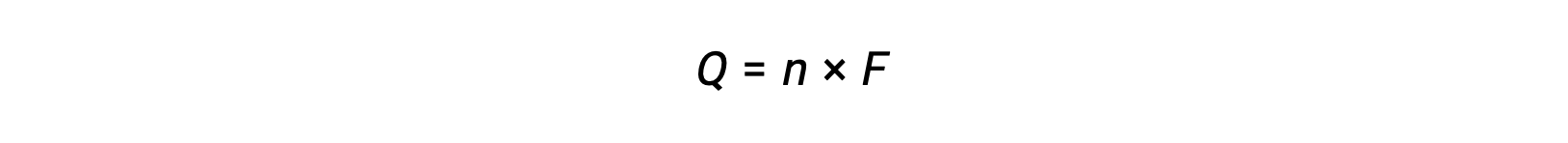
여기서 F는 패라데이의 상수, 전자의 한 두더지에 대한 coulombs의 충전. 전기 화학 전지의 경우, 전류 흐름이 측정되고 세포 반응과 관련된 스토이치오메트릭 계산에 사용될 수 있다.
