18.10:
Elektroliz
18.10:
Elektroliz
Galvanik bir hücrede, spontan redoks reaksiyonları tarafından üretilen elektronlar harici bir devreden aktarıldığı için elektriksel iş, çevresindeki bir redoks sistemi tarafından yapılır. Alternatif olarak, harici bir devre, elektroliz olarak bilinen bir işlemde farklı bir spontan olmayan reaksiyonu ilerletmek için yeter kadar voltaj uygulayarak bir redoks sistemi üzerinde çalışır. Örneğin, bir pilin şarj edilmesi, spontan (deşarj) hücre reaksiyonunu ters yönde ilerletmek için harici bir güç kaynağının kullanılmasını içerir, bu da yarım hücrelerin bileşimini ve pilin voltajını bir dereceye kadar geri yükler. Diğer örnekler arasında metalik cevherlerin arıtılmasında elektroliz kullanımı, emtia kimyasallarının üretimi ve metalik kaplamaların mutfak eşyaları, mücevherler vb. üzerine elektroliz edilmesi sayılabilir.
Elektroliz Ürününü Tahmin Etme
Erimiş sodyum klorürün elektrolizi, NaCl (l), metalik sodyum, Na ve klor gazı, Cl2‘nin endüstriyel üretimi için kullanılır. Sodyum iyonları (Na+) katottaki atomlara indirgenirken, klorür iyonları (Cl−) iyonları anotta klor gazı Cl2‘ye oksitlenir. Redoks reaksiyonları şunlardır:
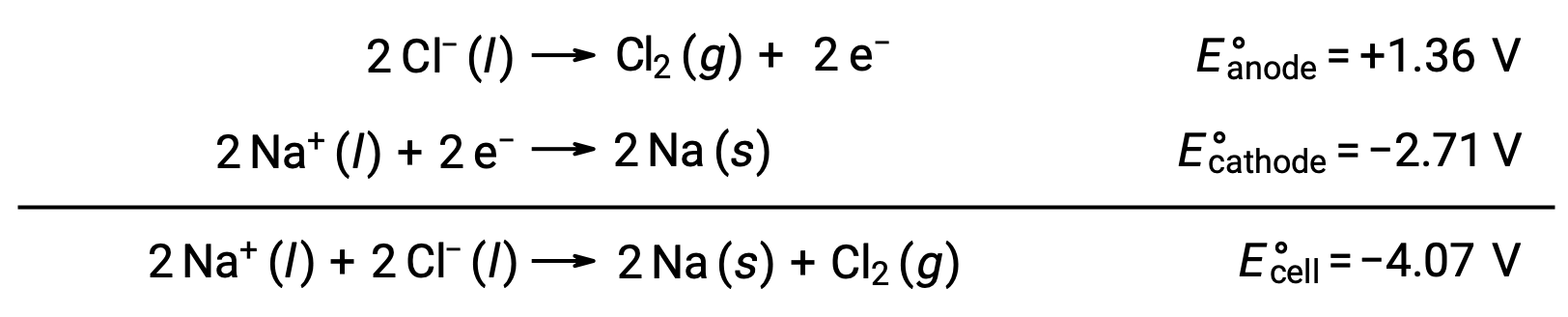
Negatif hücre potansiyeli, −4,07 V’den daha büyük bir pozitif potansiyel uygulayarak yönlendirilmesi gereken spontan olmayan bir reaksiyonu gösterir. Erimiş sodyum klorürün elektrolizi, iyonik katılar yüksek sıcaklıklarda eridiği için 801 °C’lik yüksek bir sıcaklıkta gerçekleştirilir.
Suyun elektrolizi, anotta stokiyometrik miktarda oksijen gazı ve katotta hidrojen üretir. Elektriksel iletkenliği arttırmak için, suyun hidrojen iyonu konsantrasyonu, güçlü bir asit ilave edilerek arttırılır. İlişkili redoks reaksiyonları şunlardır:
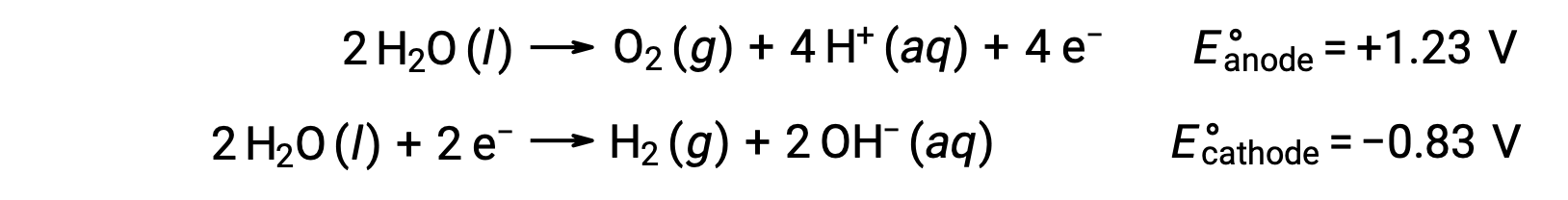
Sulu sodyum klorür gibi iyonik bileşiklerin çözeltilerinin elektrolizi, anot ve katotta su türlerinin (H2O, H+, OH–) veya çözünen türlerin (bileşiğin katyonları ve anyonları) elektrolizini içerebilir.
Sulu sodyum klorürün elektrolizi, bu iki anot reaksiyonundan herhangi birini içerebilir:
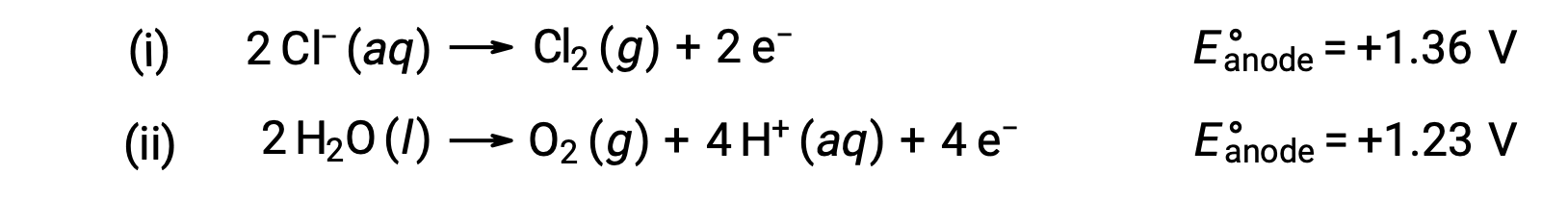
Termodinamik olarak, su daha kolay oksitlenir, ancak pratikte klor gazı üretilir. Suyun oksidasyonunu başlatmak için çok daha büyük bir voltaj gerektirecektir. Bu aşırı voltajın üstesinden gelmek için elektrotlar seçilir ve anottaki klorür iyonlarının oksidasyonunu sağlamak için hücrenin potansiyeli dikkatle izlenir.
Benzer şekilde, katottaki olası indirgeme reaksiyonları şunlardır:
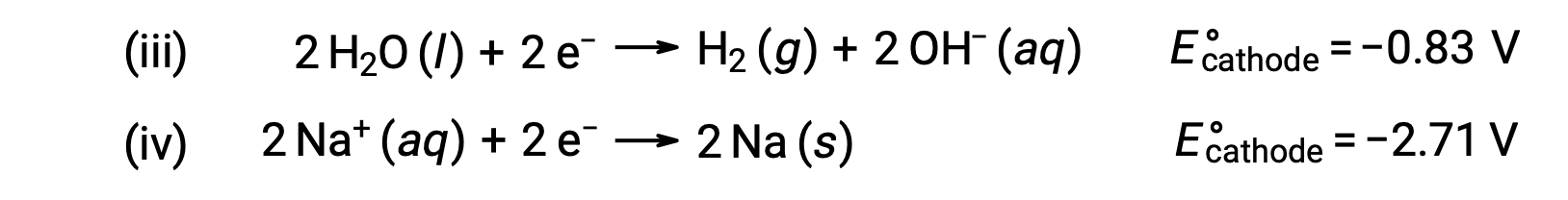
Bu standart yarı reaksiyon potansiyellerinin karşılaştırılması, suyun azaltılmasının termodinamik olarak tercih edildiğini göstermektedir. Bu durumda net hücre reaksiyonu daha sonra:
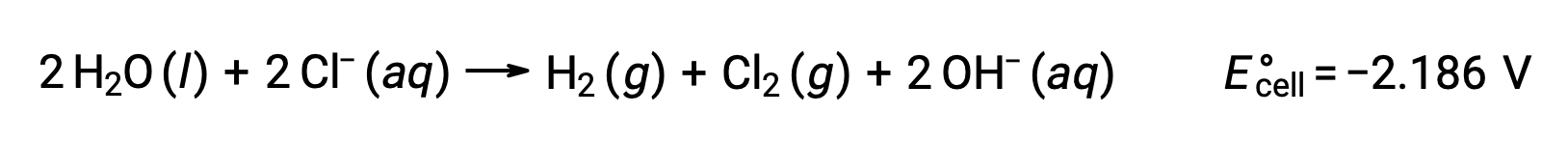
Elektrolizin Kantitatif Yönleri
Elektrik akımı elektronların akış hızıdır ve amper cinsinden ölçülür, saniyede bir coulomb (A = 1 C/s). Aktarılan yük, Q, sabit bir akımın geçişi ile, I, belirli bir zaman aralığında, t, tarafından verilir
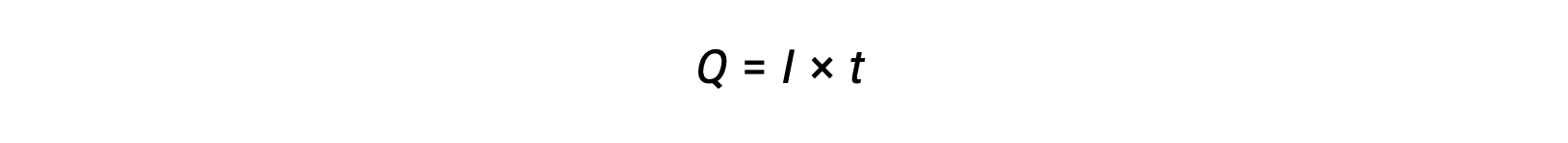
Bir redoks işlemi sırasında elektronlar transfer edildiğinde, reaksiyonun stokiyometrisi, ilgili toplam (elektronik) yük miktarını elde etmek için kullanılabilir. Örneğin, genel indirgeme işlemi,
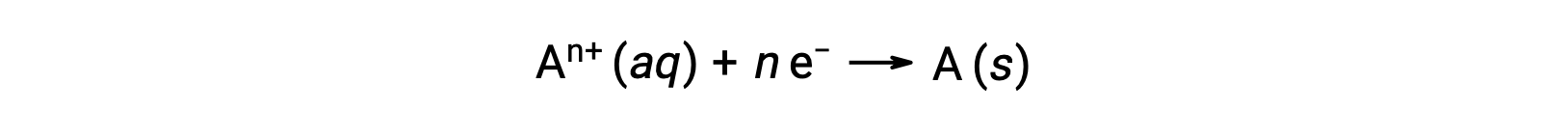
elektronların n molünün transferini içerir. Aktarılan yük, bu nedenle,
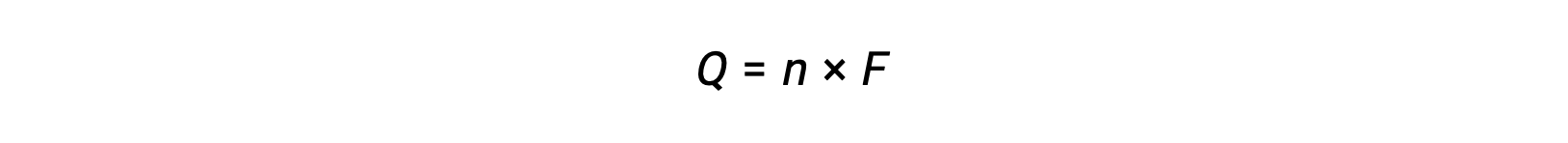
burada F, Faraday sabitidir, bir mol elektron için coulomb cinsinden yükü ifade eder. Bir elektrokimyasal hücre için, akım akışı ölçülebilir ve hücre reaksiyonu ile ilgili stokiyometrik hesaplamalarda kullanılabilir.
Bu metin bu kaynaktan uyarlanmıştır: OpenStax, Chemistry 2e, Section 17.7: Electrolysis.
