18.10:
Электролиз
18.10:
Электролиз
В гальванической ячейке электрическая работа осуществляется системой ОВП на её окрестности, поскольку электроны, производимые спонтанными окислительно-восстановительных реакциями, передаются через внешнюю цепь. В качестве альтернативы, внешняя цепь работает на ОВП-системе, устанавливая напряжение, достаточное для того, чтобы в процессе, известном как электролиз, в противном случае спонтанная реакция. Например, перезарядка аккумулятора предполагает использование внешнего источника питания для спонтанной (разряженной) реакции ячейки в обратном направлении, восстанавливая в некоторой степени состав полуячеек и напряжение батареи. К другим примерам относится использование электролиза в утончении металлических руд, производстве товарных химических веществ, а также гальваническое покрытие металлических покрытий на утварь, украшения и т.д.
Прогнозирование продукта электролиза
Электролиз расплавленного хлорида натрия, NaCl (l), используется для промышленного производства металлического натрия, Na и хлора, Cl2. Ионы натрия (Na+) уменьшаются до атомов на катоде, а ионы хлорида окисляются до хлора, Cl2, на аноде. Окислительно-восстановительные реакции:
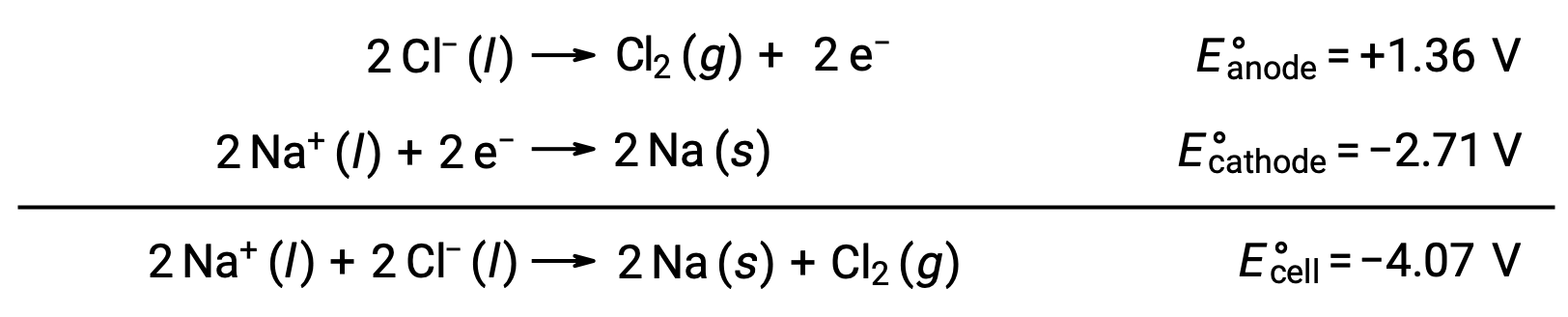
Отрицательный клеточный потенциал указывает на неспонтанную реакцию, которая должна быть проведена путем наложения положительного потенциала величиной более -12 4.07 В. Электролиз расплавленного хлорида натрия осуществляется при высокой температуре 801 °C, так как ионные твердые вещества расплавляются при высоких температурах.
Электролиз воды производит стехиометрические количества кислорода на аноде и водорода на катоде. Для улучшения электропроводности концентрация ионов водорода в воде увеличивается за счет добавления сильной кислоты. Связанные с ними окислительно-восстановительные реакции:
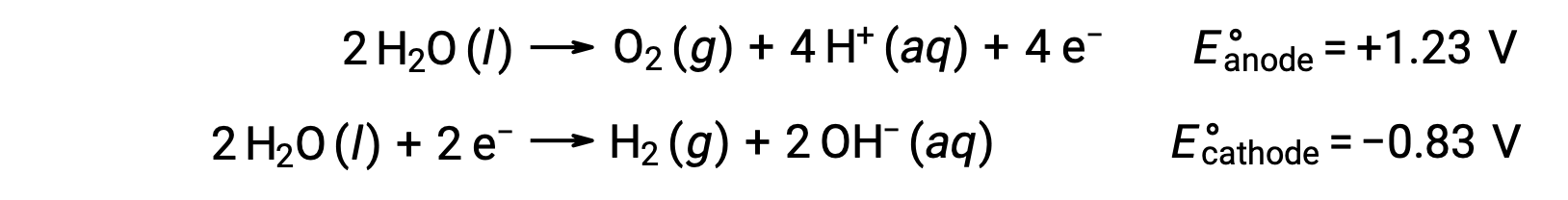
Электролиз растворов ионных соединений, таких как водный хлорид натрия, может включать электролиз как водных видов (H2O, H+, OH–), так и видов растворённое вещество (катионов и анионов соединения) на аноде и катоде.
Электролиз водного хлорида натрия может включать одну из двух реакций анода:
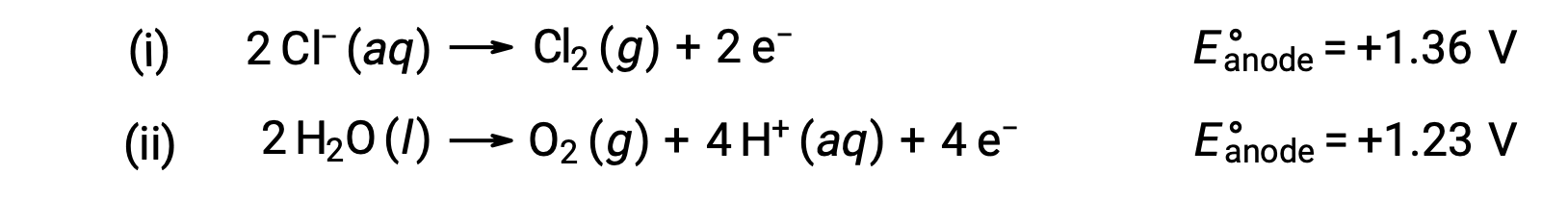
Термодинамически вода будет легче окисляться; однако на практике образуется хлор. Для окисления воды потребуется значительно большее напряжение. Для преодоления этого перенапряжения выбираются электмоль и тщательно отслеживается потенциал ячейки, чтобы гарантировать окисление ионов хлорида на аноде.
Аналогично, возможные реакции снижения на катоде:
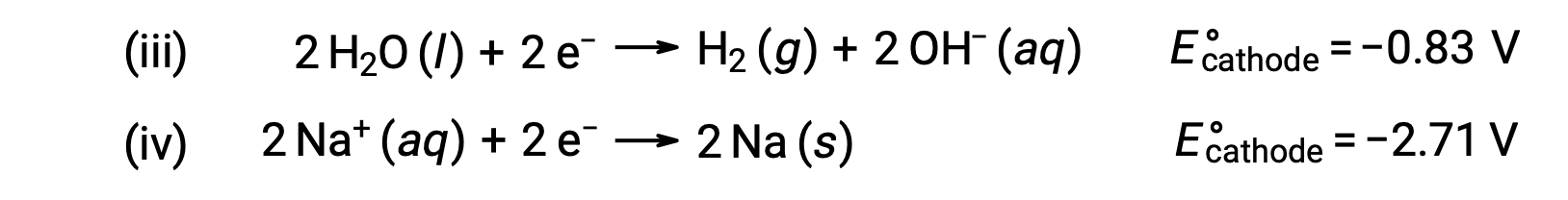
Сравнение этих стандартных потенциалов половинной реакции позволяет предположить, что снижение воды термодинамически предпочтется. В этом случае реакция ячейки сети будет следующей:
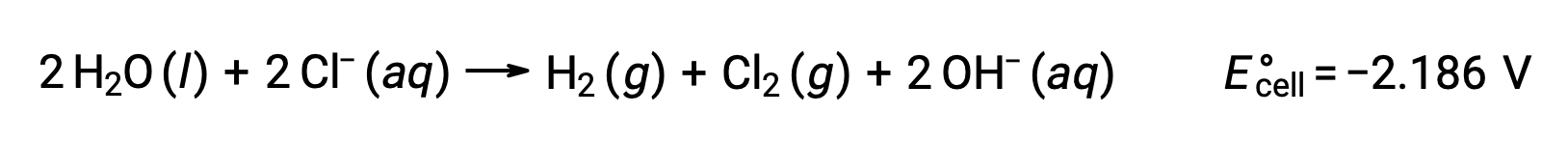
Количественные аспекты электролиза
Электрический ток — это скорость потока электронов и измеряется в амперах, один кулон в секунду (A = 1 C/s). Переданный заряд, Q, по проходу постоянного тока, I, за указанный временной интервал, t, дается
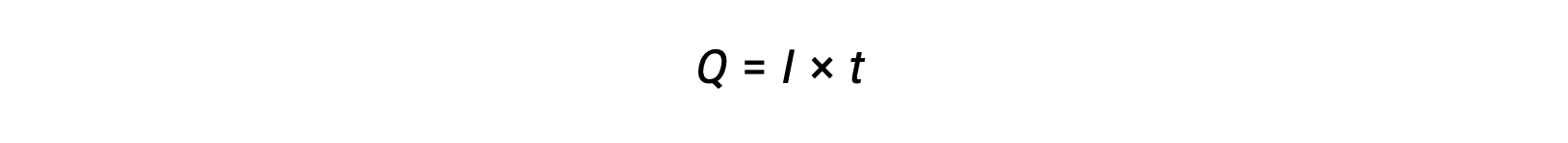
Когда электроны передаются в процессе ОВП, стехиометрия реакции может использоваться для получения общего количества (электронного) заряда. Например, общий процесс сокращения,
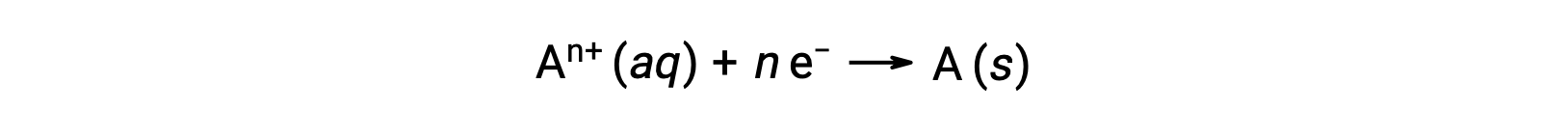
включает передачу n моль электронов. Таким образом, передаваемый сбор
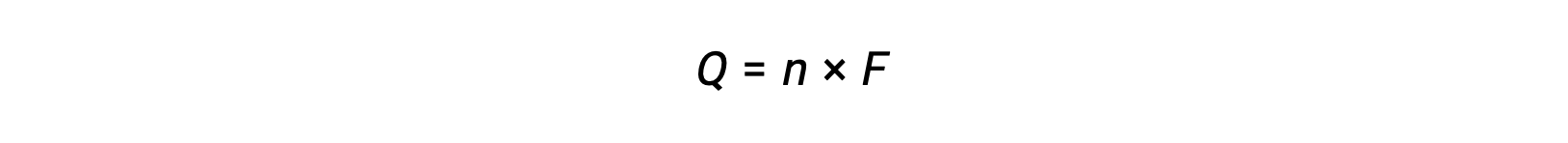
Где F – постоянная Фарадея, заряд кулонов для одного моль электронов. Для электрохимической ячейки измеряется ток, который можно использовать в стехиометрических расчетах, связанных с реакционной реакцией клетки.
Этот текст был адаптирован к OpenStax, Химия 2е изд., раздел 17.7: Электролиз.
