18.10:
Électrolyse
18.10:
Électrolyse
Dans une cellule galvanique, le travail électrique est effectué par un système redox sur son environnement extérieur, car les électrons produits par les réactions redox spontanées sont transférés à travers un circuit externe. Sinon, un circuit externe effectue un travail sur un système redox en imposant une tension suffisante pour forcer une réaction non spontanée dans un processus connu sous le nom d’électrolyse. Par exemple, la recharge d’une pile implique l’utilisation d’une source d’alimentation externe pour forcer la réaction spontanée (décharge) de la cellule dans le sens inverse, en restaurant dans une certaine mesure la composition des demi-cellules et la tension de la pile. D’autres exemples incluent l’utilisation de l’électrolyse dans le raffinement des minerais métalliques, la fabrication de produits chimiques de base et l’électrodéposition de revêtements métalliques sur les ustensiles, les bijoux, etc.
Prévision du produit de l’électrolyse
L’électrolyse du chlorure de sodium fondu, NaCl (l), est utilisée pour la production industrielle de sodium métallique, Na, et de chlore gazeux, Cl2. Les ions sodium (Na+) sont réduits en atomes à la cathode, tandis que les ions chlorure (Cl−) sont oxydés en chlore gazeux (Cl2) à l’anode. Les réactions d’oxydoréduction sont les suivantes :
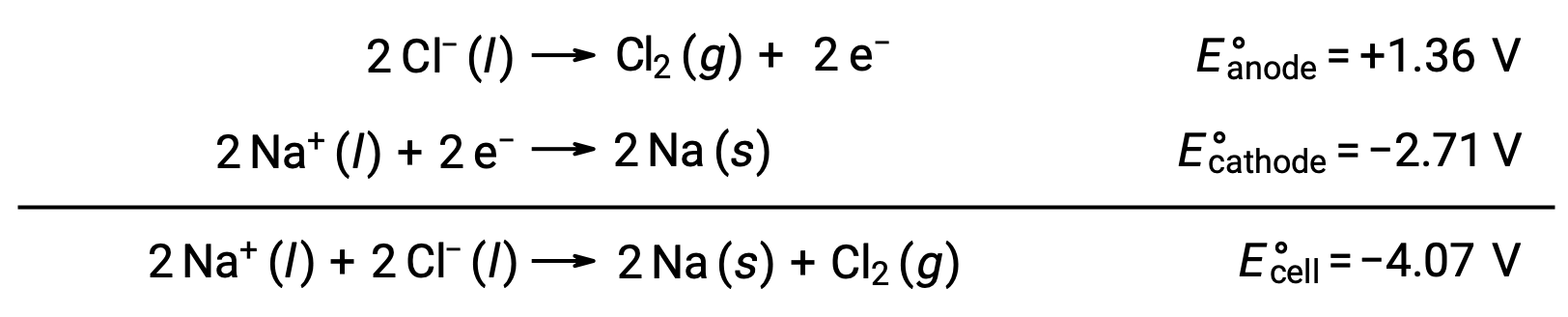
Le potentiel de cellule négatif indique une réaction non spontanée qui doit être forcée en imposant un potentiel positif d’une valeur algébrique supérieure à −4,07 V. L’électrolyse du chlorure de sodium fondu est effectuée à une température élevée de 801 °C lorsque les solides ioniques fondent à des températures élevées.
L’électrolyse de l’eau produit des quantités stœchiométriques d’oxygène gazeux à l’anode et d’hydrogène à la cathode. Pour améliorer la conductivité électrique, on augmente la concentration en ions hydrogène de l’eau en ajoutant un acide fort. Les réactions redox associées sont les suivantes :
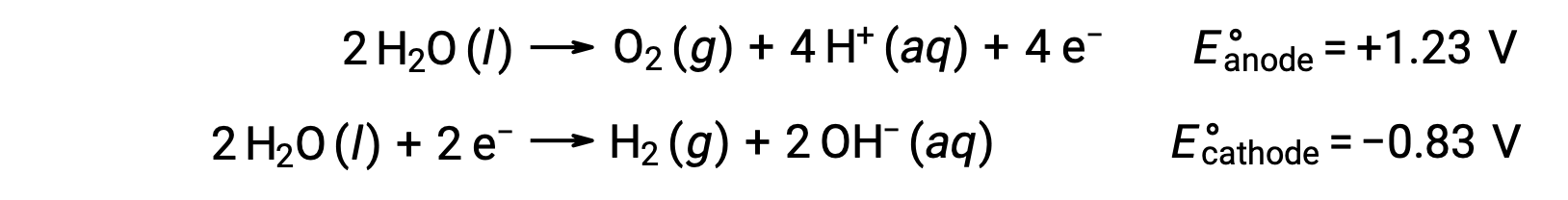
L’électrolyse de solutions de composés ioniques tels que le chlorure de sodium aqueux peut impliquer l’électrolyse des espèces de l’eau (H2O, H+, OH–) ou des espèces du soluté (les cations et anions du composé) à l’anode et à la cathode.
L’électrolyse du chlorure de sodium aqueux pourrait impliquer l’une des deux réactions suivantes à l’anode :
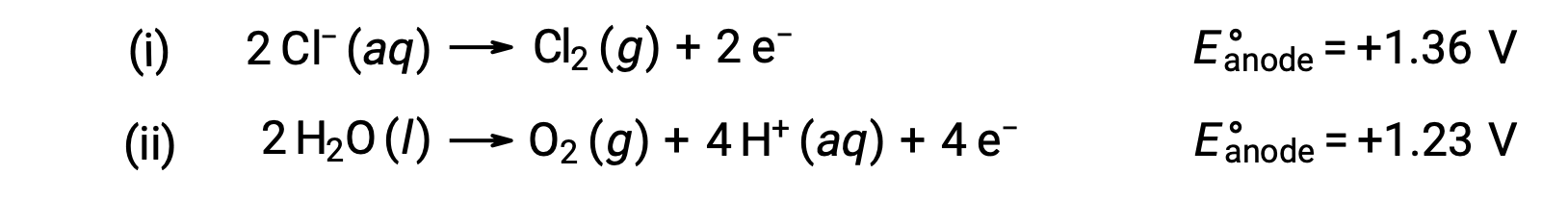
Thermodynamiquement, l’eau devrait être plus facilement oxydée ; cependant, dans la pratique, du chlore gazeux est produit. L’oxydation de l’eau nécessite une tension beaucoup plus élevée pour démarrer. Pour surmonter cette surtension, les électrodes sont choisies et le potentiel de la cellule est soigneusement surveillé afin de garantir l’oxydation des ions chlorure au niveau de l’anode.
De même, les réactions de réduction possibles au niveau de la cathode sont les suivantes :
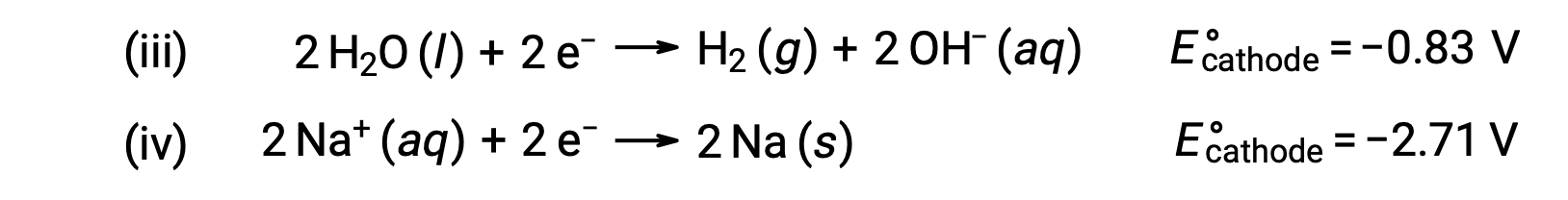
La comparaison de ces potentiels de demi-réaction standard indique que la réduction de l’eau est thermodynamiquement favorisée. Dans ce cas, la réaction de la cellule nette est la suivante :
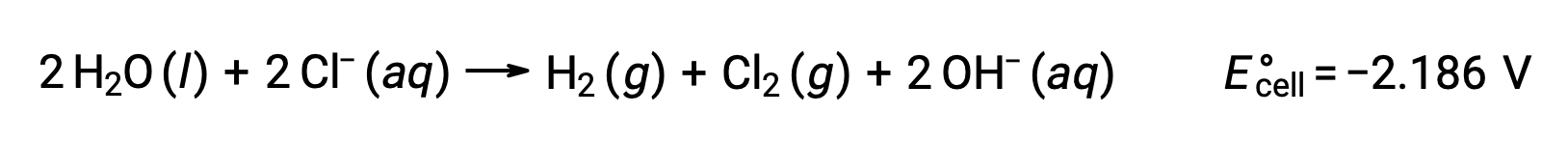
Aspects quantitatifs de l’électrolyse
Le courant électrique est la vitesse du flux d’électrons et il est mesuré en ampère, un coulomb par seconde (A = 1 C/s). La charge transférée, Q, par le passage d’un courant constant, I, sur un intervalle de temps spécifié, t, est donnée par
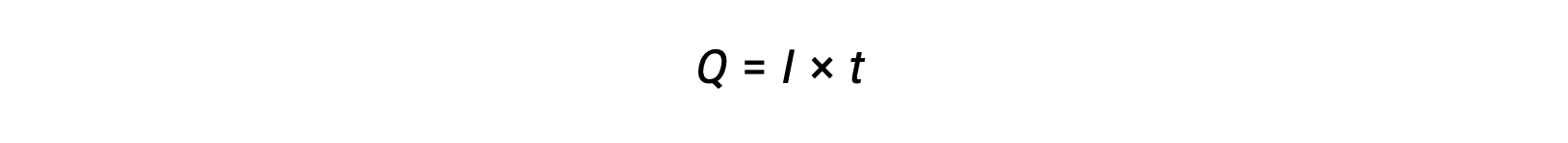
Lorsque les électrons sont transférés au cours d’un processus redox, la stœchiométrie de la réaction peut être utilisée pour déduire la quantité totale de charge (électronique) impliquée. Par exemple, le processus général de réduction,
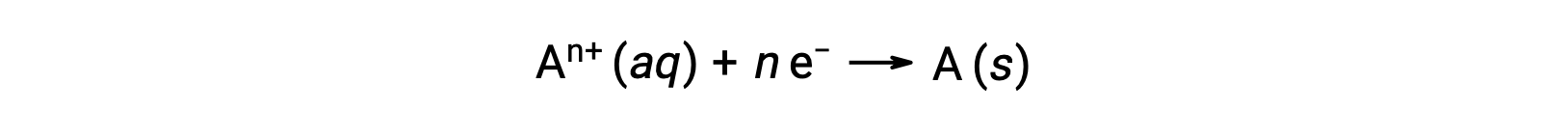
implique le transfert de n mole d’électrons. La charge transférée est, par conséquent,
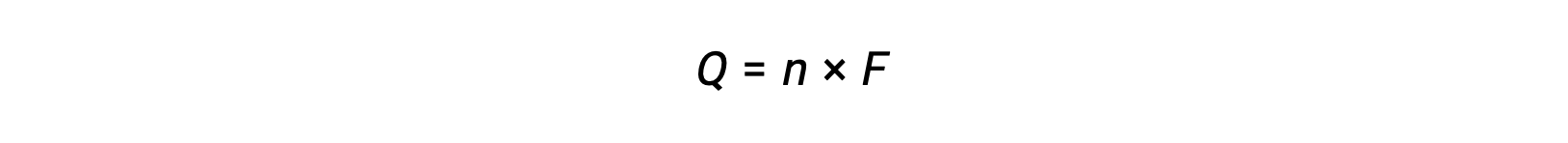
où F est la constante de Faraday, la charge en coulombs pour une mole d’électrons. Pour une cellule électrochimique, le flux de courant est mesuré et peut être utilisé dans les calculs stœchiométriques liés à la réaction de la cellule.
Ce texte est adapté de OpenStax, Chimie 2e, Section 17.7 : Électrolyse.
