18.10:
電気分解
18.10:
電気分解
ガルバニ電池では、自発的な酸化還元反応によって生成した電子が外部回路を介して移動することで、酸化還元系が外部回路に対して電気的な仕事をします。また、電気分解と呼ばれるプロセスでは、自発的ではない反応を起こすのに十分な電圧を外部回路から印加することで、酸化還元系に対して仕事をします。例えば、電池の充電では、外部電源を用いて電池の自発的な(放電)反応を逆方向に駆動させ、電池の組成および電圧をある程度回復させます。他にも、金属鉱石の精錬、汎用化学品の製造、器具や宝飾品への金属被膜の電気メッキなどにも電気分解が利用されています。
電気分解による生成物の予測
溶融した塩化ナトリウム(NaCl(l))の電気分解は、金属ナトリウム(Na)や塩素ガス(Cl2)の工業的生産に利用されています。陰極ではナトリウムイオン(Na+)が単体に還元され、陽極では塩化物イオン(Cl−)イオンが塩素ガスCl2に酸化されます。その酸化還元反応は次の通りです。
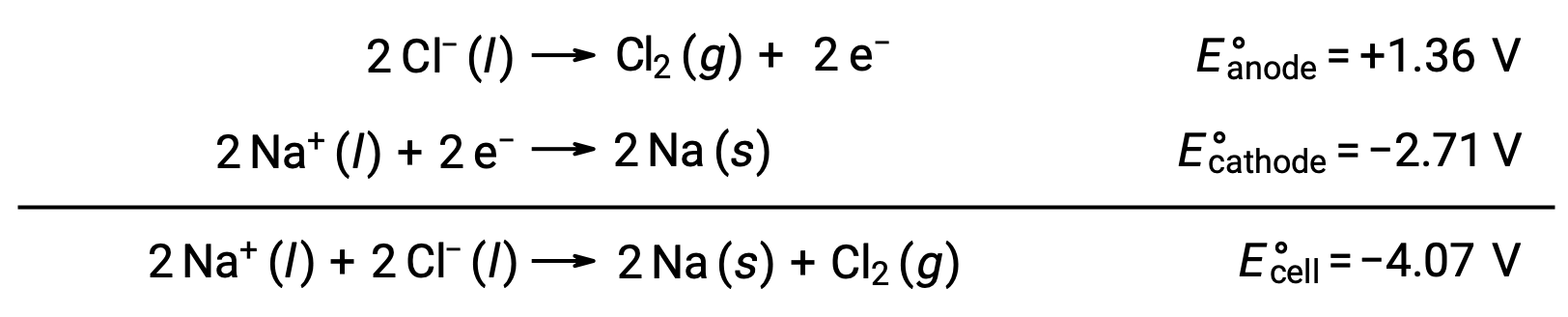
負の電位差は非自発的な反応を示しており、 −4.07 V以上の大きさの正の電位を印加することで駆動させる必要があります。イオン性固体は高温で溶けるため、溶融塩化ナトリウムの電気分解は801 °Cの高温で行われます。
水の電気分解では、アノードにて酸素ガスが、カソードに水素ガスが発生し、電気伝導性を高めるために強酸を加えて水素イオン濃度を高めています。関連する酸化還元反応は次のとおりです。
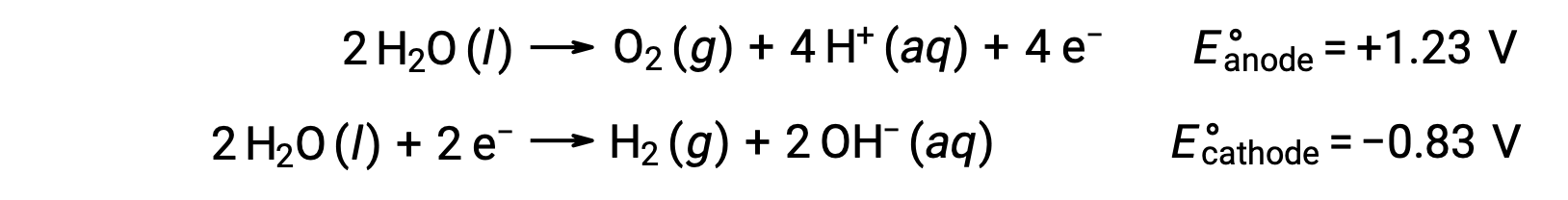
塩化ナトリウム水溶液のようなイオン性化合物の水溶液の電気分解では、アノードとカソードで水のイオン種(H2O, H+, OH–)や溶質のイオン種(化合物の陽イオンと陰イオン)が電気分解されます。
塩化ナトリウム水溶液の電気分解には、以下の2つのアノード反応が考えられます。
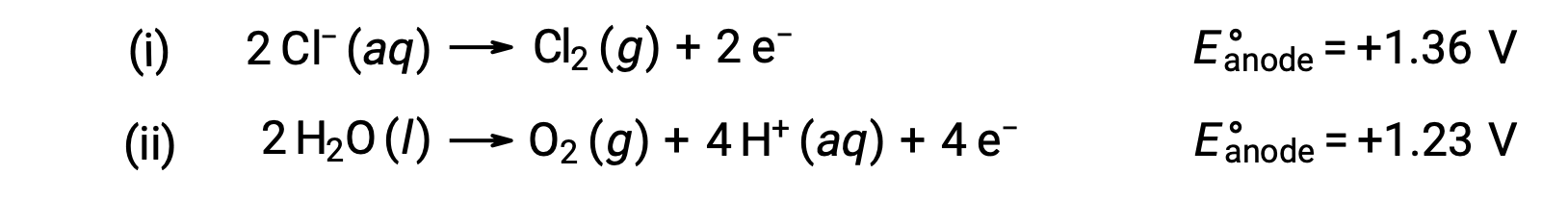
熱力学的には水の方が酸化されやすいが、実際には塩素ガスが発生します。水の酸化反応が進行するためには、より大きな電圧が必要となります。この過電圧を克服するために、適切な電極を選び、電気化学系の電位を注意深くモニターして、アノードでの塩化物イオンの酸化を確実に進行させます。
同様に、カソードで考えられる還元反応は次の通りです。
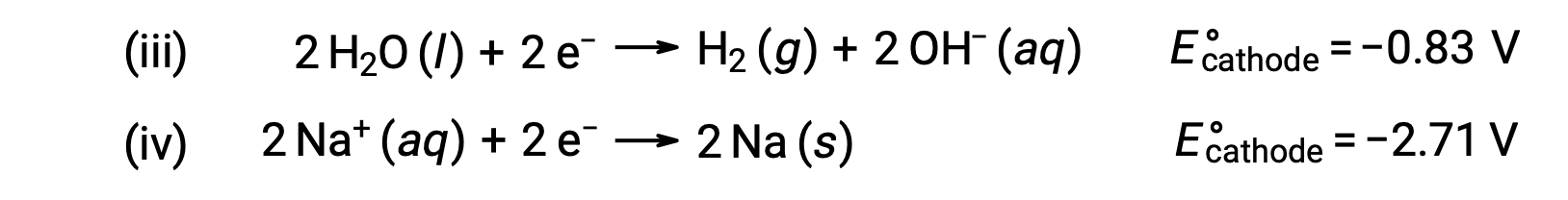
これらの標準的なの半反応の電位を比較すると、水の還元が熱力学的に有利であることがわかります。この場合の電気化学系の正味の反応は、次のようになります。
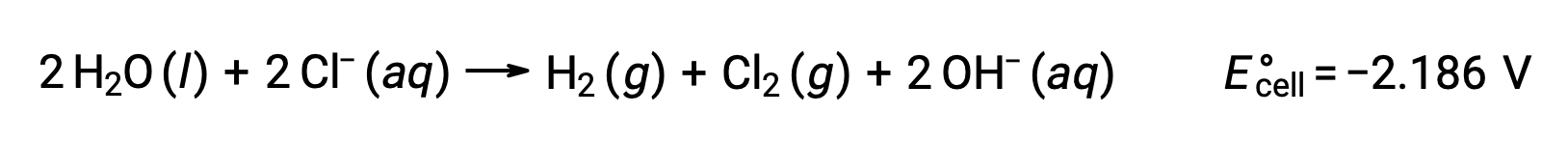
電気分解の定量的側面
電流とは電子の流速であり、単位は1アンペア、すなわち1クーロン/秒(A = 1 C/s)です。一定の時間間隔tで一定の電流Iを流すことによって移動する電荷Qは次のように与えられます。
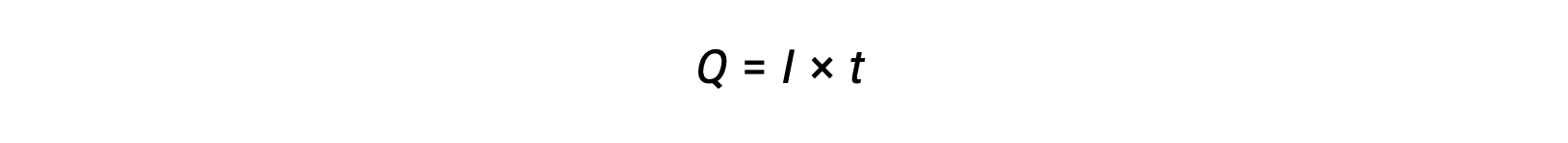
酸化還元過程で電子が移動すると、その反応の化学量論を用いて、関与する電荷の総量を計算することが出来ます。例えば、一般的な還元プロセスでは次の通りです。
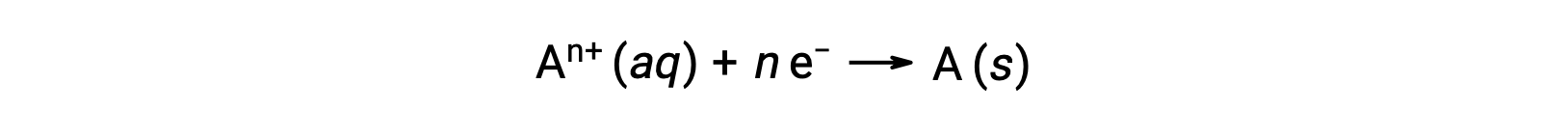
この反応は、nモルの電子の移動を伴う。そのため、移動する電荷量は、次の通りです。
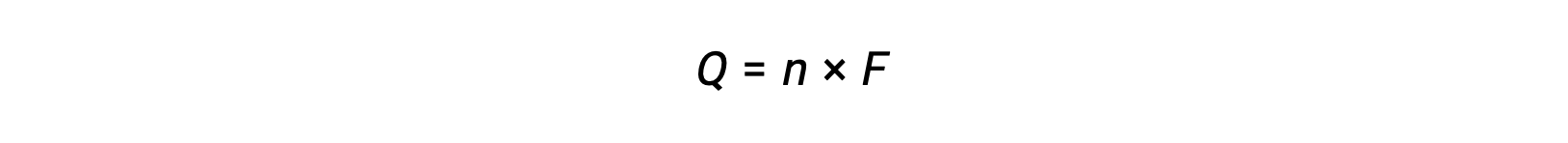
ここで、Fはファラデー定数で、1モルの電子の電荷をクーロンで表したものです。電気化学反応の場合、流れる電流を測定することで、系の反応に関する化学量論的な計算に使用することができます。
上記の文章は以下から引用しました。 OpenStax, Chemistry 2e, Section 17.7: Electrolysis.
