18.10:
La Electrólisis
18.10:
La Electrólisis
En una celda galvánica, el trabajo eléctrico es hecho por un sistema redox en su entorno mientras los electrones producidos por las reacciones espontáneas redox son transferidos a través de un circuito externo. Alternativamente, un circuito externo funciona en un sistema redox imponiendo un voltaje suficiente para accionar una reacción no espontánea en un proceso conocido como electrólisis. Por ejemplo, la recarga de una batería implica el uso de una fuente de alimentación externa para accionar la reacción espontánea de la celda (descarga) en la dirección inversa, restaurando en cierta medida la composición de las semi-celdas y el voltaje de la batería. Otros ejemplos incluyen el uso de la electrólisis en el refinamiento de minerales metálicos, la fabricación de productos químicos básicos y el electrochapado de revestimientos metálicos sobre utensilios, joyas, etc.
Predicción del producto de la electrólisis
La electrólisis del cloruro de sodio fundido, NaCl (l), se utiliza para la producción industrial de sodio metálico, Na, y gas cloro, Cl2. Los iones de sodio (Na+) se reducen a átomos en el cátodo, mientras que los iones de cloruro (Cl−) se oxidan a gas de cloro, Cl2, en el ánodo. Las reacciones redox son:
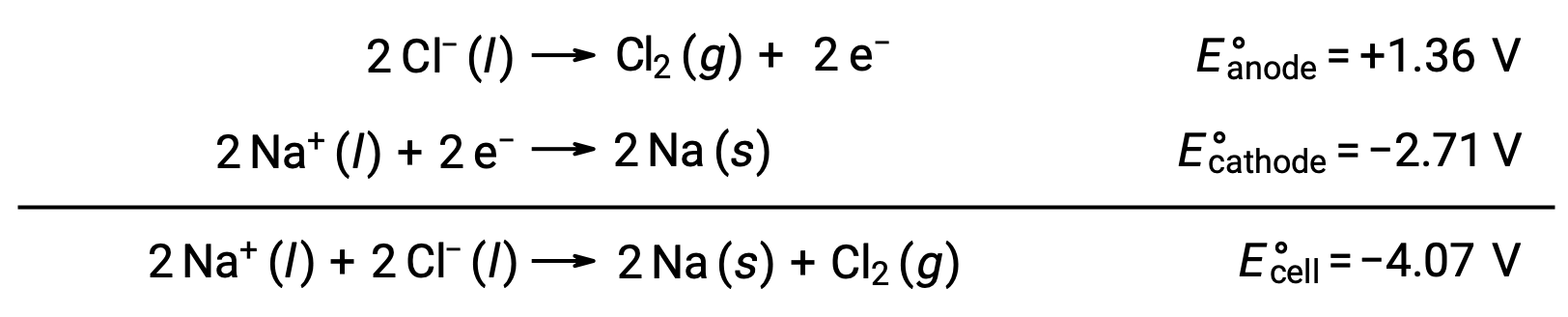
El potencial de celda negativo indica una reacción no espontánea que debe ser impulsada mediante la aplicación de un potencial positivo de magnitud superior a −4,07 V. La electrólisis del cloruro de sodio fundido se realiza a una temperatura alta de 801 °C a medida que los sólidos iónicos se funden a altas temperaturas.
La electrólisis del agua produce cantidades estequiométricas de gas oxígeno en el ánodo e hidrógeno en el cátodo. Para mejorar la conductividad eléctrica, la concentración de iones de hidrógeno del agua aumenta añadiendo un ácido fuerte. Las reacciones redox asociadas son:
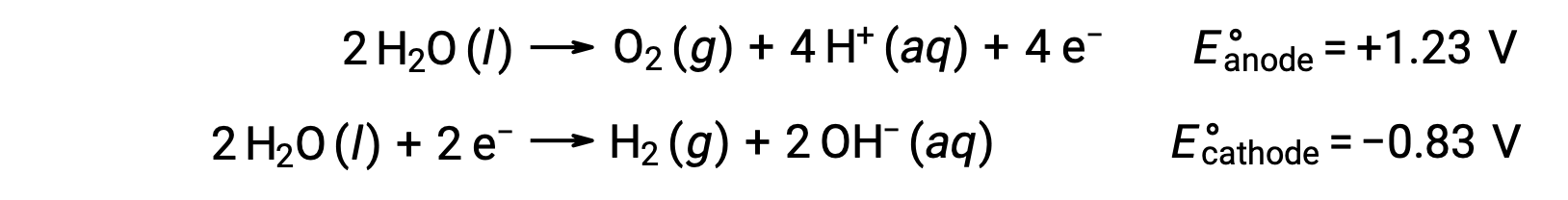
La electrólisis de soluciones de compuestos iónicos como el cloruro de sodio acuoso pueden implicar la electrólisis de especies de agua (H2O, H+, OH–) o de especies de solutos (los cationes y aniones del compuesto) en el ánodo y el cátodo.
La electrólisis del cloruro de sodio acuoso podría implicar cualquiera de estas dos reacciones anódicas:
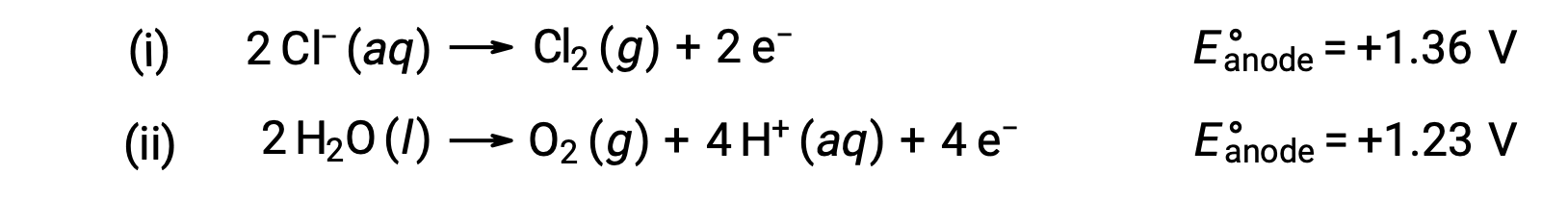
Termodinámicamente, el agua sería oxidada más fácilmente; sin embargo, en la práctica, se produce gas cloro. La oxidación del agua requeriría un voltaje mucho mayor para iniciar. Para superar esta sobretensión, se eligen electrodos y se supervisa cuidadosamente el potencial de la celda para garantizar la oxidación de iones cloruro en el ánodo.
Asimismo, las posibles reacciones de reducción en el cátodo son:
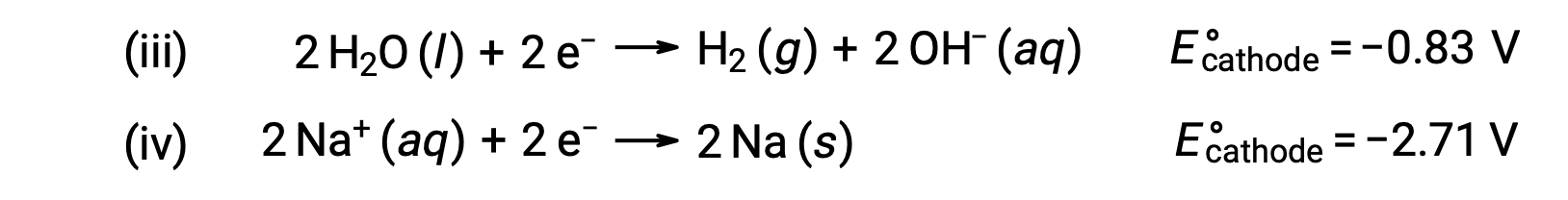
La comparación de estos potenciales de semirreacción estándar sugiere que la reducción del agua es favorecida termodinámicamente. Entonces, la reacción neta de la celda en este caso es:
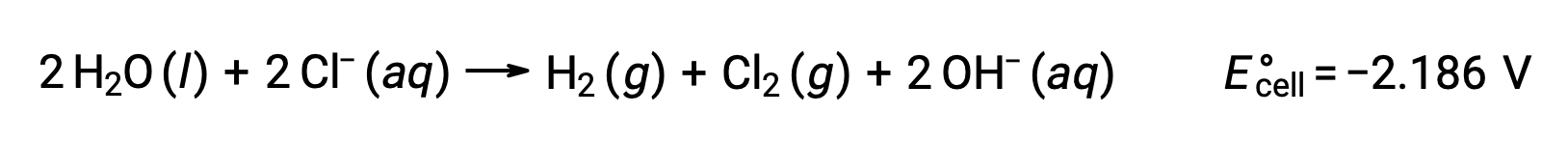
Aspectos cuantitativos de la electrólisis
La corriente eléctrica es la velocidad de flujo de los electrones y se mide en amperios, un coulomb por segundo (A = 1 C/s). La carga transferida, Q, por el paso de una corriente constante, I, durante un intervalo de tiempo especificado, t, está dada por
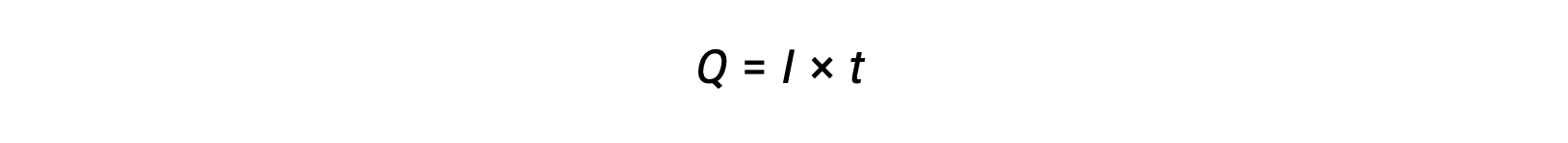
Cuando los electrones son transferidos durante un proceso redox, la estequiometría de la reacción se puede utilizar para obtener la cantidad total de carga (electrónica) involucrada. Por ejemplo, el proceso genérico de reducción,
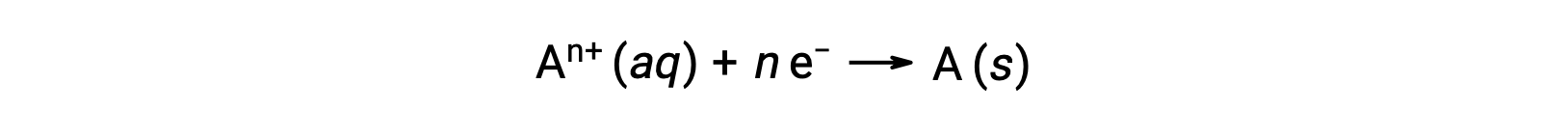
implica la transferencia de n mol de electrones. La carga transferida es, por lo tanto,
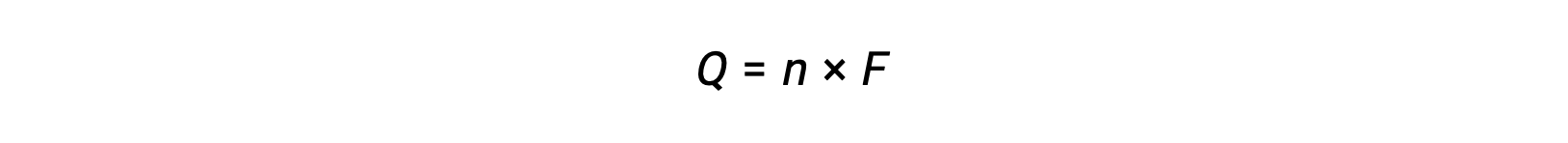
Donde F es la constante de Faraday, la carga en culombas para un mol de electrones. Para una celda electroquímica, se mide el flujo de corriente y se puede utilizar en los cálculos estequiométricos relacionados con la reacción de la celda.
Este texto está adaptado de OpenStax, Química 2e, Sección 17.7: Electrólisis.
