Summary
Aquí se describe un enfoque robótico a alto rendimiento de cristalización de proteínas de membrana en mesofases lipídicos para su uso en la determinación de estructura macromolecular usando cristalografía de rayos X. Tres robots capaces de manejar la viscosa y pegajosa proteína cargada de mesofase integral con el método se introducen.
Abstract
Los estudios de estructura-función de las proteínas de membrana se benefician mucho de tener disponibles de alta resolución de estructuras 3-D del tipo previsto a través de macromolecular cristalografía de rayos X (MX). Un ingrediente esencial del MX es una fuente constante de lo ideal de calidad de difracción de cristales. El meso o lipídica en fase cúbica (LCP) método para la cristalización de proteínas de la membrana es uno de varios métodos disponibles para la cristalización de proteínas de membrana. Se hace uso de una mesofase bicontinua en el cual crecer cristales. Como método, ha tenido algunos éxitos espectaculares en los últimos tiempos y ha llamado mucho la atención de los grupos de investigación ya muchos interesados en su uso. Uno de los desafíos asociados con el método es que la mesofase de alojamiento es extremadamente viscoso y pegajoso, que recuerda a una pasta de dientes de espesor. Por lo tanto, la dispensación de forma manual de una manera reproducible en pequeños volúmenes en los pozos de cristalización requiere habilidad, paciencia y una mano firme. Un protocolo para hacer just que se desarrolló en la membrana Estructural y Funcional de Biología (MS & FB) Grupo 1-3. Artículos Jove de vídeo que describen el método son 1,4 disponibles.
El enfoque manual para la instalación en meso ensayos tiene claras ventajas con aplicaciones especializadas, tales como la optimización de cristal y derivatización. Lo hace sin embargo sufren de ser un método de bajo rendimiento. Aquí, demostramos un protocolo para la realización de ensayos de cristalización en meso robóticamente. Un robot ofrece las ventajas de velocidad, exactitud, precisión, la miniaturización y ser capaz de trabajar de forma continua durante largos períodos de tiempo menores de lo que podría considerarse como condiciones hostiles, tales como en la oscuridad, en una atmósfera reductora o a temperaturas bajas o altas. Un robot en meso, cuando se utiliza correctamente, puede mejorar enormemente la productividad de la estructura de proteínas de membrana y la investigación función facilitando la cristalización que es uno de los pasos lentos en laestructura general tubería determinación.
En este artículo de vídeo, se demuestra el uso de tres robots disponibles comercialmente que pueden prescindir de la mesofase viscoso y pegajoso integral en crystallogenesis meso. El primer robot fue desarrollado en la MS y FB Group 5,6. Los otros dos se han convertido recientemente disponible y se incluyen aquí por completitud.
Una visión general del protocolo cubierto en este artículo se presenta en la Figura 1. Todas las manipulaciones se realizaron a temperatura ambiente (~ 20 ° C) en condiciones ambientales.
Protocol
1. Preparación de la placa de cristalización
Configuración de hacer un ensayo de cristalización robóticamente comienza con la preparación de la placa de base de la placa de vidrio cristalización sándwich (Figura 2), se describe en detalle en la referencia 2. La placa de base debe ser primero silanizada y el perforado de doble palo espaciador que crea los pocillos, se debe aplicar a la placa. Los materiales y suministros necesarios para ello se detalla en Materiales.
- Coloque la placa sobre una toalla de papel, se aplican unas pocas gotas de solución de silanización y distribuir uniformemente sobre la superficie de la placa con un pañuelo de papel.
- Eliminar el exceso de solución silanizante por inmersión de la placa en un vaso de precipitados de agua.
- Sacar la placa de la cubeta, colóquelo sobre una toalla de papel seca, lado silanizada, y secar la superficie expuesta frotando suavemente con una toalla de papel.
- Retire la cubierta protectora de la perforación, doble palo separadory aplicar el espaciador, el lado adhesivo hacia abajo, sobre la superficie seca, silanizada de la placa de vidrio. Asegúrese de que el separador está colocado correctamente en la placa base, con la esquina superior izquierda y los dos lados adyacentes del espaciador y la placa, coincidente.
- Utilizar un rodillo o rodillo para aplanar el espaciador en la placa base y para crear un sello hermético entre ellos.
Premontados placas están disponibles comercialmente (HR3-151, Hampton Research; MD11-55-100, las dimensiones moleculares, y LCP96T UVP70U-, Swissci). Por razones de coste, se prefiere montar nuestros propios platos siguiendo el protocolo anterior.
2. En Meso Robot 1
El primero en meso robot que se muestra en este artículo de vídeo es la actualmente en uso en la MS y Grupo FB (Figura 3). Los detalles completos del robot se puede encontrar en Materiales y en la sección de referencia 5. Los materiales y equipment necesario establecer un ensayo de cristalización utilizando el robot se detallan en Materiales.
- Coloque la placa base con el espaciador preparado en la Sección 1 en la cubierta del robot. Tiene su propia plataforma marcados con posiciones bien para efectos de alineación placa base. La placa debe ser marcado para fines de identificación.
- Fijar el bloque de 96 pocillos precipitante en su propia plataforma en la cubierta del robot junto a la placa de cristalización.
- Abrir el bloque cuidadosamente despegando la tapa de sellado de plástico.
- Encender el humidificador y dirigir el chorro de aire húmedo a través de una y la placa de base en la cubierta del robot. El humidificador se ha demostrado para reducir la evaporación de la solución precipitante y para mejorar la reproducibilidad a través de la placa de cristalización 5. Se puede activar antes de la puesta en marcha para pre-humedecer el área cuando la humedad relativa ambiente es baja, o de otro modo, justo antes de la dispensación de mesofase comienza.
- Inicializar el robot siguiendo las instrucciones del fabricante. Instrucciones específicas del instrumento no se describirá aquí en detalle, porque los procedimientos exactos cambiará con el tiempo. Esencialmente, lo que ocurre durante la inicialización es que la mesofase dispensación brazo del robot está provisto de posiciones de referencia en tres direcciones ortogonales X, Y y Z.
- Fije la mesofase proteína cargada en una jeringa de Hamilton, con aguja de dispensación, a 1 Brazo del robot (Figura 3). Los detalles completos de la forma de preparar la mesofase y cómo cargarlo en la jeringa se han descrito en las Referencias 3,7-10.
- Retire la cubierta protectora superior del espaciador en la cristalización placa base y alinee los pozos en la placa con fiduciales en la plataforma placa base. Nota, con el fin de reproducir el vídeo, la cubierta de protección se deja en su lugar para ayudar al espectador durante el paso de alineación.
- Alinee la punta de la aguja de la jeringuilla de dispensacióne con la parte inferior de la parte más alta y en la parte izquierda de la placa de cristalización (pocillo A1). Esto se hace por ojo ajustar la altura o la coordenada Z-del brazo de dispensación mientras ve la proximidad de la punta de la aguja llega a la parte inferior del pozo. Que la punta está justo tocando el fondo del pozo puede ser juzgado por desplazamiento de la placa de lado a lado en la plataforma mientras que muy ligeramente el ajuste de la altura del brazo de dispensación.
- Entra en el ordenador la coordenada Z del brazo de distribución donde los contactos de la punta de la placa. De dispensación está programado para tener lugar con la punta de la aguja 80 micrómetros de esta referencia de posición Z que corresponde a la superficie de la placa base.
- Posición por el ojo de la punta de la aguja en el centro del pocillo A1. Conservar en el ordenador de control en la X de referencia, la coordenada Y del brazo de distribución donde se centra la punta. Esta coordenada se utiliza para definir el centro de los pocillos restantes en la placa.
- Prime la jeringa con el comando apropiado en el equipo robot para que mesofase fresca llena la aguja de dispensación y que los primeros pozos y posterior recibir su asignación completa de mesofase. Limpie mesofase extruido en la punta de la aguja con un pañuelo de papel.
- Inicie el Run Robot (X-AP) programa para iniciar una ronda de lavado pasos donde las puntas de dispensación precipitantes en el brazo del robot 2 se lavan y se preparan para aspirar soluciones desde el bloque precipitante.
- Activar el. Dispensar función en el robot para poner en movimiento la carga secuencial de los pocillos con proteína cargada de mesofase (generalmente 50 nl) primero, una columna de ocho pocillos a la vez, seguido por soluciones precipitantes (por lo general 800 nl) Entre las columnas de carga, los rendimientos de dispensación de mesofase brazo a una posición de estacionamiento donde se coloca el extremo de la aguja en una esponja humedecida para evitar la mesofase en la punta de la desecación. El proceso de dispensación de mesofase y precipitante se repite11 veces a través de la placa hasta que la placa está llena. La carga de una placa de 96 pocillos con mesofase y precipitante tarda 5 minutos para completar.
- Tan pronto como la placa se llena y los brazos del robot han vuelto a sus posiciones de parque, retirar la placa de la cubierta del robot y colocarlo en una superficie sólida plana.
- Inmediatamente, sellar la placa con una cubierta de vidrio para minimizar cambios dependientes del tiempo en la composición también. Es importante asegurarse de que todos los 96 pozos están completamente cubiertos, que la cubierta de cristal está alineado cuadrado con la placa de base y que ninguno de la cubierta de vidrio se extiende más allá de la huella de la base de la placa. Un rodillo o rodillo se utiliza para crear un apretado y un sello uniforme entre la cubierta de vidrio y el espaciador.
- Inspeccione la placa para asegurarse de que la configuración fue como debería. Lo que se busca es un "huevo frito en una sartén 'aparición en cada pocillo. La yema del huevo frito corresponde a la mesofase. La clara del huevo es el precipitante solutiy en el borde de la cazuela es el perímetro de la cristalización bien. Idealmente, los tres son concéntricos.
- Colocar la placa en un área de almacenamiento de temperatura controlada para el crecimiento de cristales.
- Si no hay más placas se van a instalar, quitar el bloqueo precipitante de la cubierta del robot, sellarlo herméticamente y poner de nuevo en el almacenamiento.
- Retire la jeringa que contiene la mesofase del brazo del robot de dispensación, desmontarlo, y lavar sus piezas, incluidos aguja de dispensación y la férula, cuidadosamente con metanol y se seca en preparación para el próximo uso.
3. En Meso Robot 2. Mosquito LCP
El Mosquito LCP robot (figura 4) incorpora un dispensador de mesofase similar a la utilizada por Robot 1. En contraste con Robot 1, se prescinde precipitante por medio de puntas desechables. Software de programación se utiliza para configurar el instrumento para trabajar con placas de cristalización particulares y precipitbloques de hormigas, y para dispensar volúmenes definidos por el usuario de mesofase y precipitante en una secuencia especificada. Estos detalles se proporcionan por el fabricante y no se describirá aquí.
- Preparar una jeringa Hamilton, y provista de aguja y llena de proteína cargada de mesofase, como se describe anteriormente bajo Robot 1 y en el artículo JoVE 1712 1.
- Abrazadera de la jeringa en posición en el brazo de dispensación del robot.
- Utilice la cubierta montada sensor láser para establecer las coordenadas X e Y de la aguja de la jeringa de dispensación. Este es un paso importante que se requiere para asegurar que la mesofase se dispensa con precisión en el centro de cada pocillo de la placa.
- Con el toque de un botón en el panel de control principal de la jeringa para expulsar mesofase de la aguja. Eliminar mesofase extruido de la punta de la aguja con un pañuelo de papel en la preparación para usar el robot para cargar los pocillos.
- Antes de colocar la placa de cristalización en la cubierta de la humedad de roboten la superficie de la plataforma con unas cuantas gotas de agua para ayudar a mantener la placa en su lugar por capilaridad.
- Retire la cubierta protectora del espaciador en el cristal de la placa de base y colóquela en su plataforma firme para asegurar una buena adherencia. Utilizar las tres marcas fiduciales en la plataforma para alinear los pozos de esquina 3, garantizando así el correcto posicionamiento de los pozos de la placa con respecto a la punta de la aguja de dispensación. El instrumento está ahora manda a entrar en un ciclo de distribución.
- El ciclo comienza con una etapa de cebado segundo donde mesofase es dispensado sobre una placa de vidrio pequeño inmediatamente antes de pasar a cargar pozos con mesofase fresco. Las cargas primer robot con mesofase una columna vertical de 8 pozos en la placa y luego utiliza las puntas desechables para dispensar solución precipitante en la parte superior del bolo mesofase. El proceso se repite 11 veces a lo largo de la longitud de la placa hasta que todos los pocillos se llenan. Todo el proceso toma alrededor de 5 minutos para completar.
- Quitarla placa de llenado de la plataforma del robot y sellarla con una cubierta de vidrio como se describió anteriormente bajo Robot 1.
- Colocar la placa, debidamente etiquetados, en un ambiente de temperatura controlada para el crecimiento de cristales.
4. En Meso Robot 3. Gryphon LCP
El Grifo LCP robot (Figura 5) incorpora un sistema de dispensación de mesofase similares a la descrita anteriormente para Robots 1 y 2. Lo que lo distingue de los otros dos es que todas las 96 soluciones precipitantes se dispensan simultáneamente.
- Preparar la mesofase proteína cargada y cargarlo en la jeringa de dosificación, como se describe más arriba, en Robots 1 y 2, y en el artículo 1 JoVE 1712.
- Abrazadera de la jeringa en posición en el brazo de dispensación del robot.
- Colocar el bloque de solución precipitante y la placa de cristalización en la cubierta del robot.
- Cargue la Ley de Educación Superior de 96 puntad con soluciones precipitantes. A definido por el usuario el tiempo de retardo se proporciona para facilitar la aspiración precipitantes viscosos.
- Comandar el instrumento para entrar en un ciclo de distribución. El ciclo comienza con la mesofase se dispensa secuencialmente en los 96 pocillos en un proceso que toma alrededor de 1 min para completar. La cabeza 96 de punta a continuación, dispensa todos 96 soluciones precipitantes a la vez en la parte superior de los bolos de mesofase en los pocillos de la cristalización. El proceso de placa de carga completa se terminó en 2 min.
- Retire la placa de llenado de la plataforma del robot y sellarla con una cubierta de vidrio como se describió anteriormente bajo Robot 1.
- Colocar la placa, debidamente etiquetados, en un ambiente de temperatura controlada para el crecimiento de cristales.
5. Los resultados representativos
El propósito de este artículo es demostrar vídeo cómo configurar automáticamente los ensayos de cristalización con un viscoso, la membrana de proteína cargada de mesofase en vidrio sandwich placas de 96 pocillos cristalización. El énfasis está en la automatización mediante el uso de robots especializados que requieren intervención manual mínima. La reproducibilidad y precisión, en términos de volúmenes de mesofase y precipitante dispensado y la colocación de ambos dentro del pozo, se espera que cuando un robot se utiliza. Estos son importantes desde el punto de vista de la detección eficaz de condiciones que apoyan crystallogenesis. Ellos también son críticos para el siguiente paso en el análisis de tuberías que es evaluar el crecimiento del cristal hace a menudo con equipos de imágenes. Ubicación de colocación o de bolo es clave para el proceso de imágenes, y la colocación irregular e incorrecta de bolo en el pozo por lo general requiere la intervención del usuario para corregir y lleva tiempo. Para fines de ilustración, ejemplos de placas correctamente y cargado incorrectamente se muestra en la Figura 6.
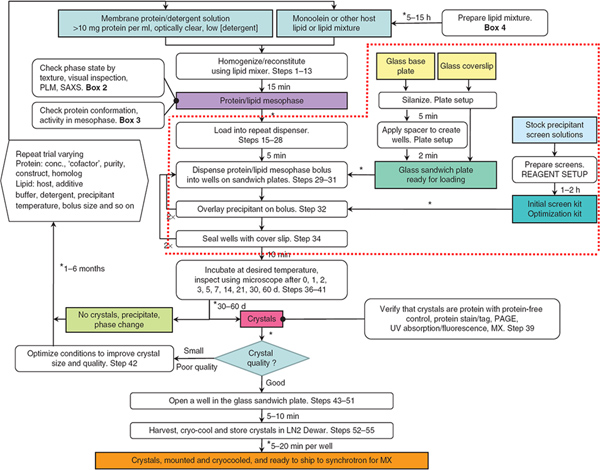
Figura 1. El diagrama de flujo resume los pasos involucrados en la producción, cosecha y enfriamiento criogénico de meso-cultivadas en cristales de proteínas de membrana. Pasos rodeados por la línea de puntos rojos son el foco de este artículo Jove. Los robots fueron utilizados para dispensar soluciones mesofase y precipitación en los pasos 29-32. De Referencia 3. Haga clic aquí para ampliar la cifra .

Figura 2. A plena carga y sellado de 96 pocillos placa de vidrio sándwich cristalización. Cada pocillo contiene 50 nl fase cúbica y una solución precipitante l. Para mayor claridad, la fase cúbica se ha manchado con el rojo Sudán y la solución precipitante incluye azul de metileno. De la referencia 5.
_upload/4000/4000fig3.jpg "alt =" Figura 3 "/>
Figura 3. El meso en robot (Robot 1). El robot tiene dos brazos. Brazo 1 dispensa la mesofase lipídica proteína cargada. Brazo 2 dispensa soluciones precipitantes. Durante el llenado, la placa de 96 pocillos se mantiene en una posición fija en la cubierta del robot que es en sí mismo estacionario. Los dos brazos se mueven para ofrecer soluciones de mesofase y precipitante. De la referencia 3.

Figura 4. El Mosquito LCP robot (Robot 2). En contraste con Robot 1, la cubierta de la LCP Mosquito, sobre la que sentarse la placa de 96 pocillos y el bloque de solución precipitante, se mueve horizontalmente durante el llenado.

Figura 5. El Grifo LCP robot (Robot 3). Durante unaestablecido, el dispensador lipídica fase cúbica se traslada a entregar proteína cargada de mesofase en la placa de 96 pocillos. La cubierta se traduce luego en horizontal para colocar la placa bajo la cabeza punta solución precipitante. Todas las 96 soluciones precipitantes se dispensan simultáneamente. Fotografía de origen del fabricante ( http://www.artrobbins.com/ ) y etiquetado.

Figura 6. Un completamente cargado y sellado 96 y placa sándwich de vidrio (A) y pocillos correctamente (B) y incorrectamente (C, D) llena utilizando el robot en meso (Robot 1). La etiqueta de código de barras en la placa en A se utiliza para el seguimiento de la placa en la placa de incubadora / formación de imágenes del dispositivo. En los paneles de BD, solución precipitante y mesofase se marcan P y M, respectivamente. La esperada "huevo frito en una sartén 'apariencia del pozo en B es característica de una carga correctamente y bien sellada. En C, el precipitado se ha dispensado en el pozo incorrectamente en una posición fuera del centro y ha entrado en contacto con el espaciador. En C, parece también que el volumen de mesofase es menos de lo que debería ser. Un ejemplo de carga incompleta con solución precipitante se muestra en D. Para la escala, el diámetro de todos los pozos es de 6 mm.
Discussion
En este artículo hemos demostrado vídeo cómo utilizar un robot para configurar automáticamente en los ensayos de cristalización meso en el 96-y placas de vidrio sándwich usando una mesofase lipídica proteína cargada. Los robots utilizados en este trabajo fueron especialmente diseñados para incluir una jeringa de vidrio de desplazamiento positivo para la entrega precisa y reproducible de volúmenes de nanolitros de la mesofase viscoso y pegajoso, como se describió originalmente 7.
La exactitud y la precisión son características importantes de un robot. Sin embargo, estas características son sólo tan buena como el grado y la regularidad que se evalúa el rendimiento del robot y la calibración se realiza. No hace falta decir que el rendimiento del robot debe ser evaluado mientras que las placas individuales se están creando. No es correcto suponer que el robot funcione sin problemas y dejar que el robot ejecute de forma desatendida. El operador atento y observador debe estar en posesiónition notar por un sonido o una aparición cuando algo no está funcionando correctamente y para corregirlo de inmediato. Además, cada placa debe ser cuidadosamente inspeccionados por ojo para la uniformidad de contenido de los pocillos tan pronto como se cierra la placa y antes de que se pone de distancia para pruebas de cristalización. Esto sólo se requieren unos pocos segundos para realizar y se puede hacer mientras que la siguiente placa se está cargando. Al darse cuenta, por ejemplo, que los pozos particulares no estén llenos como puede resaltar el hecho de que un precipitante cierta punta dispensadora está funcionando mal. Si la entrega de mesofase se ve que es irregular, el elemento defectuoso relevante tendría que ser corregido inmediatamente. Al tomar nota de estas cuestiones y hacer los ajustes pertinentes durante el tiempo que ahorrará tiempo y materiales, incluyendo lípidos y valiosa proteína de membrana. Si un generador de imágenes se utiliza para seguir el crecimiento del cristal, la exactitud y precisión también se puede monitorizar durante la exploración. Por ejemplo, los problemas sistemáticos con gota o boloubicación de la cámara indican que algo no está bien y que la acción correctiva en algún lugar río arriba en el protocolo que se necesita.
En aras de un rendimiento fiable tanto, el robot debe ser calibrado en un horario regular y según sea necesario. Calibraciones debe incluir el volumen de precipitante y mesofase suministrar, así como la colocación de bolo y precipitante en el pocillo. Obviamente, siempre que sea posible la calibración se debe hacer uso de volúmenes y materiales similares a aquellos que se utilizan en los ensayos llevados a cabo en el período cubierto por el ejercicio de control de calidad.
Tan importante como la calibración también lo es tener en stock un suministro adecuado de piezas de robot y suministros. Fracasos catastróficos e inesperados, bloqueos y caídas pueden ocurrir y ocurren. En tal caso, disponer de una punta de repuesto de entrega precipitante, por ejemplo, puede significar que una preparación de proteínas de membrana extremadamente valioso se utiliza como debería yno se desperdicia.
Algunas de las ventajas de un robot incluyen el hecho de que funcionará esencialmente de forma continua y que no sufre de o 'se quejan de "fatiga. Un robot también puede ser utilizado en condiciones que no son considerados humano de usar, tales como en la oscuridad, bajo una iluminación controlada y las condiciones ambientales, y en los extremos de temperatura. Los robots se demuestra en este artículo se han utilizado todos en condiciones ambientales a ~ 20 ° C. Sin embargo, hay proteínas y proyectos que requieren temperaturas no ambientales, luz controlada 11,12 y un oxidante o un entorno de reducción 13. Todos estos pueden ser atendidos, con relativa facilidad, cuando un robot de cristalización se utiliza.
En un artículo anterior vídeo JoVE hemos demostrado cómo los ensayos de cristalización por el método de meso se configuran manualmente 1. El volumen mínimo de mesofase que se puede prescindir de manera fiable a mano se limita by la agudeza visual y constante uso de las manos de la persona que configura los ensayos. En nuestra experiencia, los volúmenes de mesofase tan bajas como 100 nl son fácilmente manipulados. Sabemos de un laboratorio donde el volumen predeterminado dispensado manual es de aproximadamente 40 nl. Sin embargo, los volúmenes considerablemente más pequeños son posibles utilizando un robot. Por otra parte, hemos demostrado que los volúmenes de mesofase tan bajas como 550 picolitros se puede prescindir de un robot 14. A partir de ese trabajo estaba claro que miniaturización por robot es posible que, si se aplica, daría lugar a una gran reducción en la cantidad de proteína de membrana valiosa necesaria para llevar a cabo un ensayo de cristalización.
En este artículo de vídeo, tres robots disponibles comercialmente se utilizaron para demostrar de alto rendimiento de la cristalización de proteínas de membrana utilizando mesofases lipídicas. El primero de estos fue desarrollado en el Grupo de MS y FB basado en nuestra experiencia en el establecimiento ensayos manualmente, como se describe en JoVE 1712 1. Este es el instrumentoción tenemos más familiaridad y la mayor parte del artículo actual está dedicada a su uso. Los otros dos robots estaban en manifestación en el Grupo MS & FB en el momento en que fue escrito el artículo y el material pertinente se incluye aquí en aras de la exhaustividad. Los tres robots usan mucho la mesofase mismo sistema de dispensación, la característica esencial de que es una jeringa de vidrio de desplazamiento positivo 5,7. Ellos difieren más significativamente con respecto a la entrega precipitante. Robots 1 y 2 puede prescindir precipitante simultáneamente en 8 pozos, una sola columna en una placa de cristalización a la vez. Por el contrario, Robot 3 dispensa los 96 soluciones precipitantes en una sola acción. Robot 2 es el único instrumento con puntas desechables precipitantes de dispensación. Hay ventajas y desventajas asociadas con los diferentes instrumentos que dependen de la aplicación particular, los cuales no serán elaborados por aquí. Basta con decir que todo el trabajo y han producido tres cristales de mímbrane proteínas por el método en meso.
Los próximos pasos en el proceso general de determinación de la estructura por cristalografía macromolecular son para la cosecha y para la crio-cool cristales de las placas tal como se establece en este artículo y vídeo para grabar y proceso de difracción de rayos X de ellos. Estos temas se tratan en sendos artículos de esta serie Jove 1,15.
Disclosures
No hay conflictos de interés declarado.
Acknowledgments
Hay muchas personas que contribuyeron a este trabajo y la mayoría son de la membrana estructural y Grupo de Biología Funcional, ambos miembros pasados y presentes. A todos les extendemos nuestro más sincero agradecimiento y reconocimiento. Este trabajo fue apoyado en parte por subvenciones de la Science Foundation Ireland (07/IN.1/B1836), los Institutos Nacionales de Salud (GM75915, P50GM073210 y U54GM094599) y FP7 CM0902 Acción COST.
Materials
| Name | Company | Catalog Number | Comments |
| Brayer (roller) | Fisher Scientific | 50820937 | Tool |
| Gas-tight syringes | Hamilton | 81030 | Tool |
| Glass coverslips | Marienfeld | 01029990911 | Disposable |
| Glass plates | Marienfeld | 1527127092 | Disposable |
| Gryphon LCP Robot | Art Robbins | NA | Tool |
| In meso robot | Anachem/Gilson | NA | Tool |
| Lab notebook | Various | NA | Tool |
| Mosquito LCP Robot | TTP Labtech | NA | Tool |
| Perforated double-stick spacer tape | Saunders Corporation (hole-punched) | customized | Disposable |
| Precipitant solutions | Various | Various | Reagent |
| Purified water | Millipore | NA | Reagent |
| Rain-X | Shell Car Care | 80199200 | Reagent |
| Syringe tips | Hamilton | 7770-020 (gauge 22) | Tool |
| Tissues | Various | Various | Disposable |
| Water bottle | various | NA | Reagent |
References
- Caffrey, M., Porter, C. Crystallizing membrane proteins for structure determination using lipidic mesophases. J. Vis. Exp. (45), e1712 (2010).
- Cherezov, V., Caffrey, M. Nano-volume plates with excellent optical properties for fast, inexpensive crystallization screening of membrane proteins. J. Appl. Crystallogr. 36, 1372-1377 (2003).
- Caffrey, M., Cherezov, V. Crystallizing membrane proteins using lipidic mesophases. Nat. Protocols. 4, 706-731 (2009).
- Liu, W., Cherezov, V. Crystallization of membrane proteins in lipidic mesophases. J. Vis. Exp. (49), e2501 (2011).
- Cherezov, V., Peddi, A., Muthusubramaniam, L., Zheng, Y. F., Caffrey, M. A robotic system for crystallizing membrane and soluble proteins in lipidic mesophases. Acta Crystallogr. D Bio.l Crystallogr. 60, 1795-1807 (2004).
- Peddi, A. High-throughput automated system for crystallizing membrane proteins in lipidic mesophases. IEEE Trans. Autom. Sci. Eng. 4, 129-140 (2007).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Caffrey, M. Crystallizing membrane proteins for structure-function studies using lipidic mesophases. Biochem. Soc. Trans. 39, 725-732 (2011).
- Caffrey, M. Crystallizing membrane proteins for structure determination: use of lipidic mesophases. Annu. Rev. Biophys. 38, 29-51 (2009).
- Caffrey, M. Membrane protein crystallization. J. Struct. Biol. 142, 108-132 (2003).
- Gushchin, I., Reshetnyak, A., Borshchevskiy, V., Ishchenko, A., Round, E., Grudinin, S., Engelhard, M., Buldt, G., Gordeliy, V. Active State of Sensory Rhodopsin II: Structural Determinants for Signal Transfer and Proton Pumping. J. Mol. Biol. 412, 591-600 (2011).
- Jordan, P., Fromme, P., Witt, H. T., Klukas, O., Saenger, W., Krauss, N. Three-dimensional structure of cyanobacterial photosystem I at 2.5 angstrom resolution. Nature. 411, 909-917 (2001).
- Grawert, T., Span, I., Eisenreich, W., Rohdich, F., Eppinger, J., Bacher, A., Groll, M. Probing the reaction mechanism of IspH protein by x-ray structure analysis. Proc. Natl. Acad. Sci. USA. 107, 1077-1081 (2010).
- Cherezov, V., Caffrey, M. Picolitre-scale crystallization of membrane proteins. J. Appl. Crystallogr. 39, 604-606 (2006).
- Li, D., Boland, C., Aragao, D., Walsh, K., Caffrey, M. Harvesting and cryo-cooling crystals of membrane proteins grown in lipidic mesophases for structure determination by macromolecular crystallography. J. Vis. Exp. (67), e4001 (2012).



