Summary
Aqui é descrito um método para robótica de alto rendimento de cristalização de proteínas de membrana em mesofases lipídicos para utilização na determinação da estrutura utilizando a cristalografia de raios-X macromolecular. Três robôs capazes de lidar com o viscoso e pegajoso mesofase proteína-laden integrante do método são introduzidos.
Abstract
Estudos de estrutura-função de proteínas de membrana beneficiar grandemente de ter disponíveis de alta resolução de estruturas 3-D do tipo fornecido através de cristalografia de raios-X macromolecular (MX). Um ingrediente essencial de MX é uma fonte constante de difração idealmente qualidade de cristais. A meso ou em fase lipídica cúbico método (LCP) para cristalizar proteínas de membrana é um dos vários métodos disponíveis para a cristalização de proteínas de membrana. Ele faz uso de uma mesofase bicontinua em que para crescer cristais. Como método, ele teve alguns sucessos espetaculares da tarde e tem atraído muita atenção com grupos de pesquisa já muitos interessados em usá-lo. Um dos desafios associados ao método é que a mesofase hospedagem é extremamente viscoso e pegajoso, que lembra uma pasta de dente de espessura. Assim, dispensando-lo manualmente de forma reproduzível em pequenos volumes em poços de cristalização requer habilidade, paciência e uma mão firme. Um protocolo para fazer juª que foi desenvolvido na membrana estrutural e funcional Biologia (MS & FB) Grupo 1-3. Artigos de vídeo Jove que descrevem o método são 1,4 disponíveis.
A abordagem manual para a criação em meso ensaios tem vantagens distintas, com aplicações especiais, tais como otimização de cristal e derivatização. Isto, contudo, sofrem de ser um método de baixo volume de produção. Aqui, nós demonstramos um protocolo para a realização de ensaios de cristalização meso roboticamente. Um robô oferece as vantagens de rapidez, exactidão, precisão, miniaturização e ser capaz de trabalhar continuamente durante períodos prolongados sob o que poderia ser considerado como condições hostis como no escuro, numa atmosfera redutora ou a temperaturas baixas ou elevadas. Um robot de meso, quando utilizados de forma adequada, pode melhorar significativamente a produtividade da estrutura da proteína de membrana e de pesquisa de função ao facilitar a cristalização, que é um dos passos lentos naoleoduto determinação global da estrutura.
Neste artigo de vídeo, que demonstram a utilização de três robôs comercialmente disponíveis, que pode dispensar a mesofase viscoso e pegajoso integrante no crystallogenesis meso. O primeiro robô foi desenvolvido no MS & Grupo FB 5,6. Os outros dois tornaram-se recentemente disponíveis e são incluídos aqui para ser completo.
Uma visão geral do protocolo abordado neste artigo é apresentado na Figura 1. Todas as manipulações foram efectuadas à temperatura ambiente (~ 20 ° C) sob condições ambiente.
Protocol
1. Preparar a placa de Cristalização
Definindo-se a fazer um teste de cristalização roboticamente começa com a preparação da placa de base da placa de cristalização de vidro sanduíche (Figura 2), descrita em detalhe em referência 2. A placa de base tem de ser previamente silanizada e o espaçador duplo-aderente perfurado que cria cavidades, tem de ser aplicada à placa. Os materiais e suprimentos necessários para isso são discriminados em Materiais.
- Colocar a placa numa toalha de papel, aplicam-se algumas gotas de solução de silanização e distribuí-lo uniformemente ao longo da superfície da placa com um lenço de papel.
- Remover o excesso de solução de silanização por imersão da placa numa proveta de água.
- Pegue a placa fora do copo, coloque-o em uma toalha de papel seca, silanizado lado, e secar a sua superfície exposta limpando suavemente com uma toalha de papel.
- Retire a tampa de proteção no perfurada, espaçador dupla varae aplicar o espaçador lado, pegajoso para baixo, para a superfície, seca silanizada da placa de vidro. Certifique-se de que o espaçador é posicionado correctamente na placa de base, com o canto superior esquerdo e os dois lados adjacentes do espaçador e da placa, coincidentes.
- Usar um rolo ou Brayer para achatar o espaçador na placa de base e para criar uma vedação estanque entre ambos.
Pré-montadas placas estão disponíveis comercialmente (HR3-151, Hampton Research; MD11-55-100, dimensões moleculares, e LCP96T-UVP70U, Swissci). Por razões de custo, preferimos montar nossas próprias chapas seguindo o protocolo acima.
2. Na Meso Robô 1
O primeiro em meso robô para ser demonstrado neste artigo de vídeo é o actualmente em uso na MS e Grupo FB (Figura 3). Todos os detalhes sobre o robô pode ser encontrado em materiais e na seção de Referência 5. Os materiais e equipment necessário para configurar um processo de cristalização usando o robô são discriminados em Materiais.
- Colocar a placa de base com o espaçador preparado na Secção 1 sobre o convés do robô. Ele tem sua própria plataforma marcada com posições bem para fins de base de placa-alinhamento. A placa deve ser marcada para fins de identificação.
- Fixar o bloco de 96 poços precipitante na sua própria plataforma sobre o convés do robô ao lado da placa de cristalização.
- Abra o bloco de cuidado por descascar a tampa de vedação de plástico.
- Ligue o humidificador e dirigir o fluxo de ar húmido e sobre toda a placa de base sobre o convés do robô. O humidificador tem sido mostrado para reduzir a evaporação da solução de agente precipitante e para melhorar a reprodutibilidade do outro lado da placa de cristalização 5. Ele pode ser ligado antes de configurar a pré-umidificar a área quando a umidade relativa do ar é baixa, ou de outra forma, um pouco antes da dispensação de mesofase começa.
- Inicializar o robô seguindo as instruções do fabricante. Instruções específicas do instrumento não será descrito aqui em detalhe, porque os procedimentos exactos irão mudar ao longo do tempo. Essencialmente, o que acontece durante a inicialização que a mesofase dispensa braço do robô é fornecido com as posições de referência em três direcções ortogonais X, Y e Z.
- Anexar a mesofase proteína-laden numa seringa Hamilton, completo com distribuição da agulha, para o Braço 1 do robô (Figura 3). Todos os detalhes de como preparar a mesofase e colocá-lo dentro da seringa ter sido descrito em referências 3,7-10.
- Remover a tampa superior de protecção do espaçador na cristalização placa de base e alinhar as cavidades na placa com fiduciais sobre a plataforma de base da placa. Nota, para o propósito deste vídeo, a tampa de protecção foi deixado no local para auxiliar o visualizador durante a etapa de alinhamento.
- Alinhar a ponta da agulha do distribuidor syringe com o fundo do poço superior, no canto esquerdo da placa de cristalização (Bem A1). Isto é feito através do olho ajustando a altura ou a coordenada Z do braço de distribuição, enquanto observa a proximidade da ponta da agulha chega ao fundo do poço. Que a ponta é apenas a tocar o fundo da cavidade pode ser julgada, movendo a placa de lado a lado na plataforma ao mesmo tempo muito ligeiramente de ajustar a altura do braço de distribuição.
- Entre no computador da coordenada Z do braço distribuição onde os contatos ponta a placa. Dispensing está programado para ter lugar com a ponta da agulha 80 micrômetros de esta referência Z-posição que corresponde à superfície da placa de base.
- Posição por olho a ponta da agulha no centro do poço A1. Armazenar em que o computador controla a referência X, Y coordenadas do braço de distribuição em que a ponta está centrado. Esta cota é usado para definir o centro das cavidades remanescentes sobre a placa.
- Prime seringa utilizando o comando adequado no computador robô para garantir que mesofase fresco enche a agulha de distribuição, e que os primeiros poços e subsequente receber o seu complemento completo de mesofase. Limpe mesofase extrudido sobre a ponta da agulha com um tecido.
- Inicie o programa Run Robot (X-AP) para iniciar uma rodada de rubor etapas onde as pontas precipitantes distribuição no braço 2 do robô são lavados e preparados para aspirar soluções a partir do bloco precipitante.
- Activar o. Dispensar função do robô para colocar em movimento o carregamento sequencial de poços com proteína carregada de mesofase (normalmente 50 nl) em primeiro lugar, uma coluna de oito poços de uma vez, seguido de soluções de precipitantes (geralmente 800 nl) Entre as colunas de carga, os retornos mesofase braço de distribuição para uma posição de estacionamento, onde a ponta da agulha é colocada em uma esponja humedecida para impedir a mesofase na ponta de secar. O processo de dosagem e mesofase precipitante é repetido11 vezes ao longo da placa até que a placa seja preenchida. O carregamento de uma placa de 96 poços com mesofase e precipitante leva 5 minutos para completar.
- Assim que a placa está cheio, e os braços de robô regressaram às suas posições de parque, remover a placa do convés do robô e colocá-lo sobre uma superfície plana e sólida.
- Imediatamente, selar a placa com uma tampa de vidro para minimizar o tempo-dependentes de alterações na composição bem. É importante assegurar que todos os 96 poços estão completamente cobertos, que o vidro de cobertura está alinhada com a base quadrada de placa e que nenhum do vidro de cobertura estende-se para além da área de contacto da placa de base. Um rolo ou Brayer é usado para criar um selo apertado e uniforme entre a cobertura de vidro e o espaçador.
- Inspecione a placa para garantir que o set-up foi como deveria. O que se está procurando é um "ovo frito em uma panela" aparência em cada poço. A gema do ovo frito corresponde ao mesofase. A clara de ovo é a soluti precipitanteem e a borda da panela é o perímetro da cristalização bem. Idealmente, os três são concêntricas.
- Colocar a placa numa área de armazenamento de temperatura controlada para o crescimento de cristais.
- Se não houver mais placas estão a criar, remover o bloco precipitante da plataforma do robô, feche-o bem e colocá-lo de volta para o armazenamento.
- Remover a seringa que contém a mesofase do braço de distribuição do robô, desmontá-la, e lavar as peças, incluindo distribuição de agulhas e de virola, cuidadosamente com metanol e seco, em preparação para a próxima utilização.
3. Na Meso robô 2. Mosquito LCP
O LCP Mosquito robô (Figura 4) inclui um distribuidor de mesofase semelhante ao utilizado pelo robô 1. Em contraste com um robô, dispensa precipitante, por meio de pontas descartáveis. Software de programação é usado para configurar o instrumento para trabalhar com placas de cristalização particulares e precipitblocos de formigas, e para dispensar volumes definidos pelo usuário de mesofase e precipitante em uma seqüência especificada. Tais detalhes são fornecidos pelo fabricante, e não será descrito aqui.
- Prepara-se uma seringa Hamilton, completo com a agulha e preenchido com proteína carregada de mesofase, como descrito acima sob Robot 1 e no artigo JoVE 1712 1.
- Prender a seringa na posição sobre o braço de distribuição do robô.
- Usar o convés montado sensor laser para estabelecer as coordenadas X e Y da agulha na seringa distribuidora. Este é um importante passo necessário para garantir que a mesofase é distribuído com precisão no centro de cada poço na placa.
- Com o toque de um botão no painel de controle, primeiro a seringa para expulsar mesofase da agulha. Remover mesofase extrudido a partir da ponta da agulha com um tecido em preparação para a utilização do robô para carregar poços.
- Antes de colocar a placa de cristalização no convés do robô húmidoen o da superfície da plataforma, com algumas gotas de água para ajudar a manter a placa no lugar por capilaridade.
- Remova a tampa protetora do espaçador no vidro placa de base e colocá-lo em sua plataforma com firmeza para garantir uma boa aderência. Use as três fiduciais na plataforma para alinhar as três cavidades de canto desse modo assegurando o posicionamento adequado dos poços na placa em relação à ponta da agulha de distribuição. O instrumento é agora comandado para introduzir um ciclo de distribuição.
- O ciclo começa com um passo de escorva segundo onde mesofase é dispensada numa placa de vidro pequeno imediatamente antes de passar para carregar cavidades com mesofase fresco. As cargas primeiro robô com mesofase uma coluna vertical de 8 poços na placa e, em seguida, utiliza as pontas descartáveis para dispensar solução precipitante no topo do bolo de mesofase. O processo é repetido 11 vezes ao longo do comprimento da placa até que todos os poços são cheios. Todo o processo leva cerca de 5 minutos para completar.
- Removera placa cheia a partir da plataforma do robô e selá-lo com uma tampa de vidro, tal como descrito acima sob o título do robô 1.
- Colocar a placa, adequadamente rotulado, num ambiente de temperatura controlada para o crescimento de cristais.
4. Na Meso Robot 3. Gryphon LCP
O LCP Gryphon robô (Figura 5) incorpora um sistema de distribuição de mesofase semelhante ao descrito acima para os robôs 1 e 2. O que o distingue dos outros dois é que todas as 96 soluções precipitantes são dispensados simultaneamente.
- Preparar a mesofase proteína-laden e carregá-lo no interior da seringa de distribuição, tal como descrito acima, sob Robots 1 e 2, e no artigo JoVE 1712 1.
- Prender a seringa na posição sobre o braço de distribuição do robô.
- Coloque o bloco solução precipitante e prato de cristalização no convés do robô.
- Coloque o hea 96-pontad com soluções precipitantes. Um utilizador definido tempo de atraso é fornecido para facilitar a aspiração de precipitantes viscosos.
- Comandar o aparelho para introduzir um ciclo de distribuição. O ciclo inicia-se com a mesofase ser distribuído sequencialmente para os 96 poços em um processo que leva cerca de 1 min para completar. A cabeça 96 da ponta, em seguida, distribui-as 96 soluções precipitantes de uma só vez no topo dos bolus mesofase nos poços de cristalização. O processo de carregamento de toda a placa é terminado em 2 min.
- Remova a placa cheia a partir da plataforma do robô e selá-lo com uma tampa de vidro, tal como descrito acima sob o título do robô 1.
- Colocar a placa, adequadamente rotulado, num ambiente de temperatura controlada para o crescimento de cristais.
5. Resultados representativos
O objetivo deste artigo é demonstrar de vídeo como configurar automaticamente ensaios de cristalização com um viscoso, mesofase membrana-proteína carregado de vidro sandwich placas de 96 poços de cristalização. A ênfase está na automação através do uso de robôs especializados que requerem intervenção manual mínima. Reprodutibilidade e precisão, em termos de volumes de mesofase e precipitante dispensado e a colocação de ambos dentro do poço, é esperado quando um robô é usado. Estes são importantes do ponto de vista de rastreio eficaz de condições que suportam crystallogenesis. Eles também são críticos para a etapa seguinte em que o oleoduto análise é o de avaliar o crescimento de cristais, muitas vezes feitas com equipamentos de imagem. Local de soltar ou bolus é a chave para o processo de imagem e posicionamento irregular e indevida de bolus no bem normalmente requer intervenção do usuário para corrigir e leva tempo. Para fins de ilustração, exemplos de chapas correcta e incorrectamente carregadas são mostradas na Figura 6.
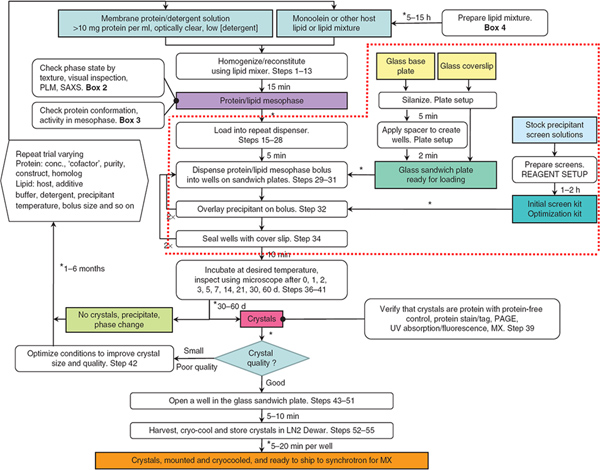
Figura 1. O fluxograma resume os passos envolvidos na produção de colheita, e crio-de arrefecimento em meso-crescidos cristais de proteína de membrana. Passos cercado pela linha vermelha são o foco deste artigo Jove. Robôs foram usados para distribuir soluções mesofase e precipitante em Passos 29-32. Da referência 3. Clique aqui para ver maior figura .

Figura 2. Uma totalmente carregado e selado de 96 poços da placa de vidro de cristalização sanduíche. Cada poço contém 50 nl fase cúbica e uma solução precipitante ul. Para maior clareza, a fase cúbica foi corado com Sudan Red e a solução precipitante compreende azul de metileno. A partir de Referência 5.
_upload/4000/4000fig3.jpg "alt =" Figura 3 "/>
Figura 3. No meso O robô (Robot 1). O robô tem duas armas. Braço uma dispensa a mesofase proteína-laden lipídica. Braço 2 distribui soluções precipitantes. Durante o enchimento, a placa de 96 poços permanece fixo em posição no convés do robô que em si é estacionária. Os dois braços se movem para oferecer soluções mesofase e precipitante. A partir de Referência 3.

Figura 4. Mosquito A LCP robô (Robot 2). Em contraste com o robô 1, o convés do LCP Mosquito, sobre a qual se sente a placa de 96 poços e o bloco solução precipitante, se move horizontalmente, durante o enchimento.

Figura 5. Gryphon A LCP robô (Robot 3). Durante umaconfigurado, o distribuidor de fase lipídica cúbico move-se para proporcionar a proteína carregada de mesofase para a placa de 96 poços. O deck então traduz na horizontal para posicionar a placa sob a cabeça precipitante solução ponta. Todas as 96 soluções precipitantes são dispensados simultaneamente. Imagem obtida a partir do fabricante ( http://www.artrobbins.com/ ) e etiquetadas.

Figura 6. Um totalmente carregado e selado de 96 poços da placa de sanduíche de vidro (A) e os poços adequadamente (B) e impropriamente (C, D) preenchido com o no meso robot (robô 1). A etiqueta de código de barras sobre a placa de A é utilizado para rastrear a placa na incubadora a placa de dispositivo / de imagem. Em painéis de solução de BD, precipitante e mesofase são marcados P e M, respectivamente. O esperado 'ovo frito em uma panela'aparecimento do bem em B é característica de um correctamente colocado e selado bem. Em C, o precipitado foi distribuído para dentro do poço indevidamente numa posição fora de centro e entrou em contacto com o espaçador. Em C, afigura-se também que o volume de mesofase é menor do que deveria ser. Um exemplo de carga incompleta com solução precipitante é mostrado em D. Por escala, o diâmetro de cada um dos poços é de 6 mm.
Discussion
Neste artigo de vídeo demonstramos como usar um robô para configurar automaticamente em ensaios de cristalização meso em placas de 96 poços de vidro sanduíche usando uma mesofase proteína-laden lipídica. Os robôs usados neste trabalho foram especialmente concebidos de modo a incluir uma seringa de vidro de deslocamento positivo para o fornecimento preciso e reprodutível dos volumes nanolitros da mesofase viscosa e pegajosa, conforme descrito originalmente 7.
Exatidão e precisão são características importantes de um robô. No entanto, essas características são apenas tão bom quanto o grau de e regularidade que o desempenho do robô é avaliado e calibração é realizada. Escusado será dizer que o desempenho do robô deve ser avaliada enquanto pratos individuais estão a ser criadas. Não é adequado para assumir que o robô funcionará perfeitamente e deixar o robô para execução autônoma. O operador atento e observador deve estar em um position notar por um som ou uma aparência quando algo não está funcionando corretamente e para corrigi-lo imediatamente. Além disso, cada uma das placas deve ser cuidadosamente inspeccionadas por olho para a uniformidade de conteúdo do poço, logo que a placa é selada e antes de ser colocado afastado para ensaios de cristalização. Isso só deve exigir alguns segundos para executar e pode ser feito enquanto a placa ao lado está sendo carregado. Perceber, por exemplo, que os poços particulares não são devidamente preenchido pode destacar o fato de que um certo precipitante ponta distribuição está funcionando corretamente. Deve entrega de mesofase ser visto para ser irregular, o produto relevante defeituoso teria de ser corrigida imediatamente. Ao notar estes problemas e fazer os ajustes relevantes durante o set up vai poupar tempo e materiais, incluindo lipídios valioso e proteína de membrana. Se um gerador de imagens é usado para acompanhar o crescimento de cristais, exatidão e precisão também pode ser monitorado durante o exame. Por exemplo, problemas sistemáticos com gota ou boluslocalização pelo imageador indicam que algo não está certo e que medidas corretivas em algum lugar a montante no protocolo é necessário.
No interesse de um desempenho confiável, portanto, o robô deve ser calibrado em uma programação regular e conforme necessário. Calibrações deve incluir o volume de agente precipitante e mesofase entregue, bem como a colocação de bolus e precipitante no poço. Obviamente, onde quer que possível calibração deve ser feito o uso de volumes e materiais semelhantes aos que serão utilizadas em ensaios realizados no período do exercício de controlo de qualidade.
Tão importante quanto a calibração é assim também está a ter em estoque uma quantidade adequada de peças do robô e suprimentos. Falhas catastróficas e inesperada, bloqueios e acidentes podem acontecer. Em tal caso, ter disponível um substituto ponta entrega precipitante, por exemplo, pode significar que uma preparação de proteína da membrana é extremamente valioso utilizado como deveria eque não seja desperdiçado.
Algumas das vantagens de um robô incluem o facto de que vai funcionar essencialmente de forma contínua e que não sofra de ou "queixar-se de" fadiga. Um robô também pode ser utilizado sob condições que não sejam consideradas humano-friendly, tais como, no escuro, sob iluminação controladas e das condições ambientais, e a temperaturas extremas. Os robôs demonstrados neste artigo foram todas usadas em condições ambientais a ~ 20 ° C. No entanto, há proteínas e projectos que exigem temperaturas ambientes não-controlada, luz 11,12 e um oxidante ou um ambiente de redução 13. Todos estes podem ser servidos, com relativa facilidade, quando um robô de cristalização é usado.
Em um artigo de vídeo anterior JoVE demonstramos como ensaios de cristalização pelo método no meso são configuradas manualmente 1. O volume mínimo de mesofase que pode ser dispensado de forma fiável por mão é limitada by imparcialidade da acuidade visual e constante da pessoa configurar os ensaios. Na nossa experiência, os volumes de mesofase tão baixas como 100 nl são facilmente manipulados. Sabemos de um laboratório onde o volume padrão dispensado manualmente é cerca de 40 nl. No entanto, os volumes consideravelmente menores são possíveis usando um robô. Separadamente, mostrámos que os volumes de mesofase tão baixas como 550 picolitros pode ser dispensada roboticamente 14. Desse trabalho, ficou claro que uma maior miniaturização de robô é possível que, se aplicada, levaria a uma grande redução na quantidade de proteína de membrana valioso necessário para levar a cabo um ensaio de cristalização.
Neste artigo de vídeo, três robôs comercialmente disponíveis foram utilizados para demonstrar a high-throughput cristalização de proteínas de membrana utilizando mesofases lipídicas. O primeiro destes foi desenvolvido no Grupo MS & FB com base na nossa experiência configurar manualmente ensaios, tal como descrito no JoVE 1712 1. Este é o instrumento temos mais familiaridade e a maior parte do artigo actual é dedicado à sua utilização. Os outros dois robôs estavam em demonstração no MS & Grupo FB no momento que o artigo foi escrito e as filmagens relevante é incluído aqui, no interesse da completude. Todos os três robôs usar muito o mesmo sistema de distribuição de mesofase, a característica essencial do qual é uma seringa de vidro de deslocamento positivo 5,7. Eles diferem mais significativamente no que se refere à entrega precipitante. 1 e 2, os robôs podem dispensar precipitante simultaneamente em 8 poços, uma única coluna em um prato de cristalização de cada vez. Em contraste, a Robot 3 dispensa todos os 96 precipitantes soluções em uma única ação. Robô 2 é o único instrumento com descartáveis precipitantes dicas de dispensação. Há prós e contras associados com os diferentes instrumentos que dependem da aplicação em particular, estes não serão elaborados aqui. Basta dizer que o trabalho de todos os três e produziram cristais de membrane proteínas pelo método de meso.
Os próximos passos do processo global de determinação de estrutura por cristalografia macromolecular são para a colheita e para crio-cool cristais a partir de placas, constituídas como descrito no artigo de vídeo e de registo e de difracção de raio-X processo a partir deles. Esses temas são abordados em artigos separados Jove desta série 1,15.
Disclosures
Não há conflitos de interesse declarados.
Acknowledgments
Há muitas pessoas que contribuíram para este trabalho e são mais da membrana estrutural e Grupo de Biologia Funcional, ambos membros passados e presentes. Para todos nós estendemos nossos mais sinceros agradecimentos e apreciação. Este trabalho foi financiado em parte por doações da Fundação Ciência da Irlanda (07/IN.1/B1836), os Institutos Nacionais de Saúde (GM75915, P50GM073210 e U54GM094599), e do 7 CM0902 Acção COST.
Materials
| Name | Company | Catalog Number | Comments |
| Brayer (roller) | Fisher Scientific | 50820937 | Tool |
| Gas-tight syringes | Hamilton | 81030 | Tool |
| Glass coverslips | Marienfeld | 01029990911 | Disposable |
| Glass plates | Marienfeld | 1527127092 | Disposable |
| Gryphon LCP Robot | Art Robbins | NA | Tool |
| In meso robot | Anachem/Gilson | NA | Tool |
| Lab notebook | Various | NA | Tool |
| Mosquito LCP Robot | TTP Labtech | NA | Tool |
| Perforated double-stick spacer tape | Saunders Corporation (hole-punched) | customized | Disposable |
| Precipitant solutions | Various | Various | Reagent |
| Purified water | Millipore | NA | Reagent |
| Rain-X | Shell Car Care | 80199200 | Reagent |
| Syringe tips | Hamilton | 7770-020 (gauge 22) | Tool |
| Tissues | Various | Various | Disposable |
| Water bottle | various | NA | Reagent |
References
- Caffrey, M., Porter, C. Crystallizing membrane proteins for structure determination using lipidic mesophases. J. Vis. Exp. (45), e1712 (2010).
- Cherezov, V., Caffrey, M. Nano-volume plates with excellent optical properties for fast, inexpensive crystallization screening of membrane proteins. J. Appl. Crystallogr. 36, 1372-1377 (2003).
- Caffrey, M., Cherezov, V. Crystallizing membrane proteins using lipidic mesophases. Nat. Protocols. 4, 706-731 (2009).
- Liu, W., Cherezov, V. Crystallization of membrane proteins in lipidic mesophases. J. Vis. Exp. (49), e2501 (2011).
- Cherezov, V., Peddi, A., Muthusubramaniam, L., Zheng, Y. F., Caffrey, M. A robotic system for crystallizing membrane and soluble proteins in lipidic mesophases. Acta Crystallogr. D Bio.l Crystallogr. 60, 1795-1807 (2004).
- Peddi, A. High-throughput automated system for crystallizing membrane proteins in lipidic mesophases. IEEE Trans. Autom. Sci. Eng. 4, 129-140 (2007).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Caffrey, M. Crystallizing membrane proteins for structure-function studies using lipidic mesophases. Biochem. Soc. Trans. 39, 725-732 (2011).
- Caffrey, M. Crystallizing membrane proteins for structure determination: use of lipidic mesophases. Annu. Rev. Biophys. 38, 29-51 (2009).
- Caffrey, M. Membrane protein crystallization. J. Struct. Biol. 142, 108-132 (2003).
- Gushchin, I., Reshetnyak, A., Borshchevskiy, V., Ishchenko, A., Round, E., Grudinin, S., Engelhard, M., Buldt, G., Gordeliy, V. Active State of Sensory Rhodopsin II: Structural Determinants for Signal Transfer and Proton Pumping. J. Mol. Biol. 412, 591-600 (2011).
- Jordan, P., Fromme, P., Witt, H. T., Klukas, O., Saenger, W., Krauss, N. Three-dimensional structure of cyanobacterial photosystem I at 2.5 angstrom resolution. Nature. 411, 909-917 (2001).
- Grawert, T., Span, I., Eisenreich, W., Rohdich, F., Eppinger, J., Bacher, A., Groll, M. Probing the reaction mechanism of IspH protein by x-ray structure analysis. Proc. Natl. Acad. Sci. USA. 107, 1077-1081 (2010).
- Cherezov, V., Caffrey, M. Picolitre-scale crystallization of membrane proteins. J. Appl. Crystallogr. 39, 604-606 (2006).
- Li, D., Boland, C., Aragao, D., Walsh, K., Caffrey, M. Harvesting and cryo-cooling crystals of membrane proteins grown in lipidic mesophases for structure determination by macromolecular crystallography. J. Vis. Exp. (67), e4001 (2012).



