Summary
Umodifiserte og hyperfosforylert tau proteiner ble brukt i to in vitro aggregering analyser for å avdekke hyperfosforylering avhengige rask aggregering kinetikk. Disse analysene bane vei for fremtidige skjermer for forbindelser som kan modulerer tilbøyelighet til hyperfosforylert tau for å danne fibriller som ligger til grunn for utviklingen av Alzheimers sykdom.
Introduction
Alzheimers sykdom (AD) er en av en stor samling av nevrodegenerative lidelser kjent som tauopatier. Den typiske patologi underliggende tauopati er de nevrofibrillære floker, NFTs, i nevroner, astrocytter og mikroglia 1-4. NFT tetthet korrelerer med kognitiv svikt 3,5 og tap av nevroner 6. NFT inneholder primært hyperfosforylert Tau-protein (referert til som "p-tau" heretter) som danner rette eller parede heliske filamenter (PHF) 7,8. Tau er en microtubule assosiert protein tenkt å lette aksonal transport som er avgjørende for neuronal signalering og menneskehandel 9,10. Hver tau molekylet inneholder 2 til 3 fosfater i normal hjerne, men de fosforylhalogenider innhold øker med flere folder i tauopati pasienter 11. Flere kinaser vil trolig bidra til tau hyperfosforylering inkludert GSK3P (glykogensyntasekinase 3β) og cdk5 (cyklin-dehengig kinase 5) 12,13, men den direkte trigger for patologisk fosforylering forblir unnvikende 14. Unormal fosforylering i eller i nærheten av de mikrotubul bindende motiver distanserer tau fra microtubule 15, og fører tau mis-lokalisering til somatodendritic rommet, hvor p-tau oligomerizes til rette eller sammenkoblede spiraltråder som til slutt kan polymeriserer i NFT slutninger. Den nære forbindelsen mellom tau hyperfosforylering, NFT formasjon, og neurodegenerasjon førte til en utbredt hypotese om at p-tau floker lokke fram apoptotiske og andre cytotoksiske svar, og dermed er den underliggende årsaken til tauopati neurodegenerering 16,17. Narkotika-skjermer og tidlige kliniske tester basert på denne forutsetningen har blitt lansert 18. Møter imidlertid denne hypotesen utfordringer 19,20. For eksempel, Santacruz et al., Viste at kognitive funksjoner hos transgene mus kan forbedres ved å undertrykke ekspresjonen av et mutantmenneskelig tau, selv om NFTs fortsatte å danne fra eksisterende tau molekyler 21. I en Drosophila modell, ble NFT vist seg å beslaglegge den giftige cytosolisk tau for å beskytte de underliggende nervecellen celler 22,23. Åpenbart patogenesen rollen til NFT, om noen, vil i stor grad påvirke retningen av tauopati legemiddelutvikling.
I høye konsentrasjoner, rekombinant eller normal hjerne tau-protein, men spontant polymeriserer langsomt inn i en PHF lignende struktur in vitro, som vist ved binding av flere β arks foretrukne fluorescerende fargestoffer, elektronmikroskopi, og lysspredning spektroskopi 24-27. Legge heparin eller arakidonsyre, en rikelig fettsyre i menneskets hjerne, drastisk akselererer PHF-formasjonen i tau isoform- og induser konsentrasjonsavhengig oppførsel 28-32. Forbløffende nok hyperfosforylert tau renset fra AD hjerner eller utarbeidet av uttømmende in vitro fosforyleringsreaksjoner enggregates raskere og mer effektivt 26,33-35. Disse resultatene er i godt samarbeid med de patologiske rollene til p-tau. Et in vitro-system basert på aggregering av p-tau kan således tjene som et kraftig verktøy for AD medikamentscreening.
Gitt den nære tilknytningen mellom tau aggregering og den progressive nevrodegenerasjon av AD, samt den siste svikt i legemiddelutvikling rettet mot Ap plakett, en annen viktig histologisk markør for 36-38 e.Kr., interessen i å oppdage narkotika som styrer tau aggregering er økende. Faktisk har flere grupper allerede begynt narkotika-skjermer på ulike gjennomstrømning, ved hjelp av in vitro tau aggregering reaksjoner som den primære analysen. En rekke kjemikalier ble funnet å vise hemmende eller reversering aktiviteter på tau aggregering in vitro 39-42. Men alle gjeldende tau aggregering regulator skjermer bruker umodifisert tau som savner nøkkelen patologisk preg av fosforylation, oppdra en bekymring for spesifisitet og effekt av å bruke disse forbindelsene i AD behandling.
En av de store hindrene for utvikling av aggregering analyser for biokjemisk karakterisering og AD narkotika screening er produksjon av tilstrekkelige mengder av patofysiologisk relevant hyperfosforylert tau protein. Ved hjelp av glidelåser assistert Catalysis system hvor 1N4R isoformen av tau og GSK-3β kinase er co-uttrykt i E. coli som leucine glidelås fusjonsproteiner, har vi overvinne denne utfordringen (. Sui et al, innsendt, se figur 1 for sluttproduktene med tau og p-tau, også se 43 for foreløpig massespektrometri karakterisering av p-tau). Fra et panel av antistoffer som er spesifikke for ni forskjellige fosforyleringsseter av tau, ble positive signaler sett i åtte stillinger (data ikke vist). Nedenfor beskriver vi protokoller og besetninger som kan differensiere aggregering kinetic differences mellom umodifisert tau og p-tau arter. Disse analysene ble endret fra publiserte protokoller som målte økningen av fluorescens av thioflavin T (ThT) eller thioflavin S (THS) ved amyloid (tau aggregater) binding 26. I den første "terminal", no-fargestoff tilnærming, blir aggregering reaksjoner satt sammen og inkubert i fravær av amyloid fargestoff. På forskjellige tidspunkter, blir en alikvot av hver reaksjon fjernet og blandet med like stort volum av ThT-holdig buffer for å stoppe aggregering og tillate ThT til å binde tau aggregater. Fluorescens måles ved en IAP FluoroMax-2 fluorometeret. I den andre "med-dye" kontinuerlig overvåking analysen, ThT eller Ths er inkludert i samlings reaksjoner. Fluorescens kan måles kontinuerlig under hele eksperimentet manuelt eller ved hjelp av en multi-plateleser. I tillegg beskrives en metode som benytter en nær fysiologisk konsentrasjon av tau og p-tau for aggregasjon i den kontinuerlige måling mode. Effekten av fosforylering forblir lett påvisbar. Nedenfor vil vi beskrive steg-for-steg driftsprosedyrer, og viser representative resultatene av disse analysene. Diskusjon av noen av de fordeler og ulemper med hver tilnærming, samt potensielle narkotika screening-programmer vil følge.
Ved en høy konsentrasjon, aggregater tau til amyloid-lignende strukturer spontant. Men i laboratoriet, tau fibrillization typisk akselerert av slike induktorer som heparin (molekylvekt, 6000 g / mol) og arakidonsyre. Eksemplene som vises her inkluderer 30 mikrometer heparin. Dannelsen av tau amyloid aggregater overvåkes av fluorescens som følge av amyloid binding av thioflavin T (ThT) eller thioflavin S (THS). Ved å binde seg til tau aggregater, viser ThT en rød skift i fluorescens (eksitasjon: 450 nm; peak utslipp: 485 nm). Ths, på den annen side, har svak emisjon ved 510 nm (eksitasjon ved 450 nm) før amyloid binding, men dette fluorescence øker betydelig i nærvær av en amyloidprotein slik som den aggregerte tau 44. Begge fargestoffer fungerer godt i å oppdage tau og p-tau aggregering. På grunn av den sterke og forholdsvis bredt emisjonstopp av ThT (se figur 2), er det bare 30% reduksjon i fluorescens-enhet ved 510 nm. For enkelhets skyld bruker vi den samme kombinasjonen av eksitasjon / utslippsbølgelengder (dvs. 450 nm / 510 nm) for å overvåke tau aggregering når du bruker enten fargestoff.
Tau aggregering kan utføres i nærvær eller fravær av farvestoffet, avhengig av formålet for analysen og tilgjengeligheten av tau-protein. Begge moduser av reaksjoner er vist nedenfor. I tillegg, viser vi til drift av to forskjellige instrumenter - en enkelt sample-fluorometer (ISA-SPEX FluoroMax-2) og et multi-plateleser (SpectraMax M2). Leserne bør være i stand til å tilpasse disse protokollene som passer deres spesifikke behov og instrument tilgjengelighet.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Utarbeidelse av reagenser
- Forbered aggregering buffer (20 mM Tris, pH 7,4, 100 mM NaCl, 1 mM EDTA). Lagre på RT, stabilt i flere måneder. Supplere 1 mM dithiothreitol (DTT) før bruk.
MERK: en HEPES-basert buffer (10 mM HEPES, pH 7,5, 0,1 mM EDTA, 5 mM DTT) produserer også lignende resultater i tau aggregering. - Forberede thioflavin T eller thioflavin S stamløsning (3 mm, oppløst i aggregering buffer), og filter ved 0,22 mikrometer sterilt filter enhet. Oppbevar ved -20 ° C i et rør som er dekket av aluminiumsfolie, stabile i flere måneder.
- Forbered heparin stamløsning (300 uM, oppløst i aggregering buffer). Oppbevares ved -20 ° C, stabil i månedsvis.
- Forbered dithiothreitol (DTT) lager (1 M, oppløst i vann). Alikvoter på 1,5 ml rør. Lagre ved -20 ° C. Før aggregering assays, tine 1 M oppløsning ved romtemperatur. Fra dette 1,000x lager, forberede en delmengde av 100 mm Arbeids lager med avionisert vann. La på istil alt er klart.
- Fjern tau fra -80 ° C fryser. Tine på is. Juster tau til forhåndsbestemt konsentrasjon med aggregering buffer. Spin i en mikrosentrifuge ved 20.800 xg i 10 min ved 4 ° C for å fjerne preformede store aggregater. Denne pre-spinnetrinnet øker konsistensen i den etterfølgende måling av fluorescens hver batch av proteinet prep. Overfør supernatanten til et annet rør; la på is inntil klar til å montere aggregering reaksjon.
2. No-dye, Terminal Assay
MERK: aggregering reaksjon av denne analysen gjøres i fravær av det fluorescerende fargestoff. Etter blanding av alle komponentene, blir reaksjonen lov til å fortsette til forhåndsbestemte tidspunkter. Aliquoter blir deretter tatt ut av aggregering reaksjonen og blandes med ThT eller Ths for amyloid binding før fluorescens lesing. Den initiale volum av aggregering reaksjonen avhenger av antall tidspoeng som trengs. Denne tilnærmingen kan requIre en stor mengde av tau-protein, men er rask, enkel, og kan utføres i et fluorometer eller en multi-brønn plate-leser (se diskusjon). Nedenfor er steg-for-steg drift, ved hjelp av ISA SPEX FluoroMax-2 kompakt spektrofluorometer for fluorescens kvantifisering.
- Sett opp aggregering blandingen i 1,5 ml Eppendorf-rør som i tabell 1. Hver kolonne representerer ingrediensene som er nødvendig for en 100 ul reaksjon, som er nok for en tids-punkt-måling. Juster mengden for hele aggregering mix basert på tidspunkter som trengs for den spesielt eksperiment. Tilsett ytterligere 10% av hver komponent for å gi rom for pipettering feil. Den typiske reaksjon inneholdende heparin som vises her kan erstattes av arakidonsyre eller aggregering buffer. Legg DTT 1 mM til reaksjonsblandingen. Hvis hele reaksjonen varer mer enn en dag, supplere frisk hver dag DTT (1 mM) for å sikre et reduserende miljø.
- Snu røret et par ganger for å blande. Place hver reaksjon i en 37 ° C inkubator eller vannbad. Omrøring er ikke nødvendig for tau-aggregering.
- Før måling av fluorescens, slå på spektrofluorometer (lampe først, og deretter datamaskinen).
MERK: xenon buelampe som kan brukes med en gang. Men for best resultat lar maskinen å varme opp i ca 10 min før du leser fluorescens. - Start programvaren på datamaskinen.
- Velg Real Time Display modus i Instrument Control Center, satt eksitasjonsbølgelengde til 450 nm (slit til 2 nm) og utslipp bølgelengde til 510 nm (slit til 5 nm). Lukk Real Time Display mode vinduet for å gå tilbake til Instrument Control Center.
- Velg Constant Wavelength Analysis, trykker du Legg >> nøkkelen i den øvre rammen for å legge bølgelengder sett. Satt oppkjøps parametere av Standard Error til 1 og maksimum Trials til 3, og klikk deretter Legg til. Klikk på Go! Å åpne datadisplayvinduet.
- I Data Display-vinduet klikker du på Start ACQ å åpne dialogboksen Ny Sample boks. Velg "ukjent" for prøvetype.
- Til hver 100 fil aggregering blanding, tilsett 98 mL aggregering buffer og 2 ul 3 mM thioflavin T. Pipet flere ganger for å blande.
- Overfør hele blandingen til en kyvette (FCA3, utvendig dimensjon, wxlxh = 12,5 mm x 12,5 mm x 45 mm). Plassere kyvetten i prøveholderen i prøven-rommet og lukke lokket. Klikk Kjør for å samle fluorescens data. Registrere data.
- Fjern kyvetten og dekanter løsningen. Skyll kyvetten med destillert vann tre ganger. Tørr ved å blåse luft inn og utenfor kyvetten.
3. Med-dye, Kontinuerlig Mode-analysen på en SpectraMax M2 Plate Reader
NB: Denne analyse er forskjellig fra den forrige ved at det fluorescerende fargestoff ThT eller Ths er inkludert i aggregasjon reaksjon. Dette tillater kontinuerlig måling av det samme sett av reaksjoner. På grunn av gjentatt bruk av reaksjonen, er denne metoden bedre utført med en automatisk flerbrønnsplate-leser (som vist under drift av SpectraMax M2). En vanlig fluorometer også fungerer, men hyppigheten av måling av aggregering raske reaksjoner er noe begrenset på grunn av den manuelle arten av operasjonen.
- Sett opp aggregering blanding i en 96-brønns plate (96-brønners sorte faste plate, godt volum 360 ul, flat bunn) som i tabell 2. Hver kolonne representerer ingrediensene som er nødvendig for en 200 ul reaksjon, noe som er nok for en tidspunkts-måling. Bland godt ved å pipettere flere ganger. Supplere frisk 1mM DTT hver dag i løpet av eksperimenter.
- Inkuber i 96-brønners plate ved 37 ° C.
- På hvert tidspunkt før fluorescens måling, slå på multi-modus mikroplateleser og datamaskinen. Gi tilstrekkelig tid for machine å stabilisere, ca 10 min.
- Start programvaren på datamaskinen. Still temperaturen til 37 ° C og velge Fluorescens Intensitet (FI-Top Les) modus, still eksitasjonsbølgelengde ved 450 nm og emisjon bølgelengde på 510 nm.
- Sett 96-brønns plate i skuffen, og trykk på LES-tasten for å starte målingen.
- Etter å ha lest, fjerne platen og returnere det tilbake til 37 ° C inkubator. Kopiere data og lime inn i et Excel-regneark for dataanalyse og plotting.
4. Med-dye, Kontinuerlig Mode-analysen på en Compact spektrofluorometer
- Sett opp aggregering blandingen i 1,5 ml Eppendorf-rør som i tabell 3. Hver kolonne representerer ingrediensene som er nødvendig for en 200 ul reaksjon, som er nok for en tids-punkt-måling.
- Snu røret et par ganger for å blande.
- Slå på spektrofluorometer og sett programvare som i trinn 2.3 og 2.4.
- Overfør hele blandingen toa kyvette. Plassere kyvetten i prøveholderen i prøven-rommet og lukke lokket. Klikk Kjør for å samle fluorescens data. Registrere data.
- Fortsett å lese med passende mellomrom ved å klikke Kjør og registrering av data. Dersom aggregering skal overvåkes ved en høy frekvens (f.eks, hver 30 eller 60 s), lar reaksjonen i kuvetten og i maskinen inntil enten målingen er ferdig, eller når det er tilstrekkelig tid for å bytte reaksjoner eller kyvetter.
- Fjern kyvetten og dekanter løsningen. Skyll kyvetten med destillert vann tre ganger. Tørr ved å blåse luft inn og utenfor kyvetten.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Ved hjelp av rekombinant tau og p-tau (figur 1), etablerte vi to forskjellige protokoller for å sammenligne kinetikken av aggregering av tau og p-tau, drar nytte av den sterke fluorescens utslipp av ThT og Ths ved binding til amyloidal proteinaggregater, inkludert tau og p-tau (figur 2). Med eller uten den fluorescerende fargestoff i samlings reaksjonen, observerte vi konsekvent forbedring av tau-hyperfosforylering aggregering av (figurene 3-5). Denne stimuleringen er uavhengig av heparin (data ikke vist). I en typisk reaksjon, tau og p-tau-oligomerisere ved store hastigheter inne i den første 30 min før sakker signifikant (figur 3 og 5), med p-tau som oppviser høyere fluorescens-enheter i løpet av eksperimentet. Inkludert ThT i samlings reaksjoner forårsaker betydelig retardasjon i frekvensen av aggregering (figur 4). Begge isoformene nærmet plateau 160 timer etter reaksjonene hadde startet. Ths, på den annen side, ikke forårsaker nevneverdig nedgang av aggregasjon (figur 5).

Figur 1. Renset tau og hyperfosforylert Tau (p-tau) anvendt i denne studien Prøver ble løst. Av en 10% SDS-PAGE-gel og farget med Coomassie blått R250 (venstre) og probet med et anti-tau-monoklonalt antistoff (høyre panel). Kjørefelt M, molekylvekt markør; felt 1 og 3, ufosforylerte tau; lane2 og 4, hyperfosforylert tau.

Figur 2. Utslipp spektra for ThT (30 mm) med eller uten binding tau aggregater. Emission Kjøpet ble s hermetisert fra 460 nm til 600 nm (1 nm økning, 0,1 sek integrasjon, 5 nm slit bredde), eksitasjon ved 450 nm. Tau aggregater ble oppnådd ved å tillate 50 uM tau aggregering å forløpe ved 37 ° CO / N (se protokoll 2 for detaljer).
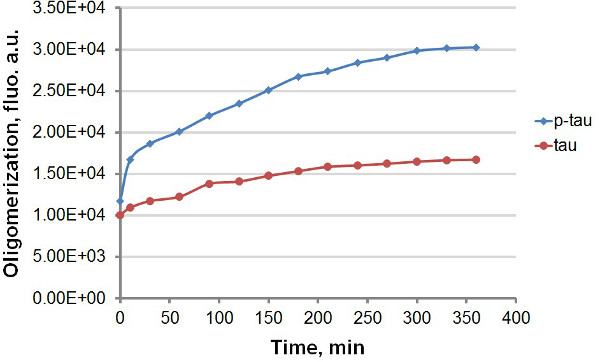
Figur 3. Aggregation kurver for tau og p-tau i terminal analysen. Aggregering av 50 mikrometer tau og p-tau ble gjennomført med 30 mikrometer heparin som indus. Til forskjellige tider etter starten av reaksjonen, ble 100 ul av reaksjonsblandingen ble fjernet og blandet med samme volum av 60 mM ThT før fluorescens-måling. Fluorescens ble målt ved 450 nm eksitasjon, 510 nm emisjon. "au", vilkårlige enheter. Legg merke til at tidsskalaen er i minutter.
"Figur 4" src = "/ files / ftp_upload / 51537 / 51537fig4highres.jpg" />
Figur 4. Aggregation kurver for ThT alene, tau og p-tau i den kontinuerlige målemodus i nærvær av ThT. Hver reaksjonsblanding bestod av 0 eller 50 uM tau eller p-tau, 30 mM heparin og 30 mM ThT i aggregering buffer . Reaksjoner ble inkubert ved 37 ° C i en 96-brønns plate. På forskjellige tidspunkter, ble platen fjernet fra inkubatoren og lastet til plate-leser for å lese fluorescens (eksitasjon 450 nm, emisjon 510 nm). Mellom avlesningene ble platen holdt i en inkubator uten omrøring under et deksel. Tilstedeværelsen av ThT bremset betydelig ned aggregering, men enda viktigere, den hyperfosforylert tau fortsatt utstilt en raskere hastighet av aggregering enn gjorde sin umodifiserte motstykke. Legg merke til at omfanget av tid er i timer.
pload / 51537 / 51537fig5highres.jpg "/>
Figur 5. Småskala tau aggregering analyser i nærvær av Ths. In vitro-heparin-indusert aggregasjon av 6 pM tau og p-tau ble vurdert i den kontinuerlige måling modus med thioflavin S som indikatorfarge. I tillegg til proteinet, inneholdt hver reaksjon 30 mM heparin og 20 uM Ths i HEPES aggregering buffer (10 mM HEPES pH 7,5, 5 mM DTT, 0,1 mM EDTA). Alle ingrediensene bortsett fra heparin ble blandet og bragt i likevekt ved romtemperatur. Etter tilsetning av heparin, ble reaksjonsblandingen overført til en kyvette og anbrakt i prøveholderen. Fluorescens ble målt umiddelbart som T 0, og fortsettes i ca. 2 timer eller inntil fluorescens økning bremset ned til nær null. På grunn av den relativt korte reaksjonstiden, ble hele reaksjonen utføres ved RT i samme kyvette.
| tau | p-tau | |
| 60-100 mikrometer tau | 50 pl | 0 mL |
| 60-100 mikrometer p-tau | 0 mL | 50 pl |
| 300 mikrometer heparin | 10 pl | 10 pl |
| aggregering buffer | 39 mL | 39 mL |
| 100 mM DTT | 1 mL | 1 mL |
Tabell 1. Aggregation blandingskomponenter for no-dye, terminal analysen.
| tau | p-tau | Fargestoff alene | |
| 60-100 mikrometer tau | 50 pl | 0 mL | 0 mL |
| 60-100 mikrometer p-tau | 0 mL | 50 pl | |
| 300 mikrometer heparin | 20 mL | 20 mL | 20 mL |
| 3 mm thioflavin T | 2 pl | 2 pl | 2 pl |
| Aggregering buffer | 126 mikroliter | 126 mikroliter | 176 mikroliter |
| 100 mM DTT | 2 pl | 2 pl | 2 pl |
Tabell 2. Aggregation blandingskomponenter for med-dye, kontinuerlig analyse på en plateleser.
| tau | p-tau | Fargestoff alene | |
| 60-100 mikrometer tau | 5 mL | 0 mL | 0 mL |
| 60-100 mikrometer p-tau | 0 mL | 5 mL | 01; l |
| 300 mikrometer heparin | 20 mL | 20 mL | 20 mL |
| 3 mm thioflavin S | 1,5 mL | 1,5 mL | 1,5 mL |
| Aggregering buffer | 171,5 mL | 171,5 mL | 176,5 mL |
| 100 mM DTT | 2 pl | 2 pl | 2 pl |
Tabell 3. Aggregation blandingskomponenter for med-dye, kontinuerlig analyse på en kompakt spektrofluorometer.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Denne protokollen demonstrerer ulike analysebetingelser og virkemidler som gjenkjenner fosforyleringen avhengige rask tau aggregering kinetikk. I terminalen analysen, blir fluorescens fargestoff ThT tilsatt til en del av reaksjonen fjernes fra konsentrat-blanding ved hvert tidspunkt. Amyloid-indusert binding Fluorescens måles deretter 26. I den andre, med fargestoff-modus blir tau-aggregering utføres i nærvær av ThT eller Ths, slik at denne type reaksjon er egnet for sanntids automatisk vurdering av veksten av tau-aggregater. Hver av disse metodene har sine fordeler og ulemper.
Terminalen-modus reaksjonen gjennomføres kun med de ingredienser som er nødvendig for tau-aggregering. Fortynning og blanding av reaksjonsblandingen med thioflavin T drastisk senker frekvensen av fluorescensen øker, i det vesentlige stopper reaksjonen for fluorescens-kvantifisering. Denne metoden er derfor også kompatibel med manuell betjening. Men fordi reaction er praktisk talt avsluttet ved ThT tillegg kan en stor mengde av tau være nødvendig for å plotte en kurve aggregering. En annen potensiell trussel for denne metoden er at hyppig tilgang til reaksjonsblandingen kan innføre mikrobiell eller proteolytisk forurensning, eller proteinoksidasjon. I motsetning til dette tillater den med fargestoff-modus generering av amyloid i nærvær av ThT eller Ths. Fremme av aggregering kan overvåkes kontinuerlig uten noen gang å forstyrre reaksjonen. Denne funksjonen er spesielt attraktivt ved etablering av en automatisert analyseplattform. Imidlertid kan ulike fargestoffer lokke fram konkrete svar. Faktisk retards ThT tau og p-tau aggregering betydelig, men Ths har liten effekt (sammenligne figur 3 og 5). Det finnes flere andre fluorescens-farvestoffer, herunder Congo rød og tiaziner, som har vært brukt i histologiske og cellebiologiske studier for PHF dannelse. Minst en rapport fremgår at noen av disse farvestoffer kan indusere tau aggregering i vevkultur celler 45. Derfor, når man velger disse forbindelser for amyloidogenesis kinetiske studier, forsiktighet skal praktiseres, og at forskjellige fargestoffer kan ha for å bli sammenlignet.
Med hensyn til valg av instrumentet, enkelt-prøven fluorometer anvendt i den første metode er svært pålitelig, men operasjonen kan være arbeidskrevende når mer enn noen få reaksjoner som skal sammenlignes. Bruke flere kyvetter kan bidra til å unngå krysskontaminering mellom reaksjoner, selv om kostnaden av disse skjøre kvarts kyvetter kan være uoverkommelige for noen. Omvendt kan den fler brønns mikroplate-leser undersøke flere reaksjoner samtidig. Bruken av engangs 96-brønners plater er fordelaktig i tillegg. Med et varmeelement, kan en mikroplateleser være en dedikert anordning for overvåkning av flere reaksjoner ved 37 ° C i en lengre tidsperiode. Men kanskje fordampning være en bekymring. DiNitto et al. Kledde en lignende reaksjon med mineralolje for å forhindrefordampning 46.
Noen forholdsregler skal tas for de ovennevnte protokoller for å sikre konsistente og kvantitative resultater. For det første, tau og p-tau spontant danne amyloid aggregater over tid, særlig når den er i en høy konsentrasjon. Det er således viktig å fryse alle alikvoter av protein preps, og tine kun den nødvendige volumet før forsøkene. Likevel, kanskje noen aggregater, inkludert de granulære mellom påvisbare ved ThT 47 har dannet under utarbeidelsen av rekombinante proteiner. En betydelig første fluorescens lesning av en typisk aggregering reaksjon er derfor vanlig. Likevel, tilsetning av et pre-spinnetrinnet og overføring av supernatanten til et separat rør, selv uten en synlig protein pellet, kan redusere og opprettholde ensartet, innledende fluorescens av den samme batch av tau og p-tau-prep. For det andre arbeidsstamløsning av ThT (dvs. 60 pM) er stabil ved romtemperatur i mindre enn en uke før the fluorescens avtar. Det er derfor anbefalt å re-make 60 mikrometer ThT hver flere dager.
En fremtredende årsak underliggende studier av p-tau aggregering er utvikling av nye AD diagnostikk og terapi. Forbindelser som hemmer eller tilbakestilles rekombinant tau aggregering har blitt identifisert fra high-throughput skjermer og målrettede tester 18,40,41,48. Effekten av disse forbindelsene for p-tau aggregering er ikke klarlagt. Disse skjermene ble utført i terminalmodus ved dispensering av et felles samlings blanding uten fargestoff til de enkelte multiplate brønner med forskjellige forbindelser. Vanligvis etter O / N inkubasjon ThT eller Ths lagt for fluorescens måling, avslører den hemmende effekt av mange forbindelser. Den med fargestoff-tilnærming som er nevnt ovenfor og ved å Rankin et al., 49 ennå ikke er tatt med for å high-throughput-skjermer. Nå med hyperfosforylert tau tilgjengelig for kinetiske og farmasøytiske studier av paretskruelinjeformet filamentdannelse, er Alzheimers sykdom drug discovery sannsynlig å avansere videre.
Til slutt er det verdt å merke seg at studiet av p-tau aggregering er av avgjørende betydning for ikke bare tauopatier, men kan også påvirke en enda større befolkning. For eksempel finnes det rapporter om at nevrofibrillære floker kan påvises hos noen pasienter med kronisk traumatisk encefalopati, slik som profesjonelle amerikanske fotballspillere og boksere 50-52. Lignende sammenheng er også rapportert for enkle eller gjentatte traumatisk hjerneskade pasienter, inkludert soldater 53. Protokoller som er beskrevet i dette arbeidet kan dermed bidra til oppdagelsen og utviklingen av nye behandlingsformer rettet mot p-tau aggregater i nerveceller.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Trizma base | Sigma | T1503 | |
| NaCl | Macron Fine Chemicals | MAL-7581-06 | |
| Ethylenediaminetetraacetic Acid (EDTA) | Invitrogen | 15576-028 | |
| Thioflavin T | Sigma | T3516 | Stored in dark |
| Thioflavin S | Sigma | T1892 | Stored in dark |
| heparin | Sigma | H3393 | |
| DL-Dithiothreitol (DTT) | Sigma | D9779 | Stored at 4 °C |
| 96-well plate | Corning | 3917 | |
| ISA SPEX FluoroMax-2 | Horiba | ||
| SpectraMax M2 Multi-Mode Microlate Reader | Molecular Devices | ||
| Mouse Anti-Tau Monoclonal Antibody | R&D Systems | MAB3494 | Stored at –80 °C |
References
- Lee, V. M., Goedert, M., Trojanowski, J. Q. Neurodegenerative tauopathies. Annu Rev Neurosci. 24, 1121-1159 (2001).
- Ballatore, C., Lee, V. M., Trojanowski, J. Q. Tau-mediated neurodegeneration in Alzheimer's disease and related disorders. Nat Rev Neurosci. 8 (9), 663-672 (2007).
- Arriagada, P. V., Marzloff, K., Hyman, B. T. Distribution of Alzheimer-type pathologic changes in nondemented elderly individuals matches the pattern in Alzheimer's disease. Neurology. 42 (9), 1681-1688 (1992).
- Arriagada, P. V., Growdon, J. H., Hedley-Whyte, E. T., Hyman, B. T. Neurofibrillary tangles but not senile plaques parallel duration and severity of Alzheimer's disease. Neurology. 42 (3 Pt 1), 631-639 (1992).
- Bancher, C., Braak, H., Fischer, P., Jellinger, K. A. Neuropathological staging of Alzheimer lesions and intellectual status in Alzheimer's and Parkinson's disease patients. Neurosci Lett. 162 (1-2), 179-182 (1993).
- Guillozet, A. L., Weintraub, S., Mash, D. C., Mesulam, M. M. Neurofibrillary tangles, amyloid, and memory in aging and mild cognitive impairment. Arch Neurol. 60 (5), 729-736 (2003).
- Hasegawa, M., et al. Protein sequence and mass spectrometric analyses of tau in the Alzheimer's disease brain. J Biol Chem. 267 (24), 17047-17054 (1992).
- Matsuo, E. S., et al. Biopsy-derived adult human brain tau is phosphorylated at many of the same sites as Alzheimer's disease paired helical filament tau. Neuron. 13 (4), 989-1002 (1994).
- Bamburg, J. R., Bloom, G. S. Cytoskeletal pathologies of Alzheimer disease. Cell Motil Cytoskeleton. 66 (8), 635-649 (2009).
- Denk, F., Wade-Martins, R. Knock-out and transgenic mouse models of tauopathies. Neurobiol Aging. 30 (1), 1-13 (2009).
- Gong, C. X., Iqbal, K. Hyperphosphorylation of microtubule-associated protein tau: a promising therapeutic target for Alzheimer disease. Curr Med Chem. 15 (23), 2321-2328 (2008).
- Mazanetz, M. P., Fischer, P. M. Untangling tau hyperphosphorylation in drug design for neurodegenerative diseases. Nat Rev Drug Discov. 6 (6), 464-479 (2007).
- Brunden, K. R., Trojanowski, J. Q., Lee, V. M. Advances in tau-focused drug discovery for Alzheimer's disease and related tauopathies. Nat Rev Drug Discov. 8 (10), 783-793 (2009).
- Querfurth, H. W., LaFerla, F. M. Alzheimer's disease. N Engl J Med. 362 (4), 329-344 (2010).
- Buee, L., Bussiere, T., Buee-Scherrer, V., Delacourte, A., Hof, P. R. Tau protein isoforms, phosphorylation and role in neurodegenerative disorders. Brain Res Brain Res Rev. 33 (1), 95-130 (2000).
- Lee, V. M., Brunden, K. R., Hutton, M., Trojanowski, J. Q. Developing therapeutic approaches to tau, selected kinases, and related neuronal protein targets. Cold Spring Harb Perspect Med. 1 (1), 006437 (2011).
- Mandelkow, E. M., Mandelkow, E. Biochemistry and cell biology of tau protein in neurofibrillary degeneration. Cold Spring Harb Perspect Med. 2 (7), a006247 (2012).
- Bulic, B., Pickhardt, M., Mandelkow, E. Progress and Developments in Tau Aggregation Inhibitors for Alzheimer Disease. J Med Chem. 56 (11), 4135-4155 (2013).
- Cowan, C. M., Quraishe, S., Mudher, A. What is the pathological significance of tau oligomers. Biochem Soc Trans. 40 (4), 693-697 (2012).
- Spires-Jones, T. L., Kopeikina, K. J., Koffie, R. M., de Calignon, A., Hyman, B. T. Are tangles as toxic as they look. J Mol Neurosci. 45 (3), 438-444 (2011).
- SantaCruz, K., et al. Tau suppression in a neurodegenerative mouse model improves memory function. Science. 309 (5733), 476-481 (2005).
- Wittmann, C. W., et al. Tauopathy in Drosophila: neurodegeneration without neurofibrillary tangles. Science. 293 (5530), 711-714 (2001).
- Shulman, J. M., Feany, M. B. Genetic modifiers of tauopathy in Drosophila. Genetics. 165 (3), 1233-1242 (2003).
- Wille, H., Drewes, G., Biernat, J., Mandelkow, E. M., Mandelkow, E. Alzheimer-like paired helical filaments and antiparallel dimers formed from microtubule-associated protein tau in vitro. J Cell Biol. 118 (3), 573-584 (1992).
- Alonso, A., Zaidi, T., Novak, M., Grundke-Iqbal, I., Iqbal, K. Hyperphosphorylation induces self-assembly of tau into tangles of paired helical filaments/straight filaments. Proc Natl Acad Sci U S A. 98 (12), 6923-6928 (2001).
- Barghorn, S., Biernat, J., Mandelkow, E. Purification of recombinant tau protein and preparation of Alzheimer-paired helical filaments in vitro. Methods Mol Biol. 299, 35-51 (2005).
- Wilson, D. M., Binder, L. I. Polymerization of microtubule-associated protein tau under near-physiological conditions. J Biol Chem. 270 (41), 24306-24314 (1995).
- Wilson, D. M., Binder, L. I. Free fatty acids stimulate the polymerization of tau and amyloid beta peptides. In vitro evidence for a common effector of pathogenesis in Alzheimer's disease. Am J Pathol. 150 (6), 2181-2195 (1997).
- Perez, M., Valpuesta, J. M., Medina, M., Montejo de Garcini, E., Avila, J. Polymerization of tau into filaments in the presence of heparin: the minimal sequence required for tau-tau interaction. J Neurochem. 67 (3), 1183-1190 (1996).
- Carlson, S. W., et al. A complex mechanism for inducer mediated tau polymerization. Biochemistry. 46 (30), 8838-8849 (2007).
- Goedert, M., et al. Assembly of microtubule-associated protein tau into Alzheimer-like filaments induced by sulphated glycosaminoglycans. Nature. 383 (6600), 550-553 (1996).
- King, M. E., Gamblin, T. C., Kuret, J., Binder, L. I. Differential assembly of human tau isoforms in the presence of arachidonic acid. J Neurochem. 74 (4), 1749-1757 (2000).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pseudo-phosphorylation of tau at Ser202 and Thr205 affects tau filament formation. Brain Res Mol Brain Res. 138 (1), 84-93 (2005).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Pre-assembled tau filaments phosphorylated by GSK-3b form large tangle-like structures. Neurobiol Dis. 31 (3), 368-377 (2008).
- Grundke-Iqbal, I., et al. Abnormal phosphorylation of the microtubule-associated protein tau (tau) in Alzheimer cytoskeletal pathology. Proc Natl Acad Sci U S A. 83 (13), 4913-4917 (1986).
- Castellani, R. J., Perry, G. Pathogenesis and disease-modifying therapy in Alzheimer's disease: the flat line of progress. Arch Med Res. 43 (8), 694-698 (2012).
- Green, R. C., et al. Effect of tarenflurbil on cognitive decline and activities of daily living in patients with mild Alzheimer disease: a randomized controlled trial. JAMA. 302 (23), 2557-2564 (2009).
- Gauthier, S., et al. Effect of tramiprosate in patients with mild-to-moderate Alzheimer's disease: exploratory analyses of the MRI sub-group of the Alphase study. J Nutr Health Aging. 13 (6), 550-557 (2009).
- Pickhardt, M., et al. Anthraquinones inhibit tau aggregation and dissolve Alzheimer's paired helical filaments in vitro and in cells. J Biol Chem. 280 (5), 3628-3635 (2005).
- Crowe, A., Ballatore, C., Hyde, E., Trojanowski, J. Q., Lee, V. M. High throughput screening for small molecule inhibitors of heparin-induced tau fibril formation. Biochem Biophys Res Commun. 358 (1), 1-6 (2007).
- Taniguchi, S., et al. Inhibition of heparin-induced tau filament formation by phenothiazines, polyphenols, and porphyrins. J Biol Chem. 280 (9), 7614-7623 (2005).
- Sigurdsson, E. M. Tau-focused immunotherapy for Alzheimer's disease and related tauopathies. Curr Alzheimer Res. 6 (5), 446-450 (2009).
- Tan, Y. J., et al. Phosphopeptide Enrichment with TiO-Modified Membranes and Investigation of Tau Protein Phosphorylation. Anal Chem. 85 (12), 5699-5706 (2013).
- Santa-Maria, I., Perez, M., Hernandez, F., Avila, J., Moreno, F. J. Characteristics of the binding of thioflavin S to tau paired helical filaments. J Alzheimers Dis. 9 (3), 279-285 (2006).
- Lira-De Leon, K. I., et al. Molecular mechanism of tau aggregation induced by anionic and cationic dyes. J Alzheimers Dis. 35 (2), 319-334 (2013).
- DiNitto, J. P., Wang, L., Wu, J. C. Continuous fluorescence-based method for assessing dicer cleavage efficiency reveals 3' overhang nucleotide preference. BioTechniques. 48, 303-311 (2010).
- Maeda, S., et al. Granular tau oligomers as intermediates of tau filaments. Biochemistry. 46 (12), 3856-3861 (2007).
- Pickhardt, M., et al. Phenylthiazolyl-hydrazide and its derivatives are potent inhibitors of tau aggregation and toxicity in vitro and in cells. Biochemistry. 46 (35), 10016-10023 (2007).
- Rankin, C. A., Sun, Q., Gamblin, T. C. Tau phosphorylation by GSK-3beta promotes tangle-like filament morphology. Mol Neurodegener. 2, 12 (2007).
- McKee, A. C., et al. Chronic traumatic encephalopathy in athletes: progressive tauopathy after repetitive head injury. J Neuropathol Exp Neurol. 68 (7), 709-735 (2009).
- Herrup, K. Reimagining Alzheimer's disease--an age-based hypothesis. J Neurosci. 30 (50), 16755-16762 (2010).
- Gavett, B. E., Stern, R. A., McKee, A. C. Chronic traumatic encephalopathy: a potential late effect of sport-related concussive and subconcussive head trauma. Clin Sports Med. 30 (1), 179-188 (2011).
- Tsitsopoulos, P. P., Marklund, N. Amyloid-beta Peptides and Tau Protein as Biomarkers in Cerebrospinal and Interstitial Fluid Following Traumatic Brain Injury: A Review of Experimental and Clinical Studies. Front Neurol. 4, 79 (2013).



