Citometria de Fluxo protocolos para a superfície e intracelular Antigen análises de tipos de células neurais
Summary
We provide a detailed description of a protocol for flow cytometric analysis of surface antigens and/or intracellular antigens in neural cell types. Critical aspects of experimental planning, step-by-step methodological procedures, and fundamental principles of flow cytometry are explained in order to enable neurobiologists to exploit this powerful technology.
Abstract
Flow cytometry has been extensively used to define cell populations in immunology, hematology and oncology. Here, we provide a detailed description of protocols for flow cytometric analysis of the cluster of differentiation (CD) surface antigens and intracellular antigens in neural cell types. Our step-by-step description of the methodological procedures include: the harvesting of neural in vitro cultures, an optional carboxyfluorescein succinimidyl ester (CFSE)-labeling step, followed by surface antigen staining with conjugated CD antibodies (e.g., CD24, CD54), and subsequent intracellar antigen detection via primary/secondary antibodies or fluorescently labeled Fab fragments (Zenon labeling). The video demonstrates the most critical steps. Moreover, principles of experimental planning, the inclusion of critical controls, and fundamentals of flow cytometric analysis (identification of target population and exclusion of debris; gating strategy; compensation for spectral overlap) are briefly explained in order to enable neurobiologists with limited prior knowledge or specific training in flow cytometry to assess its utility and to better exploit this powerful methodology.
Introduction
A citometria de fluxo foi explorado extensivamente em imunologia, hematologia e oncologia para definir populações de células através de dispersão propriedades intrínsecas, a expressão do antigénio da superfície celular, e outros parâmetros de fluorescência 1-3. Os nossos insights sobre desenvolvimento linhagem de sangue e doença são o resultado de um significativo grau de refinamento contínuo desta metodologia após a sua implementação inicial de 4,5. O aumento da consciência do potencial analítico quantitativo e global de citometria de fluxo tem incentivado recentemente o seu uso mais difundido na pesquisa com células-tronco e pode permitir semelhante profunda progresso em um tempo mais curto 6. No entanto, a aplicação da citometria de fluxo para analisar especificamente e isolar populações neuronais tem sido entendida como um desafio. Em contraste com as células hematopoiéticas que existem naturalmente em suspensão, os tipos de células neuronais são tipicamente colhidas de fontes excessivamente complexas que podem incluir células gliais e vários outras células circundantes, bem como uma intrincada rede de neurônios portadores de processo. Consequentemente, neurobiologia ainda tem que implementar a versatilidade de citometria de fluxo para o seu potencial completo em rotinas do cotidiano da pesquisa. No entanto, desde que uma única suspensão de células viáveis podem ser gerados (e protocolos têm sido desenvolvidos e optimizados para esse fim 7), citometria de fluxo e de células activadas por fluorescência (FACS) pode ser considerado um elemento valioso do repertório analítico em neurobiologia 8-11.
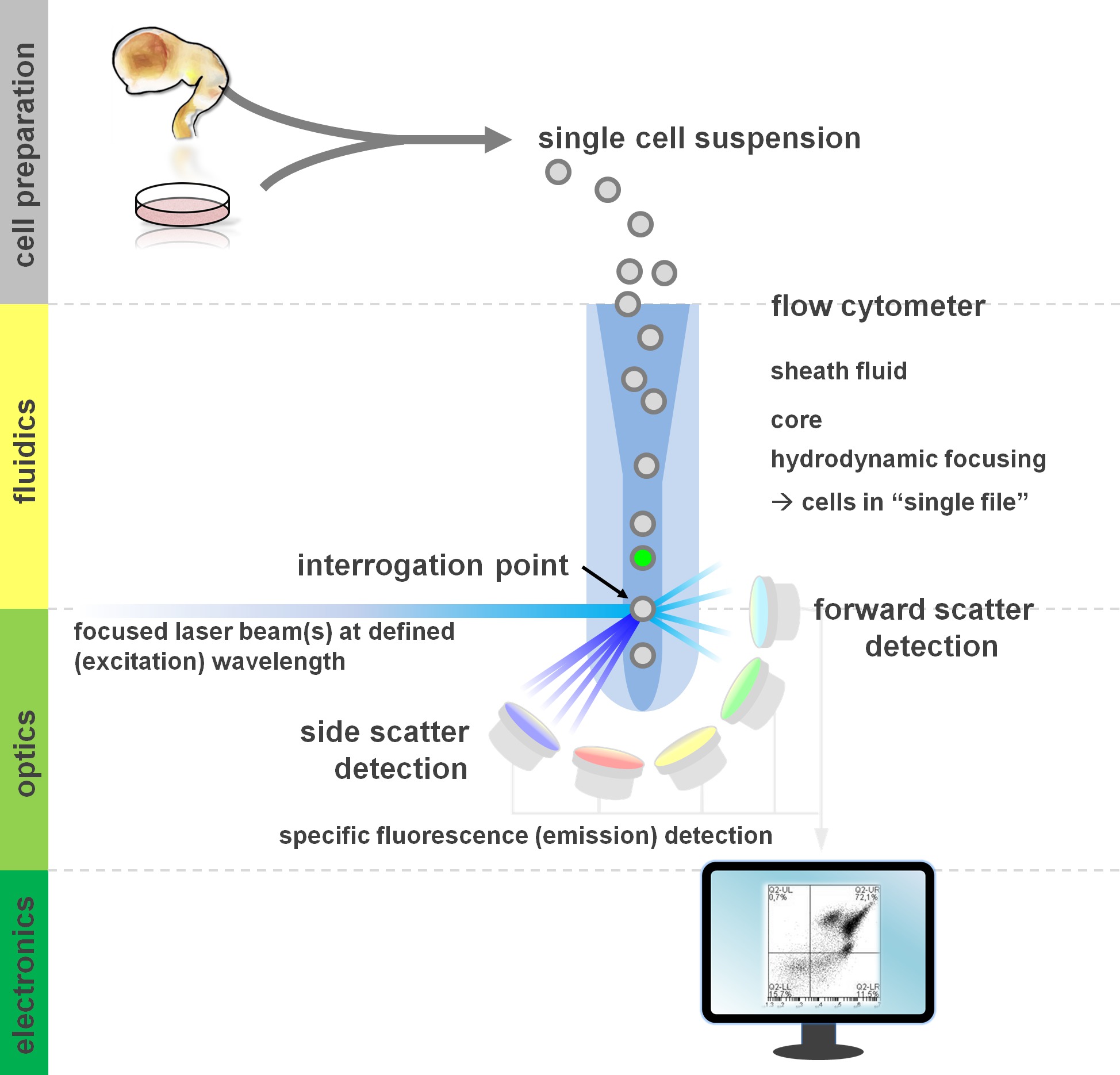
. Figura 1. Princípio da análise de citometria de fluxo e componentes de um citômetro de fluxo Fluxo cytometers compreendem três sistemas principais: fluídicos, óptica e eletrônica. Um fluxo simplificado de células em suspensão (preparada a partir de tecido primário ou em cultura in vitro) é realizada pela bainha Fluid através de focagem hidrodinâmica, a limitação da amostra para o seu núcleo central. As peças ópticas são compostos de lasers que iluminam o fluxo de células e os filtros ópticos que encaminham o sinal para os detectores apropriados. Os sinais de luz detectados são convertidos em sinais eletrônicos, posteriormente processadas por um computador e visualizadas em um monitor para análise de dados e gating. Por favor, clique aqui para ver uma versão maior desta figura.
Usuários de métodos de citometria de fluxo de lucro de pelo menos um conhecimento básico dos fundamentos subjacentes, incluindo blocos de construção de um citómetro (para revisão ver 12,13; também veja a Figura 1). Um feixe de raios laser intersecta com um fluxo de fluidos hidrodinamicamente focado que contém as células em suspensão, que por sua vez, passam através do feixe de laser em um ficheiro único "um após o outro. O Interceptino de uma célula (ou qualquer outra partícula, para esse efeito) com os resultados de laser na dispersão de luz a partir deste ponto de interrogação. Luz dispersada pode ser detectada na continuação da direcção de laser (dispersão frontal, associada ao tamanho da partícula), bem como perpendiculares à sua direcção (dispersão lateral; reflectindo a granulosidade da partícula / célula). Estas propriedades de dispersão acima mencionados não exigem rotulagem específica, razão pela qual uma amostra não marcado (ou também os restos celulares, bolhas de ar, etc.) gerará um sinal (evento) na dispersão para a frente bivariada e lado dispersão comumente usado para gating inicial. Ao utilizar os lasers e filtros específicos para os espectros de excitação e de emissão correspondente adequadas, uma célula pode ser analisada quanto a sua positividade, o nível de intensidade, ou na ausência de marcadores fluorescentes. A maioria das aplicações de citometria de fluxo têm-se centrado na caracterização através de antigénios da superfície celular. Ao contrário do lineag hematopoiéticase, a linhagem neural permaneceu menos extensivamente definido de acordo com a superfície de expressão epitopo padrões 5. Uma vantagem de explorar os antigénios de superfície é que as células vivas podem ser submetidas a triagem celular paradigmas tais como FACS. Em contraste, a coloração do antigénio intracelular requer fixação e permeabilização passos para mediar a interacção epitopo-anticorpo, o que impede a jusante aplicações que exigem células viáveis. Digno de nota, tais abordagens ainda permitem inúmeros ensaios quantitativos 14, bem como análises a jusante para RNA e proteína expressão 15. Hematologia, imunologia e oncologia, muitas vezes utilizado mais de uma dúzia de marcadores em conjunto para definir determinadas subpopulações 16. Além disso, citometria de massa ou CyTOF pode agora ser utilizado para analisar se a 30 parâmetros simultaneamente 17,18.
Para aplicações de células-tronco neurais, bem como culturas primárias 14,19,20 A heterogeneidade das célulasvitro é um fenômeno comum 21-23. As células não representam a população alvo de interesse encarnar um fator potencialmente confusão para leitura experimental 24,25. Convenientemente, os diferentes tipos celulares presentes dentro de uma suspensão celular heterogénea suportar perfis de expressão de antigénio distintas (conhecidas ou ainda a ser decifrados), que podem ser utilizados para definir estes diferentes populações. A citometria de fluxo pode, portanto, desempenhar um papel crucial na resolução de heterogeneidade celular e, assim, facilitar aplicações biomédicas (ensaios in vitro, de terapia celular) e otimizar a leitura quantitativa, concentrando-se no subconjunto mais relevantes 24,26. Várias combinações de antigénios de superfície foram identificados nos últimos anos para permitir o isolamento e quantificação de tipos de células neuronais específicas. Isto inclui CD133 para o enriquecimento de células estaminais neurais 27, uma combinação dos / CD24 / CD29 antigénios de superfície CD15 para o isolamento da NSC, Differentiated neurônio e células da crista neural 28 ou CD15 / CD24 / CD44 / CD184 / CD271 para isolar neural e subconjuntos gliais 25, entre outras assinaturas 29,30. Além neurônios, marcadores gliais incluem A2B5 31, CD44 25, NG2 32 e GLAST 33. Uma publicação recente tem explorado o mesencéfalo marcador precursor floorplate CORIN 34,35 para enriquecer precursores dopaminérgicos no transplante de células Parkinson paradigmas 36. Moléculas de CD não são apenas marcadores, mas mediadores funcionalmente relevantes de interações célula-célula e da capacidade de uma célula para responder a estímulos a partir de moléculas de matriz extracelular e fatores de crescimento 37. Uma estratégia de reforçar ainda mais o arsenal de antigénios CD combinatórias para caracterizar desenvolvimento da linhagem neural é a utilização de marcadores intracelulares conhecidos para rastrear e definir as combinações de antigénios CD para um tipo particular de célula de interesse. Nós exploramos recentemente essa abordagem e identificaram CD49F – / CD200 padrões de expressão combinatórias altas como uma nova abordagem para o enriquecimento de subconjuntos de neurônios de pluripotentes induzidas sistemas de cultura de células-tronco diferenciadas neurally 38. Aqui, nós incluímos e discutir o último protocolo (e variações opcionais dos mesmos), em que a coloração da superfície e coloração intracelular pode ser utilizado simultaneamente para definir sub-populações de células neurais, por citometria de fluxo.

Figura 2. Diagrama do sistema de opções de protocolos experimentais. A figura ilustra uma representação esquemática dos principais passos envolvidos no protocolo. Passos opcionais (corante CFSE ou rotulagem antígeno intracelular) são indicados por caixas de cinza claro. Após a colheita, é essencial avaliar o número e a viabilidade de células de suspensões de células neuronais antes da coloração da superfície celular. Positivo comobem como os controlos negativos devem ser incluídos em adição às amostras de interesse. As amostras podem ser analisadas por análise de citometria de fluxo e / ou utilizadas em paradigmas de separação de células. Por favor, clique aqui para ver uma versão maior desta figura.
Embora se tenha usado previamente anticorpos primários em combinação com anticorpo secundário por 38 coloração intracelular, que agora introduzir a rotulagem não-covalente do anticorpo primário através de fragmentos Fab fluorescentes (rotulagem Zenon) como uma ligeira variação, reduzindo, assim, os passos de manipulação de células 39. Além disso, como mais um exemplo da versatilidade do protocolo, que empregam uma etiquetagem opcional de um subconjunto experimental por carboxifluoresceína éster de succinimidilo (CFSE) antes da coloração de antigénio de superfície. Essa pré-rotulagem CFSE permite a comparação direta imediata de duas linhas celulares ou condições experimentais (CFSE marcado vs. sem rótulo) dentro de um único tubo de amostra, reduzindo variação ou diferenças sutis no tempo de incubação e de poupança de anticorpos. CFSE é um corante fluorescente estabelecido que é comumente usado para rastreamento de células 40, na proliferação 41,42 e barcoding experiências 43,44. Finalmente, embora passos reais (FACS, de separação de células imunomagn�ica ou immunopanning) não fazem parte deste protocolo, em princípio, os procedimentos de colheita e de rotulagem descritos aqui fazer amostras de rendimento que podem ser submetidos a superfície antígeno ou aplicações de classificação baseada em rotulagem intracelulares 15 25,28.
Com este artigo, pretendemos: resumir um protocolo de coloração antígeno de superfície viável 25,28, resumir um protocolo para detecção de alvos intracelulares, bem como superfície combinada e análise do antígeno intracelular 38, apresentar uma CFSE marcação com corante passo intracelular 41,45 como um opção experimental para comanalisa comparativo de populações de células neurais, e resumir abordagens para análise de citometria de fluxo (controles apropriados 13,46, gating estratégia e dados apresentação 47).
Protocol
Representative Results
Discussion
O protocolo aqui apresentado é bem estabelecido para as culturas de células neurais derivadas de células estaminais humanas, mas pode ser igualmente aplicado a outras fontes de células neurais, incluindo tecido primário ou linhas de células neuronais. Para além das fontes embrionárias, células estaminais ou progenitoras neurais pode ser extraído a partir das regiões do cérebro adulto neurogénicos 27. Além disso, a citometria de fluxo e FACS pode ser explorada para quantificar, analisar e isolar …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Our research program is funded through the Emmy Noether-Program of the German Research Foundation (DFG), grant PR1132/3-1. Further support by the Müller-Fahnenberg Foundation of the University of Freiburg is gratefully acknowledged. This study was supported in part by the Excellence Initiative of the German Research Foundation (GSC-4, Spemann Graduate School).
Materials
| DMEM/F12 (1:1) (Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12) | Life Technologies | 11330057 | www.lifetechnologies.com | |
| DPBS without Ca2+ Mg2+ | Life Technologies | 14190169 | www.lifetechnologies.com | |
| Fetal bovine serum, qualified, E.U.-approved, South America origin (FBS) | Life Technologies | 10270-106 | www.lifetechnologies.com | |
| MEM Non-essential amino acids (100 x) | Life Technologies | 11140035 | www.lifetechnologies.com | |
| TrypLE Express | Life Technologies | 12604013 | www.lifetechnologies.com | |
| Trypan blue solution, 0.4% | Life Technologies | 15250061 | www.lifetechnologies.com | |
| Paraformaldehyde | Carl Roth | 335.3 | www.carlroth.com | |
| Bovine serum albumin (BSA) Fraction V | PAA Laboratories, Coelbe | K41-001 | www.gelifesciences.com | |
| Tween-20 Detergent | Calbiochem | 655205 | www.merckmillipore.de | |
| Carboxyfluorescein succinimidyl ester (CFSE) | eBioscience | 65-0850-84 | www.ebioscience.com | |
| DMSO | AppliChem | A1584 | www.applichem.com | |
| Bottle top filters express plus 0.22 µm, 250 ml | Millipore | SCGPU02RE | www.millipore.com | |
| Cell culture treated flasks (T 25) | NUNC | 156367 | www.thermoscientific.com | |
| Cell culture treated flasks (T 75) | NUNC | 156499 | www.thermoscientific.com | |
| Conical tubes (15 ml) | Greiner Bio-One | 188271 | www.greinerbioone.com | |
| Conical tubes (50 ml) | Greiner Bio-One | 227261 | www.greinerbioone.com | |
| Pasteur pipet, glass (150 mm) | STEIN Labortechnik, Remchingen | S03710150 | www.stein-labortechnik.de | |
| Pipet tips (0.1-10 µl) | Corning | 4125 | www.corning.com | |
| Pipet tips (1-200 µl) | Corning | 4126 | www.corning.com | |
| Pipet tips (100-1000 µl) | Corning | 4129 | www.corning.com | |
| Serological pipets, 5 ml | Corning | 4051 | www.corning.com | |
| Serological pipets, 10 ml | Corning | 4101 | www.corning.com | |
| Serological pipets, 25 ml | Corning | 4251 | www.corning.com | |
| Microcentrifuge tubes (0.5 ml) | Sarstedt | 72,699 | www.sarstedt.com | |
| Microcentrifuge tubes (1.5 ml) | Greiner Bio-One | 616201 | www.greinerbioone.com | |
| Microcentrifuge tubes (2.0 ml) | Sarstedt | 72,695,500 | www.sarstedt.com | |
| Anti-Human CD24 APC monoclonal antibody | eBioscience | 17-0247-42 | www.ebioscience.com Working dilution 1:50 |
|
| Anti-Human CD54 PE monoclonal antibody | eBioscience | 12-0549-42 | www.ebioscience.com Working dilution 1:50 |
|
| Neuronal Class III β-Tubulin (Tuj1) polyclonal antibody | Covance | PRB-435P | www.covance.com Working dilution 1:2000 |
|
| Alexa Fluor 488 Donkey anti Rabbit | Life Technologies | A21206 | www.lifetechnologies.com Working dilution 1:2000 |
|
| Zenon® Fluorescein Rabbit IgG Labeling Kit | Life Technologies | Z-25342 | www.lifetechnologies.com | |
| Neubauer-Improved counting chamber | Marienfeld | 0640010 | www.marienfeld-superior.com | |
| Vortex | Scientific Industries | G560E | www.scientificindustries.com | |
| Thermomixer comfort | Eppendorf | 5355 000.001 | www.eppendorf.com | |
| Accuri C6 flow cytometer | Becton Dickinson (BD) | 653118 | www.bdbiosciences.com/instruments/accuri | |
| Microcentrifuge refrigerated, PerfectSpin 24 R | Peqlab | 91-PSPIN-24R | www.peqlab.de | |
| Orbital shaker, Unimax 1010 | Heidolph | 543-12310-00 | www.heidolph-instruments.de | |
| Centrifuge refrigerated, Rotanta 96 RC | Hettich | 4480-50 | www.hettichlab.com | |
| Class II Biological safety cabinet Safe 2020 | Thermo Scientific | 51026640 | www.thermoscientific.com | |
| CO2 Incubator, Heracell 240i | Thermo Scientific | 51026331 | www.thermoscientific.com | |
| Vacuum system, Vacusafe comfort | Integra Biosciences | 158320 | www.integra-biosciences.de | |
| Microscope, Axiovert 40 CFL | Zeiss | 451212 | www.zeiss.de | |
| Pipet controller, accu-jet pro | Brand | 26303 | www.brand.de | |
| Micropipet, Pipetman neo P20N (2-20 µl) | Gilson | F144563 | www.gilson.com | |
| Micropipet, Pipetman neo P200N (20-200 µl) | Gilson | F144565 | www.gilson.com | |
| Micropipet, Pipetman neo P1000N (100-1000 µl) | Gilson | F144566 | www.gilson.com |
References
- Herzenberg, L. A., et al. The History and Future of the Fluorescence Activated Cell Sorter and Flow Cytometry: A View from. 48 (10), 1819-1827 (2002).
- Chattopadhyay, P. K., Roederer, M. Cytometry: today’s technology and tomorrow’s horizons. Methods (San Diego, Calif). 57 (3), 251-258 (2012).
- Jaye, D. L., Bray, R. A., Gebel, H. M., Harris, W. A. C., Waller, E. K. Translational applications of flow cytometry in clinical practice). J. Immunol. 188 (10), 4715-4719 (2012).
- Henel, G., Schmitz, J. Basic Theory and Clinical Applications of Flow Cytometry. Lab Med. 38 (7), 428-436 (2007).
- Seita, J., Weissman, I. L. Hematopoietic stem cell: self-renewal versus differentiation. Wiley Interdiscip. Rev. Syst. Biol. Med. 2 (6), 640-653 (2010).
- Ulrich, H., Bocsi, J. Phenotypes of stem cells from diverse origin. Cytometry. A. 77 (1), 6-10 (2010).
- Panchision, D. M., et al. Optimized flow cytometric analysis of central nervous system tissue reveals novel functional relationships among cells expressing CD133, CD15, and CD24. Stem cells. 25 (6), 1560-1570 (2007).
- Meyer, R. A., Zaruba, M. E., McKhann, G. M. Flow cytometry of isolated cells from the brain. Anal. Quant. Cytol. 2 (1), 66-74 (1980).
- Junger, H., Junger, W. G. CNTF and GDNF, but not NT-4, support corticospinal motor neuron growth via direct mechanisms. Neuroreport. 9 (16), 3749-3754 (1998).
- McLaren, F. H., Svendsen, C. N., Vander Meide, P., Joly, E. Analysis of neural stem cells by flow cytometry: cellular differentiation modifies patterns of MHC expression. J. Neuroimmunol. 112 (1-2), 35-46 (2001).
- Wang, S., Roy, N. S., Benraiss, A., Goldman, S. A. Promoter-based isolation and fluorescence-activated sorting of mitotic neuronal progenitor cells from the adult mammalian ependymal/subependymal. 22 (1-2), 167-176 (2000).
- Tanke, H. J., vander Keur, M. Selection of defined cell types by flow-cytometric cell sorting. Trends Biotechnol. 11 (2), 55-62 (1993).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243 (1-2), 77-97 (2000).
- Sergent-Tanguy, S., Chagneau, C., Neveu, I., Naveilhan, P. Fluorescent activated cell sorting (FACS): a rapid and reliable method to estimate the number of neurons in a mixed population. J. Neurosci. Methods. 129 (1), 73-79 (2003).
- Ernst, A., et al. Neurogenesis in the striatum of the adult human brain. Cell. 156 (5), 1072-1083 (2014).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nat. Rev. Immunol. 4 (8), 648-655 (2004).
- Bandura, D. R., et al. Mass cytometry: technique for real time single cell multitarget immunoassay based on inductively coupled plasma time-of-flight mass spectrometry. Anal. Chem. 81 (16), 6813-6822 (2009).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Neveu, I., Rémy, S., Naveilhan, P. The neuropeptide Y receptors, Y1 and Y2, are transiently and differentially expressed in the developing cerebellum. Neuroscience. 113 (4), 767-777 (2002).
- Pruszak, J., Just, L., Isacson, O., Nikkhah, G. Isolation and culture of ventral mesencephalic precursor cells and dopaminergic neurons from rodent brains. Curr. Protoc. Stem Cell Biol. 2 (Unit 2D.5), (2009).
- Suslov, O. N., Kukekov, V. G., Ignatova, T. N., Steindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc. Natl. Acad. Sci. U.S.A. 99 (22), 14506-14511 (2002).
- Bez, A., et al. Neurosphere and neurosphere-forming cells: morphological and ultrastructural characterization. Brain Res. 993 (1-2), 18-29 (2003).
- Pruszak, J., Isacson, O. Molecular and cellular determinants for generating ES-cell derived dopamine neurons for cell therapy. Adv. Exp. Med. Biol. 651, 112-123 (2009).
- Carson, C. T., Aigner, S., Gage, F. H. Stem cells: the good, bad and barely in control. Nat. Med. 12 (11), 1237-1238 (2006).
- Yuan, S. H., et al. Cell-surface marker signatures for the isolation of neural stem cells, glia and neurons derived from human pluripotent stem cells. PloS One. 6 (3), e17540 (2011).
- Roy, N. S., Cleren, C., Singh, S. K., Yang, L., Beal, M. F., Goldman, S. Functional engraftment of human ES cell-derived dopaminergic neurons enriched by coculture with telomerase-immortalized midbrain astrocytes. Nat. Med. 12 (11), 1259-1268 (2006).
- Uchida, N., et al. Direct isolation of human central nervous system stem cells. Proc. Natl. Acad. Sci. U. S. A. 97 (26), 14720-14725 (2000).
- Pruszak, J., Ludwig, W., Blak, A., Alavian, K., Isacson, O. CD15, CD24, and CD29 define a surface biomarker code for neural lineage differentiation of stem cells. Stem Cells. 27 (12), 2928-2940 (2009).
- Peh, G. S. -. L., Lang, R. J., Pera, M. F., Hawes, S. M. CD133 expression by neural progenitors derived from human embryonic stem cells and its use for their prospective isolation. Stem Cells Dev. 18 (2), 269-282 (2009).
- Golebiewska, A., Atkinson, S. P., Lako, M., Armstrong, L. Epigenetic landscaping during hESC differentiation to neural cells. Stem Cells. 27 (6), 1298-1308 (2009).
- Dietrich, J., Noble, M., Mayer-Proschel, M. Characterization of A2B5+ glial precursor cells from cryopreserved human fetal brain progenitor cells. Glia. 40 (1), 65-77 (2002).
- Nishiyama, A. NG2 cells in the brain: a novel glial cell population. Hum. Cell. 14 (1), 77-82 (2001).
- Jungblut, M., et al. Isolation and characterization of living primary astroglial cells using the new GLAST-specific monoclonal antibody ACSA-1. Glia. 60 (6), 894-907 (2012).
- Ono, Y., et al. Differences in neurogenic potential in floor plate cells along an anteroposterior location: midbrain dopaminergic neurons originate from mesencephalic floor plate cells. Development. 134 (17), 3213-3225 (2007).
- Chung, S., et al. ES cell-derived renewable and functional midbrain dopaminergic progenitors. Proc. Natl. Acad. Sci. U.S.A. 108 (23), 9703-9708 (2011).
- Doi, D., et al. Isolation of Human Induced Pluripotent Stem Cell-Derived Dopaminergic Progenitors by Cell Sorting for Successful Transplantation. Stem Cell Reports. 2 (3), 337-350 (2014).
- Solozobova, V., Wyvekens, N., Pruszak, J. Lessons from the embryonic neural stem cell niche for neural lineage differentiation of pluripotent stem cells. Stem Cell Rev. 8 (3), (2012).
- Turaç, G., et al. Combined flow cytometric analysis of surface and intracellular antigens reveals surface molecule markers of human neuropoiesis. PloS One. 8 (6), e68519 (2013).
- Buchwalow, I. B., Böcker, W. Chapter 2. Immunohistochemistry: Basics and Methods. , 9-17 (2010).
- Tario, J. D., et al. Optimized staining and proliferation modeling methods for cell division monitoring using cell tracking dyes. J. Vis. Exp. (70), e4287 (2012).
- Lyons, A. B., Parish, C. R. Determination of lymphocyte division by flow cytometry. J. Immunol. Methods. 171 (1), 131-137 (1994).
- Hawkins, E. D., et al. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2 (9), 2057-2067 (2007).
- Quah, B. J. C., Parish, C. R. The use of carboxyfluorescein diacetate succinimidyl ester (CFSE) to monitor lymphocyte proliferation. J. Vis. Exp. 44, (2010).
- Sukhdeo, K., et al. Multiplex flow cytometry barcoding and antibody arrays identify surface antigen profiles of primary and metastatic colon cancer cell lines. PloS One. 8 (1), e53015 (2013).
- Jiang, L., et al. Daucosterol promotes the proliferation of neural stem cells. The J. Steroid Biochem. Mol. Biol. 140, 90-99 (2014).
- Hulspas, R., et al. Considerations for the control of background fluorescence in clinical flow cytometry. Cytometry. B. 76 (6), 355-364 (2009).
- Moloney, M., Shreffler, W. G. Basic science for the practicing physician: flow cytometry and cell sorting. Annals of Allergy, Asthm., & Immunology: Official Publication of the American College of Allergy, Asthma., & Immunology. 101 (5), 544-549 (2008).
- Siebzehnrubl, F. A., et al. Isolation and characterization of adult neural stem cells. Methods Mol. Biol. 750, 61-77 (2011).
- Guez-Barber, D., et al. FACS purification of immunolabeled cell types from adult rat brain). J. Neurosci. Methods. 203 (1), 10-18 (2012).
- Tham, C. -. S., Lin, F. -. F., Rao, T. S., Yu, N., Webb, M. Microglial activation state and lysophospholipid acid receptor expression. Int. J. Dev. Neurosci. 21 (8), 431-443 (2003).
- Nguyen, H. X., Beck, K. D., Anderson, A. J. Quantitative assessment of immune cells in the injured spinal cord tissue by flow cytometry: a novel use for a cell purification method. J. Vis. Exp. (50), e2698 (2011).
- Marchenko, S., Flanagan, L. Counting human neural stem cells. J. Vis. Exp. (7), 262 (2007).
- Brunlid, G., Pruszak, J., Holmes, B., Isacson, O., Sonntag, K. C. Immature and neurally differentiated mouse embryonic stem cells do not express a functional Fas/Fas ligand system. Stem Cells. 25 (10), 2551-2558 (2007).
- Brewer, G. J. Isolation and culture of adult rat hippocampal neurons. J. Neurosci. Methods. 71 (2), 143-155 (1997).
- Cardona, A. E., Huang, D., Sasse, M. E., Ransohoff, R. M. Isolation of murine microglial cells for RNA analysis or flow cytometry. Nat. Protoc. 1 (4), 1947-1951 (2006).
- Nielsen, J. A., Maric, D., Lau, P., Barker, J. L., Hudson, L. D. Identification of a novel oligodendrocyte cell adhesion protein using gene expression profiling. J. Neurosci. 26 (39), 9881-9891 (2006).
- Daneman, R., et al. The mouse blood-brain barrier transcriptome: a new resource for understanding the development and function of brain endothelial cells. PloS One. 5 (10), e13741 (2010).
- Gräbner, R., Till, U., Heller, R. Flow cytometric determination of E-selectin, vascular cell adhesion molecule-1, and intercellular cell adhesion molecule-1 in formaldehyde-fixed endothelial cell monolayers. Cytometry. 40 (3), 238-244 (2000).
- Quah, B. J. C., Parish, C. R. New and improved methods for measuring lymphocyte proliferation in vitro and in vivo using CFSE-like fluorescent dyes. J. Immunol. Methods. 379 (1-2), 1-14 (2012).
- Lathia, J. D., et al. High-throughput flow cytometry screening reveals a role for junctional adhesion molecule a as a cancer stem cell maintenance factor. Cell Rep. 6 (1), 117-129 (2014).
- Ganat, Y. M., et al. Identification of embryonic stem cell-derived midbrain dopaminergic neurons for engraftment. J. Clin. Invest. 122 (8), 2928-2939 (2012).
- Hedlund, E., et al. Embryonic stem cell-derived Pitx3-enhanced green fluorescent protein midbrain dopamine neurons survive enrichment by fluorescence-activated cell sorting and function in an animal model of Parkinson’s disease. Stem Cells. 26 (6), 1526-1536 (2008).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Chivet, M., Hemming, F., Pernet-Gallay, K., Fraboulet, S., Sadoul, R. Emerging role of neuronal exosomes in the central nervous system. Front. Physiol. 3, 145 (2012).
- Graner, M. W., et al. Proteomic and immunologic analyses of brain tumor exosomes. FASEB J. 23 (5), 1541-1557 (2009).
- Eldh, M., Lötvall, J. Isolation and characterization of RNA-containing exosomes. J. Vis. Exp. (59), e3037 (2012).
- Capela, A., Temple, S. LeX is expressed by principle progenitor cells in the embryonic nervous system, is secreted into their environment and binds Wnt-1. Dev. Biol. 291 (2), 300-313 (2006).
- Nieoullon, V., Belvindrah, R., Rougon, G., Chazal, G. mCD24 regulates proliferation of neuronal committed precursors in the subventricular zone. Mol. Cell. Neurosci. 28 (3), 462-474 (2005).
- Nagato, M., et al. Prospective characterization of neural stem cells by flow cytometry analysis using a combination of surface markers. J. Neurosci. Res. 80 (4), 456-466 (2005).
- Hall, P. E., Lathia, J. D., Miller, N. G. A., Caldwell, M. A., French-Constant, C. Integrins are markers of human neural stem cells. Stem Cells. 24 (9), 2078-2084 (2006).
- Hargus, G., et al. Differentiated Parkinson patient-derived induced pluripotent stem cells grow in the adult rodent brain and reduce motor asymmetry in Parkinsonian rats. Proc. Natl. Acad. Sci. U.S.A. 107 (36), 15921-15926 (2010).
- Elkabetz, Y., et al. Human ES cell-derived neural rosettes reveal a functionally distinct early neural stem cell stage. Genes Dev. 22 (2), 152-165 (2008).

