Introduction
Фосфатидилэтаноламин метилтрансферазы (PEMT) ферменты катализируют ковалентное присоединение одной или более метильными группами с использованием S -adenosylmethionine (SAM) в качестве донора метильной группы на ПЭ, ПЭ-монометиловый или диметил-PE, чтобы дать монометиловый-PE, диметил-PE и / или фосфатидилхолин (PC). Эти ферменты почти повсеместно в клетках животных и грибов. Они также могут быть найдены в некоторых растений 1 и примерно 10% бактерий, особенно те, которые взаимодействуют с эукариот 2.
PEMTs имеют отношение к биологии клетки не только вклад в производстве ПК, который является основным классом липидов в клетках животных, но также выполняет другие важные клеточные функции. У млекопитающих, в основном PEMTs экспрессируется в печени, где они необходимы для нормального секреции липопротеины очень низкой плотности, и они также способствуют индуцированным диетой ожирением 3, атеросклероз 4, и инсулин сопротивлениеANCE 5. Кроме того, PEMT млекопитающих также выражены в адипоцитах, хотя на более низкие уровни, и участвовать в отложение жира 6, 7. Было также показано, PEMT роль в развитии рака, апоптозе 8 9 и 10 клеточного роста. У бактерий, PEMT ферменты, как было показано, важна для нормального роста клеток 2 вирулентности 2 и симбиозе с растения-хозяина 11.
Цель и обоснование данного протокола является измерение PEMT деятельность с целыми клеточных экстрактов без необходимости очистки фермента. Две различные протоколы были разработаны для измерения PEMT активность. Первый и самый распространенный измеряет передачу тритием метил группы из радиоактивного SAM на ПЭ, которая является темой данной статьи. Этот протокол был изначально разработан для измерения активности PEMT из дрожжей 12 и в клетках млекопитающих (печени) 13, чтобы получить understАндинг ПК биосинтеза в этих клетках, а также для определения специфичности этих ферментов. В дальнейшем этот метод был применен к другим типам клеток, таких как бактерии 2 (с помощью базового значения рН для анализа, хотя 15) и простейшими паразитами 14. Эта методика может быть использована с целым клеточных экстрактов, а также очищенный фермент, и потенциально могут быть применены к любому клеточного экстракта системы. A Non радиоактивных анализ был также разработан, которая опирается на ферментативной количественного S -adenosylhomocysteine, в трансметилирования продукта SAM 16. Последнее анализ может быть более удобно, так как не предполагает радиоактивности, но это подходит только для очищенных ферментов.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Подготовка экстракт клеток
- Выращивают клетки Leishmania в стерильной пластиковой бутылки запечатанной крышкой герметично при 26 ° С в среде из 1x M199 с добавкой 20 мМ HEPES рН 7,4, 100 ед / мл пенициллина, 100 мкг / мл стрептомицина, 5 мкг / мл гема , 0,35 г / л Naco 2 Н, 0,1 мМ аденина и 2 мкг / мл biopterin без встряхивания. Сбора клеток центрифугированием при 1500 г в течение 5 мин при 4 ° С, когда они достигают плотности клеток 1-2 × 10 7 / мл.
- Жидкость над осадком сливают с пипеткой и промыть клетки путем ресуспендирования клеточного осадка с серологическим пипеткой в половине объема культуральной в холодной фосфатным буферным солевым раствором (137 мМ NaCl, 2,7 мМ KCl, 10 мМ Na 2 HPO 4, 1,8 мМ KH 2 PO 4, pH 7,4). Утилизировать клеток супернатантов в соответствии с директивами безопасности BL2.
- Центрифуга клетки снова при 1500 г в течение 5 мин при 4 ° С. Жидкость над осадком сливают с пипеткой. Действуйте тО следующем шаге или оснастки заморозить осадок клеток в жидком азоте для длительного хранения при -80 ° С (до трех месяцев).
- Подготовка 2x буфера для лизиса (0,5 М сахарозы, 0,1 М Трис HCl, рН 7,5, 2 мМ ЭДТА, и ингибитор протеазы коктейль 2x) и держать его в 4 ºC на льду.
- Ресуспендируют осадок клеток (свежие или замороженные) в равном объеме 2х буфера для лизиса. Добавить 1x объем стеклянных шариков. Вихревой энергично при 4 ° С в течение 10 мин.
- Добавить 2 тома 1x буфера для лизиса и перемешать. Клеточные экстракты центрифуге при 1500 мкг при 4 ° С в течение 10 мин для осаждения клеток и неразрывные ядра.
- Передача супернатант с пипеткой в чистую центрифужную пробирку прохладном и держать клеточных экстрактов на льду до завершения эксперимента.
2. Определить концентрация белка клеточной Extract, используя белок Estimation Kit Такие, как бицинхониновой кислоты анализе
- Подготовка бицинхониновой кислоты (BCA) раствор (1 мл / пробирка) при смешивании BCA и меди (II) сulfate в соотношении 49: 1 (объем / объем).
- Подготовка белка стандарты 0, 10, 20, 30, 40, 50, и 60 мкг / мл разбавлением 10 мг / мл бычьего сывороточного альбумина (БСА) маточного раствора в 1 мл аликвоты раствора BCA.
- Добавьте 2 мкл клеток экстрактов в 1 мл раствора БСА в дубликатах. Выдержите стандарты и образцы белка в течение 10 мин в водяной бане подогретого 60 °.
- Образцы передачи на лед в течение 3 мин. Измеряют поглощение стандартов и образцов белка с помощью спектрофотометра при длине волны 562 нм.
- Рассчитывают концентрации белка в клеточных экстрактах с использованием стандартного BSA в качестве ссылки, как описано в протоколе производителя. Развести клеточных экстрактов до концентрации белка 10 мг / мл лизирующего буфера 1x.
3. Ферментативный анализ в 200 мкл на пробирку
ПРИМЕЧАНИЕ: Carry следующие шаги в химической капотом.
- Проверьте каждый образец в двух экземплярах в 15 млконическую трубку. Подготовка 20 мкл 1 М Трис HCl рН 7,5 трубки и держать его на льду. Подготовка 2 мл смеси хлороформ / метанол (1: 1 (объем / объем); стоп-раствора) при КТ в течение каждой пробирке.
- Внесите 20 мкл 1 М Трис HCl рН 7,5 в каждой 15 мл коническую трубку на льду.
- Соблюдайте рекомендации радиационной безопасности здесь на. Добавить эквивалент 0,06 мкМ (0,2 мкКи) S - [метил- 3 H] аденозил-L-метионина и 50 мкМ холодным SAM за трубки в общей сложности 50,06 мкМ SAM. Добавить х мкл холодной воды, где х = 200- (20 (для буфера) + 20 (для клеточных экстрактов) + объем холодной и радиоактивных SAM) на пробирку.
- Передача каждого коническую трубку, чтобы водяной бане подогретого 30 ° C. Добавить в каждую пробирку 20 мкл клеточных экстрактов (эквивалент 200 мкг белка), чтобы начать реакцию. Инкубируют в течение желаемого времени (от 0 до 45 мин).
- Остановки реакции добавлением 2 мл смеси хлороформ / метанол (1: 1 об / об; стоп-раствора) в каждую пробирку. Перевести коническую трубку комнатной температуре (20-256; С).
4. Добыча липидов
ПРИМЕЧАНИЕ: Carry следующие шаги в химической капотом.
- Добавить 700 мкл воды в каждую пробирку, содержащую образец ферментативной реакции. Вортексе в течение 30 сек. Центрифуга при 1500 х г в течение 5 мин при комнатной температуре, чтобы отделить органический от водной фазы.
- Передача нижнюю органическую фазу в новую 15 мл коническую пробирку при помощи пипетки. Добавить 1 мл воды на каждую "фазу" нижней содержащей трубку и вихрь энергично в течение 30 сек. Центрифуга снова в 1500 мкг в течение 5 мин, чтобы отделить органический от водной фазы.
- Передача нижнюю органическую фазу в сцинтилляционный трубки с помощью пипетки. Сухие образцы в потоке N 2. Утилизируйте воды фазы, содержащие нон-включены радиоактивные SAM и радиоактивные конические пробирки как за принципов излучения.
- Добавить 2 мл / трубки сцинтилляционного жидкости. Измерьте включенной радиоактивности с помощью сцинтилляционного куГюнтер согласно протоколу производителя и использования инструмента.
- Рассчитать ферментативной активности в нмоль / мг белка с использованием следующего общего уравнения:
CPM значение х 10 х 3 [всего (радиоактивные и холодной) Концентрация SAM (мм)] х 5 удельная активность радиоактивных SAM (Ки / ммоль) [х концентрации радиоактивных SAM (мМ)]
ПРИМЕЧАНИЕ: выше протокол может быть изменен для концентрации SAM зависимой или зависимой белка PEMT анализа. Для концентрации САМ зависимого ферментативного количественного анализа, время остается постоянным (15 мин, что в линейном диапазоне) и различные количества холодной SAM добавляются в анализе, а для белка зависимой PEMT анализа, концентрации SAM (мы выбрали 0,05 мм) и время остаются постоянными (15 мин). Кроме того, рН буфера может быть изменен при необходимости, если некоторые ферменты PEMT иметь различное оптимальное значение рН.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
На рисунке 1 показана времени зависит PEMT анализа, который проводили с Leishmania экстракта цельноклеточной качестве источника фермента с использованием эндогенной PE в качестве субстрата. Количество радиоактивности в органической фазе количественно с помощью сцинтилляционного счетчика. Полученные цифры были использованы для расчета количества меченного тритием метильных групп переносится на ПЭ. PEMT деятельность была линейной в течение примерно 20 мин. Затем достигало плато в пределах 30 мин, после чего оставались неизменными в течение еще 15 мин. Как и ожидалось, PEMT активность не была обнаружена при отсутствии клеточные экстракты были добавлены к пробе (Рис.2). Кроме того, эта деятельность была отменена в присутствии бромида octadecyltrimethylammonium 100 мкм, что является ингибитором L. Основными метилтрансферазы PE LMJ PEM1 и LMJ PEM2 14. PEMT активность была также концентрация белка dependenт, и эта деятельность была прямо пропорциональна количеству белка применяется для ферментативного количественного анализа (рис 3). Наконец, концентрация SAM зависит PEMT анализ проводили, в котором увеличение концентрации SAM были протестированы (Рисунок 4). PEMT активность достигало плато в концентрации SAM примерно 0,5 мм. Все вместе, эти четыре анализы показывают, что активность PEMT специфична и может быть измерена из цельных клеточных экстрактов без необходимости очистить фермент (ы).
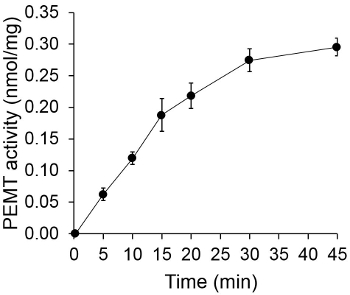
Рисунок 1. Время зависит PEMT анализа. Ферментативный анализ проводили дважды в двух экземплярах с 0,2 мг целых клеточных экстрактах Leishmania как функцию времени. PEMT активность представлена как нмоль метильных групп переносится на ПЭ на мг белка и рэ ч. Для времени "O", клеточные экстракты сначала смешивают с 2 мл стоп-раствора из смеси хлороформ / метанол (1: 1, по объему) перед добавлением к раствору, содержащему анализа SAM. Стандартные отклонения показаны.
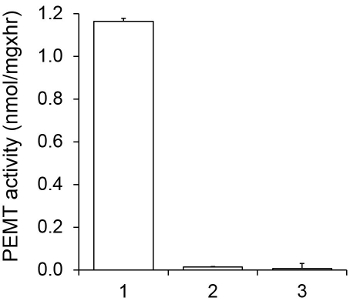
Рисунок 2. Специфичность PEMT активности. PEMT анализ проводили дважды в двух экземплярах в течение 15 мин в присутствии 0,05 мм SAM. Белковый экстракт 1, 0,2 мг; 2, нет клеточный экстракт; 3, 0,2 мг белка и 0,1 мм octadecyltrimethylammonium бромид. Стандартные отклонения показаны.
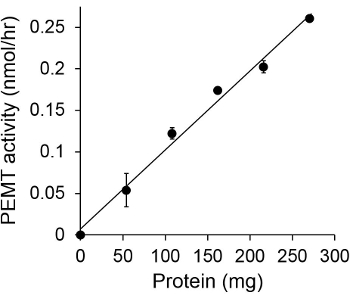
Рисунок 3. Белки зависит PEMT анализ. Ферментативная анализ проводили дважды вдублировать в отсутствие (точка 'O') или в присутствии различных количеств белков Leishmania 0,05 мМ SAM в течение 15 мин. Стандартные отклонения показаны.
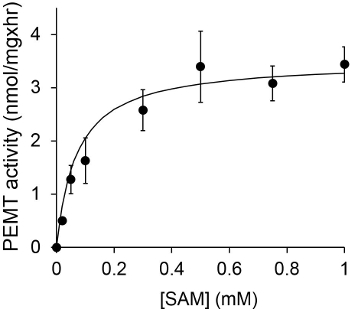
Рисунок 4. PEMT анализ проводили дважды в двух экземплярах с 0,2 мг целых клеточных экстрактах Leishmania в присутствии различных концентраций SAM в течение 15 мин. Стандартные отклонения показаны.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Это просто, быстро PEMT анализ позволяет количественно метилированных форм ПЭ, что приводит от переноса радиоактивных метильных групп из SAM на ПЭ, используя экстракт цельных клеток в качестве источника белка. Это быстро, чувствителен, воспроизводимым, а также подходит для очищенных ферментов 17. Монометил- или диметил-РЕ могут быть добавлены к пробе если метилтрансферазы интерес является специфическим для этих субстратов, а не PE 12,13,18,19. Если используется очищенный фермент PEMT, ПЭ могут быть добавлены к пробе. Ограничение этого протокола является то, что анализ не выявляет продукты реакции (монометил-PE, PE-диметил или PC). Тем не менее, личность продуктов реакции (монометил-PE, PE-диметил, ПК) могут быть дополнительно проанализированы одномерной тонкослойной хроматографии, как описано в 20,21. Кроме того, некоторые из продуктов деградации SAM, таких как S -adenosylhomocysteine и 5'-methylthioadenosine может ингибировать активность PEMT бу ингибирование обратной связи. Тем не менее, Leishmania обладает S -adenosylhomocysteine гидролазы 22, который расщепляет S -adenosylhomocysteine в аденина и S -ribosylhomocysteine, и methylthioadenosine фосфорилазы, которая производит аденина и methylthioribose-1-фосфат 23. Тем не менее, неизвестно, будет ли достаточно высоки, чтобы эффективно усваивать S -adenosylhomocysteine и methylthioadenosine, соответственно, так что нет ингибирование активности PEMT не происходит S -adenosylhomocysteine гидролазы и фосфорилазы methylthioadenosine действия. В том случае, S -adenosylhomocysteine гидролазы и / или 5'-methylthioadenosine метаболического фермента отсутствуют в клетках интерес, добавление соответствующих очищенных рекомбинантных ферментов, могут быть добавлены к пробе, чтобы облегчить ингибированию по типу обратной SAM продуктов разложения 24,25, 26.
Есть четыре важных шагов в этом протоколе: я)ингибитора протеазы коктейль порошок должен быть добавлен в буфер для лизиса непосредственно перед использованием (этап 1.1); II) все клеточные экстракты должны быть использованы в следующих часов после приготовления (после этапа 1.4); III) в процессе стадий экстракции липидов (шаги 4.2 и 4.4), осторожность должна быть применена к любому не передавать межфазной или воды фазе, содержащей избыток меченого тритием SAM, и IV), чтобы аликвоту радиоактивный S - [метил- 3 Н] аденозил-L-метионин и холодная реагент при получении в виде повторных циклов замораживания и оттепель ухудшить его в 5'-methylthioadenosine и гомосериндегидрогеназу лактона с последующим гидролизом до аденина и S -pentosylmethionine 26,27,28, которые могут объяснить отсутствие измеримы PEMT деятельность. Плохие целые клеточные экстракты могут также нести ответственность за не ферментативной активности. В этом случае качество клеточного экстракта может быть оценена путем измерения другую известную ферментативную активность. Последнее, отсутствие PEMT деятельности может рассчитывать на PEMT анфермент специфичен для монометиловым-PE или диметил-PE, а не PE. Добавление монометилового-РЕ и / или диметил-PE субстратов в анализе может восстановить PEMT активность.
Альтернативный, не радиоактивный SAM зависит метилтрансферазы Анализ был разработан, которая опирается на ферментативной количественного гомоцистеина, что трансметилирования продукции из SAM 29. Этот протокол был успешно применен для измерения PE конкретный метилтрансферазы деятельность 16. К сожалению, этот анализ подходит только для очищенного фермента и не экстракта цельных клеток, и не раскрывать личность продуктов реакции либо.
Настоящий Протокол может возможно быть применен к любому типу клеток. Кроме того, этот анализ может быть использован для проверки потенциальных лекарств, специфичные для PEMT интереса в контексте испытаний новых антимикробных соединений в борьбе с бактериальными инфекциями или терапевтические средства против новых индуцированным диетой атеросклероза, ожиренияИ резистентность к инсулину.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
О столкновении интересов не заявлено
Materials
| Name | Company | Catalog Number | Comments |
| S-[Methyl-3H]adenosyl-L-methionine (specific activity of 5-15 Ci/mMole) | Perkin Elmer | NET155050UC | Aliquot the reagent and freeze at -20 °C; follow radiation safety guidelines while using this reagent |
| Protease inhibitor cocktail | Roche Life Sciences | 11836170001 | dilute it fresh |
| Glass beads, acid washed, 425-600 mm | Sigma Aldrich | G8772 | |
| Bicinchoninic acid solution | Sigma Aldrich | B9643 | |
| Copper (II) sulfate | Sigma Aldrich | C2284 | |
| Scintillation counter MicroBeta2 with 1-detector | Perkin Elmer | 2450-0010 | |
| Spectrophotometer Biomate 3 | Thermo Scientific | 840208300 | |
| BSA stock solution (10 mg/ml) | New England Biolabs | B9001S | |
| Scintillation liquid | Research Product International Corp | 111198 | |
| S-(5'-Adenosyl)-L-methionine chloride (hydrochloride) | Cayman Chemicals | 13956 | dilute the reagent in 20 mM HCl and freeze aliquots at -80 °C |
References
- Keogh, M. R., Courtney, P. D., Kinney, A. J., Dewey, R. E. Functional characterization of phospholipid N-.methyltransferases from Arabidopsis and soybean. J Biol Chem. 284 (23), 15439-15447 (2009).
- Geiger, O., Lopez-Lara, I. M., Sohlenkamp, C. Phosphatidylcholine biosynthesis and function in bacteria. Biochim Biophys Acta. 1831 (3), 503-513 (2013).
- Gao, X., et al. Decreased lipogenesis in white adipose tissue contributes to the resistance to high fat diet-induced obesity in phosphatidylethanolamine N-.methyltransferase-deficient mice. Biochim Biophys Acta. 1851 (2), 152-162 (2015).
- Zhao, Y., et al. Lack of phosphatidylethanolamine N-.methyltransferase alters plasma VLDL phospholipids and attenuates atherosclerosis in mice. Arterioscler Thromb Vasc Biol. 29 (9), 1349-1355 (2009).
- Vance, D. E. Phospholipid methylation in mammals: from biochemistry to physiological function. Biochim Biophys Acta. 1838 (6), 1477-1487 (2014).
- Nishimaki-Mogami, T., Suzuki, K., Takahashi, A. The role of phosphatidylethanolamine methylation in the secretion of very low density lipoproteins by cultured rat hepatocytes: rapid inhibition of phosphatidylethanolamine methylation by bezafibrate increases the density of apolipoprotein B48-containing lipoproteins. Biochim Biophys Acta. 1304 (1), 21-31 (1996).
- Noga, A. A., Zhao, Y., Vance, D. E. An unexpected requirement for phosphatidylethanolamine N-.methyltransferase in the secretion of very low density lipoproteins. J Biol Chem. 277 (44), 42358-42365 (2002).
- Li, D., et al. Epigenetic repression of phosphatidylethanolamine N-.methyltransferase (PEMT) in BRCA1-mutated breast cancer. Oncotarget. 5 (5), 1315-1325 (2014).
- Cui, Z., Houweling, M., Vance, D. E. Suppression of rat hepatoma cell growth by expression of phosphatidylethanolamine N-.methyltransferase-2. J Biol Chem. 269 (40), 24531-24533 (1994).
- Cui, Z., Shen, Y. J., Vance, D. E. Inverse correlation between expression of phosphatidylethanolamine.N-.methyltransferase-2 and growth rate of perinatal rat livers. Biochim Biophys Acta. 1346 (1), 10-16 (1997).
- Minder, A. C., de Rudder, K. E., Narberhaus, F., Fischer, H. M., Hennecke, H., Geiger, O. Phosphatidylcholine levels in.Bradyrhizobium japonicum. membranes are critical for an efficient symbiosis with the soybean host plant. Mol Microbiol. 39 (5), 1186-1198 (2001).
- Kodaki, T., Yamashita, S. Yeast phosphatidylethanolamine methylation pathway. Cloning and characterization of two distinct methyltransferase genes. J Biol Chem. 262 (32), 15428-15435 (1987).
- Tanaka, Y., Amano, F., Maeda, M., Nishijima, M., Akamatsu, Y. Purification and properties of phosphatidyl-N-.monomethylethanolamine N-.methyltransferase, the enzyme catalyzing the second and the third steps in the phosphatidylethanolamine N-.methyltransferase system, from mouse liver microsomes. Jpn J Med Sci Biol. 43 (3), 59-73 (1990).
- Bibis, S. S., Dahlstrom, K., Zhu, T., Zufferey, R. Characterization of Leishmania major phosphatidylethanolamine methyltransferases LmjPEM1 and LmjPEM2 and their inhibition by choline analogs. Mol Biochem Parasitol. 196 (2), 90-99 (2014).
- deRudder, K. E., Thomas-Oates, J. E., Geiger, O. Rhizobium meliloti. mutants deficient in phospholipid N-.methyltransferase still contain phosphatidylcholine. J Bacteriol. 179 (22), 6921-6928 (1997).
- Aktas, M., Narberhaus, F. In vitro characterization of the enzyme properties of the phospholipid N-.methyltransferase PmtA from Agrobacterium tumefaciens. J Bacteriol. 191 (7), 2033-2041 (2009).
- Ridgway, N. D., Vance, D. E. Phosphatidylethanolamine N-.methyltransferase from rat liver. Methods Enzymol. 209, 366-374 (1992).
- Gaynor, P. M., Carman, G. M. Phosphatidylethanolamine methyltransferase and phospholipid methyltransferase activities from Saccharomyces cerevisiae. Enzymological and kinetic properties. Biochim Biophys Acta. 1045 (2), 156-163 (1990).
- Arondel, V., Benning, C., Somerville, C. R. Isolation and functional expression in Escherichia coli. of a gene encoding phosphatidylethanolamine methyltransferase (EC 2.1.1.17) from Rhodobacter sphaeroides. J Biol Chem. 268 (21), 16002-16008 (1993).
- Wessel, M., Klusener, S., Godeke, J., Fritz, C., Hacker, S., Narberhaus, F. Virulence of Agrobacterium tumefaciens. requires phosphatidylcholine in the bacterial membrane. Mol Microbiol. 62 (3), 906-915 (2006).
- Klusener, S., Aktas, M., Thormann, K. M., Wessel, M., Narberhaus, F. Expression and physiological relevance of Agrobacterium tumefaciens. phosphatidylcholine biosynthesis genes. J Bacteriol. 191 (1), 365-374 (2009).
- Henderson, D. M., et al. Cloning of the gene encoding Leishmania donovani.S.-adenosylhomocysteine hydrolase, a potential target for antiparasitic chemotherapy. Mol Biochem Parasitol. 53 (1-2), 169-183 (1992).
- Koszalka, G. W., Krenitsky, T. A. 5'-Methylthioadenosine (MTA) phosphorylase from promastigote of Leishmania donovani. Purine and Pyrimidine Metabolism in Man V, Adv Exp Med Biol. Nyhan, W. L., Thompson, L. F., Watts, R. W. E. 131, Springer US. 559-563 (1986).
- Biastoff, S., Teuber, M., Zhou, Z. S., Dräger, B. Colorimetric activity measurement of a recombinant putrescine N.-methyltransferase from Datura stramonium. Planta Med. 72 (12), 1136-1141 (2006).
- Hendricks, C. L., Ross, J. R., Pichersky, E., Noel, J. P., Zhou, Z. S. An enzyme-coupled colorimetric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 326 (1), 100-105 (2004).
- Cannon, L. M., Butler, F. N., Wan, W., Zhou, Z. S. A stereospecific colorimetric assay for (S.,S.)-adenosylmethionine quantification based on thiopurine methyltransferase-catalyzed thiol methylation. Anal Biochem. 308 (2), 358-363 (2002).
- Hoffman, J. L. Chromatographic analysis of the chiral and covalent instability of S.-adenosyl-L-methionine. Biochemistry. 25 (15), 4444-4449 (1986).
- Wu, S. E., Huskey, W. P., Borchardt, R. T., Schowen, R. L. Chiral instability at sulfur of S.-adenosylmethionine. Biochemistry. 22 (12), 2828-2832 (1983).
- Dorgan, K. M., et al. An enzyme-coupled continuous spectrophotometric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 350 (2), 249-255 (2006).



