Introduction
Fosfatidiletanolamin metiltransferaz (PEMT) PEMT enzimler monometil-PE, dimetil-PE ve / veya vermek için PE, monometil-PE veya dimetil-PE üzerine metil grubu donörü S -adenosylmethionine (SAM) ile bir veya daha fazla metil grubu kovalent bağlanmasını katalize eden bir fosfatidilkolin (PC). Bu enzimler, hayvan hücreleri ve mantarlar hemen hemen her zaman görülmektedir. Ayrıca, bazı bitkilerin 1 ve bakterilerin yaklaşık% 10, ökaryotlarda 2 ile etkileşim özellikle bulunabilir.
PEMTs değil, aynı zamanda diğer önemli hücresel fonksiyonları yerine getirerek hayvan hücrelerinde ana lipid sınıf PC, üretimine katkıda bulunarak hücre biyolojisine alakalı. Memelilerde, PEMTs esas olarak çok düşük yoğunluklu lipoprotein normalin üzerinde bir salgılama için gerekli olan karaciğer olarak ifade edilmiştir ve ayrıca diyet indükte obeziteye 3, ateroskleroz 4 katkıda bulunur ve insülin karşıance 5. Buna ek olarak, bir memeli PEMT da her ne kadar düşük seviyelere, adipositler ile ifade edilmiştir ve yağ depolanması 6, 7 katılırlar. Kanser gelişimi 8, 9 apoptoz ve hücre büyümesi 10'da PEMT rolü de ortaya konmuştur. Bakterilerde PEMT enzimler ana bitki 11, normal hücre çoğalması 2, virülans 2 ve simbiyoz için önemli olduğu gösterilmiştir.
Mevcut protokolün amacı ve gerekçesi enzimi arındırmak gerek kalmadan bütün hücre ekstrelerinden PEMT aktivitesini ölçmektir. İki farklı protokoller PEMT aktivitesini ölçmek için, geliştirilmiştir. İlk ve en yaygın olanı, bu makalenin konusu olan PE, üzerine radyoaktif SAM trityumlu metil grubunun transferini ölçer. Bu protokol, ilk olarak bir underst elde etmek için maya 12 ve memeli hücrelerinde (karaciğer) 13 den PEMT aktivitesini ölçmek için, geliştirilmiştirBu hücrelerde PC biyosentezinin anding yanı sıra, bu enzim özgüllüğünü belirlemek için. Daha sonra, bu teknik ve tek hücreli parazitlerin 14 (15 olsa deneyi için bir bazik pH değeri kullanılarak) bu tür bakteri 2 gibi diğer hücre tiplerinde uygulanmıştır. Bu teknik, bütün hücre hülasaları hem de saflaştırılmış enzim ile birlikte kullanılabilir ve potansiyel olarak herhangi bir hücre ekstresi sistemine uygulanabilir. Olmayan bir radyoaktif deneyi de S -adenosylhomocysteine, SAM 16 metillenmenin ürünün enzimatik miktarının dayandığı dizayn edilmiştir. Bu radyoaktivite içermeyen olarak ikinci deney daha uygun olabilir ancak saflaştınldı enzimler için uygundur.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Hücre Özüt Hazırlama
- 20 mM HEPES pH7.4, 100 U / ml penisilin / ml streptomisin, 5 ug / ml heme 100 ug ile takviye edilmiş M199 1 x yapılmış bir ortam içinde 26 ° C 'de hava geçirmez kapak ile sızdırmaz steril plastik şişe Leishmania hücreleri büyümek çalkalamadan, 0.35 g / L NACO 2H, 0.1 mM adenin, ve 2 ug / ml biopterin. Bunlar 1-2 x 10 7 / ml'lik bir hücre yoğunluğuna ulaştığında 4 ° C 'de 5 dakika süre ile 1500 g'de santrifüje edilerek hücreler hasat.
- Bir pipet ile süpernatant atılır ve soğuk fosfat tamponlu serum fizyolojik kültürün hacmi (137 mM NaCI, 2.7 mM KCI yarısı bir serolojik pipet hücre topağın tekrar askıda bırakılmasıyla yıkama hücreleri, 10 mM Na-2 HPO 4, 1.8 mM KH 2 PO 4, pH 7.4). BL2 güvenlik kurallarına göre hücre süpernatantlar bertaraf edin.
- Hücrelerin tekrar santrifüj 4 ° C'de 5 dakika boyunca 1500 g'de. Bir pipet ile süpernatant atın. T Devamya da bir sonraki adıma o -80 ºC (üç ay) uzun süreli saklama için sıvı nitrojen içinde hücre pelletini dondurmak oturtun.
- 2x lizis tamponu (0.5 M sukroz, 0.1 M TrisHCl, pH 7.5, 2 mM EDTA ve 2 x proteaz inhibitör kokteyli) hazırlayın ve buz üzerinde 4 ° C'de tutun.
- 2x lizis tamponu eşit hacimde (taze veya dondurulmuş) hücre pelletini. Cam boncuklar 1x hacmi ekleyin. Vorteks kuvvetli bir şekilde 10 dakika boyunca 4 ° C'de.
- 1x liziz tamponu 2 hacim ekleyin ve karıştırın. 10 dakika boyunca 4 ° C'de 1500 x g'de santrifüjleyin hücre ekstreleri kesintisiz hücre ve çekirdeklerin: pelet.
- Bir taze soğuk bir santrifüj tüpü içine pipetle aktarın ve süpernatant deney tamamlanana kadar buz üzerinde hücre ekstreleri tutun.
2. Bu tür Bikinkoninik Asit Testi Protein Tahmin Kiti Kullanımı Cep Özü Protein Konsantrasyon belirleyin
- Bisinkoninik asit hazırlanması (BCA) çözeltisi BCA ve bakır (II) karıştırılması ile (1 mL / tüp) s49 oranında ulfate: 1 (v / v).
- Protein standartlarını hazırlayın 0, 10, 20, 30, 40, 50 ve BCA solüsyonun 1 ml'lik alikolar içinde bir 10 mg / ml bovin serum albümini (BSA) stok solüsyonu seyreltilerek 60 ug / ml olmuştur.
- Tekrarlardaki BCA çözeltisi 1 ml hücre ekstrelerinin 2 ul ekleyin. Önceden ısıtılmış 60 ° C su banyosu içinde 10 dakika için standartlar ve protein örnekleri inkübe edin.
- Aktarım numuneler 3 dakika boyunca buz. 562 nm bir dalga boyunda bir spektrofotometre ile standart ve protein örnekleri absorbansı ölçülür.
- Üreticinin protokolünde tarif edildiği gibi, bir referans olarak BSA standardı kullanılarak hücre ekstrelerinin protein konsantrasyonu hesaplanır. 1x lizis tamponu ile mi, 10 mg / bir protein konsantrasyonuna hücre ekstreleri seyreltilir.
Tüp başına 200ul 3. Enzimatik Deneyi
NOT: Bir kimyasal kaputu aşağıdaki adımları uygulayın.
- 15 ml nüsha halinde her bir numune test edinkonik tüp. Tüp başına 20 ul 1 M TrisHCl pH 7.5 hazırlayın ve buz üzerinde tutmak. Her bir tüp, oda sıcaklığında, (çözelti durdurma 1 (h / h) 1) kloroform / metanol 2 ml hazırlayın.
- Pipet, buz üzerinde, her 15 ml konik bir tüp içinde 1 M TrisHCl pH 7.5, 20 ul.
- Burada radyasyon güvenlik kurallarına uyun. SAM 50,06 uM toplam tüp başına [metil- 3 H] adenosil-L-metionin ve 50 uM soğuk SAM - 0.06 uM (0.2 uCi), S eşdeğer ekleyin. Soğuk su ul x ekle x = 200- (20 (+ hücre ekstreleri için 20 () + soğuk ve radyoaktif SAM hacmi) tamponu için) tüp başına.
- Önceden ısıtılmış 30 ºC su banyosunda her konik tüp aktarın. Reaksiyonu başlatmak için her bir tüpe, hücre ekstreleri (proteinin 200 ug eşdeğer) 20 ul ekle. İstediğiniz zaman (0-45 dakika) inkübe edin.
- Kloroform / metanol 2 ml ilave ederek reaksiyonu durdurun (1: 1; v / v; durdurma çözeltisi) her tüpe. (Oda sıcaklığına 20-25 konik tüp transfer6 ° C).
4. Lipid Ekstraksiyon
NOT: Bir kimyasal kaputu aşağıdaki adımları uygulayın.
- Enzimatik reaksiyon örneğini içeren her tüpe su 700 ul ekle. Kuvvetlice 30 saniye boyunca girdap. Oda sıcaklığında 5 dakika boyunca 1500 x g'de santrifüjleyin su fazının organik ayırmak için.
- Bir pipet yardımıyla yeni bir 15 ml konik tüp içine alt organik fazı aktarın. 30 saniye boyunca kuvvetli bir şekilde boru ve vorteks içeren her "düşük değerli faz" su 1 ml ilave edilir. Tekrar santrifüj 5 dakika boyunca 1500 x g'de su fazının organik ayırmak için.
- Bir pipet, bir sintilasyon tüpüne alt organik faz transfer edin. N2 akışı altında kuru örnekleri. Olmayan anonim radyoaktif SAM ve radyasyon kurallarına göre radyoaktif konik tüpler içeren su fazları bertaraf edin.
- 2 ml / sintilasyon sıvısı tüp ekleyin. Bir sintilasyon cou ile radyoaktiviteyi ölçünnter üreticilerin protokol ve enstrümanın kullanıma göre.
- Aşağıdaki genel denklemi kullanarak nmol / mg protein enzimatik aktivite hesaplanır
cpm x değeri 10 3 x [SAM (mM) 'nin toplam (radyoaktif ve soğuk) konsantrasyonu], radyoaktif SAM (Ci / mmol) x x 5 spesifik aktivitesi [radyoaktif SAM konsantrasyonu (mM)]
Not: Yukarıdaki protokole bağlı SAM konsantrasyonu ya da bir protein bağlı PEMT tahlili için değiştirilebilir. SAM, konsantrasyona bağlı enzimatik deney için, zaman ise, protein bağlı PEMT tahlilinde, SAM konsantrasyonu için tahlil eklenir sabit (lineer aralığında 15 dakika) ve soğuk SAM çeşitli miktarlarda tutulur (biz mM 0.05 seçtik) ve zaman sabiti (15 dakika) tutulur. Ayrıca tampon çözeltisinin pH değeri, bazı PEMT enzimler farklı optimal pH değerine sahip olması gerektiği gibi değiştirilebilir.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Şekil 1, bir alt-tabaka olarak endojen PE kullanılarak, bir enzim kaynağı olarak Leishmania bütün hücre ekstresi ile gerçekleştirildiği zamana bağlı PEMT deneyi göstermektedir. Organik faz içinde radyoaktivite miktarı, sintilasyon sayımı ile nicelendirildi. Elde edilen PE numaraları üzerine transfer tritiye metil gruplarının miktarını hesaplamak için kullanıldı. PEMT aktivitesi yaklaşık 20 dakika boyunca doğrusal olmuştur. Daha sonra, başka bir 15 dakika boyunca sabit kalmıştır, bundan sonra yaklaşık 30 dakika, bir düzlüğe ulaşmıştır. Beklendiği gibi herhangi bir hücre ekstreleri tahlilinde (Şekil 2) çözeltisine ilave edildiğinde, PEMT aktivitesi tespit edilmemiştir. Bundan başka, bu faaliyet L. inhibitörüdür 100 uM octadecyltrimethylammonium bromid mevcudiyetinde kaldırıldı ana PE metiltransferaz Lmj PEM1 ve Lmj PEM2 14. PEMT faaliyetleri aynı zamanda protein konsantrasyonu bağımlı hazırlık olarakt ve bu etkinliği enzimatik tahlil (şekil 3) uygulanan protein miktarı ile doğru orantılı olmuştur. Son olarak, SAM, konsantrasyona bağımlı PEMT tahlil SAM artan konsantrasyonları (Şekil 4) test edildi gerçekleştirilmiştir. PEMT aktivitesi yaklaşık olarak 0.5 mM konsantrasyonda SAM bir düzlüğe ulaşmıştır. Hep birlikte bu dört tahlilleri PEMT faaliyeti, spesifik ve enzim (ler) saflaştırmak için gerek kalmadan, tüm hücre ekstrelerinden ölçülebilir olduğunu göstermektedir.
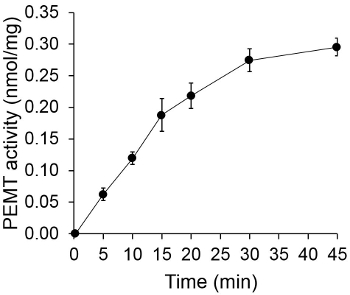
Şekil 1. zamana bağlı PEMT deneyi. Enzimatik deney zaman fonksiyonu olarak bütün Layişmanya hücre ekstrelerinin 0,2 mg, iki kopya halinde iki kez gerçekleştirildi. PEMT etkinliği ile proteinin ve p mg başına PE üzerine transfer nmol metil grubu olarak temsil edilirer sa. SAM içeren deney solüsyonuna eklenmeden önce (hacme göre 1, 1) zaman "O" için, hücre ekstreleri, ilk olarak kloroform / metanol yapılan durdurma çözeltisinin 2 ml'si ile karıştırılmıştır. Standart sapmalar gösterilir.
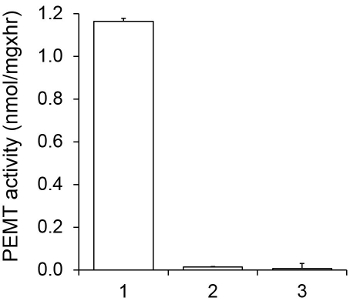
PEMT deneyi 0,05 mM SAM mevcudiyetinde 15 dakika için iki kopya halinde iki kez gerçekleştirildiği Spesifiklik PEMT aktivitesi. Şekil 2.. 1, 0.2 mg protein ekstraktı; 2, hiçbir hücre ekstresi; 3, 0.2 mg protein ve 0.1 mM octadecyltrimethylammonium bromitten hazırlandı. Standart sapmalar gösterilir.
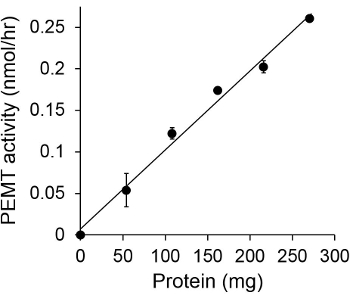
Şekil 3. Protein bağlı PEMT deneyi. Enzimatik deney iki kez gerçekleştirildi15 dakika boyunca 0.05 mM SAM ile yokluğunda (nokta 'O') ya da Leishmania proteinlerinin çeşitli miktarlarda varlığını çoğaltmak. Standart sapmalar gösterilir.
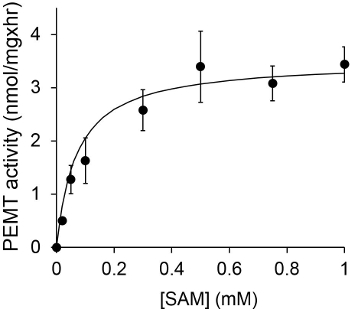
Şekil 4. PEMT deney, 15 dakika boyunca SAM çeşitli konsantrasyonlarının varlığında, bütün Layişmanya hücre ekstrelerinin 0,2 mg kopya halinde iki kez gerçekleştirilmiştir. Standart sapmalar gösterilmektedir.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Bu basit, pratik PEMT tahlil, bir protein kaynağı olarak bütün hücre ekstresi kullanarak PE üzerine SAM radyoaktif metil gruplarının transferi sonucu PE metillenmiş formlarının ölçümü sağlar. Bu, hızlı, hassas ve tekrarlanabilir ve saflaştırılmış enzimler 17 için de uygundur. Ilgi metiltransferaz yerine PE 12,13,18,19 daha Bu yüzeylerde özgü olup olmadığını monometil veya dimetil-PE tahlilinde eklenebilir. Saflaştınldı PEMT enzim kullanılırsa, PE tahlilinde eklenebilir. Bu protokolün bir sınırlama tahlil reaksiyonları ürünleri (monometil-PE, dimetil-PE veya PC) tespit olmamasıdır. 20,21 de tarif edildiği gibi ancak reaksiyon ürünlerinin (monometil-PE, dimetil-PE, PC) kimlik ayrıca bir boyutlu bir ince tabaka kromatografisi ile analiz edilebilir. Bundan başka, bu S -adenosylhomocysteine ve 5'-methylthioadenosine SAM bozunma ürünlerinin bazı PEMT aktivitesi b inhibey geribildirim engelleme. Bununla birlikte, Leishmania S -adenosylhomocysteine hidrolazı 22 sahip olarak bölen S -adenosylhomocysteine adenin ve S -ribosylhomocysteine ve adenin ve methylthioribose-1-fosfat 23 üreten bir methylthioadenosine fosforilaz halinde ayrıştırılır. Bununla birlikte, S -adenosylhomocysteine hidrolaz ve methylthioadenosine fosforilaz aktiviteleri PEMT aktivitesi inhibisyon yok ortaya çıkmasını sağlayacak şekilde etkili bir şekilde, sırası ile, S -adenosylhomocysteine ve methylthioadenosine metabolize etmek için yeterince yüksek olup olmadığı bilinmemektedir. Örneğin içinde, ilgili saflaştırılmış rekombinant enzimlerin eklenmesi SAM bozunma ürünleri 24,25 geri besleme inhibisyonu için tahlil tahliye eklenebilir ilgi hücrede mevcut -adenosylhomocysteine hidrolaz ve / veya 5'-methylthioadenosine metabolik enzim, S, 26.
Bu protokolde dört kritik adımlar vardır: i)proteaz inhibitör kokteyli tozu kullanımdan hemen önce liziz tamponuna (adım 1.1) ilave edilmesi gerekir; ii) ekstreler) aşama 1.4 sonra hazırlık (sonra aşağıdaki saat içinde kullanılmak üzere olan bütün hücre; iii) lipit çıkarma adımları (4.2 ve 4.4 adımları), dikkatli aşırı trityumlanmış SAM içeren interfaz veya su fazı, herhangi bir transfer değil uygulanması gereken, ve iv) radyoaktif S bölmeyin için süresince - [Metil- 3 H] adenosil-L-metionin ve dondurularak ait döngülerin tekrar edilmesi olarak aldıktan sonra, soğuk reajan ve olmaması için hesap adenin ve S -pentosylmethionine 26,27,28 hidroliz ve ardından 5'-methylthioadenosine ve homoserin lakton, içine indirgeme çözülme Ölçülebilir PEMT aktivitesi. Kötü bütün hücre özütleri de herhangi bir enzimatik aktivitesi için sorumlu olabilir. Bu durumda, hücre ekstresi kalitesi başka bilinen enzimatik aktivitesinin ölçülmesi ile tespit edilebilir. PEMT aktivite Son eksikliği PEMT en güveniyor olabilirzyme monometil-PE veya dimetil-PE ziyade PE özgü olmaktan. Monometil-PE ve / veya deneyde dimetil-PE substratların ilavesi PEMT aktivitesi yeniden sağlayabilir.
Bir alternatif, radyoaktif olmayan SAM bağımlı metiltransferaz deney homosisteinin enzimatik ölçümü, sam 29 metillenmenin ürünleri dayandığı, geliştirilmiştir. Bu protokol, başarılı bir şekilde özel bir PE metil transferaz aktivitesi 16 ölçmek için uygulanmıştır. Ne yazık ki, bu testte tam hücre özütünün sadece saflaştırılmış enzim için uygun olup, ve ya da, reaksiyon ürünlerinin tanınmasını ortaya koymamaktadır.
Bu protokol, muhtemelen bir hücre tipine uygulanabilir. Buna ek olarak, bu deney diyetin neden olduğu aterosklerozun karşı bakteriyel enfeksiyonlar veya yeni bir terapötik mücadele için yeni anti-mikrobiyal bileşikler test bağlamında ilgi konusu bir PEMT özgü potansiyel ilaçlar test etmek için de kullanılabilir, obeziteVe insülin direnci.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Herhangi bir çıkar çatışması ilan
Materials
| Name | Company | Catalog Number | Comments |
| S-[Methyl-3H]adenosyl-L-methionine (specific activity of 5-15 Ci/mMole) | Perkin Elmer | NET155050UC | Aliquot the reagent and freeze at -20 °C; follow radiation safety guidelines while using this reagent |
| Protease inhibitor cocktail | Roche Life Sciences | 11836170001 | dilute it fresh |
| Glass beads, acid washed, 425-600 mm | Sigma Aldrich | G8772 | |
| Bicinchoninic acid solution | Sigma Aldrich | B9643 | |
| Copper (II) sulfate | Sigma Aldrich | C2284 | |
| Scintillation counter MicroBeta2 with 1-detector | Perkin Elmer | 2450-0010 | |
| Spectrophotometer Biomate 3 | Thermo Scientific | 840208300 | |
| BSA stock solution (10 mg/ml) | New England Biolabs | B9001S | |
| Scintillation liquid | Research Product International Corp | 111198 | |
| S-(5'-Adenosyl)-L-methionine chloride (hydrochloride) | Cayman Chemicals | 13956 | dilute the reagent in 20 mM HCl and freeze aliquots at -80 °C |
References
- Keogh, M. R., Courtney, P. D., Kinney, A. J., Dewey, R. E. Functional characterization of phospholipid N-.methyltransferases from Arabidopsis and soybean. J Biol Chem. 284 (23), 15439-15447 (2009).
- Geiger, O., Lopez-Lara, I. M., Sohlenkamp, C. Phosphatidylcholine biosynthesis and function in bacteria. Biochim Biophys Acta. 1831 (3), 503-513 (2013).
- Gao, X., et al. Decreased lipogenesis in white adipose tissue contributes to the resistance to high fat diet-induced obesity in phosphatidylethanolamine N-.methyltransferase-deficient mice. Biochim Biophys Acta. 1851 (2), 152-162 (2015).
- Zhao, Y., et al. Lack of phosphatidylethanolamine N-.methyltransferase alters plasma VLDL phospholipids and attenuates atherosclerosis in mice. Arterioscler Thromb Vasc Biol. 29 (9), 1349-1355 (2009).
- Vance, D. E. Phospholipid methylation in mammals: from biochemistry to physiological function. Biochim Biophys Acta. 1838 (6), 1477-1487 (2014).
- Nishimaki-Mogami, T., Suzuki, K., Takahashi, A. The role of phosphatidylethanolamine methylation in the secretion of very low density lipoproteins by cultured rat hepatocytes: rapid inhibition of phosphatidylethanolamine methylation by bezafibrate increases the density of apolipoprotein B48-containing lipoproteins. Biochim Biophys Acta. 1304 (1), 21-31 (1996).
- Noga, A. A., Zhao, Y., Vance, D. E. An unexpected requirement for phosphatidylethanolamine N-.methyltransferase in the secretion of very low density lipoproteins. J Biol Chem. 277 (44), 42358-42365 (2002).
- Li, D., et al. Epigenetic repression of phosphatidylethanolamine N-.methyltransferase (PEMT) in BRCA1-mutated breast cancer. Oncotarget. 5 (5), 1315-1325 (2014).
- Cui, Z., Houweling, M., Vance, D. E. Suppression of rat hepatoma cell growth by expression of phosphatidylethanolamine N-.methyltransferase-2. J Biol Chem. 269 (40), 24531-24533 (1994).
- Cui, Z., Shen, Y. J., Vance, D. E. Inverse correlation between expression of phosphatidylethanolamine.N-.methyltransferase-2 and growth rate of perinatal rat livers. Biochim Biophys Acta. 1346 (1), 10-16 (1997).
- Minder, A. C., de Rudder, K. E., Narberhaus, F., Fischer, H. M., Hennecke, H., Geiger, O. Phosphatidylcholine levels in.Bradyrhizobium japonicum. membranes are critical for an efficient symbiosis with the soybean host plant. Mol Microbiol. 39 (5), 1186-1198 (2001).
- Kodaki, T., Yamashita, S. Yeast phosphatidylethanolamine methylation pathway. Cloning and characterization of two distinct methyltransferase genes. J Biol Chem. 262 (32), 15428-15435 (1987).
- Tanaka, Y., Amano, F., Maeda, M., Nishijima, M., Akamatsu, Y. Purification and properties of phosphatidyl-N-.monomethylethanolamine N-.methyltransferase, the enzyme catalyzing the second and the third steps in the phosphatidylethanolamine N-.methyltransferase system, from mouse liver microsomes. Jpn J Med Sci Biol. 43 (3), 59-73 (1990).
- Bibis, S. S., Dahlstrom, K., Zhu, T., Zufferey, R. Characterization of Leishmania major phosphatidylethanolamine methyltransferases LmjPEM1 and LmjPEM2 and their inhibition by choline analogs. Mol Biochem Parasitol. 196 (2), 90-99 (2014).
- deRudder, K. E., Thomas-Oates, J. E., Geiger, O. Rhizobium meliloti. mutants deficient in phospholipid N-.methyltransferase still contain phosphatidylcholine. J Bacteriol. 179 (22), 6921-6928 (1997).
- Aktas, M., Narberhaus, F. In vitro characterization of the enzyme properties of the phospholipid N-.methyltransferase PmtA from Agrobacterium tumefaciens. J Bacteriol. 191 (7), 2033-2041 (2009).
- Ridgway, N. D., Vance, D. E. Phosphatidylethanolamine N-.methyltransferase from rat liver. Methods Enzymol. 209, 366-374 (1992).
- Gaynor, P. M., Carman, G. M. Phosphatidylethanolamine methyltransferase and phospholipid methyltransferase activities from Saccharomyces cerevisiae. Enzymological and kinetic properties. Biochim Biophys Acta. 1045 (2), 156-163 (1990).
- Arondel, V., Benning, C., Somerville, C. R. Isolation and functional expression in Escherichia coli. of a gene encoding phosphatidylethanolamine methyltransferase (EC 2.1.1.17) from Rhodobacter sphaeroides. J Biol Chem. 268 (21), 16002-16008 (1993).
- Wessel, M., Klusener, S., Godeke, J., Fritz, C., Hacker, S., Narberhaus, F. Virulence of Agrobacterium tumefaciens. requires phosphatidylcholine in the bacterial membrane. Mol Microbiol. 62 (3), 906-915 (2006).
- Klusener, S., Aktas, M., Thormann, K. M., Wessel, M., Narberhaus, F. Expression and physiological relevance of Agrobacterium tumefaciens. phosphatidylcholine biosynthesis genes. J Bacteriol. 191 (1), 365-374 (2009).
- Henderson, D. M., et al. Cloning of the gene encoding Leishmania donovani.S.-adenosylhomocysteine hydrolase, a potential target for antiparasitic chemotherapy. Mol Biochem Parasitol. 53 (1-2), 169-183 (1992).
- Koszalka, G. W., Krenitsky, T. A. 5'-Methylthioadenosine (MTA) phosphorylase from promastigote of Leishmania donovani. Purine and Pyrimidine Metabolism in Man V, Adv Exp Med Biol. Nyhan, W. L., Thompson, L. F., Watts, R. W. E. 131, Springer US. 559-563 (1986).
- Biastoff, S., Teuber, M., Zhou, Z. S., Dräger, B. Colorimetric activity measurement of a recombinant putrescine N.-methyltransferase from Datura stramonium. Planta Med. 72 (12), 1136-1141 (2006).
- Hendricks, C. L., Ross, J. R., Pichersky, E., Noel, J. P., Zhou, Z. S. An enzyme-coupled colorimetric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 326 (1), 100-105 (2004).
- Cannon, L. M., Butler, F. N., Wan, W., Zhou, Z. S. A stereospecific colorimetric assay for (S.,S.)-adenosylmethionine quantification based on thiopurine methyltransferase-catalyzed thiol methylation. Anal Biochem. 308 (2), 358-363 (2002).
- Hoffman, J. L. Chromatographic analysis of the chiral and covalent instability of S.-adenosyl-L-methionine. Biochemistry. 25 (15), 4444-4449 (1986).
- Wu, S. E., Huskey, W. P., Borchardt, R. T., Schowen, R. L. Chiral instability at sulfur of S.-adenosylmethionine. Biochemistry. 22 (12), 2828-2832 (1983).
- Dorgan, K. M., et al. An enzyme-coupled continuous spectrophotometric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 350 (2), 249-255 (2006).



