Introduction
磷脂甲基(PEMT)酶催化的使用 S -adenosylmethionine(SAM)作为甲基供体上的PE,单甲基PE或二甲基PE,得到单甲基PE,二甲基PE和/或一个或多个甲基的共价连接磷脂酰胆碱(PC)。这些酶是在动物细胞和真菌几乎无处不在。它们也可以在一些植物1和细菌的约10%,尤其是那些与真核生物2交互找到。
PEMTs有关的细胞的生物学不仅通过,而且还通过实现其他重要的细胞功能有助于生产PC的,这是在动物细胞中的主要脂质类。在哺乳动物中,PEMTs主要表达在它们所需的极低密度脂蛋白的分泌正常肝脏和它们还有助于膳食诱导的肥胖3,动脉粥样硬化4,和胰岛素抵抗ANCE 5。此外,哺乳动物PEMT也表达在脂肪细胞,虽然到较低的水平,并且参与脂肪沉积6,7。在癌症的发展8,9凋亡和细胞生长10 PEMT作用也被证明。在细菌中,PEMT酶已被证明是对正常细胞生长2,毒力2,和共生与宿主植物11重要。
本议定书的目标和基本原理是测量从全细胞提取PEMT活动,而不需要净化酶。两个不同的协议已被开发来测量PEMT活性。第一个也是最常见的一种测量含氚甲基基团的放射性SAM转移到PE,这是本文的主题。此协议已被最初开发用于测量从酵母12和哺乳动物细胞(肝)13 PEMT活性以获得一个underst在这些细胞中的PC生物合成安定以及确定这些酶的特异性。以后,这一技术已被应用到其它类型的细胞,如细 菌2(使用用于测定虽然15碱性pH值)和原生动物寄生虫14。这种技术可以用全细胞提取物以及纯化的酶被使用,并且可以潜在地适用于任何细胞提取物的系统。一种非放射性测定法也被设计依赖在 S -adenosylhomocysteine,SAM 16的 transmethylation产物的酶量化。后者测定可能更方便,因为它不涉及放射性但它只适用于纯化的酶。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1.细胞提取物制剂
- 生长的利什曼原虫细胞与气密的瓶盖密封的无菌塑料瓶在26ºC在制成1×M199的培养基中补充有20毫米的HEPES pH7.4的,100U / ml青霉素,100微克/ ml链霉素,5微克/毫升血红素0.35克/升NACO 2小时 ,0.1毫米腺嘌呤,和2微克/毫升生物蝶呤,无晃动。收获细胞,离心在1,500rpm离心5分钟,4ºC当它们到达的1-2×10 7 / ml的细胞密度。
- 丢弃用吸管将上清液和重悬细胞沉淀用血清吸管在半冷的磷酸盐缓冲盐水的培养的体积(137毫摩尔NaCl,2.7毫米氯化钾洗细胞,10毫的 Na 2 HPO 4,1.8毫KH 2 PO 4,pH7.4)中。根据BL2安全规定进行处置细胞上清液。
- 再次离心细胞在1,500rpm离心5分钟,在4ºC。丢弃用吸管将上清液。继续牛逼Ó下一步骤或卡扣冷冻细胞沉淀在液氮中用于长期贮存于-80℃(长达三个月)。
- 制备2×裂解缓冲液(0.5M蔗糖,0.1M TrisHCl,pH7.5的,2毫摩尔EDTA,和2x蛋白酶抑制剂混合物),并保持在4ºC冰上。
- 重悬细胞沉淀中的2×裂解缓冲液等体积(新鲜或冷冻)。加入玻璃珠1倍量。涡旋剧烈4ºC10分钟。
- 加入2倍体积的1X裂解液混匀。离心细胞提取物在1500×g离心在4ºC10分钟沉淀完整细胞和核。
- 转移用吸管将上清液到新的凉爽离心管,并保持细胞提取物在冰上,直至实验结束。
2.确定细胞提取物的蛋白浓度使用蛋白估计套件如二喹啉酸含量
- 制备双金鸡宁酸(BCA)溶液(1ml /管)通过混合所述BCA和铜(II)■ulfate在49:1的比例(体积/体积)。
- 制备的蛋白标准0,10,20,30,40,50,和60微克/毫升稀释10毫克/毫升牛血清白蛋白(BSA)原液入1ml等分该BCA溶液。
- 加入2微升细胞提取物在1ml中重复BCA溶液。在一个预热的60℃水浴中孵育标准和蛋白质样品10分钟。
- 转移样品到冰3分钟。测量的标准和蛋白质样品用分光光度计的吸光度的562纳米的波长。
- 计算使用标准BSA作为参考在制造商的方案所述的细胞提取物的蛋白质浓度。稀释细胞提取物,以10毫克/毫升用1×裂解缓冲液的蛋白质浓度。
3.酶测定每管200微升
注意:携带在化学罩以下步骤。
- 测试一式两份每个样品在15ml锥形管中。准备20微升的1M TrisHCl pH为7.5,每管,并保持它在冰上。准备2 ml的氯仿/甲醇(1:1(体积/体积);终止液)在RT每个管。
- 吸取20微升的1M TrisHCl pH值7.5中的每个的15毫升锥形管在冰上。
- 按照辐射安全指引从这里开始。添加0.06微米(0.2微居里)S中的等效- [甲基3 H〕腺苷-L-蛋氨酸和50μM的冷的SAM每管,共50.06微米的SAM。请将X微升冷水,其中x = 200-(20(缓冲)+ 20(为细胞提取物)+冷和放射性SAM的容量)每管。
- 每个锥形管转移到一个预热的30°C以上水浴中。添加到每个管20微升细胞提取物(200微克蛋白质当量)以开始反应。孵育所需的时间(0到45分钟)。
- 停止反应,加入2ml氯仿/甲醇(1:1;体积/体积;终止液),以每管。锥形管转移至RT(20-256; C)。
4.脂质提取
注意:携带在化学罩以下步骤。
- 加入700微升水含酶反应样品每管。涡大力30秒。离心机在1500×g离心5分钟,在室温至有机从水相分离。
- 传送下层有机相到一个新的15毫升锥形管用吸管。加入1毫升水,以含有管和涡剧烈30秒每“低级阶段”。离心再次在1500×g离心5分钟以有机从水相分离。
- 传送下层有机相到闪烁管用吸管。根据N 2流干样品。处置含有非掺入放射性SAM和放射性锥形管作为每个辐射准则的水相。
- 加入2毫升/闪烁液管。测量结合的放射性用闪烁凑NTER根据制造商的协议和仪器的用途。
- 使用下列一般方程计算以nmol / mg蛋白质的酶活性:
的cpm值×103×[总(放射性和冷)浓度的SAM(毫摩尔)]放射性的SAM(次/毫摩尔)x的×5比活性[放射性SAM的浓度(毫摩尔)]
注:上述协议可以改变一个SAM浓度依赖性或蛋白质依赖PEMT检测。对于SAM浓度依赖性酶测定,时间保持恒定(15分钟,这是在线性范围)和各种量的冷的SAM被加入到测定而对蛋白依赖性PEMT测定中,SAM浓度(我们选择0.05毫摩尔)和时间保持恒定(15分钟)。另外,缓冲液的pH可以根据需要,如果一些PEMT酶具有不同的最佳pH值来改变。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
图1示出了时间相关的PEMT测定法,其中,进行与利什曼原虫的全细胞提取物作为使用内源性的PE作为底物的酶的来源。放射性的在有机相中的量进行定量闪烁计数。被利用所得到的数字来计算转印到PE氚化的甲基的量。所述PEMT活性是线性大约20分钟。然后,它达到了一个平台,在大约30分钟,之后将其保持恒定再15分钟。正如所料,未检测PEMT活动时没有细胞提取物加入到测定( 图 2)。而且,该活动被废除的100μM的十八烷基溴化物的存在,它是L的抑制剂各大厂家PE甲基化LMJ PEM1和LMJ PEM2 14。 PEMT活动还蛋白浓度dependen吨,而此活动成线性比例的蛋白质所申请的酶分析(图3)的量。最后,一个SAM浓度依赖性PEMT进行测定,其中SAM增加浓度进行了测试(图4)。 PEMT活动达到了高原的大约0.5mm的SAM浓度。总之,这四个实验证明PEMT活性是特异性,并且可以从全细胞提取物测量,而不需要净化酶。
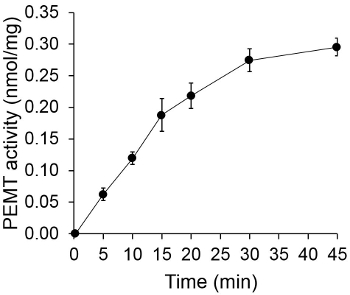
图1.时间相关PEMT测定。进行的酶测定两次重复用0.2毫克的全利什曼原虫细胞提取物作为时间的函数。 PEMT活性表示为每蛋白质和p毫克转印到PE纳摩尔甲基呃小时。被加入到含有SAM中测定溶液之前:为时间“O”,细胞提取物先用2ml制成氯仿/甲醇(1,1体积)的终止液的混合。示标准偏差。
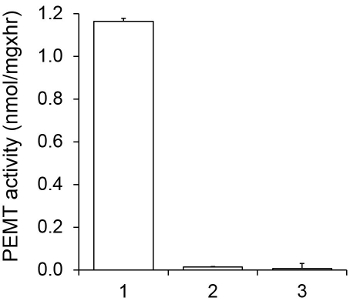
图2.特异性PEMT活性。的 PEMT测定进行两次重复15分钟在0.05毫米的SAM的存在。 1,0.2 mg蛋白提取物; 2,无细胞提取物; 3,0.2 mg蛋白和0.1mM十八烷基三溴化物。示标准偏差。
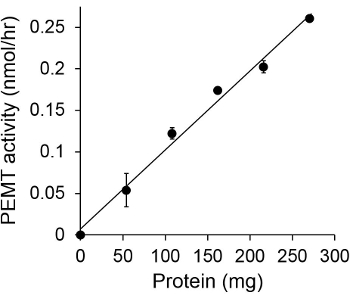
图3.蛋白依赖性PEMT测定。于进行两次的酶测定重复在不存在(点“O”)或不同量的利什曼原虫的蛋白的存在下具有0.05毫米的SAM 15分钟。示标准偏差。
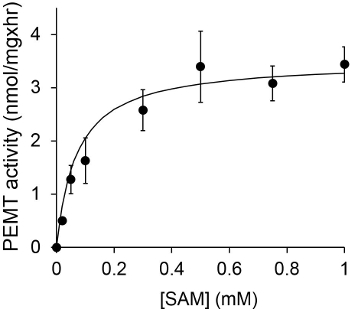
图4. PEMT测定进行两次重复用0.2毫克的全利什曼原虫细胞提取物在不同浓度的SAM的存在下进行15分钟。标准偏差一起表示。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
此简单,快速PEMT测定允许PE而导致的从SAM放射性甲基的使用全细胞提取物作为蛋白质来源转移到PE的甲基化形式的量化。它具有快速,灵敏,重现性好,也适用于纯化的酶17。单甲基或二甲基PE可以被添加到测定如果感兴趣的甲基是特定于这些基板而不是体育12,13,18,19。如果纯化PEMT酶时,PE可以被添加到测定。此协议的一个限制是,该测定不能识别的反应产物(单甲基PE,二甲基PE,或PC)。然而,该反应产物(单甲基PE,二甲基PE,PC)的身份可以进一步通过一维薄层层析如20,21描述进行分析。此外,一些的SAM降解产物如 S -adenosylhomocysteine 和5'-甲硫可能抑制PEMT b活动Ÿ反馈抑制。然而, 利什曼原虫具有一个 S -adenosylhomocysteine 水解酶22,其裂解小号 -adenosylhomocysteine 成腺嘌呤和 S -ribosylhomocysteine,和一个甲硫腺苷磷酸,产生腺嘌呤和methylthioribose -1-磷酸23。然而,它不知道小号 -adenosylhomocysteine 水解酶和甲硫腺苷磷酸活动是否高到足以有效地代谢小号 -adenosylhomocysteine 和甲硫分别使得没有抑制PEMT活性发生。在该实例š-adenosylhomocysteine 水解酶和/或5'-甲基硫代谢酶不存在于所关注的细胞,除了各自的纯化的重组酶可被加入到测定,以减轻由SAM降解产物24,25反馈抑制26。
还有在这个协议中四个关键步骤:i)的蛋白酶抑制剂混合物的粉末具有临使用之前加入到裂解缓冲液(步骤1.1); ii)所述全细胞提取物将要在以下小时内使用的制剂(步骤1.4之后后); iii)在此脂质提取步骤(步骤4.2和4.4),小心需要施加到不能传输任何相间或水相,其中含有过量的氚标记的SAM的,和iv)对等分放射性的S - [甲基3 H〕腺苷-L-蛋氨酸和在接收冷试剂如冷冻的重复循环和解冻降解成5'-甲基硫腺苷和丝氨酸内酯接着水解腺嘌呤和 S -pentosylmethionine 26,27,28,这可能说明缺乏衡量PEMT活动。坏全细胞提取物也可以是负责没有酶活性。在这种情况下,细胞提取物的质量,可以通过测量另一种已知的酶活性进行评估。最后,缺乏PEMT活动可能依靠PEMT恩ZYME是具体到单-PE或二-PE,而不是PE。加成单甲基PE和/或二甲基PE底物测定的可还原PEMT活性。
另一种选择,非放射性SAM依赖性甲基转移酶测定法已被开发出来,它依赖于高半胱氨酸的酶量化,SAM 29的 transmethylation产品。该协议已成功应用于衡量PE特定的甲基转移酶活性16。不幸的是,该测定是仅适用于纯化的酶,而不是对全细胞提取物,并没有揭示的反应产物的身份任。
本协议可能被应用到任何类型的细胞。另外,该测定可用于测试特定于感兴趣在测试新的抗微生物化合物对抗饮食诱导的动脉粥样硬化的细菌感染或新的治疗的上下文中,PEMT潜在药物,肥胖和胰岛素抵抗。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
没有利益冲突的声明
Materials
| Name | Company | Catalog Number | Comments |
| S-[Methyl-3H]adenosyl-L-methionine (specific activity of 5-15 Ci/mMole) | Perkin Elmer | NET155050UC | Aliquot the reagent and freeze at -20 °C; follow radiation safety guidelines while using this reagent |
| Protease inhibitor cocktail | Roche Life Sciences | 11836170001 | dilute it fresh |
| Glass beads, acid washed, 425-600 mm | Sigma Aldrich | G8772 | |
| Bicinchoninic acid solution | Sigma Aldrich | B9643 | |
| Copper (II) sulfate | Sigma Aldrich | C2284 | |
| Scintillation counter MicroBeta2 with 1-detector | Perkin Elmer | 2450-0010 | |
| Spectrophotometer Biomate 3 | Thermo Scientific | 840208300 | |
| BSA stock solution (10 mg/ml) | New England Biolabs | B9001S | |
| Scintillation liquid | Research Product International Corp | 111198 | |
| S-(5'-Adenosyl)-L-methionine chloride (hydrochloride) | Cayman Chemicals | 13956 | dilute the reagent in 20 mM HCl and freeze aliquots at -80 °C |
References
- Keogh, M. R., Courtney, P. D., Kinney, A. J., Dewey, R. E. Functional characterization of phospholipid N-.methyltransferases from Arabidopsis and soybean. J Biol Chem. 284 (23), 15439-15447 (2009).
- Geiger, O., Lopez-Lara, I. M., Sohlenkamp, C. Phosphatidylcholine biosynthesis and function in bacteria. Biochim Biophys Acta. 1831 (3), 503-513 (2013).
- Gao, X., et al. Decreased lipogenesis in white adipose tissue contributes to the resistance to high fat diet-induced obesity in phosphatidylethanolamine N-.methyltransferase-deficient mice. Biochim Biophys Acta. 1851 (2), 152-162 (2015).
- Zhao, Y., et al. Lack of phosphatidylethanolamine N-.methyltransferase alters plasma VLDL phospholipids and attenuates atherosclerosis in mice. Arterioscler Thromb Vasc Biol. 29 (9), 1349-1355 (2009).
- Vance, D. E. Phospholipid methylation in mammals: from biochemistry to physiological function. Biochim Biophys Acta. 1838 (6), 1477-1487 (2014).
- Nishimaki-Mogami, T., Suzuki, K., Takahashi, A. The role of phosphatidylethanolamine methylation in the secretion of very low density lipoproteins by cultured rat hepatocytes: rapid inhibition of phosphatidylethanolamine methylation by bezafibrate increases the density of apolipoprotein B48-containing lipoproteins. Biochim Biophys Acta. 1304 (1), 21-31 (1996).
- Noga, A. A., Zhao, Y., Vance, D. E. An unexpected requirement for phosphatidylethanolamine N-.methyltransferase in the secretion of very low density lipoproteins. J Biol Chem. 277 (44), 42358-42365 (2002).
- Li, D., et al. Epigenetic repression of phosphatidylethanolamine N-.methyltransferase (PEMT) in BRCA1-mutated breast cancer. Oncotarget. 5 (5), 1315-1325 (2014).
- Cui, Z., Houweling, M., Vance, D. E. Suppression of rat hepatoma cell growth by expression of phosphatidylethanolamine N-.methyltransferase-2. J Biol Chem. 269 (40), 24531-24533 (1994).
- Cui, Z., Shen, Y. J., Vance, D. E. Inverse correlation between expression of phosphatidylethanolamine.N-.methyltransferase-2 and growth rate of perinatal rat livers. Biochim Biophys Acta. 1346 (1), 10-16 (1997).
- Minder, A. C., de Rudder, K. E., Narberhaus, F., Fischer, H. M., Hennecke, H., Geiger, O. Phosphatidylcholine levels in.Bradyrhizobium japonicum. membranes are critical for an efficient symbiosis with the soybean host plant. Mol Microbiol. 39 (5), 1186-1198 (2001).
- Kodaki, T., Yamashita, S. Yeast phosphatidylethanolamine methylation pathway. Cloning and characterization of two distinct methyltransferase genes. J Biol Chem. 262 (32), 15428-15435 (1987).
- Tanaka, Y., Amano, F., Maeda, M., Nishijima, M., Akamatsu, Y. Purification and properties of phosphatidyl-N-.monomethylethanolamine N-.methyltransferase, the enzyme catalyzing the second and the third steps in the phosphatidylethanolamine N-.methyltransferase system, from mouse liver microsomes. Jpn J Med Sci Biol. 43 (3), 59-73 (1990).
- Bibis, S. S., Dahlstrom, K., Zhu, T., Zufferey, R. Characterization of Leishmania major phosphatidylethanolamine methyltransferases LmjPEM1 and LmjPEM2 and their inhibition by choline analogs. Mol Biochem Parasitol. 196 (2), 90-99 (2014).
- deRudder, K. E., Thomas-Oates, J. E., Geiger, O. Rhizobium meliloti. mutants deficient in phospholipid N-.methyltransferase still contain phosphatidylcholine. J Bacteriol. 179 (22), 6921-6928 (1997).
- Aktas, M., Narberhaus, F. In vitro characterization of the enzyme properties of the phospholipid N-.methyltransferase PmtA from Agrobacterium tumefaciens. J Bacteriol. 191 (7), 2033-2041 (2009).
- Ridgway, N. D., Vance, D. E. Phosphatidylethanolamine N-.methyltransferase from rat liver. Methods Enzymol. 209, 366-374 (1992).
- Gaynor, P. M., Carman, G. M. Phosphatidylethanolamine methyltransferase and phospholipid methyltransferase activities from Saccharomyces cerevisiae. Enzymological and kinetic properties. Biochim Biophys Acta. 1045 (2), 156-163 (1990).
- Arondel, V., Benning, C., Somerville, C. R. Isolation and functional expression in Escherichia coli. of a gene encoding phosphatidylethanolamine methyltransferase (EC 2.1.1.17) from Rhodobacter sphaeroides. J Biol Chem. 268 (21), 16002-16008 (1993).
- Wessel, M., Klusener, S., Godeke, J., Fritz, C., Hacker, S., Narberhaus, F. Virulence of Agrobacterium tumefaciens. requires phosphatidylcholine in the bacterial membrane. Mol Microbiol. 62 (3), 906-915 (2006).
- Klusener, S., Aktas, M., Thormann, K. M., Wessel, M., Narberhaus, F. Expression and physiological relevance of Agrobacterium tumefaciens. phosphatidylcholine biosynthesis genes. J Bacteriol. 191 (1), 365-374 (2009).
- Henderson, D. M., et al. Cloning of the gene encoding Leishmania donovani.S.-adenosylhomocysteine hydrolase, a potential target for antiparasitic chemotherapy. Mol Biochem Parasitol. 53 (1-2), 169-183 (1992).
- Koszalka, G. W., Krenitsky, T. A. 5'-Methylthioadenosine (MTA) phosphorylase from promastigote of Leishmania donovani. Purine and Pyrimidine Metabolism in Man V, Adv Exp Med Biol. Nyhan, W. L., Thompson, L. F., Watts, R. W. E. 131, Springer US. 559-563 (1986).
- Biastoff, S., Teuber, M., Zhou, Z. S., Dräger, B. Colorimetric activity measurement of a recombinant putrescine N.-methyltransferase from Datura stramonium. Planta Med. 72 (12), 1136-1141 (2006).
- Hendricks, C. L., Ross, J. R., Pichersky, E., Noel, J. P., Zhou, Z. S. An enzyme-coupled colorimetric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 326 (1), 100-105 (2004).
- Cannon, L. M., Butler, F. N., Wan, W., Zhou, Z. S. A stereospecific colorimetric assay for (S.,S.)-adenosylmethionine quantification based on thiopurine methyltransferase-catalyzed thiol methylation. Anal Biochem. 308 (2), 358-363 (2002).
- Hoffman, J. L. Chromatographic analysis of the chiral and covalent instability of S.-adenosyl-L-methionine. Biochemistry. 25 (15), 4444-4449 (1986).
- Wu, S. E., Huskey, W. P., Borchardt, R. T., Schowen, R. L. Chiral instability at sulfur of S.-adenosylmethionine. Biochemistry. 22 (12), 2828-2832 (1983).
- Dorgan, K. M., et al. An enzyme-coupled continuous spectrophotometric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 350 (2), 249-255 (2006).



