Introduction
Fosfatidyletanolamin metyltransferase (PEMT) enzymer katalyserer kovalent binding av en eller flere metylgrupper ved hjelp av S-adenosylmetionin (SAM) som metylgruppedonor på PE, monometyl--PE eller dimetyl-PE for å gi monometyl-PE, dimetyl-PE og / eller fosfatidylcholin (PC). Disse enzymene er nesten allestedsnærværende i dyreceller og sopp. De kan også bli funnet i noen planter 1 og omtrent 10% av bakterier, spesielt de som samhandler med eukaryoter 2.
PEMTs er relevante for biologi av cellen, ikke bare ved å bidra til produksjon av PC, som er den viktigste lipidklasse i dyreceller, men også ved å utføre andre viktige cellulære funksjoner. I pattedyr er PEMTs hovedsakelig uttrykkes i leveren, hvor de er nødvendige for normal sekresjon av meget lav-tetthets lipoprotein, og de bidrar også til diett-indusert fedme 3, aterosklerose 4, og insulin motstågen 5. I tillegg er pattedyr PEMT også uttrykt i adipocytter, men til lavere nivåer, og delta i fett deponering 6, 7. PEMT rolle i kreftutvikling 8, 9 apoptose og cellevekst 10 har også blitt demonstrert. I bakterier, har PEMT enzymer har vist seg å være viktig for normal cellevekst 2, virulens 2, og symbiose med vertsplanten 11.
Målet og begrunnelsen for den foreliggende protokollen er å måle PEMT aktivitet fra hele celleekstraktene uten behov for å rense enzymet. To forskjellige protokoller er utviklet for å måle PEMT aktivitet. Den første og mest vanlige måler overføring av tritiumbehandlet metylgruppe fra radioaktivt SAM på PE, som er tema for denne artikkelen. Denne protokollen er opprinnelig utviklet for å måle PEMT aktivitet fra gjær 12 og pattedyrceller (leveren) 13 for å få en understanding av PC-biosyntese i disse celler, så vel som for å bestemme spesifisiteten av disse enzymene. Senere, har denne teknikken blitt anvendt på andre celletyper slik som bakterier 2 (ved bruk av en basisk pH-verdi for analysen skjønt 15) og protozo parasitter 14. Denne teknikken kan brukes til hele celleekstrakter, så vel som renset enzym, og kan potensielt brukes på alle celleekstrakt system. En ikke radioaktiv analyse er også blitt utviklet som er avhengig av den enzymatiske kvantifisering av S -adenosylhomocysteine, transmetyleringsreaksjoner produkt av SAM 16. Den sistnevnte analysen kan være mer praktisk fordi den ikke medfører radioaktivitet, men det er kun egnet for rensede enzymer.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Cell Extract Forberedelse
- Dyrke Leishmania cellene i et sterilt plastflaske forseglet med lufttett lokk ved 26 ° C i et medium fremstilt av 1x M199 supplert med 20 mM HEPES pH 7,4, 100 U / ml penicillin, 100 ug / ml streptomycin, 5 ug / ml heme , 0,35 g / l Naco 2 H, 0,1 mM adenin og 2 ug / ml biopterin uten risting. Høste cellene ved sentrifugering ved 1500 g i 5 min ved 4 ° C når de når en celletetthet på 1-2 x 10 7 / ml.
- Kast supernatanten med en pipette og vaske cellene ved resuspendering cellepelleten med en serologisk pipette i halvparten av kulturen volum kald fosfatbuffret saltoppløsning (137 mM NaCl, 2,7 mM KCl, 10 mM Na2 HPO 4, 1,8 mM KH 2 PO 4, pH 7,4). Kast cellesupernatanter ifølge BL2 retningslinjer for sikkerhet.
- Sentrifuger cellene på nytt ved 1500 g i 5 min ved 4 ° C. Kast supernatanten med en pipette. Fortsett to neste steg, eller knipse fryse cellepellet i flytende nitrogen for langtidsoppbevaring ved -80 ºC (inntil tre måneder).
- Forbered 2x lysisbuffer (0,5 M sukrose, 0,1 M TrisHCl, pH 7,5, 2 mM EDTA, og 2x proteasehemmer cocktail) og holde den ved 4 ºC på is.
- Resuspender cellepelleten (fersk eller frossen) i likt volum av 2x lyseringsbuffer. Legg 1x volum av glassperler. Vortex kraftig ved 4 ° C i 10 min.
- Tilsett 2 volumdeler 1x lyseringsbuffer og bland. Sentrifuger celleekstrakter ved 1500 xg ved 4 ° C i 10 min for å pelletere ubrutte celler og kjerner.
- Overfør supernatanten med en pipette inn i en ny kule sentrifugerør og holde celleekstrakter på is inntil fullføring av forsøket.
2. Bestem Protein Konsentrasjon av Cell Extract Bruke Protein Evaluering Kit Slike som Bicinchoninic Acid Analyse
- Klargjør bicinchoninic syre (BCA) løsning (1 ml / rør) ved å blande BCA og kobber (II) sulfate i et forhold på 49: 1 (v / v).
- Fremstille proteinstandarder på 0, 10, 20, 30, 40, 50, og 60 pg / ml ved fortynning av en 10 mg / ml bovint serumalbumin (BSA) stamløsning i 1 ml aliquoter av BCA-løsning.
- Tilsett 2 mL av celleekstrakter i 1 ml av BCA oppløsning i duplikater. Inkuber standarder og proteinprøver i 10 min i et forvarmet 60 ° C vannbad.
- Overføre prøvene til is i 3 min. Mål absorbansen av standardene og proteinprøvene med et spektrofotometer ved en bølgelengde på 562 nm.
- Beregn proteinkonsentrasjonen av celleekstrakter ved bruk av BSA som en standard referanse slik som beskrevet i produsentens protokoll. Fortynn celleekstrakter til en proteinkonsentrasjon på 10 mg / ml med 1x lyseringsbuffer.
3. Enzymatisk analysen i 200 mL per Tube
MERK: Utfør følgende trinn i en kjemisk hette.
- Test hver prøve i to eksemplarer i en 15 mlkonisk tube. Forbered 20 mL 1 M TrisHCl pH 7,5 per rør og holde den på is. Forbered 2 ml kloroform / metanol (1: 1 (v / v); stoppe-løsning) ved RT i hvert rør.
- Pipetter 20 ul av 1 M Tris-HCl pH 7,5 i hver 15 ml konisk rør på is.
- Følg retningslinjene for strålingssikkerhet herfra. Tilsett ekvivalent på 0,06 um (0,2 uCi) S - [metyl- 3H] adenosyl-L-metionin og 50 uM kald SAM per rør for totalt 50,06 uM av SAM. Legg x pl kaldt vann, hvor x = 200 (20 (for buffer) + 20 (for celleekstrakter) + volum av kald og radioaktivt SAM) per rør.
- Overfør hver konisk rør i et forvarmet 30 ° C vannbad. Legg til hvert rør 20 pl celleekstrakter (tilsvarende 200 ug protein) for å starte reaksjonen. Inkuber i ønsket tid (0-45 minutter).
- Stopp reaksjonen ved å tilsette 2 ml kloroform / metanol (1: 1; volum / volum; stoppe-løsning) til hvert rør. Overfør konisk rør til RT (20-256, C).
4. Lipid Extraction
MERK: Utfør følgende trinn i en kjemisk hette.
- Legg 700 ul vann til hvert rør inneholdende det enzymatiske reaksjon prøven. Vortex kraftig i 30 sek. Sentrifuger ved 1500 xg i 5 minutter ved romtemperatur for å skille den organiske fra vannfasen.
- Overfør den nedre organiske fase inn i en ny 15 ml konisk rør med en pipette. Tilsett 1 ml vann til hver "lavere fase" inneholdende og vortex kraftig i 30 sek. Sentrifuger på nytt ved 1500 xg i 5 min for å separere den organiske fra vannfasen.
- Overfør den nedre organiske fase inn i en scintillasjons-rør med en pipette. Tørre prøver under en strøm av N2. Kast vannfaser som inneholder ikke-inkorporert radioaktivt SAM og de radioaktive koniske rør som per retningslinjer stråling.
- Tilsett 2 ml / tube scintillasjonsvæske. Mål innlemmet radioaktivitet med en scintillasjon counter i henhold til produsentens protokoll og instrumentbruk.
- Beregn enzymatisk aktivitet i nmol / mg protein ved å bruke den følgende generelle ligning:
cpm verdi x 10 3 x [total (radioaktiv og kaldt) konsentrasjonen av SAM (mM)] x 5 spesifikk aktivitet av radioaktivt SAM (Ci / mmol) x [konsentrasjon av radioaktivt SAM (mM)]
Merk: Ovennevnte protokollen kan endres for en SAM konsentrasjonsavhengig eller et protein avhengig PEMT analysen. For SAM konsentrasjonsavhengig enzymatisk assay, tiden holdt konstant (15 min, som er i det lineære området) og forskjellige mengder kaldt SAM tilsettes til analysen, mens for proteinavhengige PEMT assay SAM konsentrasjon (vi valgte 0,05 mM) og tids holdes konstant (15 min). Også pH-verdien i bufferen kan endres etter behov om noen PEMT enzymer ha en forskjellig optimal pH-verdi.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Figur 1 viser en tidsavhengig PEMT analyse, som ble utført med Leishmania hel celleekstrakt som en enzymkilde ved hjelp av endogen PE som et substrat. Mengden av radioaktivitet i den organiske fase ble kvantifisert ved scintillasjonstelling. De resulterende tall ble anvendt for å beregne mengden av tritiert metylgrupper overføres på PE. Den PEMT aktiviteten var lineær for ca 20 min. Deretter nådd et platå på rundt 30 minutter, og etter det holdt seg konstant i 15 min. Som forventet, ble PEMT aktivitet ikke påvises når ingen celleekstrakter ble tilsatt til analysen (figur 2). Videre ble denne aktiviteten opphevet i nærvær av 100 pM octadecyltrimethylammonium bromid, som er en inhibitor av L. store PE metyltransferaser LMJ PEM1 og LMJ PEM2 14. PEMT aktivitet var også proteinkonsentrasjonen dependent, og denne aktiviteten var lineært proporsjonal med mengden av proteinet anvendt for den enzymatiske analyse (Figur 3). Til slutt, ble en konsentrasjonsavhengig SAM PEMT assay utført, hvor økende konsentrasjoner av SAM ble testet (figur 4). PEMT aktivitet nådd et platå på SAM konsentrasjon på ca 0,5 mm. Til sammen er disse fire analyser demonstrerer at PEMT aktivitet er spesifikk og kan måles fra fullcelle-ekstrakter uten behov for å rense enzymet (ene).
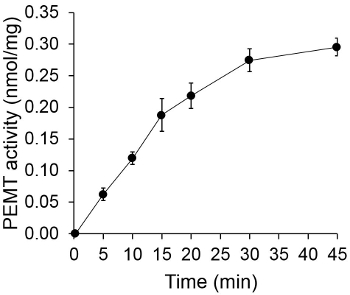
Figur 1. Tidsavhengig PEMT assay. Den enzymatiske analyse ble utført to ganger i duplikat med 0,2 mg av hele Leishmania celleekstrakter som en funksjon av tid. PEMT aktivitet er representert som nmol metylgrupper overføres på PE pr mg protein og per hr. For tiden "O", ble celleekstrakter først blandet med 2 ml stoppløsning laget av kloroform / metanol (1: 1, på volumbasis) før de ble tilsatt til analyse oppløsning inneholdende SAM. Standard avvik er vist.
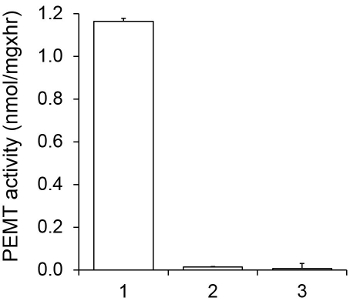
Figur 2. Spesifisitet av PEMT aktivitet. PEMT analysen ble utført to ganger in duplo i 15 min i nærvær av 0,05 mM SAM. 1, 0,2 mg protein ekstrakt; 2, ingen celle ekstrakter; 3, 0,2 mg protein og 0,1 mm octadecyltrimethylammonium bromide. Standard avvik er vist.
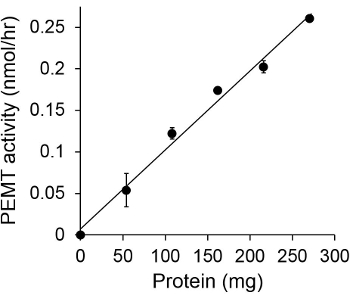
Figur 3. Protein avhengig PEMT assay. Den enzymatiske analyse ble utført to ganger iduplisere i fravær (punkt "O") eller nærvær av forskjellige mengder av Leishmania proteiner med 0,05 mM SAM i 15 min. Standard avvik er vist.
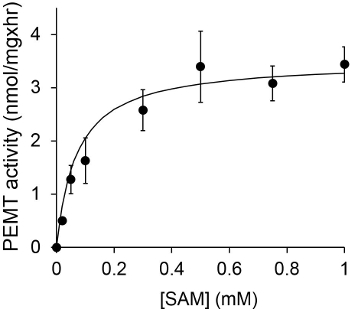
Figur 4. PEMT Analysen ble utført to ganger in duplo til 0,2 mg av hele Leishmania celle-ekstrakter i nærvær av forskjellige konsentrasjoner av SAM i 15 min. Standardavvik er vist.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Denne enkle, raske PEMT analysen tillater kvantifisering av metylerte former av PE som er resultatet av overføringen av radioaktive metylgrupper fra SAM på PE ved bruk av helcelle-ekstraktet som proteinkilde. Den er rask, følsom, reproduserbar, og passer også for rene enzymer 17. Monometyl eller dimetyl-PE kan legges til analysen dersom metyltransferase av interesse er spesifikke for slike underlag i stedet for å PE 12,13,18,19. Hvis renset PEMT enzym anvendes, kan PE tilsettes til analysen. En begrensning av denne protokollen er at analysen ikke identifiserer de reaksjoner produkter (monomethyl-PE, dimetyl-PE, eller PC). Imidlertid kan identiteten av reaksjonsproduktene (monometyl-PE, dimetyl-PE, PC) videre bli analysert av en dimensjonal tynnsjiktskromatografi som beskrevet i 20,21. Videre kan noen av SAM-nedbrytningsprodukter som S -adenosylhomocysteine og 5'-methylthioadenosine PEMT inhibere aktiviteten by tilbakemeldinger hemming. Imidlertid besitter en Leishmania S -adenosylhomocysteine hydrolase 22, som spalter S -adenosylhomocysteine inn adenin og S -ribosylhomocysteine, og en methylthioadenosine fosforylase, som produserer adenin og methylthioribose-1-fosfat-23. Det er imidlertid ikke kjent hvorvidt S -adenosylhomocysteine hydrolase og methylthioadenosine fosforylase aktivitet er høy nok til effektivt å forbrenne S -adenosylhomocysteine og methylthioadenosine, henholdsvis, slik at ingen inhibering av PEMT aktivitet forekommer. I det tilfellet S -adenosylhomocysteine hydrolase og / eller 5'-methylthioadenosine metabolske enzym er fraværende i cellen av interesse, tilsetningen av de respektive rensede, rekombinante enzymer kan tilsettes til prøven for å avlaste feedback hemming av SAM-degraderingsprodukter 24,25, 26.
Det er fire viktige skritt i denne protokollen: i)protease inhibitor cocktail pulver må tilsettes til lysis buffer rett før bruk (trinn 1.1); ii) hele cellen ekstrakter er solgt i løpet av de følgende timer etter fremstillingen (etter trinn 1.4); iii) de lipid-ekstraksjon trinn (trinnene 4,2 og 4,4), må forsiktighet for å bli brukt til å ikke overføre noen av de mellomfase eller vannfase, som inneholder overskudd av tritiert SAM, og iv) å aliquot av den radioaktive S - [metyl- 3 H] adenosyl-L-metionin og kald reagens ved mottak som gjentatte sykluser av frysing og tine degradere den i 5'-methylthioadenosine og homoserinlakton, etterfulgt av hydrolyse til adenin og S -pentosylmethionine 26,27,28, noe som kan forklare mangelen på målbar PEMT aktivitet. Bad hele celleekstrakter kan også være ansvarlig for noen enzymatisk aktivitet. I dette tilfellet, kan kvaliteten på celleekstrakt vurderes ved å måle en annen kjent enzymatisk aktivitet. Sist, mangel på PEMT aktivitet kan stole på PEMT noZyme å være spesifikk for monometyl-PE eller dimetyl-PE i stedet for PE. Tilsetning av monometyl-PE og / eller dimetyl-PE substrater for analysen, kan gjenopprette PEMT aktivitet.
En alternativ, og ikke-radioaktive SAM avhengig metyltransferase assay blitt utviklet, som er avhengig av den enzymatiske kvantifisering av homocystein, transmetyleringsreaksjoner produkter av SAM 29. Denne protokollen har blitt brukt til å måle PE spesifikk metyltransferase aktivitet 16. Dessverre er denne analysen ble kun egnet for renset enzym og ikke til hele celleekstrakt, og ikke avslører identiteten av reaksjonsproduktene enten.
Denne protokoll kan muligens brukes på alle celletype. I tillegg kan denne analysen brukes til å teste potensielle legemidler som er spesifikke for en PEMT av interesse i forbindelse med testing av nye antimikrobielle forbindelser for å bekjempe bakterielle infeksjoner eller nye behandlingsformer mot diett-indusert aterosklerose, fedmeOg insulinresistens.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Ingen interessekonflikter erklært
Materials
| Name | Company | Catalog Number | Comments |
| S-[Methyl-3H]adenosyl-L-methionine (specific activity of 5-15 Ci/mMole) | Perkin Elmer | NET155050UC | Aliquot the reagent and freeze at -20 °C; follow radiation safety guidelines while using this reagent |
| Protease inhibitor cocktail | Roche Life Sciences | 11836170001 | dilute it fresh |
| Glass beads, acid washed, 425-600 mm | Sigma Aldrich | G8772 | |
| Bicinchoninic acid solution | Sigma Aldrich | B9643 | |
| Copper (II) sulfate | Sigma Aldrich | C2284 | |
| Scintillation counter MicroBeta2 with 1-detector | Perkin Elmer | 2450-0010 | |
| Spectrophotometer Biomate 3 | Thermo Scientific | 840208300 | |
| BSA stock solution (10 mg/ml) | New England Biolabs | B9001S | |
| Scintillation liquid | Research Product International Corp | 111198 | |
| S-(5'-Adenosyl)-L-methionine chloride (hydrochloride) | Cayman Chemicals | 13956 | dilute the reagent in 20 mM HCl and freeze aliquots at -80 °C |
References
- Keogh, M. R., Courtney, P. D., Kinney, A. J., Dewey, R. E. Functional characterization of phospholipid N-.methyltransferases from Arabidopsis and soybean. J Biol Chem. 284 (23), 15439-15447 (2009).
- Geiger, O., Lopez-Lara, I. M., Sohlenkamp, C. Phosphatidylcholine biosynthesis and function in bacteria. Biochim Biophys Acta. 1831 (3), 503-513 (2013).
- Gao, X., et al. Decreased lipogenesis in white adipose tissue contributes to the resistance to high fat diet-induced obesity in phosphatidylethanolamine N-.methyltransferase-deficient mice. Biochim Biophys Acta. 1851 (2), 152-162 (2015).
- Zhao, Y., et al. Lack of phosphatidylethanolamine N-.methyltransferase alters plasma VLDL phospholipids and attenuates atherosclerosis in mice. Arterioscler Thromb Vasc Biol. 29 (9), 1349-1355 (2009).
- Vance, D. E. Phospholipid methylation in mammals: from biochemistry to physiological function. Biochim Biophys Acta. 1838 (6), 1477-1487 (2014).
- Nishimaki-Mogami, T., Suzuki, K., Takahashi, A. The role of phosphatidylethanolamine methylation in the secretion of very low density lipoproteins by cultured rat hepatocytes: rapid inhibition of phosphatidylethanolamine methylation by bezafibrate increases the density of apolipoprotein B48-containing lipoproteins. Biochim Biophys Acta. 1304 (1), 21-31 (1996).
- Noga, A. A., Zhao, Y., Vance, D. E. An unexpected requirement for phosphatidylethanolamine N-.methyltransferase in the secretion of very low density lipoproteins. J Biol Chem. 277 (44), 42358-42365 (2002).
- Li, D., et al. Epigenetic repression of phosphatidylethanolamine N-.methyltransferase (PEMT) in BRCA1-mutated breast cancer. Oncotarget. 5 (5), 1315-1325 (2014).
- Cui, Z., Houweling, M., Vance, D. E. Suppression of rat hepatoma cell growth by expression of phosphatidylethanolamine N-.methyltransferase-2. J Biol Chem. 269 (40), 24531-24533 (1994).
- Cui, Z., Shen, Y. J., Vance, D. E. Inverse correlation between expression of phosphatidylethanolamine.N-.methyltransferase-2 and growth rate of perinatal rat livers. Biochim Biophys Acta. 1346 (1), 10-16 (1997).
- Minder, A. C., de Rudder, K. E., Narberhaus, F., Fischer, H. M., Hennecke, H., Geiger, O. Phosphatidylcholine levels in.Bradyrhizobium japonicum. membranes are critical for an efficient symbiosis with the soybean host plant. Mol Microbiol. 39 (5), 1186-1198 (2001).
- Kodaki, T., Yamashita, S. Yeast phosphatidylethanolamine methylation pathway. Cloning and characterization of two distinct methyltransferase genes. J Biol Chem. 262 (32), 15428-15435 (1987).
- Tanaka, Y., Amano, F., Maeda, M., Nishijima, M., Akamatsu, Y. Purification and properties of phosphatidyl-N-.monomethylethanolamine N-.methyltransferase, the enzyme catalyzing the second and the third steps in the phosphatidylethanolamine N-.methyltransferase system, from mouse liver microsomes. Jpn J Med Sci Biol. 43 (3), 59-73 (1990).
- Bibis, S. S., Dahlstrom, K., Zhu, T., Zufferey, R. Characterization of Leishmania major phosphatidylethanolamine methyltransferases LmjPEM1 and LmjPEM2 and their inhibition by choline analogs. Mol Biochem Parasitol. 196 (2), 90-99 (2014).
- deRudder, K. E., Thomas-Oates, J. E., Geiger, O. Rhizobium meliloti. mutants deficient in phospholipid N-.methyltransferase still contain phosphatidylcholine. J Bacteriol. 179 (22), 6921-6928 (1997).
- Aktas, M., Narberhaus, F. In vitro characterization of the enzyme properties of the phospholipid N-.methyltransferase PmtA from Agrobacterium tumefaciens. J Bacteriol. 191 (7), 2033-2041 (2009).
- Ridgway, N. D., Vance, D. E. Phosphatidylethanolamine N-.methyltransferase from rat liver. Methods Enzymol. 209, 366-374 (1992).
- Gaynor, P. M., Carman, G. M. Phosphatidylethanolamine methyltransferase and phospholipid methyltransferase activities from Saccharomyces cerevisiae. Enzymological and kinetic properties. Biochim Biophys Acta. 1045 (2), 156-163 (1990).
- Arondel, V., Benning, C., Somerville, C. R. Isolation and functional expression in Escherichia coli. of a gene encoding phosphatidylethanolamine methyltransferase (EC 2.1.1.17) from Rhodobacter sphaeroides. J Biol Chem. 268 (21), 16002-16008 (1993).
- Wessel, M., Klusener, S., Godeke, J., Fritz, C., Hacker, S., Narberhaus, F. Virulence of Agrobacterium tumefaciens. requires phosphatidylcholine in the bacterial membrane. Mol Microbiol. 62 (3), 906-915 (2006).
- Klusener, S., Aktas, M., Thormann, K. M., Wessel, M., Narberhaus, F. Expression and physiological relevance of Agrobacterium tumefaciens. phosphatidylcholine biosynthesis genes. J Bacteriol. 191 (1), 365-374 (2009).
- Henderson, D. M., et al. Cloning of the gene encoding Leishmania donovani.S.-adenosylhomocysteine hydrolase, a potential target for antiparasitic chemotherapy. Mol Biochem Parasitol. 53 (1-2), 169-183 (1992).
- Koszalka, G. W., Krenitsky, T. A. 5'-Methylthioadenosine (MTA) phosphorylase from promastigote of Leishmania donovani. Purine and Pyrimidine Metabolism in Man V, Adv Exp Med Biol. Nyhan, W. L., Thompson, L. F., Watts, R. W. E. 131, Springer US. 559-563 (1986).
- Biastoff, S., Teuber, M., Zhou, Z. S., Dräger, B. Colorimetric activity measurement of a recombinant putrescine N.-methyltransferase from Datura stramonium. Planta Med. 72 (12), 1136-1141 (2006).
- Hendricks, C. L., Ross, J. R., Pichersky, E., Noel, J. P., Zhou, Z. S. An enzyme-coupled colorimetric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 326 (1), 100-105 (2004).
- Cannon, L. M., Butler, F. N., Wan, W., Zhou, Z. S. A stereospecific colorimetric assay for (S.,S.)-adenosylmethionine quantification based on thiopurine methyltransferase-catalyzed thiol methylation. Anal Biochem. 308 (2), 358-363 (2002).
- Hoffman, J. L. Chromatographic analysis of the chiral and covalent instability of S.-adenosyl-L-methionine. Biochemistry. 25 (15), 4444-4449 (1986).
- Wu, S. E., Huskey, W. P., Borchardt, R. T., Schowen, R. L. Chiral instability at sulfur of S.-adenosylmethionine. Biochemistry. 22 (12), 2828-2832 (1983).
- Dorgan, K. M., et al. An enzyme-coupled continuous spectrophotometric assay for S.-adenosylmethionine-dependent methyltransferases. Anal Biochem. 350 (2), 249-255 (2006).



