Summary
在此, 我们报告的合成和结晶的 35-吡啶n-氧化物脱水的一个简单的协议, 不同于经典合成吡啶N氧化物。该协议采用不同的起始材料, 反应时间较少, 产生一种新的溶解超分子结构, 在缓慢蒸发下结晶。
Abstract
合成 35-吡啶n-氧化物脱水, 1, 在 2-氨基吡啶-35 二羧酸的合成路线中实现。落合首次在12小时的过程中使用了非取代吡啶的方法, 但没有获得 X 射线合适的晶体。此处介绍的方法中使用的取代环清楚地影响了将水分子加入不对称单元, 在1中赋予不同的亲核强度。X 射线适当的水晶复合物1是可能的由于消极充电的安定在氧气由二个水分子的存在, 在那里氢原子捐赠正电荷入圆环;这种水分子能很好地构建超分子相互作用。水合分子可能为碱性系统, 通过调整 pH 值达到10。重要的是, 双甲基取代环和反应时间为5小时, 使其成为一个更通用的方法和更广泛的化学应用, 未来的环插入。
Introduction
如今, 全球各地的科学家一直在为芳香族的功能化开发新的合成路线, 这是众所周知的低反应性前添加反应1,2, 3。吡啶, 其中氮原子替代碳原子, 呈现类似的化学反应的模拟环只组成碳原子3, 它通常会经历替代机制, 而不是加法。N-氧化物由在氧原子3上的 nonbonding 电子对的重叠所形成的氮与氧之间存在的供体键的存在而独特。特别地, 吡啶n-氧化物是刘易斯基地, 因为他们的 n-O 基团可能充当电子捐赠者, 并且他们可能结合刘易斯酸形成对应的刘易斯酸基对。这个物产有一个基本的化学后果, 因为它可能增加路易斯酸的 nucleophilicity 对潜在的 electrophiles, 因此允许他们在通常反应不会发生的情况下反应。可能最频繁使用这种化合物是在各种氧化反应, 它们作为氧化剂4。吡啶N-氧化物和它们的许多环功能性衍生物是生物活性和药理作用的经常性分子5, 并建立了一个清晰的空间分布由不同的光谱工具对于其中一些6,7。在研究将不同的基团附着在吡啶环上时, 科学家们测试了各种方法, 以产生一种简单而传统的方法, 因为 isoxazolines 需要催化量的基础, 如 DBU 在沸腾二甲苯形成 6-substituted-2-aminopyridine N-氧化物8,9。在 CH2Cl2/CH3中, 多种吡啶衍生物转化为相应的N-氧化物, 其催化量为四 (26-diclorophenyl) 卟啉和醋酸铵。CN8,10。其他吡啶被氧化到他们的氧化物使用 H2O2在有催化量的 methyltrioxorhenium8,11, 或由加法多余的 dimethyldioxirane 在 CH2Cl2摄氏0摄氏度, 导致相应的N氧化物8,12,13,14。双 (三甲基硅) 过氧化物在 trioxorhenium 的存在中, 在 CH2Cl2中, 已用于合成吡啶N-氧化物8,11。此外, 还报告了用卡萝酸 (peroxomonosulfuric 酸) 合成氨基吡啶N氧化物的情况8。然而, 这里报告的方法, 以及使用落合1报告的方法的一部分, 提供了非常好的结果, 使用更便宜和容易接近的试剂, H 2 O 2 和冰川乙酸.这种做法更适合用于大型制剂, 对叔胺, 它产生良好的产量, 在一个反应, 只需要30% 过氧化氢和冰川乙酸在70-80 摄氏度之间的温度, 并使用净化过程这是可利用的在多数综合实验室例如蒸馏, 不用催化剂或更昂贵的试剂1。文献报道, 其他方法也经常涉及时间框架从10-24 小时和温度在100°c 4,8, 并且清楚地被形成的水晶的屈服为 x 射线分析很少报告。
被动, 各种n-氧化物衍生物用于充分激活吡啶环, 无论是亲核或亲方式。亲核或亲因子受取代基的影响。随着吡啶环为电子提取基团, 主要因子为亲核特征1。自由的N氧化物化合物很少被隔绝作为适当的水晶为 x-射线分析由于移位充电在芳香圆环。然而, 溶剂化因子对于稳定氧的负密度15至关重要。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. 反应
- 在通风罩中放置一个打开的圆形100毫升瓶与0.5 摩尔 (29.8 毫升) 的冰川醋酸和添加0.051 摩尔 (5.82 毫升) 35-吡啶和5毫升的 H2O2 (35%)。保持混合反应在恒定的磁性搅拌下, 在内部温度为80°c 为5小时。
- 在反应时间以后, 冷却烧瓶到24°c 与冰 (不暴露乙酸气体到冰), 并且插入它到一个高真空蒸馏单位为90-120 分钟去除多余的乙酸。
注意: 不要使用热材料。等待, 直到玻璃器皿达到可控温度。这也将避免蒸汽进入蒸馏装置的顶部。 - 添加蒸馏水 (10 毫升) 两次, 以确保去除任何醋酸的痕迹, 并尽可能集中的混合物。
2. 碱度调整和提取
- 溶解在双馏分水隔离的粘性和透明的产品, 并使用电位器调整 pH 值为 10, 纯固态 Na2CO3。
- 小心地放置在一个250毫升分离漏斗的解决方案, 并提取它5倍250毫升的 CHCl3 , 以提高产量。恢复有机层并将其干燥到固态 Na2, 因此4的最大值为30分钟, 其中将包含产品。如有必要, 请用所需量的 CHCl3重新提取水相。
警告: CHCl3可能导致嗜睡和头晕;小心处理, 并在通风罩内。 - 用高真空蒸馏装置去除减压液中的溶剂, 直至形成一种非常吸湿的透明米色结晶粉末 (70%)。
3. 结晶过程
- 在50毫升的冷高液相色谱 (HPLC) 二乙基醚中溶解4.3 克的结晶粉末。真空过滤器的解决方案, 以消除任何痕迹的固体起动材料甚至灰尘。将滤液倒入玻璃培养皿中, 使其在实验室冰箱中缓慢蒸发4摄氏度。
- 确保两天后, 透明无色晶体得到。然后测量熔点, 它应该在 310-311 K 的范围内。
4. 35-吡啶n-氧化物脱水的分析
- 通过迁从烧瓶的墙壁中取出形成的、呈棱镜形状和无色的晶体, 进一步进行 X 射线分析。如果不立即使用, 保持晶体在乙醚, 以避免晶体水化。
- 在0.4 毫升 CDCl3中溶解0.010 克的 35-吡啶n-氧化物脱水, 执行核磁共振 H1和 C13分析以证明该过程的有效性。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
该协议实质上是落合技术1的扩展.但是, 较低的温度和更少的时间被应用。这个简单的方法可以用来获得一个多才多艺的配体, 这是一个替代的吡啶N氧化物衍生物。要确认1的形成, 请选择核磁共振1H 和13C 分析, 以测试过程的有效性。
化学位移表明了1的形成。信号在 2.28 ppm (每百万) 对应于二个甲基小组的六等效氢在3和5位置, 感觉磁场以较少比例比永久磁性。有两组 septuplets: 一个属于质子在 c 位置在 7.9, 加倍的大小其他信号在6.9 属于质子在位置 a.图 1显示了由氧原子存在引起的化学位移邦德d 到吡啶环的氮原子。氧气原子是电撤回和更加接近的氢原子对氧气原子 (c 和 a) 显示位移到一个更高的频率比那为甲基氢 (b)。
为核磁共振13C 频谱 (图 2) 绘制了相同的过程, 其中, 更接近碳的信号与氧原子 (C 和 a) 之间显示了其ΔC = 1300 Hz 和δa = 200 Hz 信号之间的频率分离。再次, 甲基碳没有显示任何变化。红外光谱也可以用来看到该方法的成功。
ORTEP 图图 4显示了两个水分子围绕不对称分子的存在。这些分子被认为能稳定 N O 键。在类似的情况下, 它被描述为吡啶N氧化物和相关的芳香氧化物。有一个重要的稳定π型 O→N 后捐赠, 反映在计算的债券顺序高于1和一些电子孤对低于 36。
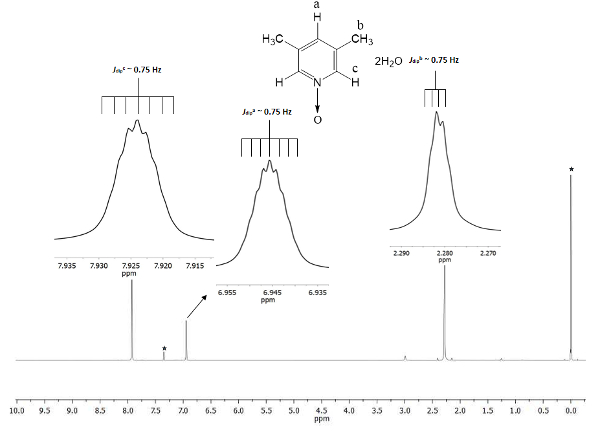
图 1.TMS 引用 CDCl3 500 MHz NMR 1H 频谱 1.三信号的积分和化学位移与三种不同类型的氢原子在 lutine N-氧化物中存在一致。请单击此处查看此图的较大版本.
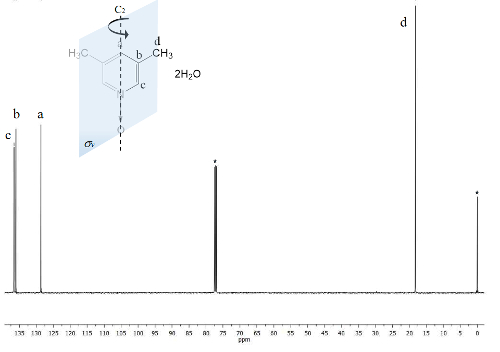
图 2.TMS 引用 CDCl3 100 MHz NMR 13C 频谱 1.三信号被观察为五芳香碳和一个为二个甲基小组。请单击此处查看此图的较大版本.
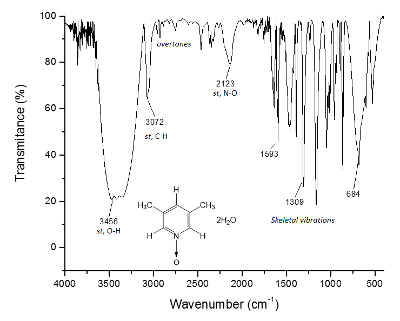
图 3.红外光谱 1.O H 键, 高于 3300 cm-1, 负责超分子结构的形成和晶体的形成。请单击此处查看此图的较大版本.

图 4.ORTEP 图 1, 其中 H2O 的两个分子与吡啶的氧气形成桥梁氢键, 使氢原子向氧原子驱动.这一数字已从美利奴加西亚et . 修改。12请单击此处查看此图的较大版本.

图 5.在二乙基醚 (顶部) 和在露天 (底部), 适当的 X 射线衍射晶体的图片 1.其中一个晶体被证实在 x 射线衍射仪和显示 x 射线衍射路径, 这是中伤和提炼的特殊计算程序在分子和晶体结构24,25, 26,27,28。请单击此处查看此图的较大版本.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
本文提出的协议是将氧原子与 35-吡啶的氮原子相连接的传统方法, 作为基质的功能化方法。这项技术也很好的建立, 以产生 x 射线合适的脱水晶体 (图 5, 拍摄的照片与一个 DSC-HX300 的网络拍摄索尼相机)。就我们而言, 没有多少报告描述了这种晶体的生产16。许多化合物生长理想晶体的 x 射线分析时, 它们是螯合的各种金属17,18,19,20。一旦结晶粉末形成, 重要的是从他们的母亲的酒, 使用北瓶和傅书礼漏斗提取。使用橡胶软管, 北烧瓶连接到一个真空线, 并在它的顶部, 傅书礼漏斗放置与过滤纸。一旦真空打开, 过滤纸就会用少量的溶剂润湿, 而产品结晶。这防止水晶粉末通过真空作用滴入傅书礼漏斗。在过滤纸固定后, 含有结晶粉末的溶液被震动, 以确保所有的结晶粉末被过滤, 并没有残留在瓶底。溶液很快倒在傅书礼漏斗上。所获得的结晶粉末在滤纸上留下约10分钟, 然后真空关闭, 结晶粉末与纸张分离, 储存在不透明的玻璃瓶中, 标有其编码, 保持在4摄氏度, 直到进一步分析。将过滤后的液体倒入玻璃培养皿中, 使其缓慢蒸发4摄氏度, 以改善 X 射线分析中适当晶体的形成。
重要的是注意到, 该协议使用的溶剂和材料, 容易获得, 一般是在任何研究实验室发现。通过添加 Na2CO3和一致的磁搅拌对最终产品的屈服率来说, pH 值的调整是至关重要的。然而, 重要的是要在所有的过程步骤, 特别是在萃取阶段, 在没有起始材料的痕迹必须存在, 以支付晶体粉末的形成和随后的晶体的额外仔细注意。因此, 这种萃取/净化阶段可以通过核磁共振或红外光谱来监测, 以确保产品的质量。
为了保证该协议的重现性, 核磁共振是一个很好的工具。即使是细微的细节也可以在频谱中看到。在图 1中, 所有信号都显示为嵌入。这些镶嵌清晰地描述了所有信号的分裂, 即多重性。例如, 质子 b (Jdipb ~ 0.75 Hz) 显示四峰值在信号的波峰, 与他们之间的分离 (Δ峰值) 的恶心常数 0.0075 ppm。使用以下等式21可以将 0.0075 ppm 转换为能量
 等式1
等式1

由于信号是由甲基基团的三氢核之间的偶极空间相互作用而产生的, 即使它们比4单质子 c 和 a 键更远, 它们也能感知它们的偶极磁动量相互作用22。此外, 在甲基基团中的自由西格玛键合旋转允许超级超精细质子-质子相互作用在信号的多重性中可见。质子 a 和 c 的 septuplets 为6.9 和 7.9 ppm, 分别来源于相同的偶极性质现象。在这些情况下, 质子 a 和 c 可以将甲基基团中的质子区分为相同的旋转动力学。最后, 按照预期, a、b 和 c 的计算出的Jdip的值几乎相同, 即0.75 赫兹。这些相互作用的数量证实了氢核空间安排在整个磁性各向异性。
另一方面, 1的C2v 对称性使等效碳23。13C 频谱 (图 2) 显示了与芳香环相连的甲基基团的典型信号, 碳 d 为 18 ppm。此外, 由于电负元素对碳 a 的影响较小, 在这个区域可以看到 129 ppm 的信号。在高频率信号为更加暴露的炭原子核到磁场在 137 ppm22被提出。
所提出的方法对于合成吡啶 n-氧化物是非常有用的, 在合理的时间内提供良好的产率, 在软反应条件和便宜和容易接近的试剂, 不需要额外的催化剂。这些条件可用于科学和教育界获得广泛的吡啶 n-氧化物作为前体的其他利益分子。适当的方法给学生提供了在教育实验室中获取基本的实验和概念工具的机会, 证明了化合物的成功合成和看到晶体形成的快乐。然而, 重要的是要强调, 像任何化学反应, 有必要采取一切预防措施, 因为通常使用的试剂是危险的。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
所有作者声明没有利益冲突。
Acknowledgments
目前的工作得到了 BUAP、推广科学和项目编号 Vicerrectoría de Investigación y 研究中心 Posgrado 的支持。REOY-NAT14, 15, 16 克 HEAS-NAT17。RMG 感谢 CONACyT (墨西哥) 奖学金417887。
Materials
| Name | Company | Catalog Number | Comments |
| 3,5-lutidine | Sigma-Aldrich | L4206-500ML | |
| Glacial acetic acid | Fermont | 3015 | |
| Hidrogen peroxide (35%) | Sigma-Aldrich | 349887-500ML | |
| Na2CO3 anhydrous | Productos Químicos Monterrey | 1792 | |
| Na2SO4 anhydrous | Alfa reactivos | 25051-C | |
| CHCl3 | Fermont | 6205 | |
| Ethyl eter | Mercury Chemist | QME0309 | |
| Distilled water | Comercializadora Química Poblana | not-existent |
References
- Ochiai, E. Recent Japanese work on the chemistry of pyridine 1-oxide and related compounds. J. Org. Chem. 18 (5), 534-551 (1953).
- Solomons, T. W. G. Organic Chemistry 2nd Edition. , John Wiley & Sons. 1110 (1976).
- Albini, A., Pietra, S. Heterocyclic N-Oxides. , CRC Press. ISBN: 0849345529 328 (1991).
- Koukal, P., Ulc, J., Necas, D., Kotora, Heterocyclic N.-Oxides. Topics in Heterocyclic Chemistry. 53, 29-58 (2017).
- Wen-Man, Z., Jian-Jun, D., Xu, J., Jun, X., Huan-Jian, X. Visible-Light-Induced C2 alkylation of pyridine N.-oxides. J. Org. Chem. 82 (4), 2059-2066 (2017).
- Merino García, M. R., Ríos-Merino, F. J., Bernès, S., Reyes-Ortega, Y. Crystal structure of 3,5-dimethylpyridine N-oxide dihydrate. Acta Cryst. 72 (12), 1687-1690 (2016).
- Sarma, R., Karmakar, A., Baruah, J. B. N-Oxides in Metal-Containing Multicomponent Molecular Complexes. Inorg. Chem. 47 (3), 763-765 (2008).
- Youssif, S. Recent trends in the chemistry of pyridine N-oxides. ARKIVOC. 2001, 242-268 (2001).
- Chucholowski, A. W., Uhlendorf, S. Base catalyzed rearrangement of 5-cyanomethyl-2-isoxazolines; novel pathway for the formation of 2-aminopyridine N-oxides. Tetrahedron Lett. 31 (14), 1949-1952 (1990).
- Thellend, A., Battioni, P., Sanderson, W., Mansuy, D. Oxidation of N-Heterocycles by H2O2 Catalyzed by a Mn-Porphyrin: An Easy Access to N-Oxides Under Mild Conditions. Synthesis. 1997 (12), 1387-1388 (1997).
- Copéret, C., Adolfson, H., Tinh-Alfredo, V. K. h, Yudin, A. K., Sharpless, K. B. A simple and Efficient Method for the Preparation of Pyridine N-Oxides. J. Org. Chem. 63 (5), 1740-1741 (1998).
- Ferrer, M., Sánchez-Baeza, F., Messeguer, A. On the preparation of amine N-oxides by using dioxiranes. Tetrahedron. 53 (46), 15877-15888 (1997).
- Adam, W., Briviba, K., Duschek, F., Golsch, D., Kiefer, W., Sies, H. Formation of singlet oxygen in the deoxygenation of heteroarene N-oxides by dimethyldioxirane. J. Chem. Soc. Chem. Commun. 1995 (18), 1831-1832 (1995).
- Murray, R. W., Singh, M. A Facile One-Step Synthesis of C-Arylnitrones Using Dimethyldioxirane. J.Org.Chem. 55 (9), 2954-2957 (1990).
- Kim, S. W., Um, T., Shin, S. Brønsted acid-catalyzed α-halogenation of ynamides from halogenated solvents and pyridine-N-oxides. Chem. Commun. 53 (18), 2733-2736 (2017).
- Campeau, L., Rousseaux, R., Fagnou, K. A solution to the 2-pyridyl organometallic cross-coupling problem: regioselective catalytic direct arylation of pyridine N-oxides. J. Am. Chem. Soc. 127 (51), 18020-18021 (2005).
- Gang, L., et al. Metal-free methylation of a pyridine N-oxide C-H bond by using peroxides. Org. Biomol. Chem. 13 (46), 11184-11188 (2015).
- May, D., Nyman,, Hampden-Smith, M. J., Duesler, E. N. Synthesis, characterization, and reactivity of group 12 metal thiocarboxylates M(SOCR)2Lut2[M) Cd, Zn; R ) CH3, C(CH3)3; Lut ) 3,5-Dimethylpyridine (Lutidine)]. Inorg. Chem. 36 (10), 2218-2224 (1997).
- Cho, S. H., Hwang, S. J., Chang, S. Palladium-Catalyzed C-H Functionalization of Pyridine N-Oxides: Highly Selective Alkenylation and Direct Arylation with Unactivated Arenes. J. Am. Chem. Soc. 130 (29), 9254-9256 (2008).
- Ide, Y., et al. Spin-crossover between high-spin (S = 5/2) and low-spin (S = 1/2) states in six-coordinate iron(III) porphyrin complexes having two pyridine-N. oxide derivatives. Dalton Trans. 46 (1), 242-249 (2017).
- Drago, R. S. Physical Methods in Chemistry. , Saunders College Publishing USA. 750 (1977).
- Cervantes-Mejía, V., et al. Branched Polyamines Functionalized with Proposed Reaction Pathways Based on 1H-NMR, Atomic Absorption and IR Spectroscopies. American Journal of Analytical Chemistry. 5 (16), 1090-1101 (2014).
- Huheey, J. E., Keiter, E. A., Keiter, R. L. Inorganic Chemistry: Principles of Structure and Reactivity, 4th Edition. , Oxford University Press. Mexico. ISBN: 9706131620 1023 (1997).
- Rigaku, CrysAlisPRO. , (2013).
- Sheldrick, G. M. SHELXT - Integrated space-group and crystal-structure determination. Acta Cryst. 71 (1), 3-8 (2015).
- Sheldrick, G. M. Crystal structure refinement with SHELXL. Acta Cryst. 71 (1), 3-8 (2015).
- Sheldrick, G. M. A short history of SHELX. Acta Cryst. 64 (1), 112-122 (2008).
- Macrae, C. F., et al. Mercury CSD 2.0 - new features for the visualization and investigation of crystal structures. J. Appl. Cryst. 41 (2), 466-470 (2008).
- ChemBioDraw Ultra 13. , PerkinElmer. (2013).



