Summary
Her rapporterer vi syntese og krystallisering av 3,5-lutidine N -oksid mister en enkel protokoll som er forskjellig fra klassisk syntese av pyridine N-oksid. Denne protokollen bruker forskjellige utgangsmaterialet og innebærer mindre reaksjonstid å gi en ny solvated supramolecular struktur, som krystalliseres under langsom fordampning.
Abstract
Syntese av 3,5-lutidine N -oksid tørke, 1, ble oppnådd i syntese ruten 2-amino-pyridine-3,5-dicarboxylic acid. Ochiai først brukt metodene for ikke-substituert pyridines i 1957 i en 12t prosess, men ingen X-ray egnet krystaller ble innhentet. Substituerte ringen brukes i metodikk presenteres her tydelig påvirket tillegg av vannmolekyler i asymmetriske enheten, som gir forskjellig nukleofil styrke i 1. X-ray egnet krystall sammensatte 1 var mulig på grunn av stabilisering av negativ ladning i oksygen av tilstedeværelsen av to vannmolekyler der til hydrogenatomer donere positive ladningen inn i ringen; slike vannmolekyler tjene godt til å konstruere en supramolecular interaksjon. Hydrert molekyler kan være mulig for alkaliske systemet som nås ved å justere pH 10. Viktigere, den doble metyl erstattet ring og en reaksjonstid 5 h, gjør det en mer allsidig metode og med større i kjemiske miljøer for fremtidige ring innsettinger.
Introduction
I dag, forskere over hele verden har vært å investere ressurser i utviklingen av nye syntetiske ruter for functionalization av aromatiske grupper, som er kjent for lav reaktivitet foran til tillegg reaksjoner1,2, 3. Pyridine, der en nitrogen atom erstatter en karbonatom, presenterer en lignende kjemisk reaktivitet til analoge ringer består utelukkende av karbon atomer3, og det gjennomgår vanligvis en substitusjon mekanisme i stedet for tillegg. N-oksider er karakteristiske av tilstedeværelsen av en donor bånd mellom nitrogen og oksygen dannet av overlappingen av nonbonding elektron paret på nitrogen med en tom orbital på oksygen atom3. Spesielt pyridine N-oksider er Lewis baser, fordi deres N-O moiety kan fungere som en elektron-giver, og de kan kombinere med Lewis syrer danner tilsvarende Lewis syre-base parene. Denne egenskapen har en viktig kjemiske konsekvens, fordi det kan øke nucleophilicity av Lewis syrer mot potensielle elektrofiler og dermed tillate dem å reagere under forhold der vanligvis reaksjonen ikke forekommer. Trolig er den mest hyppige bruken av slike stoffer i ulike reaksjoner hvor de fungere som oksidanter4. Pyridine N-oksider og mange av deres ring-functionalized derivater er tilbakevendende molekyler av biologisk aktive og farmakologiske agenter5, og en klar romlige fordelingen av ulike spektroskopiske verktøy har blitt etablert for noen av dem6,7. I forskning på ulike grupper vedlegges pyridine ringen, har forskere testet ulike metoder for å produsere en lett og konvensjonelle metoden, siden isoxazolines krever en katalytisk mengde base som DBU i kokende xylen skjemaet 6- erstattet-2-aminopyridine N-oksider8,9. En rekke pyridine derivater ble omgjort til deres tilsvarende N-nitrogenoksider i nærvær av en katalytisk mengde mangan tetrakis(2,6-diclorophenyl) porphyrin og ammonium acetate på lm2Cl2ugyldig3 CN8,10. Andre pyridines er oksidert til deres oksider bruker H2O2 i nærvær av katalytisk beløp for methyltrioxorhenium8,11, eller tillegg av overflødig dimethyldioxirane i lm2Cl2 ved 0 ° C, noe som fører til tilsvarende N-oksider8,12,13,14. BIS (trimethylsilyl) peroxide i nærvær av trioxorhenium i lm2Cl2 er brukt for syntese av pyridine N-oksider8,11. Syntese av aminopyridine N-oksider som involverer acylation bruker Caros syre (peroxomonosulfuric acid) har også vært rapportert8. Likevel gir metodikken rapporterte her, og som bruker en del av metodikken rapportert av Ochiai1, svært gode resultater med bruk av billigere og tilgjengelig reagenser, H2O2 og iseddik. Denne praksisen er mer egnet for bruk i stor skala preparater som fungerer på tertiær aminer, det gir god avkastning i en reaksjon som krever bare 30% hydrogenperoksid og iseddik i en temperatur mellom 70-80 ° C og den bruker en renselsesprosess som er tilgjengelig i de fleste syntese laboratorier som destillasjon, uten bruk av katalysator eller dyrere reagenser1. Litteraturen rapporterer at andre metoder også ofte innebære tidsrammer fra 10-24 h og temperaturer over 100 ° C 4,8, og avkastningen av velformet krystaller for X-ray analyser er sjelden rapportert.
Reaktivt, brukes ulike N -oksid derivater til å aktivere tilstrekkelig lutidine ringen, på enten nukleofil eller Elektrofil måte. Nukleofil eller Elektrofil faktoren er påvirket av substituents. Med pyridine ringen blir uttak av elektron gruppene, er den viktigste faktoren i nukleofil karakteristiske1. Gratis N-oksid forbindelser er sjelden isolert som passer krystaller for X-ray analyse på grunn av delocalized tillegget i den aromatiske ringen. Men er solvation faktor avgjørende for å stabilisere negative tettheten av oksygen15.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. reaksjon
- Plasser i avtrekksvifte en åpnet rundt 100 mL flasken 0,5 mol (29.8 mL) iseddik og legge 0.051 mol (5.82 mL) 3,5-dimethylpyridine og 5 mL av H2O2 (35%). Hold blanding reaksjonen under konstant magnetic røre, på en indre temperatur på 80 ° C i 5 h.
- Etter reaksjonstid, kule kolbe 24 ° c med is (gjør ikke utsett av eddiksyre klimagasser på isen), og koble den til en høy vakuumdestillasjon enhet i 90-120 minutter å fjerne overflødig eddiksyre.
Advarsel: Ikke bruk varmt stoff. Vent til glass når en håndterlig temperatur. Dette vil også unngå damp inn toppen av destillasjon. - Legge til destillert vann (10 mL) to ganger for å sikre at fjerning av noen spor av eddiksyre og å satse blandingen mye som mulig.
2. basicity justering og utvinning
- Oppløse i bi-distillated vann isolert tyktflytende og gjennomsiktig produktet og bruke et potensiometer for å justere pH 10 med ren solid Na2CO3.
- Sett nøye løsningen i 250 mL separasjon trakt og ekstra det 5 ganger med 250 mL CHCl3 for å forbedre avkastningen. Gjenopprette organisk laget og tørk den over solid Na2så4 i 30 min maksimum som inneholder produktet. Om nødvendig Pakk den vandige fasen med ønsket mengde CHCl3.
Forsiktig: CHCl3 kan forårsake døsighet og svimmelhet; behandle med omsorg og i avtrekksvifte. - Fjerne løsemiddelet under redusert trykk med en høy vakuumdestillasjon enhet, til dannelsen av en meget hygroskopisk klart beige pulver (70%).
3.-krystallisering prosess
- Oppløse 4,3 g av pulveret i 50 mL kaldt høy utføres flytende kromatografi (HPLC) klasse diethyl Ether. Vakuum filtrere løsningen å fjerne alle spor av solid start materiale eller med støv. Hell filtratet i et glass Petriskål, la det til å sakte fordampe på 4 ° C i laboratoriet kjøleskap.
- At etter to dager, klart fargeløs krystaller hentes. Deretter måle Smeltepunkt, som bør være i størrelsesorden 310-311 K.
4. analyse av 3,5-Lutidine N -oksid Dehydrate
- Fjerne krystaller som er dannet, prismatiske figur og fargeløs, av decantation fra kolbes vegger for videre X-ray analyse. Hvis ikke brukt, holde krystaller i diethyl Eter å unngå krystall hydration.
- Oppløse 0.010 g 3,5-lutidine N -oksid tørke i 0,4 mL CDCl3 utføre NMR H1 og C13 analyse for å bevise effektiviteten til prosedyren.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Protokollen er i hovedsak en forlengelse av Ochiais teknikk1. Lavere temperatur, og mindre tid brukes. Denne enkle metoden kan brukes til å få en allsidig ligand, som er en substituerte pyridine N-og derivate. For å bekrefte dannelsen av 1, er NMR 1H og 13C analyse foretrukket å teste effektiviteten av prosedyren.
Kjemisk skiftet viser dannelsen av 1. Signalet på 2.28 ppm (parts per million) tilsvarer de seks tilsvarende bygget to metyl gruppene i de 3 og 5 stillingene, som oppfatter det magnetiske feltet mindre andel enn permanent magnetisk. Det er to sett med septuplets: en tilhører proton i c posisjon på 7.9, hvilke dobler størrelsen på andre signalet på 6,9 som tilhører proton i posisjon a. figur 1 viser den kjemiske Skift provosert av tilstedeværelsen av oksygen atom bonde d til nitrogen atom pyridine ringen. Oksygenatom er elektro-uttak og nærmere hydrogenatomer å oksygenatom (c og a) Vis forskyvning til en høyere frekvens enn for den metyl bygget (b).
Den samme prosessen er plottet for NMR 13C spekteret, figur 2, hvor signalene for nærmere karbonatomer å oksygenatom (c og) viser frekvensen separasjon mellom signalene Δc = 1300 Hz og Δen = 200 Hz. Igjen, Vis metyl karbonatomer ikke endringer. IR spekteret kan brukes til å se effekten av metoden også.
ORTEP diagrammet, Figur 4, viser tilstedeværelse av to molekyler rundt asymmetrisk molekylet. Disse molekylene antas å stabilisere N-O bånd. Liknende saker, den har blitt beskrevet for pyridine N-oksid og relaterte aromatiske oksider. Det er en betydelig stabilisere π-type O→N tilbake-donasjon, gjenspeiles i en beregnet bond for høyere enn 1 og et antall elektron enslig par på O atom lavere enn 36.
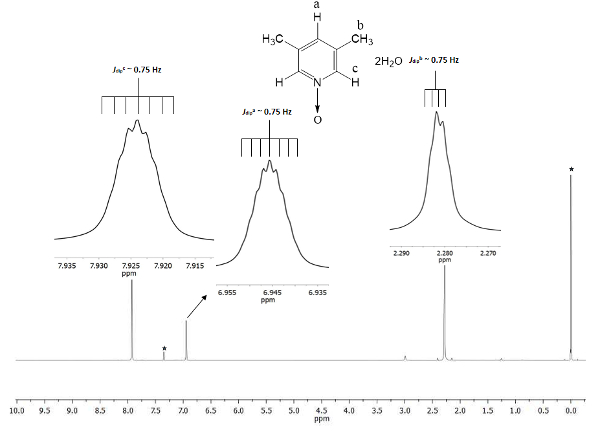
Figur 1 . TMS refererte CDCl3 500 MHz NMR 1H spekteret av 1. Integrasjoner og kjemiske Skift tre signaler enig med tre typer hydrogenatomer i lutine N-oksid. Klikk her for å se en større versjon av dette tallet.
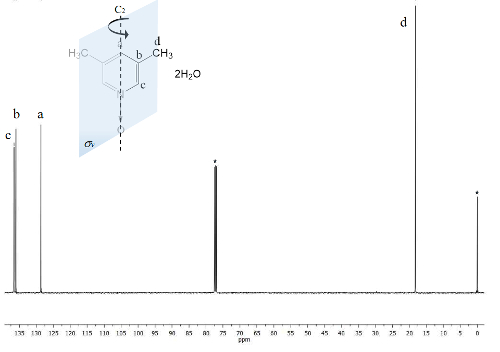
Figur 2 . TMS refererte CDCl3 100 MHz NMR 13C spekteret av 1. Tre signaler er observert for de fem aromatiske karbonatomer og én for de to metyl-gruppene. Klikk her for å se en større versjon av dette tallet.
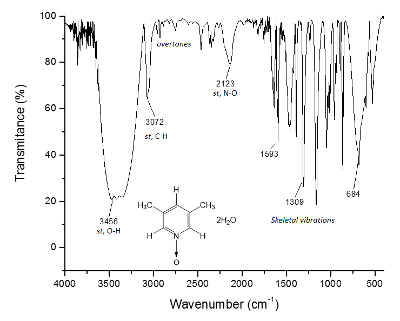
Figur 3 . IR spekteret av 1. O-H obligasjoner, over 3300 cm-1, er ansvarlig for supramolecular struktur dannelse og krystall-formasjonen. Klikk her for å se en større versjon av dette tallet.

Figur 4 . ORTEP diagram av 1 der to molekyler av H2O former bro hydrogenbindinger med lutidine's oksygen, kjøre deres hydrogenatomer mot oksygenatom. Dette tallet har blitt endret fra Merino García et al. 12 Klikk her for å se en større versjon av dette tallet.

Figur 5 . Bilder av egnet X-ray Diffraksjon krystaller av 1 i diethyl Eter (øverst) og friluft (nederst). En av disse krystallene ble bekreftet i X-ray diffractometer og viste en Diffraksjon sti av X-ray, som var traduced og raffinert av spesielle beregningsorientert programmer i en molekylære og krystallinsk struktur24,25, 26,27,28. Klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Protokollen presenteres her er en tradisjonell metoden koble oksygenatom til nitrogen atom av 3,5-lutidine som functionalization underlag. Denne teknikken er også godt etablert å gi X-ray egnet dehydrert krystaller (figur 5, bilder tatt med et Sony DSC-HX300 Cyber-shot-kamera). Så vidt vi er bekymret, har ikke mange rapporter beskrevet produksjonen av slike krystaller16. Mange forbindelser vokse ideelle krystaller for X-ray analyse når de er chelated av ulike metaller17,18,19,20. Når pulveret er dannet, er det viktig å trekke den fra sin mor brennevin ved hjelp av en Kitasato kolbe og Buchner trakt. Bruke gummi slanger, Kitasato kolbe er koblet til en vakuum linje og på toppen av det plasseres Buchner trakten med filter papir. Når vakuum er aktivert, er filter papir fuktet med en liten mengde løsemiddel som produktet krystallisert. Dette hindrer at pulveret sildret inn Buchner trakten av vakuum effekten. Etter at filter papir, er løsningen som inneholder pulveret rystet for å sikre at alle pulveret er filtrert, og ingen forblir i bunnen av flasken. Løsningen er raskt strømmet over Buchner trakten. Pulveret innhentet er igjen i ca 10 min på filter papir, vakuum er deaktivert og pulveret er løsrevet fra papiret og lagret i en ugjennomsiktig hetteglass, merket med koden og holdt på 4 ° C til videre analyse. Filtrert væske helles i et glass Petriskål, la det til sakte fordampning på 4 ° C å forbedre dannelsen av tilstrekkelig krystaller for X-ray analyse.
Det er viktig å legge merke til at denne protokollen bruker løsemidler og materialer som er lett skaffes og vanligvis finnes i et forskningslaboratorium. PH justering med tillegg av Na2CO3 og konsekvent magnetiske omrøring er kritiske til avkastningen av det endelige produktet. Det er imidlertid viktig å betale ekstra forsiktig oppmerksomhet i alle trinnene i prosessen, spesielt i utvinning scenen der ingen spor av starter materiale må finnes råd til dannelsen av pulver og krystaller. Dermed kan dette utvinning/rensing stadiet overvåkes av NMR eller IR spektroskopi å sikre kvaliteten på produktet.
For å sikre reproduserbarhet i denne protokollen, er NMR et utmerket verktøy. Selv fine detaljer vises i spekteret. Alle signaler vises som insets i figur 1. Disse insets viser tydelig en splitt, nemlig mangfold, alle signaler. For eksempel protoner b (Jdukkertb ~ 0,75 Hz) viser fire topper på toppen av signalet, med et skille mellom dem (Δtopp-peak) kvalm konstant av ~ 0.0075 ppm. 0.0075 ppm kan omdannes til energi ved hjelp av følgende ligning21
 Formel 1
Formel 1

Transformasjonen anbefales fordi signalene unfolding kommer fra dipolar romlige samspillet mellom tre bygget kjerner av gruppen metyl, og selv om de er lenger enn 4 single båndene med protoner c og en, de er i stand til å oppfatte deres dipolar magnetisk momentum interaksjoner22. I tillegg gir gratis sigma liming rotasjon i gruppen metyl super hyperfine proton-proton samspillet skal være synlig i mangfoldet av signalet. Septuplets av protoner en og c på 6,9 og 7.9 ppm, henholdsvis er avledet fra samme dipolar naturfenomenet. I disse tilfellene, protoner en og c kan skille protoner i gruppen metyl for samme rotasjon dynamisk. Sist, som forventet, beregnet Jdukkert for a, b og c har knapt samme verdi, ~ 0,75 Hz. Disse antallene for samhandlingene bekrefte hydrogen kjerner romlige ordningen i den magnetiske anisotropy.
På den annen side, gjør C2v symmetri 1 tilsvarende karbonatomer23. 13C spekteret, figur 2, viser typisk signalet for metylgrupper knyttet til aromatiske ringer, karbonatomer d på 18 ppm. Videre et signal på 129 ppm er synlig på dette området på grunn av mindre electronegative element påvirket karbon en. Ved høye frekvenser presenteres signalet for mer utsatt karbonatomer kjerner til magnetfeltet på 137 ppm22.
Presentert metodikken er svært nyttig for syntese av pyridine N-oksider, gi god avkastning, i en rimelig tid med myk reaksjonen forhold og billig og lett tilgjengelig reagenser, som ikke krever ekstra katalysatorer. Disse forholdene kan brukes for vitenskapelig og pedagogisk samfunnet for å få et bredt spekter av pyridines N-oksider som forløpere for andre molekyler av interesse. Egnet metodikken gir muligheten til å tilegne seg grunnleggende eksperimentelle og konseptuelle verktøy i pedagogisk laboratorier for studenter, beviser en vellykket syntese av forbindelser og lykke å se dannelse av krystaller. Det er imidlertid viktig å understreke at som noen kjemisk reaksjon, er det nødvendig å ta alle forholdsregler siden generelt reagensene brukes er farlig.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Alle forfattere erklære noen interessekonflikt.
Acknowledgments
Dette arbeidet har blitt støttet av Vicerrectoría de Investigación y Estudios de Posgrado fra BUAP, L'Auditori of Science og prosjekter nr. REOY-NAT14, 15, 16-G. HEAS-NAT17. RMG Takk CONACyT (Mexico) for stipend 417887.
Materials
| Name | Company | Catalog Number | Comments |
| 3,5-lutidine | Sigma-Aldrich | L4206-500ML | |
| Glacial acetic acid | Fermont | 3015 | |
| Hidrogen peroxide (35%) | Sigma-Aldrich | 349887-500ML | |
| Na2CO3 anhydrous | Productos Químicos Monterrey | 1792 | |
| Na2SO4 anhydrous | Alfa reactivos | 25051-C | |
| CHCl3 | Fermont | 6205 | |
| Ethyl eter | Mercury Chemist | QME0309 | |
| Distilled water | Comercializadora Química Poblana | not-existent |
References
- Ochiai, E. Recent Japanese work on the chemistry of pyridine 1-oxide and related compounds. J. Org. Chem. 18 (5), 534-551 (1953).
- Solomons, T. W. G. Organic Chemistry 2nd Edition. , John Wiley & Sons. 1110 (1976).
- Albini, A., Pietra, S. Heterocyclic N-Oxides. , CRC Press. ISBN: 0849345529 328 (1991).
- Koukal, P., Ulc, J., Necas, D., Kotora, Heterocyclic N.-Oxides. Topics in Heterocyclic Chemistry. 53, 29-58 (2017).
- Wen-Man, Z., Jian-Jun, D., Xu, J., Jun, X., Huan-Jian, X. Visible-Light-Induced C2 alkylation of pyridine N.-oxides. J. Org. Chem. 82 (4), 2059-2066 (2017).
- Merino García, M. R., Ríos-Merino, F. J., Bernès, S., Reyes-Ortega, Y. Crystal structure of 3,5-dimethylpyridine N-oxide dihydrate. Acta Cryst. 72 (12), 1687-1690 (2016).
- Sarma, R., Karmakar, A., Baruah, J. B. N-Oxides in Metal-Containing Multicomponent Molecular Complexes. Inorg. Chem. 47 (3), 763-765 (2008).
- Youssif, S. Recent trends in the chemistry of pyridine N-oxides. ARKIVOC. 2001, 242-268 (2001).
- Chucholowski, A. W., Uhlendorf, S. Base catalyzed rearrangement of 5-cyanomethyl-2-isoxazolines; novel pathway for the formation of 2-aminopyridine N-oxides. Tetrahedron Lett. 31 (14), 1949-1952 (1990).
- Thellend, A., Battioni, P., Sanderson, W., Mansuy, D. Oxidation of N-Heterocycles by H2O2 Catalyzed by a Mn-Porphyrin: An Easy Access to N-Oxides Under Mild Conditions. Synthesis. 1997 (12), 1387-1388 (1997).
- Copéret, C., Adolfson, H., Tinh-Alfredo, V. K. h, Yudin, A. K., Sharpless, K. B. A simple and Efficient Method for the Preparation of Pyridine N-Oxides. J. Org. Chem. 63 (5), 1740-1741 (1998).
- Ferrer, M., Sánchez-Baeza, F., Messeguer, A. On the preparation of amine N-oxides by using dioxiranes. Tetrahedron. 53 (46), 15877-15888 (1997).
- Adam, W., Briviba, K., Duschek, F., Golsch, D., Kiefer, W., Sies, H. Formation of singlet oxygen in the deoxygenation of heteroarene N-oxides by dimethyldioxirane. J. Chem. Soc. Chem. Commun. 1995 (18), 1831-1832 (1995).
- Murray, R. W., Singh, M. A Facile One-Step Synthesis of C-Arylnitrones Using Dimethyldioxirane. J.Org.Chem. 55 (9), 2954-2957 (1990).
- Kim, S. W., Um, T., Shin, S. Brønsted acid-catalyzed α-halogenation of ynamides from halogenated solvents and pyridine-N-oxides. Chem. Commun. 53 (18), 2733-2736 (2017).
- Campeau, L., Rousseaux, R., Fagnou, K. A solution to the 2-pyridyl organometallic cross-coupling problem: regioselective catalytic direct arylation of pyridine N-oxides. J. Am. Chem. Soc. 127 (51), 18020-18021 (2005).
- Gang, L., et al. Metal-free methylation of a pyridine N-oxide C-H bond by using peroxides. Org. Biomol. Chem. 13 (46), 11184-11188 (2015).
- May, D., Nyman,, Hampden-Smith, M. J., Duesler, E. N. Synthesis, characterization, and reactivity of group 12 metal thiocarboxylates M(SOCR)2Lut2[M) Cd, Zn; R ) CH3, C(CH3)3; Lut ) 3,5-Dimethylpyridine (Lutidine)]. Inorg. Chem. 36 (10), 2218-2224 (1997).
- Cho, S. H., Hwang, S. J., Chang, S. Palladium-Catalyzed C-H Functionalization of Pyridine N-Oxides: Highly Selective Alkenylation and Direct Arylation with Unactivated Arenes. J. Am. Chem. Soc. 130 (29), 9254-9256 (2008).
- Ide, Y., et al. Spin-crossover between high-spin (S = 5/2) and low-spin (S = 1/2) states in six-coordinate iron(III) porphyrin complexes having two pyridine-N. oxide derivatives. Dalton Trans. 46 (1), 242-249 (2017).
- Drago, R. S. Physical Methods in Chemistry. , Saunders College Publishing USA. 750 (1977).
- Cervantes-Mejía, V., et al. Branched Polyamines Functionalized with Proposed Reaction Pathways Based on 1H-NMR, Atomic Absorption and IR Spectroscopies. American Journal of Analytical Chemistry. 5 (16), 1090-1101 (2014).
- Huheey, J. E., Keiter, E. A., Keiter, R. L. Inorganic Chemistry: Principles of Structure and Reactivity, 4th Edition. , Oxford University Press. Mexico. ISBN: 9706131620 1023 (1997).
- Rigaku, CrysAlisPRO. , (2013).
- Sheldrick, G. M. SHELXT - Integrated space-group and crystal-structure determination. Acta Cryst. 71 (1), 3-8 (2015).
- Sheldrick, G. M. Crystal structure refinement with SHELXL. Acta Cryst. 71 (1), 3-8 (2015).
- Sheldrick, G. M. A short history of SHELX. Acta Cryst. 64 (1), 112-122 (2008).
- Macrae, C. F., et al. Mercury CSD 2.0 - new features for the visualization and investigation of crystal structures. J. Appl. Cryst. 41 (2), 466-470 (2008).
- ChemBioDraw Ultra 13. , PerkinElmer. (2013).



