Summary
מוצג כאן הוא פרוטוקול של תא בודד, מיקרוסקופ מבוססי הטכניקה המבוססת לכמת שיעורי המרעה באיקריוטיס טורף מימיים עם דיוק גבוהה ורזולוציה מטקמי.
Abstract
להבהיר אינטראקציות הזנה, כגון מקדם והשפעותיו, היא משימה תכופה לחוקרים רבים באקולוגיה. למחקר של קהילות מיקרוביאלית יש מגבלות רבות, וקביעת שיעורי טורף, טרף, ושיעור טורף הוא לעתים קרובות קשה. מוצג כאן היא שיטה ממוטבת המבוססת על תוספת של טרף מתויג באמצעות פלואורוסקופים כמו מכשיר מעקב, אשר מאפשר כימות אמין של שיעורי המרעה בבית eukaryotes טורף מימיים והערכה של העברה מזינים לרמות הזנה גבוהות יותר.
Introduction
Heterotrophic prokaryotes הם רכיב ביולוגי מפתח במערכות מימיות וחשבון עבור חלק משמעותי של פלנקטון ביומסה1,2,3. גורמים השולטים השפע שלהם, גיוון, ופעילות הם חיוניים להבנת התפקיד שלהם ברכיבה על אופניים ביוגיאוכימיים (כלומר, גורלם של פחמן אורגני וחומרים מזינים אחרים וזרימת האנרגיה prokaryotes לרמות הזנה גבוהה). פרוטוזוזה מרעה הוא אחד מהגורמים החשובים הללו. בקטונאייבורי של heterotrophic nanoflagellates ו סיליטים מטילה שליטה חזקה מלמעלה למטה על שפע prokaryotic, הקהילה פונקציה, מבנה, גיוון, ואפילו מורפולוגיה סלולרית ושיעור הצמיחה של קבוצות בקטריאלי מסוים4, 5,6. במערכות מסוימות, הפרולנים משמשים כגורם העיקרי לתמותת חיידקים6,7.
הגישה הסטנדרטית המשמשת להערכת פרוטוזומין בקטריה שנהב, אשר כבר בשימוש כבר זמן מה עכשיו, כרוך בשימוש של חיידקים המסומנים באמצעות פלואורוסקופים (FLB) כמו המיקרוסקופ טרף ו אפיפלואורסצנטית. שיעורי ספיגה ספציפיים לתא ניתן לקבוע על ידי כימות מספר חלקיקי טרף שכותרתו בתוך ומזון מאכלים protistan על פני מסלול זמן נבחר8. לגישה זו יש מספר יתרונות. המעקב מתווסף לדגימות טבעיות. של טורף וטרף טבעי יש מניפולציה לדוגמה מינימלית לפני דגירה, מינימום שינוי לדוגמה על ידי מעקב FLB הוסיף, וזמני דגירה קצרים כדי להבטיח תוצאות הקול שהתקבלו תחת התנאים באתרו. לחילופין, בסביבות עם מספרים נמוכים של bacterivorous protists או זואופלנקטון (למשל, מערכות ימיות ימיות), שיעורי היעלמות של FLB שנוספו דגימות בכמויות נמוכות (2%-3% מעקב) ניתן לזהות באמצעות cy, הזרמת לטווח ארוך (12-24 h) . ניסויים בדגירה לאחר מכן, מספרים של FLB בנקודות ההתחלה והסיום (שילוב ההשפעה של כל הbacterivores) הם כימות על ידי הזרמת cy, (לפרטים, ראה פרסום קודם9). עם זאת, פרמטר כזה מייצג רק שיעורי בקטרק שנהב צבורים שאינם ניתנים לייחס ישירות לקבוצות או מינים מסוימים של protistan ו-זואופלנקטון גרזר.
בסך הכל, לכמת את המינים protistan-או מורפולטיפ-שיעורי תמותה חיידקיים ספציפיים בסביבה הימית במדויק עם משמעות אקולוגית יכול להיות מאתגר. חלק מהפרולנים הם גררנים סלקטיבית, והגודל והצורה של התא של מעקב FLB הוסיף עשוי לעוות שיעורי טבעי של טרף בליעה10,11. יתר על כן, פעילות protistan ומטבוליזם הם מאוד רגישים לטמפרטורה12; לכן, את כמות המעקב הוסיף FLB צריך להיות מניפולציות בקפידה עבור כל סוג לדוגמה בודדים (לא רק מבוסס על השפע הטבעי, גודל, מורפולוגיה של חיידקים וסוגים השוררים של bacterivores, אבל גם על הטמפרטורה). רוב המחקרים מתמקדים בפעילות מרעה בתפזורת; עם זאת, בקטיואייבורי של מינים מסוימים protistan לעתים קרובות מחזיקה ערך מידע גבוה הרבה יותר ויכול להיות עדיף. במקרה זה, יש צורך בידע מטקמי של המין הפרוטיסטים המצויים במדגם והבנה של התנהגותם. מכאן, כמויות משמעותיות של זמן ועבודה נדרשים לקבל תוצאות קול על שיעורי מינים ספציפיים של בקטיית שנהב המיוחס לקבוצה מסוימת protistan או מינים.
למרות הקשיים הללו, גישה זו נותרה הכלי המתאים ביותר הזמין כיום להערכת בקטאסטן בקטטיאייבורי בהגדרות טבעיות. המוצג כאן הוא שיטה מקיפה וקלה לביצוע לשימוש ב-FLB כמעקב במחקרים אקולוגים מימיים. כל ההיבטים הבעייתיים של הגישה מוזכרים ומתוארת זרימת עבודה משופרת, עם שני ניסויים מסביבות מנוגדות, כמו גם מינים מנוגדים כדוגמאות.
מקרה המחקר הראשון נערך בסביבה epilimnetic ממאגר המים mesotrophic, ברפובליקה הצ, אשר מראה גרזר ו בקטריאלי מדומה לגופים מים מתוקים ביותר של פני השטח (cf.5,7). מקרה המחקר השני נערך בסביבה ספציפית מאוד בתוך מלכודות של צמח טורף מימיים Reflexa Cularia, אשר מארחת מספרים גבוהים מאוד של שניהם מרעה mixotrophic סיליטים (טטרהימנה קורט) ותאי חיידקים. חישובי שיעורי המרעה הספציפיים לתא ומניות עמידה חיידקית בשני סוגי המדגם מוצגים. לאחר מכן נדון במגוון פירושים אקולוגיים לתוצאות, ודוגמאות למחקרים אפשריים להמשך הטיפול מוצעות בסופו של דבר.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. אוסף דוגמאות
-
אוסף של המים מאגר לדוגמה: המקרה הראשון מחקר (Exp I; הטבעי התחתון באתרו טורף וטרף מערכת שפע)
- לאסוף דגימות מים מהמיקום הרצוי בעומק מתאים. לשמור את הדגימות בקירור מבוקרת טמפרטורה מילא בטמפרטורה באתרו (הימנעות ההלם הטמפרטורה; יש לציין כי שיעורי ספיגת הפרולנים הם תלויי טמפרטורה) במהלך הובלה למעבדה.
הערה: הדגימה שלנו נערכה ב-מזו-eutrophic הקניון בצורת מאגר מטרים (דרום בוהמיה, כרך 34.5 x 106 m3, עומק מקסימלי 43 m, מתכוון זמן השמירה 100 ימים, dimictic). אתר הדגימה נמצא בעומק של 30 מ', קרוב לסכר. דגימה מעורבת בעומק 0.5 מ' נאספה על ידי מדגם 2-l פרידנגר. - המשך לסעיף 1.2 בהקדם האפשרי.
- לאסוף דגימות מים מהמיקום הרצוי בעומק מתאים. לשמור את הדגימות בקירור מבוקרת טמפרטורה מילא בטמפרטורה באתרו (הימנעות ההלם הטמפרטורה; יש לציין כי שיעורי ספיגת הפרולנים הם תלויי טמפרטורה) במהלך הובלה למעבדה.
-
אוסף של נוזל מן המלכודות של reflexa צמחים במעי הקרה והצומח: המקרה השני מחקר (Exp II; מערכת עם טורף וטרף גבוה טורפים, מדגם קטן מאוד)
- לטלטל בעדינות את הצמחים מתחת למים, להסיר ממיכל הטיפוח ולהניח אותם על חומר סופג כדי לקלוט מים עודפים. בהתאם לחוסן של הצמחים והגודל של המלכודות, בחר 8-10 אנשים צמחיים.
- לחלק כל לירות לחלקים שווים בערך על ידי ספירת בלוטות עלים הנושאת איברים השמנה. כל קטע לירות ישמש לאסוף דגימות מעורבות המייצגים צעירים, בגיל העמידה, ומלכודות ישנות.
- הצמד נימי זכוכית דקים ובקבוקון Eppendorf לאיסוף מדגם למשאבת פריסטלטית. המשך להכניס את העצה הקפילר לתוך פתח המלכודת. באמצעות משאבת ואקום, לשאוב את כל הנוזלים מכל מלכודת עד 900 ± 100 μL של נוזל המלכודת נאסף עבור כל קטגוריית גיל מלכודת.
- השתמש בדגימות משנה של מטרילקאט של 200 μL של נוזל המלכודת המאגר עבור ניסויים מרעה באמצעות protistan. עבד אותם מיד כמפורט בסעיף 3. שמור על שאר ± 300 μL של המדגם עבור כל הניתוחים האחרים של רכיבי מיקרוביאלית החיים בנוזל, כמפורט להלן (סעיף 2).
- . המשך מיד לאגף 2
2. קיבוע דגימות שנאספו
- Exp I ו-II: לתקן מים/מלכודת נוזל תת-דגימות עבור ספירת חיידקים (סעיף 4; כ 20 מ"ל ו 0.3 mL, בהתאמה) עם פורמלדהיד עבור לפחות 1 h כדי לקבל את הנפח 2% הסופי: ריכוז נפח בכל מדגם.
הערה: מטפלים בפורמלדהיד באופן בלעדי במכסה המנוע, וחובשים כפפות כל הזמן תוך כדי טיפול בדגימות.
3. סינון לדוגמה
- דילול לדוגמה (Exp I): אין צורך בדילול עבור דגימות המים במאגר. (Exp II): לדלל את דגימת נוזל המלכודת 10x-100x עם מים MQ ללא חלקיקים כדי להשיג הפצה מתאימה של חיידקים היעד על משטחי מסנן לפני הספירה באמצעות מיקרוסקופ אפידלנטית.
- מסנן 1-2 mL (exp I) של המים במאגר או 10-30 μl (exp II) של מדגם תת של נוזל המלכודת עבור ספירת חיידקים אל שחור 0.2 יקרומטר בגודל הנקבוביות מסננים, באמצעות משפך סינון (25 מ"מ קוטר).
- כתם את המסננים עם DAPI (4 ', 6-diamidino-2'-פניינילידול דיהידרוטסטוסטרון, 0.2% ריכוז סופי) עבור 4 דקות.
הערה: הימנע מעור וזיהום משטח העבודה, וללבוש כפפות. - מניחים את המסנן עם חיידקים מרוכזים על טיפת שמן טבילה (עבור מיקרוסקופ פלורסנט) על שקופית מיקרוסקופ. מניחים ירידה בשמן נוסף על מרכז המסנן וכיסוי עם שמיכות, וודא כי השמן מופץ באופן שווה.
- בשלב זה, רצוי לעבד דגימות מיד, או לחלופין, לאחסן אותן במקפיא (20 ° c) במשך מספר שבועות עד לניתוח נוסף.
4. ספירת מספרים בקטריאליים על המסננים
- מקם את השקופית תחת מיקרוסקופ אפיסננטית (עם ערכת הסינון המתאימה ל-fluorochrome DAPI). הצב 10 x 10 לספור הרשת לתוך אחד oculars. הזז את השקופית למיקום אקראי.
- מכמת תאים חיידקיים (כחול פלואורסצנטית) באזור של רשת הספירה (תחת ההגדלה 1000x). בספירות, כלול את התאים החוצים את הקצוות השמאליים והעליונים של רשת הספירה, תוך הכללה של אלה הממוקמים מעבר לקצוות הימניים והתחתונים.
- מעבר למיקום אקראי אחר וספירה חוזרת על לפחות 10-15 רשתות ספירה, בהיקף של 500 תאים שנספרו בסך הכל.
- הקמת פקטור המרה למיקרוסקופ והגדלה מסוימת, בהתבסס על היחס בין השטח של רשת אחת לאזור הסינון האפקטיבי הכולל של המסנן. לאחר מכן, חלק את המספר הכולל של תאים שנספרו לפי מספר הרשתות שנספרו, ומניב מספר ממוצע של חיידקים לכל רשת.
- הכפל את הפרמטר האחרון על-ידי פקטור ההמרה שהוקם ולנרמל את המספר המתקבל לכל mL של מדגם (בהתאם לנפח של מדגם מסונן) כדי לקבל את השפע החיידקי הכולל לכל mL.
5. קביעת שגשוג הפרוטיסטן
- לתקן את מדגימת המים (Exp I) או נוזל המלכודת (Exp II) תת דגימות עם או glutarאלדהיד (1% הריכוז הסופי, מתאים יותר לדגימות עם נוכחות של כלורופיל המכילים חלקיקים להיות מעובד ימים שבועות לאחר קיבעון) או באמצעות טכניקת הדהלמול-תאיוסולפט המצוינת להלן.
הערה: שתי טכניקות השימור מונעות הגנה של החומר הבלוע מן המזון וחללים של פרולנים8. - בנוגע לטכניקת הדמול-תאיוסולפט, הוסף 100 μL/1 μL של הפתרון של Lugol לתוך 20 מ ל/200 μL של נוזל המים/מלכודת מדגם תת-השני (Exp I/Exp II, בהתאמה).
- בצע מיד עם תוספת של 0.5 mL/50 μL של בוראט-באגירה לאחר מכן 20 μL/2 μL של 3% נתרן thiosulphate (Exp I/Exp II, בהתאמה).
הערה: הנתרן האואיוסולפט בצבע הצהוב של Lugol כדי לאפשר התבוננות של תאים תחת המיקרוסקופ epiפלואורסצנטית8. - לסנן נפח ידוע של מדגם (בהתאם למספר היעדים של היעד) אל מסנני פוליקרבונט שחור בגודל הנקבוביות 1 יקרומטר.
- הערכת מספר המינים הפרוסטים היא ספירת לפחות 200 תאים תחת הגדלה 600x באמצעות רשת הספירה (ראה לעיל).
- הפחת את עוצמת הדגימה מתחת לוואקום בתוך משפך הסינון על ידי ואקום נמוך כ-2 מ ל. לאחר מכן, שחררו את הלחץ והוסיפו את ה-DAPI fluorochrome (4, 6-diamidino-2-פניינילידולדיהידרוטסטוסטרון, 0.2% ריכוז סופי) עבור 2 דקות.
6. קביעת מבנה קהילתי של סיליטים בדגימות פלנקטון
הערה: הקהילות בבתי הגידול במים מתוקים מגוונות מאוד14,15,16, 18, והנחישות המיקרוסקופית שלהם מאתגרת. מיון קבוצות הסיליזות לתוך הגילדות הפונקציונלי10,14,16, 17 מאפשר ניתוח מפורט יותר של קבוצות הסיליזות שונות כמו פלאז bacterivores.
- הערכת מבנה הקהילה באמצעות שילוב הפרטים הבאים:
- DAPI-מוכתם דגימות במיקרוסקופיה אפיפלואורסצנטית (כדי להתאים את התאים הסיליפה עם זריחה בהירה של מאקרו-ומיקרו-גרעיני בגדלים שונים ומורפולוגיה) בשילוב עם ספיגה של חיידקים בעלי תווית פלואורוסקופים (FLB8; לקבלת פרטים, ראה להלן), מעקב אחר היכולת של סיליטים להאכיל את החיידקים.
- התבוננות לדוגמה חיה במקרים נבחרים17,19. לפרטים נוספים על הגישות והקריטריונים המשמשים לקיבוץ סיליטים בקטגוריות מטקמיים שונות, ראו פרסומים קודמים16,17.
הערה: מחקרים מצוטטים הצביעו על כך, בין היתר, בין המינים המוגזניים מסטיכוטריצ'יה (genera האלריה ופלאגוריה) ו-Oligotrichia (כלומר rimoסטרובידיום spp.) הם הצרכנים החשובים ביותר בקרב ה bacterioplankton ברוב עצום של בתי המים המתוקים10,17,18.
7. אומדן שיעורי המרעה בסיליף
- חישוב שיעורי ספיגה של סיליטים על חיידקים המבוססים על שינויים במספר הממוצע של מעקב [i.e., FLB8 לכל סיליאט הקשורים לזמן של דגירה (5-15 דקות)] ואת כמות מעקב של flb הוסיף, חשבונאות ביותר עבור 5%-15% של חיידקים סה כ.
- כדי להשוות שיעורי ספיגה בין מינים protistan שונים, לנרמל את שיעורי ספיגה כמו מספר החיידקים לאחד לשעה, עם חישובים המבוססים על זמן הדגירה בפועל ואת החלק של FLB מעקב הוסיף.
הערה: הערכה הכללית של יישום ה-FLB להערכת שיעורי השימוש בדגימות התאים או המינים הספציפיים ביותר בדוגמאות טבעיות מתוארת באיור 1. - הכנת FLB מזנים חיידקיים הילידים לסביבה מים מתוקים8
- בחר גודל מתאים (ממוצע תא נפח = MCV) ו מורפולוגיה של חיידקים, כך שהם ביעילות לחקות את הגדלים אופייני של bacterioplankton/בקטריאלי תאים במערכת הימית נחקר.
הערה: עבור Exp I, תערובת של זנים מבודדים מהמיקום במחקר של הסוג Limnohabitans ו Polynucleobacter נעשה שימוש (כלומר, אופייני, שופע bacterioplankton מאוד באגמים ובריכות)20. לפרטים על מורפולוגיה וגדלים של זנים, ראה פרסומים קודמים3,17,18,21. - הקציר תאים חיידקיים מן התרבות על ידי צנטריפוגה (5,000 x g) עבור 15 דקות בשלב מוקדם נייח ולערבב אותם ביחס מספרי התשואות mcv ± SD של התאים בתערובת המתאים mcv אופייני של חיידקים במיקום שנבחר.
- השהה את כדורי ב-10 מ"ל של תמיסת מלח מוזרמת פוספט (PBS; pH = 9).
- להוסיף 2 מ ג של צבע צהוב ירוק רואה 5-(4, 6-diכלור triazin-2-yl) מאמיללואועין (התחבר, נקשר חלבונים) אל ההשעיה התא במאגר מלוחים פוספט, ו מודרין ב 60 ° c באמבט מים עבור 2 h.
- לאחר הדגירה, צנטריפוגה את התאים למטה, decant פתרון DTAF ולשטוף ו צנטריפוגה 3x עם PBS.
- לאחר השטיפה הסופית, להשעות מחדש את התאים 20 מ ל של מאגר PPi-מלוחים.
- וורטקס הבולם FLB ו הפיפטה 1.5 mL משנת לתוך 2 מ"ל מבחנות הקפאה, ואז לשמור קפוא (ב-20 ° c) במאגר PPi-מלוחים עד השימוש.
- מאגר טרום מסנן PPi-מלוחים באמצעות מסנן פוליקרבונט 0.2 יקרומטר לשימוש בשלב הבא.
- כדי לקבוע ריכוז flb, העברת סדרת מחלקים קטן (בדרך כלל 20-40 μl) ל 2 מ ל של מאגר החלקיקים-sonicate-מלוחים, ללא חלקיק, ולאחר 30 ואט עבור מספר התפרצויות של 2 s, ולסנן אל 0.2 יקרומטר פוליקרבונט שחור מסנן לספירה באמצעות אפיאונטית מיקרוסקופ (1, 000X הגדלה) תחת הגדרות מסנן אופטי עבור DTAF 448 nm/520-540 ננומטר).
- בחר גודל מתאים (ממוצע תא נפח = MCV) ו מורפולוגיה של חיידקים, כך שהם ביעילות לחקות את הגדלים אופייני של bacterioplankton/בקטריאלי תאים במערכת הימית נחקר.
- טכניקת מעקב להערכת בקטקשנהב
- עבור ניסויים המרעה בבתי גידול טבעי פלנקטון, לוותר 300 mL דגימות לתוך היטב שטפה 1 L מבחנות ו דגירה בטמפרטורה באתרו עבור 15 דקות (כדי לאפשר protists כדי להתאושש ההלם טיפול).
- הוסף מכשלי FLB כדי להוות 5%-15% מכלל החיידקים, כאשר הכמויות מתווספות בהתאם לעונה ולטמפרטורת המים.
הערה: יש ספקטרום מאוד רחב, תלוי העונה ב-סיליטה שיעורי ספיגה ספציפיים למספר הזמנות של מספר בסדר גודל (כלומר, מ 101-104 חיידקים בסיליטה-1 לשעה)10,16, 17,18,22,23,24. - בתקופות של התרחשות משופרת של סיליטים עם שיעורי ספיגה גבוהה (בדרך כלל במהלך הקיץ), גם להפעיל דגירה מקבילה עם תוספות FLB נמוך מאוד, מהווים רק 2%-4% של חיידקים סה כ כדי למנוע טעינה מוגזמת של וללא מופרז של וחללים באמצעות מעקב FLB (ראה דוגמאות באיור 2).
- מודטה/פלנקטון דגימות של FLB עבור 5-15 דקות.
- ישנן שתי אפשרויות לקיבוע דגימה כדי למנוע הפחתת החומר הבלוע ממזון וחללים של פרולנים8. סיים את הincubations בתוספת של 1% גלוראלדהיד (הריכוז הסופי המתאים יותר לדגימות עם החלקיקים המכילים כלורופיל, כגון אצות). לחילופין, השתמש 100 μL/10 μL של הפתרון של Lugol לתוך 20 מ ל/200 μL של מים/מלכודת נוזל תת מדגם, ואחריו מיד על ידי תוספת של 0.5 mL/10 μL של בוראט-באגירה ולאחר מכן 200 μL/2 μL של 3% נתרן thiosulphate (Exp I/Exp
- לאחר הוספת הfixative, תן לדגימות לנוח לפחות 1 h בחשיכה ב -4 ° צ' כדי להבטיח שימור מעמיק של תאי סיליאט.
- לקחת הטבעי פלנקטון תת-דגימות מ 4-30 mL/10-30 μL (Exp I/Exp II, בהתאמה; אמצעי האחסון תלוי בשפע סיליאט) ומכתים עם DAPI (ריכוז סופי 0.2% wt/vol; לפרטים, ראה שלב 3.2 לעיל).
- לעבור דרך 1 יקרומטר מסננים שחור ולבדוק באמצעות מיקרוסקופ אפינוליטי כדי לספור סיליטים (600x הגדלה) ולספור את מספר מנותבים flb שבלע (בעיקר בהגדלה של 1000x) כפי שמפורט בפרסומים הקודמים2,17 . בדיקת דגימות בתוך 7 ימים לאחר שימור.
- להערכת סה כ פרוטוזוזן/מינים ספציפיים למרעה, להכפיל את שיעורי ספיגת הממוצע של כל סיליטים, או רק את מינים סיליate כפי שזוהו על ידי שפע באתרו.
- דוגמה לחישוב שיעורי ספיגה לפי תא מתוך נתונים באתרו מתוך מאגר המים המוקצב מתואר כדלקמן:
- נניח כי ריכוז חיידקי הוא 3.55 x 106 חיידקים/ML ו flb מעקב נוסף הוא 0.25 x 106 flb/ml, אשר מניב סכום של 3.8 x 106 חיידקים/ml של חלקיקים בקטריאלי הכולל (חיידקים טבעיים + flb = 100% של חלקיקי טרף) זמין לphagotrophic פרולנים במדגם הטבעי.
הערה: המשדרים FLB הוסיף ובכך מייצגים 6.58% (פרוייקט של 0.25/0.038) של חלקיקים חיידקיים מוחלטים. המספר הממוצע של FLB לכל האלריה הוא 6.2 flb ב 5 דקות incubations. - כדי לנרמל את ספיגת השעות בשעה, השתמש בחישוב הבא: (6.2 x 12)/(6.58/100) = 1131 חיידקים לכל תא אלריה /h.
הערה: לקבלת דוגמאות נוספות של הפצות על שיעורי ספיגת הפרט של האלריה מזוהה תחת טמפרטורות מים משתנה, כמויות (כפרסנט) של מעקב flb נוסף, וזמני דגירה שונים עם flb, ראה איור 3.
- נניח כי ריכוז חיידקי הוא 3.55 x 106 חיידקים/ML ו flb מעקב נוסף הוא 0.25 x 106 flb/ml, אשר מניב סכום של 3.8 x 106 חיידקים/ml של חלקיקים בקטריאלי הכולל (חיידקים טבעיים + flb = 100% של חלקיקי טרף) זמין לphagotrophic פרולנים במדגם הטבעי.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
לדוגמה ניסוי הייתי במאגר המים של העיר התחתית (דרום בוהמיה, CZ), שהוא אתר טבעי עם הטבעי התחתון של טורף באתרו וטרף שפע. הנתונים הנציגים מדווחים על מינים של הזנים הסיליביתייםשל המינים, שהוא גרזר שופע ויעיל של picoplankton (< 2 μm) חלקיקים10,16,17,18 ,22. איור 3 מציג את מספר הקופסא והויקר של מספרי flb לתאים של האלריה מאגר המים המחודש (איור 3א), שהיה מחושב מחדש לשיעורי ספיגה חיידקית בשעה (איור 3ב) זוהו בארבעה ניסויים בודדים שנערכו באפריל, מאי, אוגוסט וספטמבר. היו שונות גבוהה בשיעורי ספיגה סיליטה, שנגרמו ברובו על ידי הבדלי הזמן בטמפרטורת המים.
יש לציין כי הפרמטר Q10 משקף את העובדה שתהליכי החיידקים פועלים כ-2.5 x מהר יותר עם עליית טמפרטורה של 10 ° צ'12, אשר מחזיקה גם עבור שיעורי ספיגת ספיגה על חיידקים. עם הכלל הפיזיולוגי הזה בראש, פרופורציות שונות במידה ניכרת של FLB וזמני הדגירה שימשו עבור עונות שונות (לפרטים, ראה איור 3א). לפיכך, אפקט הטמפרטורה הצפויה היה מפוצה על, וההגדרה הניסיונית הניבה ערכים ממוצעים וחציון ממוטבת של שיעורי ספיגה בין 5-10 FLB לקבלת תא. באופן כללי, כמויות אלה של flb לבלוע הם בקלות קבוצה בת (ראה דוגמאות באיור 2, שתי תמונות שמאל), יצירת הערכות מדויקות של מעקב (בעיקר להיות בין 1-15 flb לכל לאחד) שיעורי ספיגה. עם זאת, בשל מנותב FLB שונה הוסיף (%) ובפעמים שונות של הדגירה לדוגמה את הערכים המוחלט (מבוטא בתור מספר חיידקים שפשף סיליט לשעה) שונה באופן משמעותי (p < 0.01, מבחן קרוקאל-ווליס; ואחריו מבחן מרובה השוואה של דאן, p < 0.05; ראה דוגמאות באיור 3ב) בין הניסויים. הנתונים מדגימים גם שינויים טבעיים טיפוסיים בשיעורי בקטלישנהב מוחלטים באוכלוסיות הפלקטיות של האלריה גרטינולה, עם התאמה קרובה לערכים המורעים והבינוניים (איור 3).
בנוכחות bacterivorous סיליטים יעילים ביותר בדגימות, כגון peritrichous סיליטים, הם יכולים להיות מאוד "מתויג מחדש" על ידי FLB בכמויות מעקב אופייני של 5%-10% של חיידקים סה (ראה צילום צד ימין באיור 2). זה עשוי להגביל בתוקף את הקוונפיקציה מדויקת של FLB בלע. במקרים כאלה, הוא הציע להפעיל incubations מקבילים נוספים עם כמויות נמוכות בלבד של חשבונאות FLB עבור רק 1.5%-3% של חיידקים סה כ. עם זאת, בדרך כלל גם סכומי המעקב, כמו גם זמני הדגירה יכולים להיות מניפולציות כדי למטב את מספר FLB לכל תא (איור 2).
לדוגמה הניסוי II: מוצג הנתונים מתוך מערכת עם טורף גדול וטרף מחולות, שבו רק נפח מדגם קטן מאוד זמין להערכה ניסיונית שיעורי בקטאביום של הקינימנה של הטטריום 25. זהו גרזר בקטריאלי מתון חיים שפע גבוה באופן בלעדי במלכודות של reflexa צמחים אוכלי בשר מטורפים26,27. איור 4 מציג את מגרשים בקופסה ו-הקצעה של מספר flb לתאים של T. מתוך הגדרות ניסוי שונות (איור 4A, B) המחושבים מחדש לתוך שיעורי ספיגת בקטריאלי בשעה (איור 4 C, D) זוהה במלכודות צעירות, בוגרות וישנות. מעניין במלכודות, האוכלוסייה הנושאת כלורפור של ה, הנושאים האלה של החיידק t. התגלתה בשנת, בעוד שapochloric אוכלוסיות של t. שבבים קורט היו מבודדים ממלכודות ומתוחזקים על ההשעיה חיידקי מעורב גדל על גרגרי חיטה באפילה (לפרטים, ראה איור 1 בפרסום קודם26).
האוכלוסיות הנושאות האחרונות חיות במלכודות מוארות באור; לפיכך, הכללוקיים יכול לספק מקור פחמן אורגני נוסף וחמצן למארח הסילימי. אחד ההשערות נבדק היה כי האוכלוסיות apochloric סיליטה שפשף חיידקים מהר משמעותית, כמו החיידקים מייצגים את המקור החלקיקים היחיד של פחמן אורגני זמין לאוכלוסיות מבודדות הגדלים כהה של הסיליטה.
ואכן, אמנם לא היו הבדלים משמעותיים בשיעורי בקטשנהב של החיים הקטנים, הבוגרים והישנים של הreflexa האלה של קולריה (איור 4א, ג), האוכלוסיות הapochloric של T. קורט שריטה חיידקים באופן משמעותי (p < 0.01, מבחן קרוקאל-ווליס; ואחריו מבחן מרובה השוואה של דאן, p < 0.05), כ 3x מהר יותר מאשר הנושאת כchloroplast החיים בגיל צעיר, בוגרת, ומלכודות ישנות (איור 4ג, ד). שימו לב ששוב, הן כמויות המעקב והן בזמני דגירה (איור 4א, ב, למעלה) שונו כדי למטב את מספר flb לכל תא (בדרך כלל בין 1-15), עם ערכים ממוצעים וחציון סביב 5 flb/סיליאט. מספרים אלה הם להבדיל בתוך וללא שואבי מזון וכלי ספירת מעקב מדויקת. עם זאת, מתבטאת במספר מוחלט של חיידקים שריטה לשעה, הapochloric כchloroplast ואוכלוסיות שפשף כ 350 ו 1,000 חיידקים לשעה, בהתאמה. הערכה ניסיונית זו הביאה תובנות חדשות לתכונות המטבולית והפיזיולוגית של שתי אוכלוסיות משנה נפרדות של אותם מינים סיליate החיים תחת אילוצים סביבתיים שונים להפליא25,26, . עשריםואחד
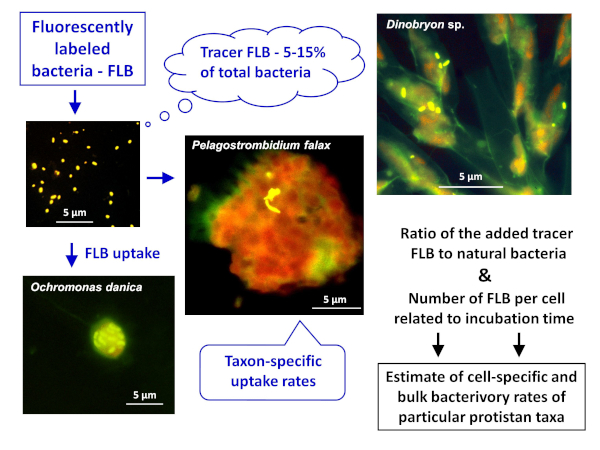
איור 1 : זרימת עבודה של שימוש בחיידקים המסומנים באמצעות פלואורוסקופים (flb) כדי להעריך תא-ומינים-שיעורי המרעה ספציפיים מיחס של FLB מעקב בלע למספר הכולל של חיידקים טבעיים במדגם. לקבלת פרטים נוספים, ראה סעיף 7 של הפרוטוקול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2 : דוגמאות של תאים לסיליטה מפלנקטון של בריכה eutrophic fishpond דוגמאות מוצגים מתוך הבריכה עם מספר flb בתאי סיליאט (בדרך כלל 1-10 flb מעקב לתאים, השמאל שני microphotograps) לעומת peritrichous סיליטה פלובורפורלה סלביניה (הצד הימני מיקרוצילום). גם במהלך תקופה קצרה, 5 דקות דגירה, זה הפך "מתויג מחדש" על ידי FLB מעקב, ביצוע כימות של FLB בלע מדויק או כמעט בלתי אפשרי. במקרה זה, הוא הציע להקטין את כמות המעקב ל-1.5%-3% מכלל החיידקים. עם זאת, בדרך כלל הן סכומי המעקב וזמני הדגירה יכולים להיות מניפולציות כדי למטב את מספר ה-FLB בלע לכל תא. לקבלת פרטים נוספים, ראה סעיף 7 של הפרוטוקול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3 : מספר מספרים של FLB לכל תא של האלריה (הוצאה) ממאגר המים (Exp I) (A), מחשב מחדש את קצב ספיגת החיידקים לשעה (ב). הנתונים זוהו תחת הגדרות עונתיות שונות, המיוצגות על ידי ארבע דוגמאות מאפריל עד ספטמבר. החלק העליון של הפאנל A מציג מידע על טמפרטורת המים, שונים מנותבים FLB שנוספו (%), ובזמנים שונים של דגירה המדגם. יש לציין כי שני הפרמטרים האחרונים ניתן לשנות כדי למטב את מספר ה-FLB לתאים, עם ממוצע (קו מלא) ו חציון (קו מקווקו) ערכים בין 5-10 FLB לביןהתאים (A). הסורגים מציגים את האחוזונים ה -25 ו-75 של כל הנתונים (50-180 תאים שנבדקו) והשפם עומד על אחוזונים הראשון ו-99. (ב) אותיות קטנות שונות מציינות הבדלים משמעותיים בשיעורי בקטולאייבורי ספציפיים לתאים בתקופת המחקר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4 : מספר כתיבה והקצקר של מספרי FLB לכל תא. מגרשים מוצגים על-ידי כלורופלסט הנושא האחרון של יסודות קורט מטריליליציה של צעירים, בוגרים, ומלכודות הישן של הreflexa (Exp II) (A),מחשבמחדש לשיעורי ספיגה חיידקית לשעה (C). הנתונים הושוו לשיעורי ספיגה חיידקיים של אוכלוסיות apochloric כפולות של T. קורט culariae (ב, D) מבודדים ממלכודות אבל מתוחזק על ההשעיה חיידקי מעורב גדל על גרגרי חיטה בחושך. בחלק העליון של לוחות A ו-B, מנותבים FLB שונים נוספו (%) ובזמנים שונים של דגירה מדגם מוצגים. יצוין כי שני הפרמטרים האחרונים שונו כדי למטב את מספר ה-FLB לתאים, עם הממוצע (קו מלא) ו חציון (קו מקווקו) ערכים בין 5-10 FLBלבין התאים (A, B). הסורגים מציגים את האחוזונים ה -5 ו-95th של כל הנתונים (50-100 תאים שנבדקו), והשפם עומד על האחוזונים ה -1 ו-99. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
פענוח הזנה אינטרקציה במערכות מימיות הוא תמיד מאתגר28, במיוחד בסולמות ננו-פלנקטון המעורבים protists והטרף שלהם, חיידקים. כשמדובר מסלולים ספיגה תזונתיים ו כימות, היישום של שיטות בהצלחה בשימוש ברמות הזנה גבוהה יותר הוא פחות אפשרי, בשל המורכבות הגבוהה של אינטראקציות ביוגרפיות. אלה כוללים, לדוגמה, מתקרב לתיוג האיזוטופ היציב. פרוטוקול זה מציג את היתרונות של שימוש במיקרוסקופיה אפיסטנטית וחיידקים המסומנים באמצעות פלואור כנותב כדי לעקוב ולחצי ככמת/להעריך את זרימת הפחמן (טרף חיידקי: מונים protistan וקרי כולל mixotrophic וקרי29) מסלולים דרך בסיס אתרי מזון מיקרוביאלית. יתרון אחד כזה הוא הדיוק הגבוה של הגישה לתא יחיד, והשני הוא החלטה חסרת תקדים לגבי מבנה קהילתי גרזר והבחנה בין גילדות פונקציונלי שונות, מינים (Exp I), ואף תת אוכלוסיות של אותו מינים (Exp II).
שלבים קריטיים בפרוטוקול
ישנם מספר שלבים קריטיים בפרוטוקול, אשר יכולים להבטיח שהיתרונות של המתודולוגיה מנוצלים למלוא הפוטנציאל שלהם. ראשית, הבנה בסיסית של הסביבה הנלמדת לפני תחילת הניסוי מועילה תמיד. זה כולל הקרנה מיקרוסקופית של הגיוון והשפע של הגררנים פוטנציאליים הנוכחי, בגדלים של טרף חיידקי, ואת התפלגות הטרף הן 1) בעמודת המים (למשל, פרופיל אנכי מן האפיליונים להיפולייון) ו 2) במקרה של מאגרי הקניון בצורת הסכר. שנית, מניפולציה זהירה עם דגימות שנאספו תבטיח תוצאות הנציג. הטמפרטורה היא גורם חשוב ביותר המשפיע על רוב התהליכיםהמיקרומיקרוניים 12, כולל שיעורי המרעה הפרוסטים (איור 3).
שלישית, מניפולציה של כמות מעקב הוסיף על בסיס כימות של תאים חיידקיים או סוג של גרזר במדגם יבטיח כי בעיות עם תיוג מעל (איור 2) מסולקים. יש לציין כי יש ספקטרום רחב מאוד של שיעורי ספיגה ספציפיים מינים (לפרטים, ראה שלב 7.2); לפיכך, כדי להחיל את הפרוטוקול כראוי, ידע מראש של מינים הגדול סיליate עם הזמן שלהם שיעורי ספיגה של הקורס הוא חיוני. מומלץ מאוד להריץ ניסויים מוקדמים עם כמויות מעקב שונות כדי למנוע את התיוג האפשרי מתחת לתוויות (כלום או FLB מעט מדי נלקחים לתוך תא בסיליאט, מניב נתונים מבחינה סטטיסטית) או מעל תיוג (מופיע כמספר גדול של FLB יוצרים "לדחוס ענני FLB" או להקות בחללים מזון סיליקות ארוז על ידי המשדרים, ובכך להגביל באופן חמור את הקוונפיקציה המדויקת שלהם; עיין בדוגמה הימנית העליונה באיור 2). יש גם לציין כי זמני דגירה עם FLB הם בדרך כלל קצרים יותר 30 דקות, מאז זמן העיכול הממוצע של picoplankton על ידי סיליטים הוא סביב 1.5 h, והעיכול מתחיל (picoplankton תאים שאכלו מאבד את צורתו וצבעו אופייני) כ לאחר 45-60 מינימום30. באופן דומה, דילול אופטימלי והפצה של דגימות על הפילטר לפני הצפייה מיקרוסקופיים צריך להיות מושגת עבור תוצאות מדויקות.
שינויים ופתרון בעיות
השלבים העיקריים, השינויים האפשריים, ושינויי פתרון בעיות של הטכניקה מומחשים באיור 1 ובאיור 2. בנוסף, יש לציין כי במקרים של ריכוזים גבוהים של חלקיקים שדתל, תאי פיטופלנקטון, או מושבות שלהם בפלנקטון, דוגמאות כאלה 1) צריך להיות מדולל בהתאמה כדי להשיג שלב שבו תאים בודדים גרזר יכול להיות מכובד על משטח מסנן 2) להיות נתון לכמת של תוכן מזון בוולי.
גבלות
המגבלה העיקרית של יישום מוצלח של שיטה זו טמונה בנוכחות של דקטוס אורגני שונים או שופע חלקיקים אורגניים/אורגניים עם חיידקים מצורפים או אגרגטים בכמויות המונעות הצפייה במדגם ברור מתחת אפינטית מיקרוסקופ והערכה מדויקת של סכום מעקב נוסף. יש לציין כי טכניקת המעקב המוצגת פועלת בעיקר עם חיידקים שאינם מחוברים לחלקיקים. עם זאת, בהתבסס על הניסיון שלנו והפניות לספרות (ראה פרסומים קודמים2,4,8,10,16,18,21 ) ,26), המתודולוגיה המוצגת מתאימה לרוב הסביבות הימיות. דוגמאות של שתי מערכות טבעיות, מנוגדים שונות במצב הזנה, תוכן הדסטוס וגיוון גרזר ומספרים מסופקים (איור 3 ואיור 4).
משמעות הגישה ביחס לשיטות הקיימות
חשוב מכך, מן הידע של השפע של טקסון/מטקא של bacterivores ואת המינים שלהם ספציפיים מינים שיעורי בקטיית שנהב, שיעור בקטיישנהב בתפזורת של protistan טקסון (או מכלול סיליate הכולל) ניתן לחשב. אם גישה זו מיושמת בסביבות פלנקטון טבעי במקביל הן לheterotrophic הדגלים והן לסיליטים (המייצגים את הגראזרים העיקריים של bacterioplankton2,6,7), הפרוטיסטן זמן מחזור המושרה של אוכלוסיות בקטריאלי בסביבה נתונה יכול להיות מוערך16,17,18,22. נתונים כאלה מחזיקים בחשיבות יסודית להערכת הדינמיקה של זרימת הפחמן באתרי מזון מיקרוביאלית.
יישומים עתידיים
קיימות סביבות ספציפיות אחרות שבהן שיטה זו, עם כמה שינויים, עשויה לשמש בהצלחה. אלה כוללים מערכות בוצה המופעלות, מערכת אקולוגית, משקעים מימיים, ויפרטרופית בריכות דגים17. עם זאת, היישום בסביבות אלה מזינים-חיידקים עשירים דורש בדיקות ראשוניות כדי לייעל את הפרוטוקול לגבי הגודל הנכון, מורפולוגיה, ומספרים של FLB מעקב שיכול לחקות את התפלגות גודל אופייני ומאפיינים אחרים של בקטריות טרף הטבועות בסביבה.
כיום, יש עניין הולך וגובר בשילוב גישה זו עם הכתבת הזרז תצהיר היברידיזציה באתרו (דג כרטיס), שבו הזהות של תא גרזר (למשל, heterotrophic הדגל) מזוהה עם מסוים דגים-בדיקה ושיעור ספיגת מבוסס על תוכן FLB בתוך ותאי מזון של התא הדגל על שקופית מיקרוסקופית אותו31. מתוחכם, גישה חדשה שנקרא היברידיזציה כפולה32 הוא שילוב של בדיקת דגים ברמות של תא טורף וחיידקים טרף (כי הם גם מסומנים במיוחד על ידי זן פילוגנטי, שושלת היוחסין ספציפי השושלת החוקרת). הגישה היא אלגנטית, אבל גם זמן רב דורש מיומנויות ספציפיות וניסיון31,32, בעוד היישום של שינויים בגישה לספיגת flb שונים ניתן לאמץ בקלות רבה יותר לשימוש שגרתי במעבדות.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
. למחברים אין מה לגלות
Acknowledgments
מחקר זה היה נתמך על ידי קרן המדע הצ תחת מלגת מחקר 13-00243S ו 19-16554S הוענק K. מיס ו-D. S., בהתאמה. מאמר זה נתמך גם על ידי הפרויקט "ביוניפולציה ככלי לשיפור איכות המים של מאגרי סכר" (לא CZ. 02.1.01/0.0/0.0/16_025/0007417), במימון קרן הפיתוח האזורית האירופית, במחקר התוכנית המבצעית, פיתוח והשכלה.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2-µm pore-size filters | SPI supplies, https://www.2spi.com/ | B0225-MB | Black, polycarbonate track etch membrane filters, diameter approprite for filtering apparatus used |
| 5-(4,6-dichlorotriazin-2-yl) aminofluorescein (DTAF) | Any brand | ||
| Automatic pipettes with adjustable volumes | Any brand, various sizes | ||
| Centrifuge | 22 000 x g | ||
| Cryovials | Any brand, 2 mL size | ||
| DAPI (4´,6-Diamidino-2´-phenylindole dihydrochloride) | Any brand | 1 mg ml-1 | |
| Epiflorescence microscope | Magnification from 400 x up to 1000 x | ||
| Filters appropriate for viewing in the DAPI and DTAF range | |||
| Counting grid in one of the oculars | |||
| Filtering apparatus | Usually with a diameter of 25 mm | ||
| Formaldehyde | A brand for microscopy | ||
| Glutaraldehyde | A brand for microscopy | ||
| Immersion oil for microscopy | Specific oil with low fluorescence | ||
| Lugol´s solution | Any brand or see comment | Make an alkaline Lugol' solution as follows: Solution 1 - dissolve 10 g of potassium iodide in 20 ml in MQ water, then add 5 g of iodine. Solution 2 - add 5 g of sodium acetate to 50 ml of MQ water. Add the solution 2 to the solution 1 and thoroughly mix | |
| Methanol stabilized formalin | Any brand available for microscopy purposes | ||
| Microscope slides and cover slips | Any brand produced for microscopy purposes | ||
| MQ water for diluting samples | Any brand |
||
| Phosphate-buffered saline (PBS; pH = 9) | Any brand | 0.05 M Na2HPO4-NaCl solution, adjusted to pH 9 | |
| PPi-saline buffer | Any brand | 0.02 M Na4P2O7-NaCl solution. Add 0.53 g Na4P2O7 to 100 ml of MQ water plus 0.85 g NaCl | |
| Sampling device | Appropriate for obtaining representative sample | e.g. Friedinger sampler for lake plankton | |
| Sodium thiosulfate solution | Any brand | 3% solution is used in the protocol | |
| Sonicator | Any brand | 30 W | |
| Vortex | Any brand allowing thorough mixing of the solutes and samples | ||
| Water bath | Any brand allowing temperature to be maintained at 60 °C |
References
- Azam, F., et al. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series. 10, 257-263 (1983).
- Šimek, K., et al. A finely tuned symphony of factors modulates the microbial food web of a freshwater reservoir in spring. Limnology & Oceanography. 59, 1477-1492 (2014).
- Šimek, K., et al. Bacterial prey food characteristics modulate community growth response of freshwater bacterivorous flagellates. Limnology & Oceanography. 63, 484-502 (2018).
- Šimek, K., et al. Changes in bacterial community composition, dynamics and viral mortality rates associated with enhanced flagellate grazing in a meso-eutrophic reservoir. Applied & Environmental Microbiology. 67, 2723-2733 (2001).
- Jürgens, K., Matz, C. Predation as a shaping force for the phenotypic and genotypic composition of planktonic bacteria. Antonie Van Leeuwenhoek. 81, 413-434 (2002).
- Pernthaler, J. Predation on prokaryotes in the water column and its ecological implications. Nature Reviews Microbiology. 3, 537-546 (2005).
- Berninger, U. B., Finlay, J., Kuuppo-Leinikki, P. Protozoan control of bacterial abundances in freshwaters. Limnology and Oceanography. 36, 139-147 (1991).
- Sherr, E. B., Sherr, B. F. Protistan grazing rates via uptake of fluorescently labeled prey. Handbook of Methods in Aquatic Microbial Ecology. Kemp, P. F., Sherr, B. F., Sherr, E. B., Cole, J. J. , Lewis Publishers. Boca Raton, Florida. 695-701 (1993).
- Vazquez-Dominguez, E., Peters, F., Gasol, J. M., Vaqué, D. Measuring the grazing losses of picoplankton: methodological improvements in the use of fluorescently tracers combined with flow cytometry. Aquatic Microbial Ecology. 20, 119-128 (1999).
- Šimek, K., et al. Ecological role and bacterial grazing of Halteria spp.: Small oligotrichs as dominant pelagic ciliate bacterivores. Aquatic Microbial Ecology. 22, 43-56 (2000).
- Montagnes, D. J. S., et al. Selective feeding behaviour of key free-living protists: avenues for continued study. Aquatic Microbial Ecology. 53, 83-98 (2008).
- Kirchman, D. L. Processes in Microbial Ecology. 2nd Edition. , Oxford University Press. Oxford, UK. (2018).
- Porter, K. G., Feig, Y. S. The use of DAPI for identifying and counting aquatic microflora. Limnology and Oceanography. 25, 943-948 (1980).
- Foissner, W., Berger, H. A user-friendly guide to the ciliates (Protozoa, Ciliophora) commonly used by hydrobiologists as bioindicators in rivers, lakes, and waste waters, with notes on their ecology. Freshwater Biology. 35, 375-482 (1996).
- Foissner, W., Berger, H., Schaumburg, J. Identification and ecology of limnetic plankton ciliates. Informationsberichte des Bayer Landesamtes für Wasserwirtschaft Heft. , 3-99 (1999).
- Šimek, K., et al. Ciliate grazing on picoplankton in a eutrophic reservoir during the summer phytoplankton maximum: a study at the species and community level. Limnology & Oceanography. 40, 1077-1090 (1995).
- Skibbe, O. An improved quantitative protargol stain for ciliates and other planktonic protists. Archiv für. Hydrobiolgie. 130, 339-347 (1994).
- Macek, M., et al. Growth rates of dominant planktonic ciliates in two freshwater bodies of different trophic degree. Journal of Plankton Research. 18, 463-481 (1996).
- Šimek, K., et al. Microbial food webs in hypertrophic fishponds: omnivorous ciliate taxa are major protistan bacterivores. Limnology & Oceanography. , in press (2019).
- Jezbera, J., et al. Major freshwater bacterioplankton groups: Contrasting trends in distribution of Limnohabitans and Polynucleobacter lineages along a pH gradient of 72 habitats. FEMS Microbiology Ecology. 81, 467-479 (2012).
- Kasalický, V., et al. The diversity of the Limnohabitans genus, an important group of freshwater bacterioplankton, by characterization of 35 isolated strains. PLoS One. 8, 58209 (2013).
- Stabell, T. Ciliate bacterivory in epilimnetic waters. Aquatic Microbial Ecology. 10, 265-272 (1996).
- Zingel, P., et al. Ciliates are the dominant grazers on pico- and nanoplankton in a shallow, naturally highly eutrophic lake. Microbial Ecology. 53, 134-142 (2007).
- Bickel, S. L., Tang, K. W., Grossart, H. P. Ciliate epibionts associated with crustacean zooplankton in german lakes: distribution, motility, and bacterivory. Frontiers in Microbiology. 3 (243), (2012).
- Sirová, D., et al. Hunters or gardeners? Linking community structure and function of trap-associated microbes to the nutrient acquisition strategy of a carnivorous plant. Microbiome. 6, 225 (2018).
- Šimek, K., et al. Ecological traits of a zoochlorellae-bearing Tetrahymena sp. (Ciliophora) living in traps of the carnivorous aquatic plant Utricularia reflexa. Journal of Eukaryotic Microbiology. 64, 336-348 (2017).
- Pitsch, G., et al. The green Tetrahymena utriculariae n. sp. (Ciliophora, Oligohymenophorea) with its endosymbiotic algae (Micractinium sp.), living in the feeding traps of a carnivorous aquatic plant. Journal of Eukaryotic Microbiology. 64, 322-335 (2017).
- Nielsen, J. M., Clare, E. L., Hayden, B., Brett, M. T., Kratina, P. Diet tracing in ecology: Method comparison and selection. Methods in Ecology and Evaluation. 9, 278-291 (2018).
- Beisner, B. E., Grossart, H. P., Gasol, J. M. A guide to methods for estimating phago-mixotrophy in nanophytoplankton. Journal of Plankton Research. , 1-13 (2019).
- Dolan, J. D., Šimek, K. Processing of ingested matter in Strombidium sulcatum, a marine ciliate (Oligotrichida). Limnology and Oceanography. 42, 393-397 (1997).
- Massana, R., et al. Grazing rates and functional diversity of uncultured heterotrophic flagellates. The ISME Journal. 3, 588-596 (2009).
- Grujčić, V., et al. Cryptophyta as major freshwater bacterivores in experiments with manipulated bacterial prey. The ISME Journal. 12, 1668-1681 (2018).



