Summary
Præsenteret her er en protokol for en enkelt celle, epifluorescens mikroskopi-baserede teknik til at kvantificere græsnings rater i akvatiske aggressiv eukaryoter med høj præcision og taksonomisk opløsning.
Abstract
Elucidating trofiske interaktioner, såsom prædation og dens virkninger, er en hyppig opgave for mange forskere i økologi. Studiet af mikrobielle samfund har mange begrænsninger, og fastsættelsen af et rovdyr, bytte, og aggressiv satser er ofte vanskeligt. Præsenteret her er en optimeret metode baseret på tilsætning af fluorescently mærket bytte som en Tracer, som giver mulighed for pålidelig kvantitation af græsning satser i akvatiske aggressiv eukaryoter og skøn over overførsel af næringsstoffer til højere trofiske niveauer.
Introduction
Heterotrofisk prokaryoter er en vigtig biologisk komponent i akvatiske systemer og tegner en betydelig del af plankton biomassen1,2,3. Faktorer, der styrer deres overflod, mangfoldighed og aktivitet er afgørende for at forstå deres rolle i biogeokemiske cykling (dvs. skæbne organisk kulstof og andre næringsstoffer og strømmen af energi fra prokaryoter til højere trofiske niveauer). Protozoer græsning er en af disse vigtige faktorer. Bakterien af heterotrofisk nanoflagellater og ciliater pålægger en stærk top-down kontrol over prokaryote tæthed, samfund funktion, struktur, mangfoldighed, og selv cellulære morfologi og vækstrate af bestemte bakterie grupper4, 5,6. I nogle systemer, protister tjene som den vigtigste årsag til bakteriel dødelighed6,7.
Den standardtilgang, der anvendes til at vurdere protozo bakterivory, som har været brugt i nogen tid nu, indebærer brug af fluorescently mærkede bakterier (FLB) som bytte analoger og epifluorescens mikroskopi. Celle specifikke optagelses rater kan bestemmes ved at kvantificere antallet af mærkede bytte partikler i protistan Food vakuoler over et valgt tidsforløb8. Der er flere fordele ved denne fremgangsmåde. Tracer tilsættes til naturlige prøver med naturlige rovdyr og bytte assemblages. Der er minimal prøve manipulation før inkubation, minimal stikprøve ændring af den tilføjede FLB-Tracer, og inkubationstiderne er korte for at sikre sunde resultater opnået under tæt på in situ-betingelser. Alternativt kan der i miljøer med et lavt antal bakteriæske protister eller zooplankton (f. eks. offshore marine systemer) påvises forsvinden af FLB til prøver i lave mængder (2%-3% Tracer) via flowcytometri på lang sigt (12-24 h) inkubations eksperimenter. Derefter kvantificeres antallet af FLB ved start-og slutpunkterne (integrering af virkningen af alle bakteriere) ved strømnings cytometri (Se tidligere publikation9) for yderligere oplysninger. En sådan parameter repræsenterer imidlertid kun samlede aggregerede bakterie rater, som ikke direkte kan henføres til nogen bestemt protistan-og zooplankton-grædende grupper eller arter.
Samlet set kan det være en udfordring at kvantificere de protistan arter-eller morfotype-specifikke bakterie dødelighed i vandmiljøet nøjagtigt og med økologisk betydning. Nogle protister er selektive græsere, og størrelsen og celle formen af den tilføjede FLB Tracer kan forvride naturlige rater af bytte indtagelse10,11. Desuden er protistan aktivitet og metabolisme meget temperaturfølsom12; Derfor skal mængden af tilsat FLB-Tracer omhyggeligt manipuleres for hver enkelt prøvetype (ikke kun baseret på den naturlige overflod, størrelse og morfologi af bakterier og fremherskende typer af bakteriædere, men også på temperatur). De fleste undersøgelser fokuserer på bulk protistan græsning aktivitet; imidlertid har bakterien af specifikke protistan arter ofte en meget højere informationsværdi og kan være at foretrække. I dette tilfælde er der behov for taksonomisk viden om de protist arter, der findes i en prøve, og forståelse af deres opførsel. Derfor er der behov for betydelige mængder tid og arbejdskraft for at opnå solide resultater på artsspecifikke bakterie rater, der kan henføres til en bestemt protistan gruppe eller art.
På trods af disse vanskeligheder er denne fremgangsmåde stadig det mest velegnede værktøj til vurdering af protistan bakterien i naturlige omgivelser. Præsenteret her er en omfattende, nem at følge metode til at bruge FLB som en Tracer i akvatiske mikrobielle økologi undersøgelser. Alle de nævnte problematiske aspekter af tilgangen er tegnede sig for, og en forbedret arbejdsgang er beskrevet, med to eksperimenter fra kontrasterende miljøer samt kontrasterende ciliate arter som eksempler.
Det første casestudie blev udført i et epilimnetisk miljø fra det mesotrofe římov vandreservoir i Tjekkiet, som viser græs og bakterielle mængder, der kan sammenlignes med de fleste overflade ferskvandsområder (jf.5,7). Det andet casestudie blev udført i det meget specifikke miljø inde i fælder af den akvatiske kødædende plante Utricularia reflekxa, som er vært for ekstremt høje antal af både græsnings mixotrofe ciliates (Tetrahymena utriculariae) og bakterieceller. Der vises beregninger af celle specifikke græsnings rater og bakterielle stående bestande i begge prøvetyper. En række økologiske fortolkninger af resultaterne drøftes derefter, og der foreslås endelig eksempler på mulige opfølgende undersøgelser.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. indsamling af prøver
-
Opsamling af reservoir vandprøve: det første casestudie (exp i; lavere naturlige in situ rovdyr og Prey overflod system)
- Saml vandprøver fra det ønskede sted i en passende dybde. Opbevar prøverne i en temperaturkontrolleret køler, der er fyldt ved in situ-temperatur (undgå temperaturchok; det skal bemærkes, at optagelses graden for protisterne er temperaturafhængig) under transporten til laboratoriet.
Bemærk: vores prøveudtagning blev udført i det Meso-eutrophic Canyon-formede Římov reservoir (syd Bøhmen, bind 34,5 x 106 m3, maksimal dybde 43 m, gennemsnitlig retentions tid 100 dage, dimictic). Prøveudtagningsstedet var placeret på en 30 m dybde, tæt på dæmningen. En blandet prøve på en 0,5 m dybde blev indsamlet af en 2-l Friedinger sampler. - Fortsæt til afsnit 1,2 så hurtigt som muligt.
- Saml vandprøver fra det ønskede sted i en passende dybde. Opbevar prøverne i en temperaturkontrolleret køler, der er fyldt ved in situ-temperatur (undgå temperaturchok; det skal bemærkes, at optagelses graden for protisterne er temperaturafhængig) under transporten til laboratoriet.
-
Indsamling af væske fra fælder af kødædende Utricularia reflekxa planter: den anden casestudie (exp II; et system med høj rovdyr og bytte rigeligt, ekstremt lille prøvevolumen)
- Ryst forsigtigt planterne under vandet, Fjern fra dyrknings beholderen, og Placer dem på absorberende materiale for at absorbere overskydende vand. Afhængigt af robustheden af planterne og størrelsen af fælderne, vælge 8-10 plante individer.
- Dividerer hvert skud i omtrent lige store dele ved at tælle blad noder, som bærer fælde fangstorganer. Hver shoot segment vil tjene til at indsamle blandede prøver, der repræsenterer unge, midaldrende, og gamle fælder.
- Fastgør et hætteglas med tyndt glas kapillar og Eppendorf til prøveopsamling til en peristaltisk pumpe. Fortsæt med at indsætte kapillar spidsen i fælde åbningen. Brug vakuumpumpen til at suge al væsken ud af hver fælde, indtil 900 ± 100 μL fælde væske opsamles for hver fælde alderskategori.
- Brug triplicat under prøver på 200 μL af den poolede fælde væske til protistan græsning eksperimenter. Behandle disse straks som beskrevet i afsnit 3. De resterende ± 300 μL af prøven bevares for alle andre analyser af mikrobielle bestanddele, som lever i væsken, som beskrevet nedenfor (punkt 2).
- Fortsæt straks til afsnit 2.
2. fiksering af indsamlede prøver
- Exp I og II: Fix vand/fælde flydende delprøver til bakteriel optælling (afsnit 4, henholdsvis ca. 20 mL og 0,3 mL) med formaldehyd i mindst 1 time for at opnå en 2% slutvolumen: volumenkoncentration i hver prøve.
Bemærk: håndtaget formaldehyd udelukkende i røghætten, og bær handsker på alle tidspunkter, mens du manipulerer prøver.
3. prøve filtrering
- Prøve fortynding (exp I): der er ikke behov for fortynding til vandprøverne i reservoiret. (Exp II): fortyndet fælde væskeprøve 10x-100x med partikel frit MQ vand for at opnå en passende fordeling af målmikrober på filter flader før tælling via epifluorescens mikroskopi.
- Filter 1-2 mL (exp I) af reservoir vandet eller 10-30 μL (exp II) af delprøven af fælde væsken til bakterie tælling på sorte 0,2 μm pore størrelses filtre ved hjælp af en filtrerings tragt (diameter på 25 mm).
- Filtrene med DAPI (4 ', 6-diamidino-2'-phenylindole dihydrochlorid, 0,2% endelig koncentration) i 4 min.
Bemærk: undgå hud-og arbejdsoverflade kontaminering, og bær handsker. - Anbring filteret med koncentrerede mikrober på en dråbe nedsænknings olie (for fluorescerende mikroskopi) på et mikroskop slide. Placer en anden olie dråbe på midten af filteret og dække med en dækseddel, så sørg for, at olien fordeles jævnt.
- På dette tidspunkt, fortrinsvis behandle prøver straks, eller alternativt, opbevare dem i fryseren (-20 °C) i flere uger til måneder, indtil yderligere analyse.
4. optælling af bakterie tal på filtrene
- Placer diaset under epifluorescens mikroskop (med filter sættet svarende til vha dapi). Placer et 10 x 10 tælle gitter i en af okularerne. Flyt diaset til en tilfældig position.
- Kvantificere bakterieceller (blå fluorescens) i området af tælle gitteret (under forstørrelse 1000x). Medtag de celler, der krydser venstre og øverste kant af optællings gitteret, i optællinger, mens du udelader dem, der er placeret over højre og nedre kanter.
- Flyt til en anden tilfældig position, og Gentag optællingen på mindst 10-15 tællings gitre, svarende til 500 celler, som tælles i alt.
- Etablere en omregningsfaktor for et givet mikroskop og forstørrelse, baseret på viden om forholdet mellem arealet af et gitter til det samlede effektive filtreringsområde af filteret. Dividerer derefter det samlede antal celler, som tælles med antallet af tællede gitre, hvilket giver et gennemsnitligt antal bakterier pr. gitter.
- Den sidstnævnte parameter multipliceres med den fastlagte omregningsfaktor og normaliseres det resulterende antal pr. mL af en prøve (afhængigt af mængden af filtreret prøve) for at opnå den totale bakterie forekomst pr. mL.
5. bestemmelse af forekomsten af protistan
- Fastsætte vandprøven (exp I) eller fælde væsken (exp II) under prøverne med enten glutaraldehyd (1% endelig koncentration, mere egnet til prøver med tilstedeværelsen af klorofyl indeholdende partikler, der skal behandles dage til uger efter fiksering) eller ved hjælp af formol-thiosulfate-afoloriserings teknik, der er angivet nedenfor.
Bemærk: begge Konserveringsteknikker forhindrer, at det indtagede materiale udplantes fra madvakuoler af protister8. - Med hensyn til formol-thiosulfate-afoloriserings teknikken tilsættes 100 μL/1 μL Lugol opløsning til 20 mL/200 μL af delprøven vand/fælde væske (henholdsvis exp I/exp II).
- Umiddelbart efter tilsætning af 0,5 mL/50 μL boratbuffered formalin derefter 20 μL/2 μL 3% natriumthiosulfat (henholdsvis exp I/exp II).
Bemærk: natriumthiosulfat decolorizes den gule farve Lugol at muliggøre observation af celler under epifluorescens mikroskop8. - Filtrer en kendt volumen prøve (afhængigt af antallet af målprotister) på 1 μm porestørrelse sort polycarbonat filtre.
- Anslå antallet af protist arter er ved at tælle mindst 200 celler under forstørrelse 600x ved hjælp af tælle gitteret (se ovenfor).
- Prøvens volumen reduceres under et vakuum i filtrerings tragten ved lav vakuum til ca. 2 mL. Slip derefter under trykket og tilsæt dapi vha (4 ', 6-diamidino-2-phenylindole dihydrochlorid13, 0,2% endelig koncentration) i 2 min.
6. bestemmelse af EF-strukturen for ciliater i plankton prøver
Bemærk: ciliate samfund i ferskvandshabitater er meget forskellige14,15,16, 18, og deres mikroskopiske bestemmelse er udfordrende. Sortering af ciliate grupper i funktionelle guilds10,14,16,17 giver mulighed for mere detaljeret analyse af forskellige ciliate grupper som pelagiske bakterier.
- Evaluere ciliate samfund struktur ved at kombinere følgende:
- DAPI-farvede prøver i epifluorescens mikroskopi (for at lokalisere de ciliate celler med lys fluorescens af makro-og mikro-kerner af forskellige størrelser og morfologi) kombineret med optagelsen af fluorescently mærkede bakterier (FLB8; for detaljer, Se nedenfor), spore muligheden for ciliater til foder på bakterier.
- Levende prøve observation i udvalgte tilfælde17,19. For yderligere oplysninger om ovennævnte tilgange og kriterier, der anvendes til gruppering af ciliater i forskellige taksonomiske kategorier, se tidligere publikationer16,17.
Bemærk: de citerede undersøgelser har vist, at blandt ciliater er allestedsnærværende arter fra Stichotrichia (SLA Halteria og Pelagohalteria) og oligotrichia (nemlig rimostrombidium spp.) de vigtigste pelagiske forbrugere af bakterioplankton i langt de fleste ferskvandshabitater10,17,18.
7. estimering af ciliat græsnings rater
- Beregn optagelses raten for ciliater på bakterier baseret på ændringer i det gennemsnitlige antal Tracer [dvs. FLB8 per ciliate relateret til tidspunktet for inkubation (5-15 min)] og Tracer mængden af FLB tilsat, tegner sig højst for 5%-15% af samlede bakterier.
- At sammenligne optagelses rater blandt forskellige protistan arter, normalisere optagelsen satser som antallet af bakterier per ciliate per time, med beregninger baseret på den faktiske inkubationstid og andelen af Tracer FLB tilsat.
NOTE: den almindelige ordning for FLB-metoden til vurdering af både celle-eller artsspecifik og bulk-bakterivory i naturlige prøver er afbildet i figur 1. - Fremstilling af FLB fra bakteriestammer, der er indfødte i et ferskvands miljø8
- Vælg en passende størrelse (middelcellevolumen = MCV) og morfologi af bakterier, så de effektivt efterligner de typiske størrelser af bakterioplankton/bakterieceller i det akvatiske system, der undersøges.
Bemærk: for exp I blev der anvendt en blanding af isolerede stammer fra studiestedet for slægten Limnohabitans og Polynucleobacter (dvs. typisk, meget rigeligt bakterioplankton i søer og damme)20. For detaljer om morfologi og størrelser af stammerne, se tidligere publikationer3,17,18,21. - Høst bakterieceller fra kulturen ved centrifugering (5.000 x g) i 15 min i den tidlige stationære fase og bland dem i et numerisk forhold, der giver MCV ± SD af cellerne i blandingen svarende til den typiske MCV af bakterier på det valgte sted.
- Pillerne suspenderes i 10 mL fosfat-bufferet saltvand (PBS; pH = 9).
- Tilsæt 2 mg gul-grøn fluorescerende farvestof 5-(4, 6-dichlorotriazin-2-yl) aminofluorescein (DTAF, binder til proteiner) til cellesuspensionen i fosfat-saltvands bufferen, og Inkuber i et 60 °C vandbad i 2 timer.
- Efter inkubationen centrifugeres cellerne ned, dekarer DTAF-opløsningen og vaskes og centrifugeres 3x med PBS.
- Efter den sidste vask, re-suspendere cellerne i 20 mL af PPi-salt buffer.
- Vortex FLB suspension og pipette 1,5 mL aliquoter i 2 mL kryo-hætteglas, derefter holde frosset (ved-20 °C)i PP i-saltvands buffer indtil brug.
- Pre-filter PPi-salt buffer gennem et 0,2 μm polycarbonat filter til brug i næste trin.
- For at bestemme FLB-koncentrationen, Overfør en lille alikvot (normalt 20-40 μL) til 2 mL partikel frit PPi-saltvands buffer, soniker ved 30 W for flere 2 s brister, og filtrer på 0,2 μm polycarbonat sort filter til optælling via epifluorescens mikroskopi (1, 000X forstørrelse) under optisk filterindstillinger for DTAF (448 nm/520-540 nm).
- Vælg en passende størrelse (middelcellevolumen = MCV) og morfologi af bakterier, så de effektivt efterligner de typiske størrelser af bakterioplankton/bakterieceller i det akvatiske system, der undersøges.
- Tracer teknik til estimering af ciliat bakterivory
- For græsnings forsøg i naturlige planktoniske habitater dispenseres 300 mL prøver til velskyllede 1 L kolber og inkubateres ved in situ-temperatur i 15 minutter (for at give protisterne mulighed for at komme sig efter håndterings chok).
- Tilsæt FLB røbestoffer til at udgøre 5%-15% af de samlede bakterier, med de tilføjede beløb afhængigt af sæsonen og vandtemperaturen.
Bemærk: der er en meget bred, sæson-afhængige spektrum i ciliate Arts-specifikke optagelse satser spænder over flere størrelsesordener (dvs. fra 101-104 bakterier ciliate-1 per time)10,16, 17,18,22,23,24. - I perioder med øget forekomst af ciliater med høje optagelses rater (normalt i løbet af sommeren), også køre en parallel inkubation med meget lav FLB tilføjelser, der kun udgør 2%-4% af de samlede bakterier for at undgå overdreven belastning af ciliate vakuoler af Tracer FLB (Se eksempler i figur 2).
- Inkubere/plankton prøver med FLB i 5-15 min.
- Der er to muligheder for prøve fiksering for at forhindre udsugning af det indtagne materiale fra fødevare vakuoler af protister8. Inkubationen afsluttes ved tilsætning af 1% glutaraldehyd (slutkoncentration, der er mere egnet til prøver med chlorophyllholdige partikler, såsom alger). Alternativt kan du bruge 100 μL/10 μL Lugol opløsning til 20 mL/200 μL vand/fældnings væske, efterfulgt af tilsætning af 0,5 mL/10 μL boratbuffered formalin og derefter 200 μL/2 μL 3% natriumthiosulfat (henholdsvis exp I/exp II).
- Efter tilsætning af fixativ, lad prøverne hvile i mindst 1 h i mørke ved 4 °C for at sikre en grundig bevaring af ciliat celler.
- Tag naturlige plankton-delprøver fra 4-30 mL/10-30 μL (exp I/exp II, hhv. volumen afhænger af ciliat overflod) og bejdse med DAPI (endelig koncentration 0,2% WT/vol; for detaljer, se trin 3,2 ovenfor).
- Passere gennem 1 μm sorte filtre og inspicere via epifluorescens mikroskopi at tælle ciliates (600x forstørrelse) og opregne antallet af FLB røbestoffer indtages (for det meste ved 1000x forstørrelse) som beskrevet i tidligere publikationer2,17 . Inspicer prøverne inden for 7 dage efter konservering.
- At anslå samlede protozoan/Arts-specifikke græsning, formere gennemsnitlige optagelses rater af alle ciliater, eller af kun de ciliate arter som påvist af in situ overflod.
- Eksempel på beregning af optagelses hastigheder pr. celle fra in situ-data fra Římov-vandbeholderen er beskrevet som følger:
- Antag, at den bakterielle koncentration er 3,55 x 106 bakterier/ml og Tracer FLB tilsat er 0,25 x 106 FLB/ml, hvilket giver et beløb på 3,8 x 106 bakterier/ml af totale bakterie partikler (naturlige bakterier + FLB = 100% af bytte partikler) tilgængelige for phagotrofisk protister i den naturlige prøve.
Bemærk: de tilføjede FLB-røbestoffer udgør således 6,58% (et projekt på 0,25/0.038) af totale bakterie partikler. Det gennemsnitlige antal FLB pr. Halteria Sp. er 6,2 FLB i 5 min. inkubationer. - For at normalisere optagelsen pr. time skal du bruge følgende beregning: (6,2 x 12)/(6.58/100) = 1131 bakterier pr. Halteria celle/h.
Bemærk: for flere eksempler på fordelinger af individuelle optagelses rater af Halteria Sp. detekteret under variable vandtemperaturer, beløb (som percents) af Tracer FLB tilsat, og forskellige inkubationstider med FLB, se figur 3.
- Antag, at den bakterielle koncentration er 3,55 x 106 bakterier/ml og Tracer FLB tilsat er 0,25 x 106 FLB/ml, hvilket giver et beløb på 3,8 x 106 bakterier/ml af totale bakterie partikler (naturlige bakterier + FLB = 100% af bytte partikler) tilgængelige for phagotrofisk protister i den naturlige prøve.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Eksempel eksperiment jeg blev kørt i římov vandreservoir (syd Bohemia, cz), som er et naturligt sted med lavere naturlige in situ rovdyr og bytte overflod. Der rapporteres repræsentative data for de altædende ciliatarter halteria grandinella, som er en rigelig og effektiv græsset af picoplankton (< 2 μm) partikler10,16,17,18 ,22. Figur 3 viser boks-og-Whisker plots af antallet af FLB pr. celle af halteria Sp. fra Římov reservoir (figur 3A), som blev genberegnet til frekvenser af bakteriel optagelse per time (figur 3B) påvist i fire individuelle eksperimenter, der blev gennemført i april, maj, august og september. Der var stor variation i ciliate optagelses rater, hovedsagelig forårsaget af de tidsmæssige forskelle i vandtemperaturen.
Det skal bemærkes, at parameteren Q10 afspejler det faktum, at de mikrobielle processer kører ca. 2,5 x hurtigere med en temperaturstigning på 10 °c12, som også holder for ciliate optagelses rater på bakterier. Med denne fysiologiske regel i tankerne, blev betydeligt forskellige proportioner af FLB og inkubationstider brugt til forskellige årstider (for detaljer, se figur 3A). Således blev den forventede temperatur effekt kompenseret for, og den eksperimentelle indstilling gav optimerede gennemsnitlige og mediane værdier af optagelses graden omtrent mellem 5-10 FLB pr. ciliat celle. Generelt er disse mængder af indtaget FLB let tællelige (Se eksemplerne i figur 2, to venstre fotografier), genererer præcise estimater af Tracer (for det meste er mellem 1-15 FLB per ciliate) optagelses rater. Men på grund af modificeret FLB-Tracer tilsat (%) og forskellige tidspunkter for prøve inkubation de absolutte værdier (udtrykt som antallet af bakterier græd ciliat pr. time) varierede betydeligt (p < 0,01, Krubør-Wallis test; efterfulgt af Dunns multiple-sammenligningstest, p < 0,05; se eksempler i figur 3B) blandt forsøgene. Dataene illustrerer også den typiske naturlige variation i absolutte bakterie rater i plankton populationer af Halteria grandinella, med et tæt match mellem middelværdien og middelværdierne (figur 3).
I nærværelse af højeffektive bakteriæske ciliater i prøver, såsom peritrichous ciliates, de kan blive stærkt "over-mærket" af FLB i typiske Tracer mængder af 5%-10% af de samlede bakterier (Se højre side fotografi i figur 2). Dette kan kraftigt begrænse den nøjagtige kvantificering af indtaget FLB. I sådanne tilfælde foreslås det at køre yderligere parallelle inkubationer med kun lave mængder af FLB, der kun tegner sig for 1,5%-3% af de samlede bakterier. Generelt kan både Tracer-beløbene og inkubationstiderne dog manipuleres for at optimere antallet af FLB pr. celle (figur 2).
Eksempel på eksperiment II: vises data fra et system med store rovdyr-og bytte mængder, hvor der kun er en meget lille prøvemængde til rådighed til eksperimentelt estimat af bakterivory rater af Ciliat Tetrahymena utriculariae 25. det er en moderat bakteriel Grazer lever i høj overflod udelukkende i fælder af kødædende Utricularia reflekxa planter26,27. Figur 4 viser boks-og-Whisker plots af antallet af FLB pr. celle af T. utriculariae under forskellige eksperimentelle indstillinger (figur 4A, B), der genberegnes til frekvenser af bakteriel optagelse pr. time (figur 4 C, D) detekteres i unge, modne og gamle fælder. Interessant i fælder, chloroplast-bærende populationer af ciliate T. utriculariae blev påvist, mens apochloric populationer af t. utriculariae blev isoleret fra fælder og vedligeholdt på blandet bakteriel suspension vokser på hvedekerner i mørke (for detaljer, se figur 1 i en tidligere publikation26).
De chloroplast-bærende populationer lever i lys-belyste fælder; således, chloroplaster kan give en ekstra organisk kulstofkilde og ilt til ciliate vært. En af de hypoteser testet var, at apochloric ciliate populationer græde bakterier betydeligt hurtigere, da bakterierne repræsenterer den eneste partikel kilde af organisk kulstof til rådighed for mørke-dyrkede isolerede subpopulationer af ciliat.
Selv om der ikke var nogen signifikant forskel i bakterivory rater af ciliates lever i unge, modne og gamle fælder af Utricularia Reflexa (figur 4A, C), de apochloric populationer af T. utriculariae græd bakterier signifikant (p < 0,01, Krubør-Wallis test; efterfulgt af Dunns multiple-sammenligningstest, p < 0,05), ca. 3x hurtigere end de chloroplast-bærende ciliater, som lever i unge, modne og gamle fælder (figur 4C, D). Bemærk, at både Tracer-beløbene og inkubationstiderne (figur 4A, B, top) blev ændret for at optimere antallet af FLB pr. celle (normalt mellem 1-15) med gennemsnitlige og mediane værdier omkring 5 FLB/ciliat. Disse tal adskiller sig i ciliate mad vakuoler og tillod nøjagtig spor optælling. Men udtrykt i absolutte tal af bakterier grædt pr. time, de chloroplast-bærende og apochloric populationer græste ca 350 og 1.000 bakterier ciliate i timen, hhv. Denne eksperimentelle set-up bragte ny indsigt i de metaboliske og fysiologiske træk af to særskilte delpopulationer af de samme ciliate arter lever under påfaldende forskellige miljømæssige begrænsninger25,26, 27.
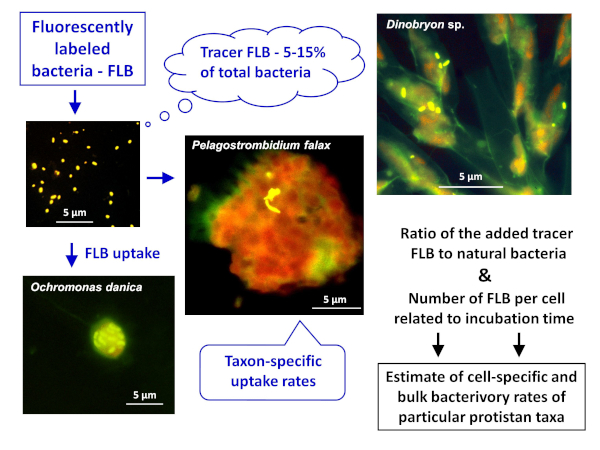
Figur 1 : Workflow for brug af fluorescently mærkede bakterier (FLB) til at estimere celle-og artsspecifikke græsnings rater fra forholdet mellem indtaget Tracer FLB og det samlede antal naturlige bakterier i prøven. Yderligere oplysninger findes i protokollens afsnit 7. Venligst klik her for at se en større version af dette tal.

Figur 2 : Eksempler på ciliatceller fra plankton af en eutrofisk fiskedam. Eksempler er vist fra dammen med tællelig FLB i ciliate celler (generelt 1-10 Tracer FLB pr celle, venstre to mikrofotografer) sammenlignet med en peritrichous ciliate pelagovorticella natans (højre side mikrofotografi). Selv i en kort, 5 min inkubationsperiode blev den "over-mærket" af Tracer FLB, hvilket gjorde kvantisering af den indtagne FLB unøjagtig eller næsten umulig. I dette tilfælde foreslås det at nedsætte sporstoffet til 1,5%-3% af de samlede bakterier. Generelt kan både spor-og inkubationstiderne dog manipuleres for at optimere antallet af FLB, der indtages pr. celle. Yderligere oplysninger findes i protokollens afsnit 7. Venligst klik her for at se en større version af dette tal.

Figur 3 : Kasse-og-Whisker-plot af antal FLB pr. celle af halteria Sp. fra Římov reservoir (exp I) (A), omregnet til frekvenser af bakteriel optagelse pr. time (B). Dataene blev registreret under forskellige sæsonmæssige indstillinger, repræsenteret ved fire eksempler fra april til september. Toppen af panel A viser oplysninger om vandtemperatur, forskellige FLB-røbestoffer tilsat (%) og forskellige tidspunkter for prøve inkubation. Det skal bemærkes, at de to sidstnævnte parametre kan ændres for at optimere antallet af FLB pr. celler, med gennemsnitlig (fuld linje) og median (stiplede linje) værdier omtrent mellem 5-10 FLB per ciliate celle (A). Søjlerne viser 25 og 75-års percentiler af alle data (50-180 celler inspiceret) og whiskers står for 1th og 99th percentiler. B) forskellige små bogstaver indikerer betydelige forskelle i celle specifikke bakterivory rater af halteria Sp. i den undersøgt periode. Venligst klik her for at se en større version af dette tal.

Figur 4 : Kasse-og-Whisker plot af antallet af FLB pr. celle. Der er påvist chloroplast-bærende Tetrahymena-utriculariae fra triplicat-behandlinger af unge, modne og gamle fælder af Utricularia Reflexa (exp II) (A), omregnet til frekvenser for bakteriel optagelse pr. time (C). Dataene blev sammenlignet med de bakterielle optagelses rater for de dobbelte apochloric populationer af T. utriculariae (B, D) isoleret fra fælder, men vedligeholdt på blandet bakteriel suspension vokser på hvedekerner i mørke. På toppen af paneler A og B, forskellige FLB røbestoffer tilsat (%) og forskellige tidspunkter for prøve inkubation vises. Det skal bemærkes, at de to sidstnævnte parametre blev ændret for at optimere antallet af FLB pr. celler med gennemsnitlig (fuld linje) og median (stiplede linje) værdier omtrent mellem 5-10 FLB pr. ciliat celle (A, B). Søjlerne viser 5th og 95th percentiler af alle data (50-100 celler inspiceret), og whiskers står for 1th og 99th percentiler. Venligst klik her for at se en større version af dette tal.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Decifrere trofiske interaktion i akvatiske systemer er altid udfordrende28, især på nano-plankton skalaer involverer protister og deres bytte, bakterier. Når det kommer til optagelse af næringsstoffer og kvantificering, er anvendelsen af metoder med succes anvendt ved højere trofiske niveauer mindre mulig på grund af den høje kompleksitet af biotiske interaktioner. Disse omfatter for eksempel stabile isotop mærkningsmetoder. Denne protokol viser fordelene ved at bruge epifluorescens mikroskopi og fluorescently mærkede bakterier som en Tracer til at spore og semi-kvantificere/estimere kulstof strømmen (bakterie bytte: forskellige protistan græsere, herunder mixotrophic græssere29) veje gennem bunden af mikrobielle fødevare spindelvæv. En sådan fordel er den høje nøjagtighed af en enkelt celle tilgang, og den anden er den hidtil usete beslutning om græsning fællesskabsstruktur og skelne mellem forskellige funktionelle guilds, arter (exp I), og selv subpopulationer af samme arter (exp II).
Kritiske trin i protokollen
Der er flere kritiske trin i protokollen, som kan sikre, at fordelene ved den metode udnyttes til deres fulde potentiale. For det første er en grundlæggende forståelse af det undersøgt miljø, før eksperimentet påbegyndes, altid gavnlig. Dette omfatter mikroskopisk screening af mangfoldigheden og overflod af potentielle græsere til stede, bakterie bytte størrelser og bytte distribution både 1) i vandsøjlen (f. eks. en vertikal profil fra epilimnion til hypolimnion) og 2) i tilfælde af Canyon-formede reservoirer, på dæmningen-inflow transect. For det andet vil omhyggelig manipulation med indsamlede prøver sikre repræsentative resultater. Temperatur er en yderst vigtig faktor, der påvirker de fleste Mikrobielle processer12, herunder protist græsnings rater (figur 3).
For det tredje vil det sikre, at problemer med over mærkning (figur 2) elimineres, hvis man manipulerer med mængden af røbestoffer, der er tilsat på grundlag af kvantificeringen af bakterieceller eller typen af græser i prøven. Det skal bemærkes, at der er et meget bredt spektrum i ciliate artsspecifikke optagelses rater (for detaljer, se trin 7,2); for at anvende protokollen på en hensigtsmæssig måde er forudgående kendskab til større ciliatarter med deres tids-og optagelses rater derfor afgørende. Det anbefales kraftigt at køre foreløbige eksperimenter med forskellige Tracer mængder for at undgå mulig ciliate under-mærkning (ingen eller for få FLB er taget op per ciliate celle, giver statistisk uforsvarlig data) eller over-mærkning (vises som et stort antal FLB danner "kondenseret FLB skyer" eller flokke i ciliate fødevarer vakuoler pakket af røbestoffer, og dermed alvorligt begrænse deres præcise kvantificering; Se eksemplet øverst til højre i figur 2). Det skal også bemærkes, at inkubationstider med FLB generelt er kortere end 30 min, da den gennemsnitlige fordøjelsestid for picoplankton af ciliates er omkring 1,5 h, og fordøjelsen starter (indtaget picoplankton celler mister sin typiske form og farve) ca efter 45-60 min30. Tilsvarende skal der opnås optimal fortynding og distribution af prøver på filteret før mikroskopisk visning for at opnå nøjagtige resultater.
Ændringer og fejlfinding
De vigtigste trin, mulige ændringer og fejlfindings modifikationer af teknikken er illustreret i figur 1 og figur 2. Det skal desuden bemærkes, at i tilfælde af høje koncentrationer af afhudede partikler, fytoplanktonceller eller deres kolonier i plankton bør sådanne prøver 1) fortyndes tilsvarende for at opnå et stadium, hvor individuelle græsningsceller kan skelnes på filteroverfladen og 2) underkastes kvantificering af madvakuolindholdet.
Begrænsninger
Den vigtigste begrænsning for en vellykket anvendelse af denne metode ligger i tilstedeværelsen af forskellige organiske efterladenskaber eller rigelige uorganiske/organiske partikler med tilknyttede bakterier eller aggregater i mængder, der forhindrer klar Prøvevisning under epifluorescens mikroskop og præcis estimering af et sporstof tilsat. Det skal bemærkes, at den præsenterede Tracer teknik arbejder primært med gratis (dvs., suspenderet) bakterier, der ikke er fastgjort til partikler. Men baseret på vores egne erfaringer og litteraturreferencer (Se tidligere publikationer2,4,8,10,16,18,21 ,26), er den præsenterede metodologi velegnet til de fleste vandmiljøer. Eksempler på to naturlige, kontrasterende systemer, der afviger med hensyn til trofiske status, indhold af efterladenskaber og græmere diversitet og tal, er tilvejebragt (figur 3 og figur 4).
Betydningen af tilgangen med hensyn til eksisterende metoder
Det er vigtigt, at der ud fra kendskabet til den overflod af en systematisk enhed/taxa af bakterierne og deres artsspecifikke bakterie rater beregnes en masse bakterie procent for protistan systematisk enhed (eller total ciliatassemblage). Hvis denne fremgangsmåde anvendes på naturlige plankton miljøer samtidig for både heterotrofisk flagellater og ciliater (der repræsenterer de største græsere af bakterioplankton2,6,7), vil protistan græsnings fremkaldt omsætningstid for bakterie populationer i et givet miljø kan anslås til16,17,18,22. Sådanne data har grundlæggende betydning for skønnet kulstof flow dynamik i mikrobielle fødevare spindelvæv.
Fremtidige ansøgninger
Der er andre specifikke miljøer, hvor denne metode, med nogle modifikationer, kan bruges med succes. Disse omfatter aktiverede slam systemer, Rumen økosystemer, akvatiske sedimenter og hypertrofisk fiskedamme17. Men, anvendelse i disse næringsstof-og mikrober-rige miljøer kræver foreløbige tests for at optimere protokollen om den korrekte størrelse, morfologi, og antallet af Tracer FLB, der kan efterligne den typiske størrelsesfordeling og andre egenskaber af bytte bakterier, som er naturligt forbundet med miljøet.
I øjeblikket er der stigende interesse i at kombinere denne tilgang med katalyseret reporter deposition fluorescens in situ hybridisering (kort-fisk), hvor identiteten af Grazer celle (f. eks heterotrofisk flagellate) detekteres med en specifik FISKE sonde og Optagelseshastigheden er baseret på FLB-indhold i madvakuoler af flagellatcellen på samme mikroskopiske slide31. En sofistikeret, ny tilgang kaldet dobbelt hybridisering32 er en kombination af fisk sonder på niveauerne af Predator celle og bytte bakterier (der er også mærket specifikt af en Fylogenetisk stamme, en bakteriel Lineage-specifikke fisk sonde). Tilgangen er elegant, men også tidskrævende og kræver specifikke færdigheder og erfaring31,32, mens anvendelsen af forskellige FLB optagelse tilgang modifikationer kan lettere vedtages til rutinemæssig brug i laboratorier.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har intet at afsløre.
Acknowledgments
Denne undersøgelse blev støttet af den tjekkiske videnskabs fond under forsknings tilskuddet 13-00243S og 19-16554S tildelt henholdsvis K. Š. og D. S. Denne artikel blev også støttet af projektet "Biomanipulation som et redskab til forbedring af vandkvaliteten i dæmnings reservoirer" (nr. CZ. 02.1.01/0,0/0,0/16_025/0007417), finansieret af den europæiske fond for regional udvikling, i det operationelle program for forskning, udvikling og uddannelse.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2-µm pore-size filters | SPI supplies, https://www.2spi.com/ | B0225-MB | Black, polycarbonate track etch membrane filters, diameter approprite for filtering apparatus used |
| 5-(4,6-dichlorotriazin-2-yl) aminofluorescein (DTAF) | Any brand | ||
| Automatic pipettes with adjustable volumes | Any brand, various sizes | ||
| Centrifuge | 22 000 x g | ||
| Cryovials | Any brand, 2 mL size | ||
| DAPI (4´,6-Diamidino-2´-phenylindole dihydrochloride) | Any brand | 1 mg ml-1 | |
| Epiflorescence microscope | Magnification from 400 x up to 1000 x | ||
| Filters appropriate for viewing in the DAPI and DTAF range | |||
| Counting grid in one of the oculars | |||
| Filtering apparatus | Usually with a diameter of 25 mm | ||
| Formaldehyde | A brand for microscopy | ||
| Glutaraldehyde | A brand for microscopy | ||
| Immersion oil for microscopy | Specific oil with low fluorescence | ||
| Lugol´s solution | Any brand or see comment | Make an alkaline Lugol' solution as follows: Solution 1 - dissolve 10 g of potassium iodide in 20 ml in MQ water, then add 5 g of iodine. Solution 2 - add 5 g of sodium acetate to 50 ml of MQ water. Add the solution 2 to the solution 1 and thoroughly mix | |
| Methanol stabilized formalin | Any brand available for microscopy purposes | ||
| Microscope slides and cover slips | Any brand produced for microscopy purposes | ||
| MQ water for diluting samples | Any brand |
||
| Phosphate-buffered saline (PBS; pH = 9) | Any brand | 0.05 M Na2HPO4-NaCl solution, adjusted to pH 9 | |
| PPi-saline buffer | Any brand | 0.02 M Na4P2O7-NaCl solution. Add 0.53 g Na4P2O7 to 100 ml of MQ water plus 0.85 g NaCl | |
| Sampling device | Appropriate for obtaining representative sample | e.g. Friedinger sampler for lake plankton | |
| Sodium thiosulfate solution | Any brand | 3% solution is used in the protocol | |
| Sonicator | Any brand | 30 W | |
| Vortex | Any brand allowing thorough mixing of the solutes and samples | ||
| Water bath | Any brand allowing temperature to be maintained at 60 °C |
References
- Azam, F., et al. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series. 10, 257-263 (1983).
- Šimek, K., et al. A finely tuned symphony of factors modulates the microbial food web of a freshwater reservoir in spring. Limnology & Oceanography. 59, 1477-1492 (2014).
- Šimek, K., et al. Bacterial prey food characteristics modulate community growth response of freshwater bacterivorous flagellates. Limnology & Oceanography. 63, 484-502 (2018).
- Šimek, K., et al. Changes in bacterial community composition, dynamics and viral mortality rates associated with enhanced flagellate grazing in a meso-eutrophic reservoir. Applied & Environmental Microbiology. 67, 2723-2733 (2001).
- Jürgens, K., Matz, C. Predation as a shaping force for the phenotypic and genotypic composition of planktonic bacteria. Antonie Van Leeuwenhoek. 81, 413-434 (2002).
- Pernthaler, J. Predation on prokaryotes in the water column and its ecological implications. Nature Reviews Microbiology. 3, 537-546 (2005).
- Berninger, U. B., Finlay, J., Kuuppo-Leinikki, P. Protozoan control of bacterial abundances in freshwaters. Limnology and Oceanography. 36, 139-147 (1991).
- Sherr, E. B., Sherr, B. F. Protistan grazing rates via uptake of fluorescently labeled prey. Handbook of Methods in Aquatic Microbial Ecology. Kemp, P. F., Sherr, B. F., Sherr, E. B., Cole, J. J. , Lewis Publishers. Boca Raton, Florida. 695-701 (1993).
- Vazquez-Dominguez, E., Peters, F., Gasol, J. M., Vaqué, D. Measuring the grazing losses of picoplankton: methodological improvements in the use of fluorescently tracers combined with flow cytometry. Aquatic Microbial Ecology. 20, 119-128 (1999).
- Šimek, K., et al. Ecological role and bacterial grazing of Halteria spp.: Small oligotrichs as dominant pelagic ciliate bacterivores. Aquatic Microbial Ecology. 22, 43-56 (2000).
- Montagnes, D. J. S., et al. Selective feeding behaviour of key free-living protists: avenues for continued study. Aquatic Microbial Ecology. 53, 83-98 (2008).
- Kirchman, D. L. Processes in Microbial Ecology. 2nd Edition. , Oxford University Press. Oxford, UK. (2018).
- Porter, K. G., Feig, Y. S. The use of DAPI for identifying and counting aquatic microflora. Limnology and Oceanography. 25, 943-948 (1980).
- Foissner, W., Berger, H. A user-friendly guide to the ciliates (Protozoa, Ciliophora) commonly used by hydrobiologists as bioindicators in rivers, lakes, and waste waters, with notes on their ecology. Freshwater Biology. 35, 375-482 (1996).
- Foissner, W., Berger, H., Schaumburg, J. Identification and ecology of limnetic plankton ciliates. Informationsberichte des Bayer Landesamtes für Wasserwirtschaft Heft. , 3-99 (1999).
- Šimek, K., et al. Ciliate grazing on picoplankton in a eutrophic reservoir during the summer phytoplankton maximum: a study at the species and community level. Limnology & Oceanography. 40, 1077-1090 (1995).
- Skibbe, O. An improved quantitative protargol stain for ciliates and other planktonic protists. Archiv für. Hydrobiolgie. 130, 339-347 (1994).
- Macek, M., et al. Growth rates of dominant planktonic ciliates in two freshwater bodies of different trophic degree. Journal of Plankton Research. 18, 463-481 (1996).
- Šimek, K., et al. Microbial food webs in hypertrophic fishponds: omnivorous ciliate taxa are major protistan bacterivores. Limnology & Oceanography. , in press (2019).
- Jezbera, J., et al. Major freshwater bacterioplankton groups: Contrasting trends in distribution of Limnohabitans and Polynucleobacter lineages along a pH gradient of 72 habitats. FEMS Microbiology Ecology. 81, 467-479 (2012).
- Kasalický, V., et al. The diversity of the Limnohabitans genus, an important group of freshwater bacterioplankton, by characterization of 35 isolated strains. PLoS One. 8, 58209 (2013).
- Stabell, T. Ciliate bacterivory in epilimnetic waters. Aquatic Microbial Ecology. 10, 265-272 (1996).
- Zingel, P., et al. Ciliates are the dominant grazers on pico- and nanoplankton in a shallow, naturally highly eutrophic lake. Microbial Ecology. 53, 134-142 (2007).
- Bickel, S. L., Tang, K. W., Grossart, H. P. Ciliate epibionts associated with crustacean zooplankton in german lakes: distribution, motility, and bacterivory. Frontiers in Microbiology. 3 (243), (2012).
- Sirová, D., et al. Hunters or gardeners? Linking community structure and function of trap-associated microbes to the nutrient acquisition strategy of a carnivorous plant. Microbiome. 6, 225 (2018).
- Šimek, K., et al. Ecological traits of a zoochlorellae-bearing Tetrahymena sp. (Ciliophora) living in traps of the carnivorous aquatic plant Utricularia reflexa. Journal of Eukaryotic Microbiology. 64, 336-348 (2017).
- Pitsch, G., et al. The green Tetrahymena utriculariae n. sp. (Ciliophora, Oligohymenophorea) with its endosymbiotic algae (Micractinium sp.), living in the feeding traps of a carnivorous aquatic plant. Journal of Eukaryotic Microbiology. 64, 322-335 (2017).
- Nielsen, J. M., Clare, E. L., Hayden, B., Brett, M. T., Kratina, P. Diet tracing in ecology: Method comparison and selection. Methods in Ecology and Evaluation. 9, 278-291 (2018).
- Beisner, B. E., Grossart, H. P., Gasol, J. M. A guide to methods for estimating phago-mixotrophy in nanophytoplankton. Journal of Plankton Research. , 1-13 (2019).
- Dolan, J. D., Šimek, K. Processing of ingested matter in Strombidium sulcatum, a marine ciliate (Oligotrichida). Limnology and Oceanography. 42, 393-397 (1997).
- Massana, R., et al. Grazing rates and functional diversity of uncultured heterotrophic flagellates. The ISME Journal. 3, 588-596 (2009).
- Grujčić, V., et al. Cryptophyta as major freshwater bacterivores in experiments with manipulated bacterial prey. The ISME Journal. 12, 1668-1681 (2018).



