Summary
Aquí se presenta un protocolo para una técnica monocelular basada en microscopía de epifluorescencia para cuantificar las tasas de pastoreo en eucariotas depredadores acuáticos con alta precisión y resolución taxonómica.
Abstract
La diluación de las interacciones tróficas, como la depredación y sus efectos, es una tarea frecuente para muchos investigadores en ecología. El estudio de las comunidades microbianas tiene muchas limitaciones, y determinar las tasas de depredadores, presas y depredadores a menudo es difícil. Aquí se presenta un método optimizado basado en la adición de presas etiquetadas fluorescentes como un trazador, que permite una cuantificación fiable de las tasas de pastoreo en eucariotas depredadores acuáticos y la estimación de la transferencia de nutrientes a niveles tróficos más altos.
Introduction
Los prokaryotes heterotróficos son un componente biológico clave en los sistemas acuáticos y representan una fracción significativa de la biomasa de plancton1,2,3. Los factores que controlan su abundancia, diversidad y actividad son cruciales para entender su papel en el ciclo biogeoquímico (es decir, el destino del carbono orgánico y otros nutrientes y el flujo de energía de los prokaryotes a niveles tróficos más altos). El pastoreo de protozoos es uno de estos factores importantes. Bacterivory de nanoflagelados y ciliados heterotróficos impone un fuerte control descendente sobre la abundancia procariótica, la función comunitaria, la estructura, la diversidad e incluso la morfología celular y la tasa de crecimiento de determinados grupos bacterianos4, 5,6. En algunos sistemas, los protistas sirven como la principal causa de mortalidad bacteriana6,7.
El enfoque estándar utilizado para evaluar el bacterivory protozoario, que se ha utilizado desde hace algún tiempo, implica el uso de bacterias etiquetadas fluorescentesmente (FLB) como análogos de presas y microscopía de epifluorescencia. Las tasas de captación específicas de células se pueden determinar cuantificando el número de partículas de presa etiquetadas en vacuolas de alimentos protistán durante un curso de tiempo seleccionado8. Este enfoque tiene varias ventajas. Tracer se añade a muestras naturales con conjuntos naturales de depredadores y presas. Hay una manipulación mínima de la muestra antes de la incubación, la alteración mínima de la muestra por el trazador FLB añadido, y los tiempos de incubación son cortos para asegurar que los resultados sonoros obtenidos en condiciones cercanas a in situ. Alternativamente, en entornos con un bajo número de protistas bacterívoros o zooplancton (por ejemplo, sistemas marinos en alta mar), las tasas de desaparición de FLB añadidas a las muestras en cantidades bajas (2%-3% trazador) se pueden detectar a través de citometría de flujo a largo plazo (12-24 h) experimentos de incubación. A continuación, los números de FLB en los puntos inicial y final (integrando el impacto de todos los bacterívoros) se cuantifican mediante citometría de flujo (para más detalles, véase la publicación anterior9). Sin embargo, este parámetro sólo representa tasas totales agregadas de bacterivory que no pueden atribuirse directamente a ningún grupo o especie de protistán y pasto de zooplancton en particular.
En general, cuantificar las tasas de mortalidad bacteriana específicas de las especies de protistán o morfotipos en el medio acuático con precisión y con significado ecológico puede ser difícil. Algunos protistas son pastores selectivos, y el tamaño y la forma celular del trazador FLB añadido pueden distorsionar las tasas naturales de ingestión de presas10,11. Además, la actividad y el metabolismo del protistán son altamente sensibles a la temperatura12; por lo tanto, la cantidad de trazador FLB añadido debe manipularse cuidadosamente para cada tipo de muestra individual (no sólo en función de la abundancia natural, el tamaño y la morfología de las bacterias y los tipos predominantes de bacterívoros, sino también de la temperatura). La mayoría de los estudios se centran en la actividad de pastoreo de protistano a granel; sin embargo, el bacterivory de especies específicas de protistán a menudo tiene un valor de información mucho más alto y puede ser preferible. En este caso, se necesita el conocimiento taxonómico de las especies protistas presentes en una muestra y comprensión de su comportamiento. Por lo tanto, se requieren cantidades considerables de tiempo y mano de obra para obtener resultados sólidos sobre las tasas específicas de bacterivo de especies atribuibles a un grupo o especie de protistán en particular.
A pesar de estas dificultades, este enfoque sigue siendo la herramienta más adecuada actualmente disponible para evaluar el bacterivory protistán en entornos naturales. Aquí se presenta un método completo y fácil de seguir para utilizar flb como marcador en estudios de ecología microbiana acuática. Se tienen en cuenta todos los aspectos problemáticos mencionados del enfoque y se describe un flujo de trabajo mejorado, con dos experimentos de entornos contrastantes, así como de especies ciliadas contrastantes como ejemplos.
El primer estudio de caso se llevó a cabo en un entorno epilimónico a partir del depósito de agua mesófico de la República Checa, que muestra abundancias de pastoreo y bacterias comparables a la mayoría de los cuerpos de agua dulce superficiales (cf.5,7). El segundo estudio de caso se llevó a cabo en el entorno altamente específico dentro de las trampas de la planta carnívora acuática Utricularia reflexa, que alberga un número extremadamente alto de ambos ciliados mixotricos de pastoreo (Tetrahymena utriculariae) y células bacterianas. Se muestran cálculos de las tasas de pastoreo específicas de las células y las existencias de pie bacteriana en ambos tipos de muestras. A continuación se discute una serie de interpretaciones ecológicas de los resultados, y finalmente se sugieren ejemplos de posibles estudios de seguimiento.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. Recogida de muestras
-
Colección de muestras de agua de depósito:el primer caso de estudio (Exp I; menor depredador natural in situ y sistema de abundancia de presas)
- Recoja muestras de agua de la ubicación deseada a una profundidad adecuada. Mantener las muestras en un enfriador con temperatura controlada llena a temperatura in situ (evitando el choque de temperatura; debe tenerse en cuenta que las tasas de absorción de los protistas dependen de la temperatura) durante el transporte al laboratorio.
NOTA: Nuestro muestreo se llevó a cabo en el reservorio meso-eutrófico en forma de cañón de éímov (Bohemia del Sur, volumen 34,5 x 106 m3,profundidad máxima 43 m, tiempo medio de retención 100 días, dimicéptico). El sitio de muestreo se encuentra a una profundidad de 30 m, cerca de la presa. Una muestra mixta a una profundidad de 0,5 m fue recogida por un muestreador de 2 l Friedinger. - Continúe con la sección 1.2 tan pronto como sea posible.
- Recoja muestras de agua de la ubicación deseada a una profundidad adecuada. Mantener las muestras en un enfriador con temperatura controlada llena a temperatura in situ (evitando el choque de temperatura; debe tenerse en cuenta que las tasas de absorción de los protistas dependen de la temperatura) durante el transporte al laboratorio.
-
Recolección de líquido de las trampas de plantas carnívoras de Utricularia reflexa: el segundo caso práctico (Exp II; un sistema con altas abundancias de depredadores y presas, volumen de muestra extremadamente pequeño)
- Agitar suavemente las plantas bajo el agua, retirar las del recipiente de cultivo y colocarlas en material absorbente para absorber el exceso de agua. Dependiendo de la robustez de las plantas y el tamaño de las trampas, elija 8-10 individuos de la planta.
- Divida cada brote en partes aproximadamente iguales contando los nodos de hojas que llevan órganos de captura. Cada segmento de brote servirá para recoger muestras mixtas que representan trampas jóvenes, de mediana edad y viejas.
- Coloque un capilar de vidrio fino y un vial de Eppendorf para la recogida de muestras en una bomba peristáltica. Proceda a insertar la punta capilar en la abertura de la trampa. Usando la bomba de vacío, succione todo el líquido de cada trampa hasta que se recojan 900 x 100 l de líquido de trampa para cada categoría de edad de trampa.
- Utilice submuestras triplicadas de 200 ml del fluido de trampa agrupado para experimentos de pastoreo de protistán. Procesarlos inmediatamente como se detalla en la sección 3. Conservar el resto de 300 ml de la muestra para todos los demás análisis de componentes microbianos que viven en el fluido, como se detalla a continuación (sección 2).
- Proceda inmediatamente a la sección 2.
2. Fijación de muestras recogidas
- Exp I y II: fijar submuestras de fluidode agua/trampa para la enumeración bacteriana (sección 4; aproximadamente 20 ml y 0,3 ml, respectivamente) con formaldehído durante al menos 1 h para obtener un volumen final del 2%: concentración de volumen en cada muestra.
NOTA: Manipule el formaldehído exclusivamente en la campana de humos y use guantes en todo momento mientras manipula las muestras.
3. Filtración de muestras
- Dilución de la muestra (Exp I): no se necesita dilución para las muestras de agua del depósito. (Exp II): diluir la muestra de fluido de trampa 10x-100x con agua MQ libre de partículas para lograr una distribución adecuada de los microbios objetivo en superficies de filtro antes de contar a través de microscopía de epifluorescencia.
- Filtrar 1-2 ml (Exp I) del agua del depósito o 10-30 l (Exp II) de la submuestra del líquido trampa para contar bacterianos en filtros negros de 0,2 m de tamaño poro, utilizando un embudo de filtración (25 mm de diámetro).
- Mancha los filtros con DAPI (4',6-diamidino-2'-phenylindole dihydrochloride, 0.2% concentración final) durante 4 min.
NOTA: Evite la contaminación de la piel y la superficie de trabajo, y use guantes. - Coloque el filtro con microbios concentrados en una gota de aceite de inmersión (para microscopía fluorescente) en una diapositiva del microscopio. Coloque otra gota de aceite en el centro del filtro y cubra con un cubreobjetos, asegurándose de que el aceite se distribuya uniformemente.
- En este punto, preferiblemente procese las muestras inmediatamente, o alternativamente, guárdelas en el congelador (-20 oC) durante varias semanas o meses hasta un análisis posterior.
4. Enumeración de números bacterianos en los filtros
- Coloque la corredera debajo del microscopio de epifluorescencia (con el conjunto de filtros correspondiente al DAPI fluorocromo). Coloque una rejilla de recuento de 10 x 10 en uno de los oculares. Mueva la diapositiva a una posición aleatoria.
- Cuantifique las células bacterianas (fluorescencia azul) en el área de la cuadrícula de recuento (bajo el aumento 1000x). En los recuentos, incluya las celdas que cruzan los bordes izquierdo e superior de la cuadrícula de recuento, excluyendo las situadas a través de los bordes derecho e inferior.
- Muévase a otra posición aleatoria y repita la enumeración en al menos 10-15 cuadrículas de recuento, lo que equivale a 500 celdas contadas en total.
- Establecer un factor de conversión para un microscopio y aumento determinados, basado en el conocimiento de la relación del área de una rejilla con el área de filtración efectiva total del filtro. Luego, divida el número total de células contadas por el número de cuadrículas contadas, produciendo un número promedio de bacterias por cuadrícula.
- Multiplique este último parámetro por el factor de conversión establecido y normalice el número resultante por ml de una muestra (dependiendo del volumen de la muestra filtrada) para obtener la abundancia bacteriana total por ml.
5. Determinación de la abundancia de protistán
- Fijar la muestra de agua (Exp I) o el fluido de trampa (Exp II) submuestras con glutaraldehído (1% concentración final, más adecuado para muestras con la presencia de partículas que contienen clorofila que deben ser procesadas días a semanas después de la fijación) o utilizando el técnica de decoloración formol-tiosulfato especificada a continuación.
NOTA: Ambas técnicas de conservación previenen la gestión del material ingerido a partir de vacuolas alimentarias de protistas8. - En cuanto a la técnica de decoloración formol-tiosulfato, añada 100 l/1 l de la solución de Lugol en 20 ml/200 ml de la submuestra de líquido de agua/trampa (Exp I/Exp II, respectivamente).
- Siga inmediatamente con la adición de 0,5 ml/50 l de formalina tamponada con borato y luego 20 l/2 l de tiosulfato sódico al 3% (Exp I/Exp II, respectivamente).
NOTA: El tiosulfato sódico decolora el color amarillo de Lugol para permitir la observación de células bajo el microscopio de epifluorescencia8. - Filtrar un volumen conocido de muestra (dependiendo del número de protistas objetivo) en filtros de policarbonato negro del tamaño de un poro de 1 m.
- Estimar el número de la especie protista es contando al menos 200 células bajo aumento 600x usando la cuadrícula de recuento (ver arriba).
- Reduzca el volumen de la muestra bajo vacío en el embudo de filtración por vacío bajo a aproximadamente 2 ml. A continuación, suelte la subpresión y añada el fluorocromo DAPI (4',6-diamidino-2-phenylindole dihydrochloride13, 0.2% concentración final) durante 2 min.
6. Determinación de la estructura comunitaria de los ciliados en muestras de plancton
NOTA: Las comunidades ciliada en hábitats de agua dulce son muy diversas14,15,16,18, y su determinación microscópica es un reto. La clasificación de los grupos ciliados en gremios funcionales10,14,16,17 permite un análisis más detallado de diferentes grupos ciliados como bacterívoros pelágicos.
- Evalúe la estructura de la comunidad ciliada combinando lo siguiente:
- Muestras manchadas de DAPI en microscopía de epifluorescencia (para localizar las células ciliadas con fluorescencia brillante de macro y micronúcleos de diferentes tamaños y morfología) combinadas con la absorción de bacterias etiquetadas fluorescentesmente (FLB8;para más detalles, ver a continuación), el seguimiento de la capacidad de los ciliados para alimentarse de bacterias.
- Observación de muestras en vivo en casos seleccionados17,19. Para más detalles de los enfoques y criterios anteriores utilizados para agrupar ciliados en diferentes categorías taxonómicas, véanse las publicaciones anteriores16,17.
NOTA: Estudios citados han indicado que entre los ciliados, las especies omnívoras de Stichotrichia (genera Halteria y Pelagohalteria)y Oligotrichia (a saber, Rimostrombidium spp.) son los consumidores pelágicos más importantes de bacterioplancton en la gran mayoría de los hábitats de agua dulce10,17,18.
7. Estimación de las tasas de pastoreo ciliado
- Calcular las tasas de ingesta de cilios en bacterias basándose en los cambios en el número medio de trazador [es decir, FLB8 por ciliar relacionado con el tiempo de incubación (5-15 min)] y la cantidad de FLB añadida, representando como máximo entre el 5% y el 15% del total de bacterias.
- Para comparar las tasas de captación entre diferentes especies de protistán, normalice las tasas de captación como el número de bacterias por ciliado por hora, con cálculos basados en el tiempo de incubación real y la proporción del FLB trazador añadido.
NOTA: En la Figura 1se muestra el esquema general de la aplicación del método FLB para estimar las tasas de bacterivory tanto celulares como específicos de especies y a granel en muestras naturales. - Preparación de FLB a partir de cepas bacterianas autóctonas a un ambiente de agua dulce8
- Seleccione un tamaño adecuado (volumen de célula s/promedio de MCV) y morfología de las bacterias para que imite eficazmente los tamaños típicos de las células bacterioplancton/bacterianas en el sistema acuático que se está investigando.
NOTA: Para Exp I, se utilizó una mezcla de cepas aisladas de la ubicación de estudio del género Limnohabitans y Polynucleobacter (es decir, bacterioplancton típico y muy abundante en lagos y estanques)20. Para más detalles sobre la morfología y el tamaño de las cepas, véanse las publicaciones anteriores3,17,18,21. - Cosechar células bacterianas del cultivo por centrifugación (5.000 x g) durante 15 minutos en la fase estacionaria temprana y mezclarlas en una proporción numérica que produzca MCV - SD de las células en la mezcla correspondiente al MCV típico de bacterias en el lugar elegido.
- Suspenda los pellets en 10 ml de solución salina con fosfato (PBS; pH n.o 9).
- Añadir 2 mg de aminofluoresceína de color amarillo-verde 5-(4,6-diclorotriazina-2-yl) (DTAF, se une a las proteínas) a la suspensión celular en el tampón fosfato-salino, e incubar en un baño de agua de 60 oC durante 2 h.
- Después de la incubación, centrifugar las células hacia abajo, decantar la solución DTAF, y lavar y centrifugar 3veces con PBS.
- Después del lavado final, vuelva a suspender las células en 20 ml del búfer PPi-salino.
- Vortex la suspensión FLB y la pipeta 1,5 ml alícuotas en crioviales de 2 ml, luego mantener congelado (a -20 oC) en el tampón PPi-salino hasta su uso.
- Prefiltro PPi-saline buffer a través de un filtro de policarbonato de 0,2 m para su uso en el siguiente paso.
- Para determinar la concentración de FLB, transfiera una pequeña alícuota (generalmente 20-40 l) a 2 ml de tampón PPi-salino libre de partículas, sonicar a 30 W durante varias ráfagas de 2 s y filtre en un filtro negro de policarbonato de 0,2 m para su enumeración a través de epifluorescencia microscopía (aumento de 1.000X) en los ajustes de filtro óptico para DTAF (448 nm/520-540 nm).
- Seleccione un tamaño adecuado (volumen de célula s/promedio de MCV) y morfología de las bacterias para que imite eficazmente los tamaños típicos de las células bacterioplancton/bacterianas en el sistema acuático que se está investigando.
- Técnica de trazador para la estimación del bacterivory ciliado
- Para experimentos de pastoreo en hábitats planctónicos naturales, dispensar muestras de 300 ml en matraces bien enjuagados e incubar a temperatura in situ durante 15 minutos (para permitir que los protistas se recuperen del amortiguador de manipulación).
- Añadir trazadores FLB para constituir 5%-15% del total de bacterias, con las cantidades añadidas dependiendo de la temporada y la temperatura del agua.
NOTA: Hay un espectro muy amplio, dependiente de la temporada en las tasas de admisión específicas de las especies ciliadas que abarcan varios órdenes de magnitud (es decir, de 101-104 bacterias ciliar-1 por hora)10,16, 17,18,22,23,24. - En períodos de mayor aparición de ciliados con altas tasas de admisión (generalmente durante el verano), también se ejecuta una incubación paralela con adiciones muy bajas de FLB, constituyendo sólo 2%-4% del total de bacterias para evitar la carga excesiva de vacuolos ciliados por el trazador FLB (ver ejemplos en la Figura 2).
- Incubar muestras de ciliado/plancton con FLB durante 5-15 min.
- Existen dos posibilidades de fijación de muestras para evitar la gestión del material ingerido a partir de vacuolas alimentarias de los protistas8. Terminar las incubaciones mediante la adición de 1% de glutaraldehído (concentración final que es más adecuada para muestras con partículas que contienen clorofila, como algas). Alternativamente, utilice 100 l/10 l de la solución de Lugol en 20 ml/200 ml de submuestra de líquido de agua/trampa, seguido inmediatamente por la adición de 0,5 ml/10 l de formalina tamponada con borato y, a continuación, 200 ml/2 l de tiosulfato sódico al 3% (Exp I/Exp II, respectivamente).
- Después de añadir el fijador, deje reposar las muestras durante al menos 1 h en la oscuridad a 4 oC para asegurar la preservación minuciosa de las células ciliada.
- Tomar submuestras de plancton naturales de 4-30 mL/10-30 l (Exp I/Exp II, respectivamente; el volumen depende de la abundancia de ciliar) y manchar con DAPI (concentración final 0,2% wt/vol; para más detalles, ver paso 3.2 anterior).
- Pasar a través de filtros negros de 1 m e inspeccionar a través de microscopía de epifluorescencia para contar los ciliados (aumento de 600x) y enumerar el número de trazadores FLB ingeridos (principalmente con aumento de 1000x) como se detalla en publicaciones anteriores2,17 . Inspeccione las muestras dentro de los 7 días posteriores a la conservación.
- Para estimar el pastoreo total protozoario/específico de la especie, multiplique las tasas medias de ingesta de todos los ciliados, o sólo de las especies ciliadas detectadas por la abundancia in situ.
- Ejemplo del cálculo de las tasas de admisión por célula a partir de los datos in situ del depósito de agua de éímov se describe de la siguiente manera:
- Supongamos que la concentración bacteriana es de 3,55 x 106 bacterias/ml y el trazador FLB añadido es de 0,25 x 106 FLB/mL, lo que produce una suma de 3,8 x 106 bacterias/ml de partículas bacterianas totales (bacterias naturales + FLB a 100% de las partículas de presas) protistas fagotróficas en la muestra natural.
NOTA: Los trazadores FLB añadidos representan así el 6,58% (un proyecto de 0,25/0,038) de partículas bacterianas totales. El número medio de FLB por Halteria sp. es de 6,2 FLB en incubaciones de 5 minutos. - Para normalizar la suatoma por hora, utilice el siguiente cálculo: (6,2 x 12)/(6,58/100) a 1131 bacterias por célula de halteria/h.
NOTA: Para obtener más ejemplos de distribuciones de las tasas de admisión individuales de Halteria sp. detectadas bajo temperaturas variables del agua, cantidades (como porcentajes) de FLB de trazador añadido y diferentes tiempos de incubación con FLB, véase la Figura 3.
- Supongamos que la concentración bacteriana es de 3,55 x 106 bacterias/ml y el trazador FLB añadido es de 0,25 x 106 FLB/mL, lo que produce una suma de 3,8 x 106 bacterias/ml de partículas bacterianas totales (bacterias naturales + FLB a 100% de las partículas de presas) protistas fagotróficas en la muestra natural.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Ejemplo de experimento que se ejecutó en el embalse de agua de Oímov (Bohemia del Sur, CZ), que es un sitio natural con menor depredador natural in situ y abundancia de presas. Se informa de datos representativos de la especie ciliada omnívora Halteria grandinella, que es un pastor abundante y eficiente de partículas de picoplancton (<2 m)10,16,17,18 ,22. La Figura 3 muestra las gráficas de caja y silbido de números de FLB por célula de Halteria sp. desde el embalse de éímov(Figura 3A), que se recalculada a tasas de acumulación bacteriana por hora(Figura 3B) detectados en cuatro experimentos individuales realizados en abril, mayo, agosto y septiembre. Hubo una alta variabilidad en las tasas de ingesta ciliada, causada en gran medida por las diferencias temporales en la temperatura del agua.
Cabe señalar que el parámetro Q10 refleja el hecho de que los procesos microbianos se ejecutan aproximadamente 2,5 veces más rápido con un aumento de la temperatura de 10 oC12,que también se mantiene para las tasas de absorción de ciliar en las bacterias. Con esta regla fisiológica en mente, se utilizaron proporciones considerablemente diferentes de FLB y tiempos de incubación para diferentes estaciones (para más detalles, véase la Figura 3A). Por lo tanto, se compensó el efecto de temperatura esperado, y el ajuste experimental produjo valores medios y medios optimizados de tasas de admisión aproximadamente entre 5-10 FLB por célula ciliada. Generalmente, estas cantidades de FLB ingerido son fácilmente contables (ver ejemplos en la Figura 2,dos fotografías a la izquierda), generando estimaciones precisas del trazador (principalmente entre 1-15 FLB por ciliar) tasas de acumulación. Sin embargo, debido a la trazación flB modificada agregada (%) y diferentes tiempos de incubación de muestras los valores absolutos (expresados como número de bacterias pastadas ciliar por hora) diferían significativamente (p < 0.01, prueba Kruskal-Wallis; seguido de la prueba de comparación múltiple de Dunn, p < 0.05; ver ejemplos en la Figura 3B) entre los experimentos. Los datos también ilustran la variabilidad natural típica en las tasas absolutas de bacterivory en las poblaciones planctónicas de Halteria grandinella,con una coincidencia cercana de sus valores medios y medios(Figura 3).
En presencia de ciliados bacteríferos altamente eficientes en muestras, como ciliados peritricos, pueden llegar a ser fuertemente "sobre-etiquetados" por FLB en cantidades típicas de trazador de 5%-10% del total de bacterias (ver fotografía del lado derecho en la Figura 2). Esto puede limitar fuertemente la cuantificación precisa de la FLB ingerido. En tales casos, se sugiere realizar incubaciones paralelas adicionales con sólo cantidades bajas de FLB que representan sólo 1.5%-3% del total de bacterias. Sin embargo, generalmente tanto las cantidades del trazador como los tiempos de incubación se pueden manipular para optimizar el número de FLB por celda(Figura 2).
Ejemplo de experimento II:Se muestran los datos de un sistema con grandes abundanciaes de depredadores y presas, donde sólo se dispone de un volumen de muestra extremadamente pequeño para estimar experimentalmente las tasas de bacterivory de los ciliados Tetrahymena utriculariae 25. Es un pastor bacteriano moderado que vive en alta abundancia exclusivamente en trampas de plantas carnívoras Utricularia reflexa 26,27. La Figura 4 muestra gráficas de caja y bigote de número de FLB por celda de T. utriculariae bajo diferentes configuraciones experimentales(Figura 4A,B) que se vuelven a calcular en tasas de admisión bacteriana por hora(Figura 4 C,D) detectaren en trampas jóvenes, maduras y viejas. Curiosamente en las trampas, se detectaron poblaciones portadoras de cloroplasto de los ciliados T. utriculariae, mientras que las poblaciones apócloras de T. utriculariae fueron aisladas de las trampas y mantenidas en suspensión bacteriana mixta granos de trigo en la oscuridad (para más detalles, véase la Figura 1 en una publicación anterior26).
Las poblaciones portadoras de cloroplastoviven en trampas iluminadas por la luz; por lo tanto, los cloroplastos pueden proporcionar una fuente de carbono orgánico adicional y oxígeno al huésped de ciliar. Una de las hipótesis probadas fue que las poblaciones de ciliar acloroados pastaban bacterias significativamente más rápido, ya que las bacterias representan la única fuente de partículas de carbono orgánico disponible para las subpoblaciones aisladas de crecimiento oscuro del ciliar.
De hecho, si bien no hubo diferencias significativas en las tasas de bacterimarfil de los ciliados que viven en trampas jóvenes, maduras y viejas de Utricularia reflexa (Figura 4A,C), las poblaciones apóclóricas de T. utriculariae pastaron bacterias significativamente (p < 0.01, prueba Kruskal-Wallis; seguida de la prueba de comparación múltiple de Dunn, p < 0.05), aproximadamente 3 veces más rápido que los ciliados portadores de cloroplasto que viven en trampas jóvenes, maduras y viejas(Figura 4C,D). Tenga en cuenta que, de nuevo, tanto las cantidades del trazador como los tiempos de incubación(Figura 4A,B,superior) se modificaron para optimizar el número de FLB por celda (generalmente entre 1-15), con valores medios y medianos alrededor de 5 FLB/ciliado. Estas cifras son distinguibles en las vacuolas de los alimentos ciliados y permiten un recuento preciso de los trazadores. Sin embargo, expresado en un número absoluto de bacterias pastadas por hora, las poblaciones de cloroplasto y apócloro pastaban aproximadamente 350 y 1.000 bacterias ciliadas por hora, respectivamente. Esta configuración experimental aportó nuevos conocimientos sobre los rasgos metabólicos y fisiológicos de dos subpoblaciones distintas de las mismas especies ciliadas que viven bajo restricciones ambientales sorprendentemente diferentes25,26, 27.
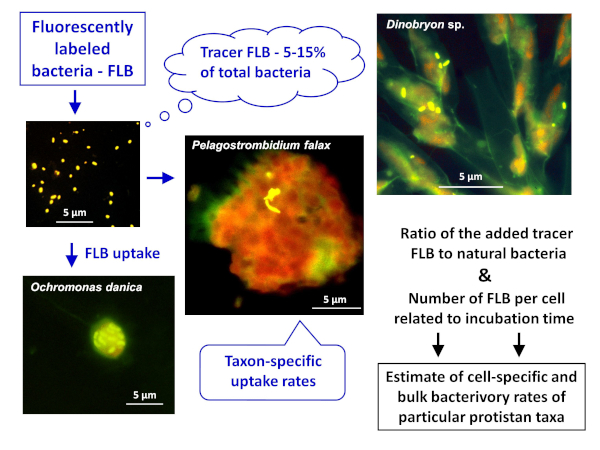
Figura 1 : Flujo de trabajo de uso de bacterias etiquetadas fluorescentes (FLB) para estimar las tasas de pastoreo específicas de células y especies de la relación entre el trazador ingerido FLB y el número total de bacterias naturales en la muestra. Para obtener más información, consulte la sección 7 del protocolo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Ejemplos de células ciliada a partir de plancton de un estanque de peces eutrófico. Los ejemplos se muestran en el estanque con FLB contable en células ciliadas (generalmente 1-10 FLB trazador por célula, los dos microfotograps izquierdos) en comparación con un ciliado peritrichous Pelagovorticella natans (la microfotografía del lado derecho). Incluso durante un corto período de incubación de 5 minutos, se convirtió en "sobre-etiquetado" por el trazador FLB, haciendo que la cuantificación de la FLB ingerida sea inexacta o casiimposible. En este caso, se sugiere disminuir la cantidad del marcador a 1.5%-3% de las bacterias totales. Sin embargo, generalmente tanto las cantidades del trazador como los tiempos de incubación se pueden manipular para optimizar el número de FLB ingeridos por celda. Para obtener más información, consulte la sección 7 del protocolo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3 : Gráficas de caja y bigote de números de FLB por célula de Halteria sp. desde el embalse de éímov (Exp I) (A), recalculadas a tasas de acumulación bacteriana por hora (B). Los datos se detectaron en diferentes configuraciones estacionales, representadas por cuatro ejemplos de abril a septiembre. La parte superior del panel A muestra información sobre la temperatura del agua, diferentes trazadores FLB añadidos (%), y diferentes tiempos de incubación de muestras. Cabe señalar que estos dos últimos parámetros se pueden modificar para optimizar el número de FLB por celdas, con valores medios (línea completa) y medianas (línea discontinua) aproximadamente entre 5-10 FLB por celda ciliada (A). Las barras muestran los percentiles 25 y 75 de todos los datos (50-180 celdas inspeccionadas) y los bigotes son sinónimo de percentiles 1 y 99. (B) Diferentes letras pequeñas indican diferencias significativas en las tasas de bacterivory específicas de las células de Halteria sp. durante el período estudiado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4 : Diagramas de caja y bigote de números de FLB por celda. Las gráficas se muestran de Tetrahymena utriculariae con cloroplasto a partir de tratamientos triplicados de trampas jóvenes, maduras y viejas de Utricularia reflexa (Exp II) (A), recalculadas a tasas de acumulación bacteriana por hora (C). Los datos se compararon con las tasas de acumulación bacteriana de las poblaciones apóclólicas duplicadas de T. utriculariae (B,D) aisladas de las trampas pero mantenidas en suspensión bacteriana mixta que crecen en granos de trigo en la oscuridad. En la parte superior de los paneles A y B, se añadieron diferentes trazadores FLB (%) y se muestran diferentes momentos de incubación de muestras. Cabe señalar que estos dos últimos parámetros se modificaron para optimizar el número de FLB por celdas, con valores medios (línea completa) y medianas (línea discontinua) aproximadamente entre 5-10 FLB por celda ciliada (A,B). Las barras muestran los percentiles 5 y 95 de todos los datos (50-100 celdas inspeccionadas), y los bigotes son sinónimo de percentiles 1 y 99. Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Descifrar la interacción trófica en los sistemas acuáticos siempre es un desafío28,especialmente a escalas de nanoplancton que involucran a los protistas y sus presas, bacterias. Cuando se trata de vías de acumulación de nutrientes y cuantificación, la aplicación de métodos utilizados con éxito en niveles tróficos más altos es menos posible, debido a la alta complejidad de las interacciones bióticas. Estos incluyen, por ejemplo, enfoques estables de etiquetado de isótopos. Este protocolo muestra las ventajas de utilizar la microscopía de epifluorescencia y las bacterias etiquetadas fluorescentemente como un marcador para rastrear y semi-cuantificar/estimar el flujo de carbono (presabacteriana: varios pastores de protistán, incluidos los pastores mixotricos29) vías a través de la base de redes de alimentos microbianos. Una de esas ventajas es la alta precisión del enfoque de una sola célula, y la otra es la resolución sin precedentes con respecto a la estructura de la comunidad de pastoreo y la distinción entre diferentes gremios funcionales, especies (Exp I), e incluso subpoblaciones de la misma especies (Exp II).
Pasos críticos en el protocolo
Hay varios pasos críticos en el protocolo, que pueden garantizar que las ventajas de la metodología se utilizan en todo su potencial. En primer lugar, una comprensión básica del entorno estudiado antes del inicio del experimento siempre es beneficiosa. Esto incluye el cribado microscópico de la diversidad y abundancia de pastores potenciales presentes, tamaños de presas bacterianas y distribución de presas 1) en la columna de agua (por ejemplo, un perfil vertical desde la epilimnion hasta la hiplimnion) y 2) en el caso de la hiplimnion) y 2) en el caso de la hiplimnion) y 2) en el caso de la hiplimnion) y 2) en el caso de la hiplimnion) y 2) en el caso de la hiplimnion) y 2) en el caso de la hiplimnion) embalses en forma de cañón, en el transecto de entrada de presa. En segundo lugar, una manipulación cuidadosa con las muestras recogidas garantizará resultados representativos. La temperatura es un factor extremadamente importante que afecta a la mayoría de los procesos microbianos12,incluidas las tasas de pastoreo protista(Figura 3).
En tercer lugar, la manipulación de la cantidad de trazador añadida en función de la cuantificación de las células bacterianas o el tipo de pastor en la muestra garantizará que se eliminen los problemas con el etiquetado excesivo(Figura 2). Cabe señalar que hay un espectro muy amplio en las tasas de ingesta específicas de especies ciliadas (para más detalles, véase el paso 7.2); por lo tanto, para aplicar el protocolo adecuadamente, es esencial el conocimiento previo de las principales especies ciliada con sus tasas de participación en el curso de tiempo. Se recomienda encarecidamente realizar experimentos preliminares con diferentes cantidades de trazador para evitar posibles preetiquetados ciliados (ninguno o muy pocos FLB se toman por célula ciliada, produciendo datos estadísticamente no sólidos) o sobreetiquetado (aparece como un gran número de FLB formando "nubes de FLB condensadas" o bandadas en vacuolas alimentarias ciliadas embaladas por los trazadores, limitando así severamente su cuantificación precisa; ver el ejemplo superior derecho en la Figura 2). También hay que señalar que los tiempos de incubación con FLB son generalmente más cortos que 30 min, ya que el tiempo medio de digestión de picoplancton por ciliados es de alrededor de 1,5 h, y comienza la digestión (las células de picoplancton ingeridos pierden su forma y color típicos) aproximadamente después de 45-60 min30. Del mismo modo, es necesario lograr una dilución y distribución óptimas de las muestras en el filtro antes de la visualización microscópica para obtener resultados precisos.
Modificaciones y solución de problemas
Los pasos principales, las posibles modificaciones y las modificaciones de solución de problemas de la técnica se ilustran en la Figura 1 y la Figura 2. Además, cabe señalar que en los casos de altas concentraciones de partículas detritales, células de fitoplancton o sus colonias en plancton, tales muestras 1) deben diluirse correspondientemente para lograr una etapa en la que las células de pastoreo individuales distinguidas en la superficie del filtro y 2) se someten a la cuantificación del contenido de vacuolos alimentarios.
Limitaciones
La principal limitación para la aplicación exitosa de este método radica en la presencia de varios detritus orgánicos o abundantes partículas inorgánicas/orgánicas con bacterias adjuntas o agregados en cantidades que impiden la visualización clara de muestras bajo la epifluorescencia microscopio y estimación precisa de una cantidad de trazador añadida. Cabe señalar que la técnica de trazador presentada funciona principalmente con bacterias libres (es decir, suspendidas) que no están unidas a partículas. Sin embargo, sobre la base de nuestra propia experiencia y referencias literarias (ver publicaciones anteriores2,4,8,10,16,18,21 ,26), la metodología presentada es adecuada para la mayoría de los entornos acuáticos. Se proporcionan ejemplos de dos sistemas naturales y contrastantes que difieren en el estado trófico, el contenido de detritus y la diversidad y los números de pastores(Figura 3 y Figura 4).
Importancia del enfoque con respecto a los métodos existentes
Es importante destacar que, a partir del conocimiento de la abundancia de un taxón/taxa de bacterívoros y sus tasas bacterídores específicas de cada especie, se puede calcular la tasa bacterívora a granel del taxón protistán (o conjunto total de ciliados). Si este enfoque se aplica a entornos de plancton naturales de forma concomitante tanto para flagelados y ciliados heterotróficos (que representan a los principales pastores de bacterioplancton2,6,7), el protistán el tiempo de rotación inducido por el pastoreo de las poblaciones bacterianas en un entorno determinado puede estimarse16,17,18,22. Estos datos tienen una importancia fundamental para la estimación de la dinámica del flujo de carbono en las redes alimentarias microbianas.
Aplicaciones futuras
Hay otros entornos específicos en los que este método, con algunas modificaciones, se puede utilizar correctamente. Estos incluyen sistemas de lodos activados, ecosistemas de rumen, sedimentos acuáticos y estanques de peces hipertróficos17. Sin embargo, la aplicación en estos entornos ricos en nutrientes y microbios requiere pruebas preliminares para optimizar el protocolo con respecto al tamaño adecuado, la morfología y el número de FLB de trazador que pueden imitar la distribución típica del tamaño y otras características bacterias de presa inherentes al medio ambiente.
Actualmente, existe un interés creciente en combinar este enfoque con la fluorescencia de fluorescencia de deposición de reportero catalizada in situ (CARD-FISH), en la que se detecta la identidad de la célula de pastoreo (por ejemplo, flagelación heterotrófica) con un flagelo específico FISH-probe y la tasa de admisión se basa en el contenido de FLB en las vacuolas alimentarias de la célula flagelada en la misma diapositiva microscópica31. Un nuevo enfoque sofisticado llamado doble hibridación32 es una combinación de sondas FISH a los niveles de la célula depredadora y las bacterias de presas (que también están etiquetadas específicamente por una cepa filogenética, una sonda FISH específica del linaje bacteriano). El enfoque es elegante pero también requiere mucho tiempo y requiere habilidades y experiencia específicas31,32, mientras que la aplicación de varias modificaciones del enfoque de adopción de FLB se puede adoptar más fácilmente para su uso rutinario en laboratorios.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores no tienen nada que revelar.
Acknowledgments
Este estudio fue apoyado por la Fundación Checa de Ciencias bajo la beca de investigación 13-00243S y 19-16554S otorgada a K. . y D. S., respectivamente. Este artículo también fue apoyado por el proyecto "Biomanipulación como herramienta para mejorar la calidad del agua de los embalses de presas" (No CZ.02.1.01/0.0/0.0/16_025/0007417), financiado por el Fondo Europeo de Desarrollo Regional, en El Programa Operativo de Investigación, Desarrollo y Educación.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2-µm pore-size filters | SPI supplies, https://www.2spi.com/ | B0225-MB | Black, polycarbonate track etch membrane filters, diameter approprite for filtering apparatus used |
| 5-(4,6-dichlorotriazin-2-yl) aminofluorescein (DTAF) | Any brand | ||
| Automatic pipettes with adjustable volumes | Any brand, various sizes | ||
| Centrifuge | 22 000 x g | ||
| Cryovials | Any brand, 2 mL size | ||
| DAPI (4´,6-Diamidino-2´-phenylindole dihydrochloride) | Any brand | 1 mg ml-1 | |
| Epiflorescence microscope | Magnification from 400 x up to 1000 x | ||
| Filters appropriate for viewing in the DAPI and DTAF range | |||
| Counting grid in one of the oculars | |||
| Filtering apparatus | Usually with a diameter of 25 mm | ||
| Formaldehyde | A brand for microscopy | ||
| Glutaraldehyde | A brand for microscopy | ||
| Immersion oil for microscopy | Specific oil with low fluorescence | ||
| Lugol´s solution | Any brand or see comment | Make an alkaline Lugol' solution as follows: Solution 1 - dissolve 10 g of potassium iodide in 20 ml in MQ water, then add 5 g of iodine. Solution 2 - add 5 g of sodium acetate to 50 ml of MQ water. Add the solution 2 to the solution 1 and thoroughly mix | |
| Methanol stabilized formalin | Any brand available for microscopy purposes | ||
| Microscope slides and cover slips | Any brand produced for microscopy purposes | ||
| MQ water for diluting samples | Any brand |
||
| Phosphate-buffered saline (PBS; pH = 9) | Any brand | 0.05 M Na2HPO4-NaCl solution, adjusted to pH 9 | |
| PPi-saline buffer | Any brand | 0.02 M Na4P2O7-NaCl solution. Add 0.53 g Na4P2O7 to 100 ml of MQ water plus 0.85 g NaCl | |
| Sampling device | Appropriate for obtaining representative sample | e.g. Friedinger sampler for lake plankton | |
| Sodium thiosulfate solution | Any brand | 3% solution is used in the protocol | |
| Sonicator | Any brand | 30 W | |
| Vortex | Any brand allowing thorough mixing of the solutes and samples | ||
| Water bath | Any brand allowing temperature to be maintained at 60 °C |
References
- Azam, F., et al. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series. 10, 257-263 (1983).
- Šimek, K., et al. A finely tuned symphony of factors modulates the microbial food web of a freshwater reservoir in spring. Limnology & Oceanography. 59, 1477-1492 (2014).
- Šimek, K., et al. Bacterial prey food characteristics modulate community growth response of freshwater bacterivorous flagellates. Limnology & Oceanography. 63, 484-502 (2018).
- Šimek, K., et al. Changes in bacterial community composition, dynamics and viral mortality rates associated with enhanced flagellate grazing in a meso-eutrophic reservoir. Applied & Environmental Microbiology. 67, 2723-2733 (2001).
- Jürgens, K., Matz, C. Predation as a shaping force for the phenotypic and genotypic composition of planktonic bacteria. Antonie Van Leeuwenhoek. 81, 413-434 (2002).
- Pernthaler, J. Predation on prokaryotes in the water column and its ecological implications. Nature Reviews Microbiology. 3, 537-546 (2005).
- Berninger, U. B., Finlay, J., Kuuppo-Leinikki, P. Protozoan control of bacterial abundances in freshwaters. Limnology and Oceanography. 36, 139-147 (1991).
- Sherr, E. B., Sherr, B. F. Protistan grazing rates via uptake of fluorescently labeled prey. Handbook of Methods in Aquatic Microbial Ecology. Kemp, P. F., Sherr, B. F., Sherr, E. B., Cole, J. J. , Lewis Publishers. Boca Raton, Florida. 695-701 (1993).
- Vazquez-Dominguez, E., Peters, F., Gasol, J. M., Vaqué, D. Measuring the grazing losses of picoplankton: methodological improvements in the use of fluorescently tracers combined with flow cytometry. Aquatic Microbial Ecology. 20, 119-128 (1999).
- Šimek, K., et al. Ecological role and bacterial grazing of Halteria spp.: Small oligotrichs as dominant pelagic ciliate bacterivores. Aquatic Microbial Ecology. 22, 43-56 (2000).
- Montagnes, D. J. S., et al. Selective feeding behaviour of key free-living protists: avenues for continued study. Aquatic Microbial Ecology. 53, 83-98 (2008).
- Kirchman, D. L. Processes in Microbial Ecology. 2nd Edition. , Oxford University Press. Oxford, UK. (2018).
- Porter, K. G., Feig, Y. S. The use of DAPI for identifying and counting aquatic microflora. Limnology and Oceanography. 25, 943-948 (1980).
- Foissner, W., Berger, H. A user-friendly guide to the ciliates (Protozoa, Ciliophora) commonly used by hydrobiologists as bioindicators in rivers, lakes, and waste waters, with notes on their ecology. Freshwater Biology. 35, 375-482 (1996).
- Foissner, W., Berger, H., Schaumburg, J. Identification and ecology of limnetic plankton ciliates. Informationsberichte des Bayer Landesamtes für Wasserwirtschaft Heft. , 3-99 (1999).
- Šimek, K., et al. Ciliate grazing on picoplankton in a eutrophic reservoir during the summer phytoplankton maximum: a study at the species and community level. Limnology & Oceanography. 40, 1077-1090 (1995).
- Skibbe, O. An improved quantitative protargol stain for ciliates and other planktonic protists. Archiv für. Hydrobiolgie. 130, 339-347 (1994).
- Macek, M., et al. Growth rates of dominant planktonic ciliates in two freshwater bodies of different trophic degree. Journal of Plankton Research. 18, 463-481 (1996).
- Šimek, K., et al. Microbial food webs in hypertrophic fishponds: omnivorous ciliate taxa are major protistan bacterivores. Limnology & Oceanography. , in press (2019).
- Jezbera, J., et al. Major freshwater bacterioplankton groups: Contrasting trends in distribution of Limnohabitans and Polynucleobacter lineages along a pH gradient of 72 habitats. FEMS Microbiology Ecology. 81, 467-479 (2012).
- Kasalický, V., et al. The diversity of the Limnohabitans genus, an important group of freshwater bacterioplankton, by characterization of 35 isolated strains. PLoS One. 8, 58209 (2013).
- Stabell, T. Ciliate bacterivory in epilimnetic waters. Aquatic Microbial Ecology. 10, 265-272 (1996).
- Zingel, P., et al. Ciliates are the dominant grazers on pico- and nanoplankton in a shallow, naturally highly eutrophic lake. Microbial Ecology. 53, 134-142 (2007).
- Bickel, S. L., Tang, K. W., Grossart, H. P. Ciliate epibionts associated with crustacean zooplankton in german lakes: distribution, motility, and bacterivory. Frontiers in Microbiology. 3 (243), (2012).
- Sirová, D., et al. Hunters or gardeners? Linking community structure and function of trap-associated microbes to the nutrient acquisition strategy of a carnivorous plant. Microbiome. 6, 225 (2018).
- Šimek, K., et al. Ecological traits of a zoochlorellae-bearing Tetrahymena sp. (Ciliophora) living in traps of the carnivorous aquatic plant Utricularia reflexa. Journal of Eukaryotic Microbiology. 64, 336-348 (2017).
- Pitsch, G., et al. The green Tetrahymena utriculariae n. sp. (Ciliophora, Oligohymenophorea) with its endosymbiotic algae (Micractinium sp.), living in the feeding traps of a carnivorous aquatic plant. Journal of Eukaryotic Microbiology. 64, 322-335 (2017).
- Nielsen, J. M., Clare, E. L., Hayden, B., Brett, M. T., Kratina, P. Diet tracing in ecology: Method comparison and selection. Methods in Ecology and Evaluation. 9, 278-291 (2018).
- Beisner, B. E., Grossart, H. P., Gasol, J. M. A guide to methods for estimating phago-mixotrophy in nanophytoplankton. Journal of Plankton Research. , 1-13 (2019).
- Dolan, J. D., Šimek, K. Processing of ingested matter in Strombidium sulcatum, a marine ciliate (Oligotrichida). Limnology and Oceanography. 42, 393-397 (1997).
- Massana, R., et al. Grazing rates and functional diversity of uncultured heterotrophic flagellates. The ISME Journal. 3, 588-596 (2009).
- Grujčić, V., et al. Cryptophyta as major freshwater bacterivores in experiments with manipulated bacterial prey. The ISME Journal. 12, 1668-1681 (2018).



