Summary
Presenteras här är ett protokoll för en encellig, epifluorescens mikroskopi-baserad teknik för att kvantifiera betes hastigheter i akvatiska rovdjur Eukaryoter med hög precision och taxonomisk upplösning.
Abstract
Att belysa trofiska interaktioner, såsom predation och dess effekter, är en flitig uppgift för många forskare inom ekologi. Studiet av mikrobiella samhällen har många begränsningar, och att fastställa ett rovdjur, bytesdjur, och underprissättning är ofta svårt. Presenteras här är en optimerad metod som bygger på tillsats av fluorescerande märkta bytesdjur som en spårämne, som möjliggör tillförlitlig kvantifiering av betes graden i akvatiska rovdjur Eukaryoter och uppskattning av näringsämne överföring till högre trofiska nivåer.
Introduction
Heterotrofiska prokaryoter är en viktig biologisk komponent i akvatiska system och står för en betydande del av plankton biomassa1,2,3. Faktorer som styr deras överflöd, mångfald och aktivitet är avgörande för att förstå deras roll i biogeokemisk cykling (dvs. ödet för organiskt kol och andra näringsämnen och flödet av energi från prokaryoter till högre trofiska nivåer). Protozoer bete är en av dessa viktiga faktorer. Bakterivory av heterotrofiska nanoflagellater och ciliater lägger en stark uppifrån och ned kontroll över prokaryotiska överflöd, gemenskap funktion, struktur, mångfald, och även cellulära morfologi och tillväxthastighet av särskilda bakterie grupper4, 5,6. I vissa system, protister fungera som den främsta orsaken till bakteriell dödlighet6,7.
Den standardmetod som används för att bedöma protozoiska bakterier, som har använts under en tid nu, innebär användning av fluorescerande märkta bakterier (FLB) som bytes analoger och epifluorescens mikroskopi. Cell-specifika upptag hastigheter kan bestämmas genom att kvantifiera antalet märkta bytes partiklar i protistan mat vakuoler under en vald tid kurs8. Det finns flera fördelar med detta tillvägagångssätt. Tracer tillsätts naturliga prover med naturliga rovdjur och byten assemblages. Det finns minimal prov manipulation före inkubering, minsta prov ändring av den tillförda FLB-spårningstiden och inkubations tiderna är korta för att säkerställa sunda resultat som erhålls under förhållanden nära in situ. Alternativt, i miljöer med ett lågt antal bakteriehaltiga protister eller zooplankton (t. ex. offshore Marina system), kan försvinnanden av FLB som tillsätts i prover i låga mängder (2%-3% spårämne) detekteras via flödescytometri på lång sikt (12-24 h) inkubations experiment. Därefter kvantifieras antalet FLB vid start-och slutpunkterna (som integrerar effekten av alla bakterienorer) med flödescytometri (för detaljer, se tidigare publikation9). En sådan parameter utgör dock endast en sammanlagd aggregerad bakterieränta som inte direkt kan hänföras till någon särskild grupp eller art av djurplankton Grazer.
Övergripande, kvantifiera protistan art-eller morfotypspecifika bakteriella dödligheten i vattenmiljön exakt och med ekologisk innebörd kan vara utmanande. Vissa protister är selektiva betare, och storleken och cellens form av den tillagda FLB Tracer kan snedvrida naturliga satser av byten intag10,11. Dessutom är protistan aktivitet och metabolism mycket temperaturkänsliga12; Därför måste mängden tillsatt FLB Tracer noggrant manipuleras för varje enskilt prov typ (inte bara baserat på det naturliga överflöd, storlek, och morfologi av bakterier och rådande typer av bakteriemedel, men också på temperatur). De flesta studier fokuserar på bulk protistan bete verksamhet; bakterien i specifika protistan-arter har dock ofta ett mycket högre informationsvärde och kan vara att föredra. I detta fall behövs taxonomisk kunskap om de protistiska arter som finns i ett prov och förståelse för deras beteende. Därför krävs avsevärda mängder tid och arbetskraft för att uppnå sunda resultat på artspecifika nivåer av bakterien som kan hänföras till en viss protistan-grupp eller art.
Trots dessa svårigheter, detta tillvägagångssätt är fortfarande det lämpligaste verktyget för närvarande för att bedöma protistan bacterivory i naturliga miljöer. Presenteras här är en heltäckande, lätt att följa metod för att använda FLB som en spårämne i akvatiska mikrobiella ekologi studier. Alla de problematiska aspekterna av tillvägagångssättet redovisas och ett förbättrat arbetsflöde beskrivs, med två experiment från kontrasterande miljöer och kontrasterande ciliatarter som exempel.
Den första fallstudien utfördes i en epilimnetisk miljö från mesotrofiska římov-vattenreservoaren i Tjeckien, som visar Grazer-och bakterie förekomster som är jämförbara med de flesta ytsötvatten-kroppar (jfr.5,7). Den andra fallstudien utfördes i den mycket specifika miljön inne i fällor av vattenlevande köttätande växten Utricularia Auktor, som är värd för extremt höga antal både betande mixotrofiska ciliater (Tetrahymena utriculariae) och bakterieceller. Beräkningar av cellspecifika betes hastigheter och bakteriella stående bestånd i båda prov typerna visas. En rad ekologiska tolkningar av resultaten diskuteras sedan, och exempel på möjliga uppföljningsstudier föreslås slutligen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. provtagning
-
Insamling av reservoar vattenprov: den första fallstudien (exp i, lägre naturliga in situ Predator och Prey överflöd system)
- Samla in vattenprover från önskad plats på lämpligt djup. Förvara proverna i en temperaturstyrd kylare fylld med in situ-temperatur (Undvik temperaturchock; det bör noteras att upptagningsgraden av protister är temperaturberoende) under transporten till laboratoriet.
Anmärkning: vår provtagning utfördes i den meso-eutrofierade Canyon-formade Římov-reservoaren (södra Böhmen, volym 34,5 x 106 m3, maximal djup 43 m, genomsnittlig retentionstid 100 dagar, dimictic). Provtagningsplatsen var placerad på ett 30 meters djup, nära dammen. Ett blandat prov på en 0,5 m djup samlades in av en 2-l Friedinger sampler. - Fortsätt till avsnitt 1,2 så snart som möjligt.
- Samla in vattenprover från önskad plats på lämpligt djup. Förvara proverna i en temperaturstyrd kylare fylld med in situ-temperatur (Undvik temperaturchock; det bör noteras att upptagningsgraden av protister är temperaturberoende) under transporten till laboratoriet.
-
Insamling av vätska från fällor av köttätande Utricularia Auktor växter: den andra fallstudien (exp II; ett system med höga rovdjur och byten överflöd, extremt liten provvolym)
- Skaka försiktigt växterna under vattnet, ta bort från odlings behållaren och placera dem på absorberande material för att absorbera överflödigt vatten. Beroende på robustheten hos växterna och storleken på fällorna, Välj 8-10 växt individer.
- Dela varje skott i ungefär lika delar genom att räkna lövnoder med svällande organ. Varje shoot segment kommer att tjäna till att samla blandade prover som representerar unga, medelålders, och gamla fällor.
- Fäst ett tunt glas kapillär och Eppendorf injektionsflaska för provinsamling till en Peristaltisk pump. Fortsätt med att sätta in kapillärspetsen i fällans öppning. Med hjälp av vakuumpumpen, suga ut all vätska från varje fälla tills 900 ± 100 μL av fällan vätska samlas in för varje fälla ålderskategori.
- Använd tre exemplar delprover på 200 μl av den poolade fällan vätska för protistan bete experiment. Behandla dessa omedelbart så som beskrivs i avsnitt 3. Bevara resterande ± 300 μL av provet för alla andra analyser av mikrobiella komponenter som lever i vätskan, enligt beskrivningen nedan (avsnitt 2).
- Fortsätt omedelbart till avsnitt 2.
2. fixering av insamlade prover
- EXP I och II: fixera delprov av vatten/trap-vätska för bakterie uppräkning (avsnitt 4; cirka 20 mL respektive 0,3 mL) med formaldehyd i minst 1 h för att erhålla en 2% slutlig volym: volym koncentration i varje prov.
Obs: hantera formaldehyd uteslutande i draghuv och Använd handskar hela tiden medan du manipulerar prover.
3. prov filtrering
- Provspädning (exp I): ingen utspädning behövs för reservoarvattenproverna. (Exp II): Späd provet med svällvätska 10X-100x med ett partikel fritt MQ-vatten för att uppnå en lämplig fördelning av mål mikroberna på filter ytorna före räkning via epifluorescens-mikroskopi.
- Filtrera 1-2 mL (exp I) av reservoarvattnet eller 10-30 μL (exp II) i fällvätskans delprov för bakterieräkning på svart filter med porstorlek 0,2 μm, med hjälp av en filtrertratt (25 mm diameter).
- Fläcken filtren med DAPI (4 ', 6-diamidino-2 '-phenylindole dihydroklorid, 0,2% slutkoncentration) för 4 min.
Undvik hud-och arbets ytkontaminering och Använd handskar. - Placera filtret med koncentrerade mikrober på en droppe nedsänkning olja (för fluorescerande mikroskopi) på en Mikroskop bild. Placera en annan olje droppe på mitten av filtret och täck med en täckslip, att se till att oljan fördelas jämnt.
- Vid denna punkt, företrädesvis bearbeta prover omedelbart, eller alternativt, förvara dem i frysen (-20 ° c) i flera veckor till månader tills ytterligare analys.
4. uppräkning av bakterie tal på filtren
- Placera bilden under epifluorescensmikroskopet (med filteruppsättningen som motsvarar fluorochromes DAPI). Placera en 10 x 10 räkna rutnät i en av oculars. Flytta bilden till en slumpmässig position.
- Kvantifiera bakterieceller (blå fluorescens) i området för räkna rutnät (under förstoringen 1000X). I räkningarna, inkludera cellerna som korsar de vänstra och övre kanterna av inventerings rutnätet, medan de som finns över höger och underkanter.
- Flytta till en annan slumpmässig position och upprepa uppräkning på minst 10-15 räkna rutnät, som uppgår till 500 celler räknas totalt.
- Fastställa en omräkningsfaktor för ett visst Mikroskop och förstoring, baserat på kunskap om förhållandet mellan området för ett rutnät till den totala effektiva filtreringen området av filtret. Dividera det totala antalet celler som räknas med antalet rutnät, vilket ger ett genomsnittligt antal bakterier per rutnät.
- Multiplicera den senare parametern med den fastställda konverteringsfaktorn och normalisera det resulterande antalet per mL av ett prov (beroende på mängden filtrerat prov) för att erhålla det totala bakterie överflöd per mL.
5. bestämning av förekomst av protistan
- Fixera vattenprovet (exp I) eller avfällnings vätska (exp II) delprover med antingen glutaraldehyd (1% slutlig koncentration, mer lämplig för prover med förekomst av klorofyll som innehåller partiklar som skall bearbetas dagar till veckor efter fixering) eller med hjälp av Formol-Thiosulfat decolorizationen teknik som anges nedan.
Notera: båda bevarande teknikerna förhindrar egestion av det intas materiellt från matvakuoler av protister8. - När det gäller Formol-tiosulfat avkoloniseringsteknik, tillsätt 100 μL/1 μL av Lugols lösning i 20 mL/200 μL av vatten/trap Fluid subprovet (exp I/exp II, respektive).
- Följ omedelbart med tillsats av 0,5 mL/50 μL boratbuffrad formalin och därefter 20 μL/2 μL 3% natriumtiosulfat (exp I/exp II).
Anmärkning: natriumtiosulfat förkolnar den gula färgen på lugol för att möjliggöra observation av celler under epifluorescensmikroskopet8. - Filtrera en känd volym av provet (beroende på antalet mål protister) på 1 μm porstorlek svart polykarbonatfilter.
- Uppskatta antalet protistiska arter är genom att räkna minst 200 celler under förstoring 600x med hjälp av räknenätet (se ovan).
- Sänk volymen av provet under ett vakuum i filtrertratten med lågvakuum till ca 2 mL. Släpp sedan under trycket och tillsätt DAPI fluorokromkonjugerat (4 ', 6-diamidino-2-phenylindole dihydroklorid13, 0,2% slutkoncentration) för 2 min.
6. fastställande av en gemenskapsstruktur för ciliater i plankton prov
Obs: ciliate samhällen i sötvatten livsmiljöer är mycket varierande14,15,16, 18, och deras mikroskopiska beslutsamhet är utmanande. Att sortera ciliatgrupperna i funktionella gillen10,14,16,17 möjliggör en mer detaljerad analys av olika ciliatgrupper som pelagiska bakterier.
- Utvärdera ciliate gemenskapsstruktur genom att kombinera följande:
- DAPI-färgade prover i epifluorescensmikroskopi (för att lokalisera ciliatceller med ljus fluorescens av makro-och mikro-kärnor av olika storlekar och morfologi) kombinerat med upptaget av fluorescerande märkta bakterier (FLB8; för detaljer, Se nedan), spårning av ciliater förmåga att livnära sig på bakterier.
- Levande prov observation i utvalda fall17,19. För mer information om ovanstående metoder och kriterier som används för gruppering av ciliater i olika taxonomiska kategorier, se tidigare publikationer16,17.
Anmärkning: citerade studier har indikerat att bland ciliater, allätare arter från Stichotrichia (släktena Halteria och pelagohalteria) och oligotrichia (nämligen rimostrombidium spp.) är de viktigaste pelagiska konsumenter av bakterioplankton i en stor majoritet av sötvatten Habitat10,17,18.
7. uppskattning av betes priset för ciliat
- Beräkna upptagshastigheten av ciliater på bakterier baserat på förändringar i det genomsnittliga antalet spårämne [dvs., FLB8 per ciliat relaterat till tiden för inkubering (5-15 min)] och Tracer mängd FLB läggas, redovisning högst för 5%-15% av de totala bakterierna.
- För att jämföra upptag priser bland olika protistan arter, normalisera upptagnings graden som antalet bakterier per ciliat per timme, med beräkningar baserade på den faktiska inkubationstiden och andelen Tracer FLB läggas.
Anmärkning: den allmänna ordningen för FLB-metoden för att uppskatta både cell-eller artspecifika och bulkbakterier i naturliga prover återges i figur 1. - Beredning av FLB från bakteriestammar infödda till en sötvatten miljö8
- Välj en lämplig storlek (genomsnittlig cell volym = MCV) och morfologi av bakterier så att de effektivt efterlikna de typiska storlekarna av bakterioplankton/bakterieceller i det akvatiska systemet utreds.
Anmärkning: för exp I, en blandning av isolerade stammar från studieplatsen för släktet Limnohabitans och Polynucleobacter användes (dvs, typiskt, mycket riklig bakterioplankton i sjöar och dammar)20. För detaljer om morfologi och storlekar av stammarna, se tidigare publikationer3,17,18,21. - Skörda bakterieceller från kulturen genom centrifugering (5 000 x g) i 15 minuter vid den tidiga stationära fasen och blanda dem med ett numeriskt förhållande som ger MCV ± SD av cellerna i blandningen som motsvarar den typiska MCV-bakterien på den valda platsen.
- Suspendera pelletsen i 10 mL fosfatbuffrad saltlösning (PBS; pH = 9).
- Tillsätt 2 mg gul-grön fluorescerande färgämne 5-(4, 6-diklortriazin-2-yl) aminofluorescein (DTAF, binder till proteiner) till cellsuspensionen i fosfat-saltlösning buffert, och inkubera i en 60 ° c vattenbad för 2 h.
- Efter inkubationen, Centrifugera cellerna, dekanera DTAF-lösningen och tvätta och centrifugera 3x med PBS.
- Efter den sista tvätten, Återsuspendera cellerna i 20 mL av PPi-saltlösning buffert.
- Vortex den FLB suspensionen och Pipettera 1,5 mL alikvoter i 2 mL Cryo-flaskor, sedan hålla frysta (vid-20 ° c) i PPi-saltlösning buffert tills användning.
- Pre-filter PPi-saltlösning buffert genom ett 0,2 μm polykarbonat filter för användning i nästa steg.
- För att bestämma FLB koncentration, överföra en liten alikvot (vanligtvis 20-40 μL) till 2 mL av partikel fria PPi-saltlösning buffert, Sonikera vid 30 W för flera 2 s skurar, och filtrera på 0,2 μm polykarbonat svart filter för uppräkning via epifluorescens mikroskopi (1, 000X förstoring) under optiska filterinställningar för DTAF (448 nm/520-540 nm).
- Välj en lämplig storlek (genomsnittlig cell volym = MCV) och morfologi av bakterier så att de effektivt efterlikna de typiska storlekarna av bakterioplankton/bakterieceller i det akvatiska systemet utreds.
- Spårteknik för uppskattning av bakteriens bakteriedödande
- För bete experiment i naturliga plankton livsmiljöer, fördela 300 mL prover i väl sköljas 1 L kolvar och inkubera vid in situ-temperaturen i 15 min (för att tillåta protister att återhämta sig från hanteringen chock).
- Lägg FLB spårämnen att utgöra 5%-15% av de totala bakterierna, med de belopp som tillsätts beroende på säsong och vattentemperatur.
Obs: det finns ett mycket brett, säsongsberoende spektrum i ciliatartspecifika upptagningsfrekvenser som spänner över flera storleksordningar (dvs. från 101-104 bakterier ciliate-1 per timme)10,16, 17,18,22,23,24. - I perioder av ökad förekomst av ciliater med hög upptagningsförmåga (vanligtvis under sommaren), också köra en parallell inkubering med mycket låga FLB tillägg, utgör endast 2%-4% av totala bakterier för att undvika överdriven lastning av ciliate vakuoler av Tracer FLB (se exempel i figur 2).
- Inkubera ciliate/plankton prover med FLB för 5-15 min.
- Det finns två möjligheter för prov fixering för att förhindra egestion av det intagna materialet från mat vakuoler av protister8. Avsluta inkuberingarna genom tillsats av 1% glutaraldehyd (slutkoncentration som är mer lämplig för prover med klorofyll-innehållande partiklar, såsom alger). Alternativt, Använd 100 μL/10 μL av Lugols lösning i 20 mL/200 μL av delprovet för vatten/fälla vätska, omedelbart följt av tillsats av 0,5 mL/10 μL boratbuffrad formalin sedan 200 μL/2 μL 3% natriumtiosulfat (exp I/exp II).
- Efter tillsats av fixativ, låt proverna vila i minst 1 h i mörkret vid 4 ° c för att säkerställa noggrann bevarande av ciliatceller.
- Ta naturliga plankton subprover från 4-30 mL/10-30 μL (exp I/exp II, respektive; volymen beror på ciliatöverflöd) och fläcken med DAPI (slutlig koncentration 0,2% WT/Vol; mer information finns i steg 3,2 ovan).
- Passera genom 1 μm svarta filter och inspektera via epifluorescens mikroskopi att räkna ciliater (600x förstoring) och räkna upp antalet FLB spårämnen intas (främst vid 1000X förstoring) som beskrivs i tidigare publikationer2,17 . Inspektera proverna inom 7 dagar efter konservering.
- För att uppskatta total användning av protozoer/artspecifik bete, multiplicera de genomsnittliga upptagningsfrekvenserna för alla ciliater eller endast av de ciliatarter som upptäcks genom in situ-förekomst.
- Exempel på beräkning av per cells upptagningsgrad från in situ-data från Římov-vattenreservoaren beskrivs på följande sätt:
- Antag att den bakteriella koncentrationen är 3,55 x 106 bakterier/ml och Tracer FLB till är 0,25 x 106 FLB/ml, vilket ger en summa av 3,8 x 106 bakterier/ml av totala bakteriella partiklar (naturliga bakterier + FLB = 100% av bytes partiklar) tillgängliga för phagotrofiska protister i det naturliga provet.
Anmärkning: FLB spårämnen läggas därmed representera 6,58% (ett projekt på 0,25/0.038) av totala bakteriella partiklar. Det genomsnittliga antalet FLB per Halteria SP. är 6,2 FLB i 5 min inkuberingar. - För att normalisera upptaget per timme, Använd följande beräkning: (6,2 x 12)/(6.58/100) = 1131 bakterier per Halteria cell/h.
Anmärkning: för fler exempel på fördelningar av individuella upptagningar av Halteria SP. detekteras under varierande vattentemperaturer, mängder (som procent) av Tracer FLB tillsätts, och olika inkubationstider med FLB, se figur 3.
- Antag att den bakteriella koncentrationen är 3,55 x 106 bakterier/ml och Tracer FLB till är 0,25 x 106 FLB/ml, vilket ger en summa av 3,8 x 106 bakterier/ml av totala bakteriella partiklar (naturliga bakterier + FLB = 100% av bytes partiklar) tillgängliga för phagotrofiska protister i det naturliga provet.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Exempel experiment jag kördes i římov vattenreservoar (södra Böhmen, CZ), som är en naturlig plats med lägre naturliga in situ rovdjur och rovdjur överflöd. Representativa data rapporteras för den allätande ciliatarten halteria grandinella, som är en riklig och effektiv betare av picoplankton (< 2 μm) partiklar10,16,17,18 ,22. Figur 3 visar fält-och-Whisker-diagram med antal FLB per cell i halteria SP. från římov-reservoaren (figur 3A), som räknades om till bakterie upptag per timme (figur 3B) upptäcktes i fyra enskilda experiment som genomfördes i april, maj, augusti och september. Det var hög variation i ciliate upptag hastigheter, till stor del orsakas av temporala skillnader i vattentemperatur.
Det bör noteras att Q10 -parametern återspeglar det faktum att de mikrobiella processerna löper cirka 2,5 x snabbare med en temperaturökning på 10 ° c12, vilket också rymmer för ciliatupptagningshastigheter på bakterier. Med denna fysiologiska regel i åtanke, mycket olika proportioner av FLB och inkubationstider användes för olika säsonger (för detaljer, se figur 3A). Den förväntade temperatureffekten kompenserades därför och den experimentella inställningen gav ett optimerat medelvärde och medianvärden för upptagningsgraden ungefär mellan 5-10 FLB per ciliatcell. Generellt är dessa mängder intagna FLB lätt räknebara (se exempel i figur 2, två vänster fotografier), som genererar exakta uppskattningar av spårämne (mestadels mellan 1-15 FLB per ciliat) upptag priser. Men på grund av ändrad FLB Tracer tillsatt (%) och olika tidpunkter för provinkubering de absoluta värdena (uttryckta som antal bakterier som betats ciliat per timme) skilde sig signifikant (p < 0,01, Kruskal-Wallis-testet, följt av Dunns flerjämförelsetest, p < 0,05; se exempel i figur 3B) bland experimenten. Uppgifterna illustrerar också typiska naturliga variationer i absoluta bakteriopriser i de plankton populationer av Halteria grandinella, med en nära matchning av deras medelvärden och medelstora värden (figur 3).
I närvaro av mycket effektiva bakterieätande ciliater i prover, såsom peritrika ciliater, de kan bli tungt "över-märkt" av FLB i typiska spårmängder av 5%-10% av totala bakterier (se höger sida fotografi i figur 2). Detta kan starkt begränsa den exakta kvantifiering av intas FLB. I sådana fall föreslås det att köra ytterligare parallella inkuberingar med endast låga mängder FLB redovisning för endast 1.5%-3% av de totala bakterierna. I allmänhet kan dock både spårmängder och inkubationstider manipuleras för att optimera antalet FLB per cell (figur 2).
Exempel experiment II: visas är data från ett system med stora rovdjur och byten i överflöd, där endast en extremt liten provvolym finns tillgänglig för att experimentellt uppskatta bacterivory klassar av den Ciliate Tetrahymena utriculariae 25. det är en måttlig bakteriell betare som lever i hög förekomst uteslutande i fällor av köttätande Utricularia Auktor växter26,27. Figur 4 visar fält-och-Whisker-diagram av antalet FLB per cell i T. utriculariae under olika experimentella inställningar (figur 4a, B) som räknas om till bakterie upptag per timme (figur 4 C, D) upptäcks i unga, mogna och gamla fällor. Intressant i fällor, var klorplast-bärande populationer av ciliate T. utriculariae upptäcktes, medan apoklorpopulationer av t. utriculariae isolerades från fällor och upprätthålls på blandad bakteriell suspension växer på vete korn i mörker (för detaljer, se figur 1 i föregående publikation26).
De klorplastbärande populationerna lever i ljusbelysta fällor. Således kan kloroplaster ge en ytterligare organisk kol källa och syre till ciliate värd. En av hypoteserna testade var att apoklorciliatpopulationerna betade bakterier betydligt snabbare, eftersom bakterierna representerar den enda partikel källan för organiskt kol som finns tillgänglig för mörka isolerade subpopulationer av ciliatet.
Faktum är att även om det inte fanns några signifikanta skillnader i bacterivory priser av ciliater som lever i unga, mogna och gamla fällor av Utricularia Auktor (figur 4A, C), apoklorpopulationerna av T. utriculariae betade bakterier signifikant (p < 0,01, Kruskal-Wallis test; följt av Dunns flerjämförelsetest, p < 0,05), ungefär 3x snabbare än de klorplastbärande ciliaterna som lever i unga, mogna och gamla fällor (figur 4C, D). Observera att både spårmängder och inkubationstider (figur 4A, B, överst) ändrades för att optimera antalet FLB per cell (vanligen mellan 1-15), med medelvärden och medianvärden runt 5 FLB/ciliat. Dessa siffror är distinguishable i ciliate mat vakuoler och tillåten exakt spår räkning. Men uttryckt i absoluta tal av bakterier betade per timme, betade klorplastbärande och apoklorerade populationer cirka 350 och 1 000 bakterier ciliat per timme, respektive. Denna experimentella uppsättning förde med sig nya insikter i de metabola och fysiologiska egenskaperna hos två distinkta subpopulationer av samma ciliatarter som lever under slående olika miljörestriktioner25,26, 27.
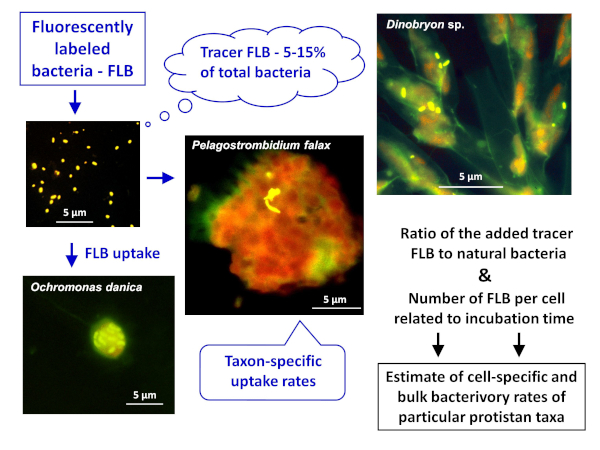
Figur 1 : Arbetsflöde för att använda fluorescerande märkta bakterier (FLB) för att uppskatta cell-och artspecifika betes hastigheter från förhållandet mellan intagna spårämne FLB till totalt antal naturliga bakterier i provet. För mer information, se avsnitt 7 i protokollet. Vänligen klicka här för att se en större version av denna siffra.

Figur 2 : Exempel på ciliatceller från plankton i en eutrofialfiskdamm. Exempel visas från dammen med räknebara FLB i ciliate celler (i allmänhet 1-10 Tracer FLB per cell, vänster två microphotograps) jämfört med en peritrika ciliate pelagovorticella natans (den högra sidan microfotografi). Även under en kort, 5 min inkubationstid, blev det "över-märkt" av Tracer FLB, vilket gör kvantifiering av intas FLB felaktiga eller nästan omöjligt. I detta fall, det föreslås att minska spårämne uppgår till 1.5%-3% av totala bakterier. Generellt kan dock både spårmängder och inkubationstider manipuleras för att optimera antalet FLB som intas per cell. För mer information, se avsnitt 7 i protokollet. Vänligen klicka här för att se en större version av denna siffra.

Figur 3 : Box-och-Whisker-diagram av antal FLB per cell av halteria SP. från římov-reservoaren (exp I) (a), omräknat till frekvenser för bakterie upptag per timme (B). Uppgifterna upptäcktes under olika säsongsmässiga inställningar, representerade med fyra exempel från april till september. Överst på panelen A visar information om vattentemperatur, olika FLB spårämnen läggas till (%), och olika tider av prov inkubering. Det bör noteras att de två sistnämnda parametrarna kan ändras för att optimera antalet FLB per celler, med genomsnittlig (full rad) och median (streckad linje) värden ungefär mellan 5-10 FLB per ciliatcell (a). Staplarna visar den 25 och 75: e percentiler av alla data (50-180 celler inspekteras) och morrhår står för 1: a och 99: e percentiler. B) olika små bokstäver visar på signifikanta skillnader i de cellspecifika bakterivvärdena för halteria SP. under den studerade perioden. Vänligen klicka här för att se en större version av denna siffra.

Figur 4 : Box-och-Whisker tomter av antal FLB per cell. Tomter visas av chloroplast-bärande Tetrahymena utriculariae från tre exemplar behandlingar av unga, mogna, och gamla fällor av Utricularia Auktor (exp II) (a), omräknat till frekvenser av bakteriell upptag per timme (C). Uppgifterna jämfördes med de bakteriella upptagningarna av de dubbla apoklorpopulationerna av T. utriculariae (B, D) som isolerats från fällor men som upprätthålls på blandad bakteriesuspension som växer på vete korn i mörker. På ovansidan av panelerna A och B har olika FLB-spårämnen lagts till (%) och olika tidpunkter för provinkubering visas. Det bör noteras att de två sistnämnda parametrarna ändrades för att optimera antalet FLB per celler, med genomsnittliga (full rad) och median (streckad linje) värden ungefär mellan 5-10 FLB per ciliatcell (a, B). Staplarna visar 5 och 95-percentiler av alla data (50-100 celler inspekterade), och morrhår står för 1: a och 99: e percentiler. Vänligen klicka här för att se en större version av denna siffra.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Dechiffrera trofiska interaktion i akvatiska system är alltid utmanande28, särskilt på nano-plankton skalor som involverar protister och deras byte, bakterier. När det kommer till näringsupptaget vägar och kvantifiering, tillämpning av metoder som framgångsrikt används vid högre trofiska nivåer är mindre möjligt, på grund av den höga komplexiteten av biotiska interaktioner. Dessa inkluderar till exempel stabila isotop märkningsmetoder. Detta protokoll visar fördelarna med att använda epifluorescensmikroskopi och fluorescerande märkta bakterier som ett spårämne för att spåra och semi-kvantifiera/uppskatta kolflödet (bakterie byte: olika protistan betare inklusive mixotrofa betare29) vägar genom basen av mikrobiella matduk. En sådan fördel är den höga noggrannheten i Single-cell-metoden, och den andra är den exempellösa resolutionen om Grazer gemenskapsstruktur och åtskillnad mellan olika funktionella gillen, arter (exp I), och även subpopulationer av samma arter (exp II).
Kritiska steg i protokollet
Det finns flera kritiska steg i protokollet, som kan säkerställa att fördelarna med metoden utnyttjas till sin fulla potential. Först, en grundläggande förståelse för den studerade miljön före inledningen av experimentet är alltid fördelaktigt. Detta inkluderar mikroskopisk screening av mångfalden och överflöd av potentiella betare närvarande, bakterie byten storlekar, och byte distribution både 1) i vatten kolumnen (t. ex. en vertikal profil från epilimnion ytvattnet till hypolimnion) och 2) när det gäller kanjon-formade reservoarer, på den fördämning-inflöde transect. För det andra kommer noggrann manipulering med insamlade prover att säkerställa representativa resultat. Temperaturen är en ytterst viktig faktor som påverkar de flesta mikrobiella processer12, inklusive protistiska betes hastigheter (figur 3).
För det tredje kommer manipuleringen av mängden spårämne som tillsätts baserat på kvantifieringen av bakterieceller eller typ av Grazer i provet att säkerställa att problem med övermärkning (figur 2) elimineras. Det bör noteras att det finns ett mycket brett spektrum i ciliatartspecifika upptagnings hastigheter (för detaljer, se steg 7,2). för att tillämpa protokollet på lämpligt sätt är det viktigt att förkunskaper om större ciliatarter med deras tidsförlopp. Det rekommenderas starkt att köra preliminära experiment med olika spårmängder för att undvika eventuella ciliat under märkning (ingen eller för få FLB tas upp per ciliatcell, vilket ger statistiskt osunda data) eller över-märkning (visas som ett stort antal FLB formning av "kondensera FLB-moln" eller flockar i ciliatmatvakuoler som packats av tracers, vilket allvarligt begränsar deras exakta kvantifiering. Se övre högra exemplet i figur 2). Det bör också noteras att inkubering gånger med FLB är i allmänhet kortare än 30 min, eftersom den genomsnittliga digestionstiden för picoplankton av ciliater är runt 1,5 h, och matsmältningen startar (intas picoplankton celler förlorar sin typiska form och färg) cirka efter 45-60 min30. Likaså måste optimal utspädning och distribution av proverna på filtret före mikroskopisk visning uppnås för korrekta resultat.
Ändringar och felsökning
De stora stegen, eventuella modifieringar och felsöknings ändringar av tekniken illustreras i figur 1 och figur 2. Dessutom bör det noteras att i fall av höga koncentrationer av detritala partiklar, fytoplankton celler eller deras kolonier i plankton bör sådana prover 1) på motsvarande sätt spädas för att uppnå ett stadium där enskilda Grazer-celler kan särskiljas på filterytan och 2) utsättas för kvantifiering av mat vakuol innehåll.
Begränsningar
Den största begränsningen för framgångsrik tillämpning av denna metod ligger i närvaron av olika organiska detritus eller riklig oorganiska/organiska partiklar med bifogade bakterier eller aggregat i mängder som förhindrar tydlig prov visning under epifluorescens Mikroskop och exakt uppskattning av ett spårämne som tillsatts. Det bör noteras att den presenterade Tracer tekniken fungerar främst med fria (dvs., suspenderade) bakterier som inte är knutna till partiklar. Baserat på våra egna erfarenheter och litteratur referenser (se tidigare publikationer2,4,8,10,16,18,21 ,26), är den presenterade metoden lämplig för de flesta vattenmiljöer. Exempel på två naturliga, kontrasterande system som skiljer sig i trofiska status, detritus innehåll, och Grazer mångfald och siffror finns (figur 3 och figur 4).
Betydelsen av metoden med avseende på befintliga metoder
Viktigare är, från kunskap om överflödet av en taxon/taxa av bakterien och deras artspecifika bacterivory klassar, den bulk bacterivory klassar av protistan taxon (eller sammanlagd ciliatassemblage) kan beräknas. Om denna metod tillämpas på naturliga plankton miljöer samtidigt för både heterotrofiska flagellater och ciliater (som representerar de större betarna av bakterioplankton2,6,7), är protistan betande-inducerad omsättningstid för bakterie populationer i en given miljö kan uppskattas till16,17,18,22. Sådana data har en grundläggande betydelse för uppskattningen av koldioxidflödesdynamiken i mikrobiella livsmedels nät.
Framtida tillämpningar
Det finns andra specifika miljöer där den här metoden, med vissa ändringar, kan användas med framgång. Dessa inkluderar aktivslam system, våmmen-ekosystem, vatten sediment och hypertrofiska fiskdammar17. Men ansökan i dessa näringsämnen-och mikrober-rika miljöer kräver preliminära tester för att optimera protokollet om rätt storlek, morfologi, och antalet Tracer FLB som kan efterlikna den typiska storleksfördelning och andra egenskaper av bytes bakterier inneboende i miljön.
För närvarande finns det ett ökat intresse för att kombinera detta tillvägagångssätt med katalyseras reporter deposition fluorescens i situ hybridisering (CARD-FISH), där identiteten hos Grazer cell (t. ex. heterotrofisk flagellate) detekteras med en specifik FISH-PROBE och upptagnings graden är baserad på FLB-halt i mat vakuoler i flagellatcellen på samma mikroskopiska bild31. En sofistikerad, ny metod som kallas dubbel hybridisering32 är en kombination av fisk sonder på nivåerna av Predator cell och byten bakterier (som också är märkta specifikt av en fylogenetiska stam, en bakteriell härstamning-specifik fisk sond). Tillvägagångssättet är elegant men också tidskrävande och kräver särskild kompetens och erfarenhet31,32, medan tillämpningen av olika FLB upptag metodändringar kan vara lättare att antas för rutinmässig användning i laboratorier.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har inget att avslöja.
Acknowledgments
Denna studie stöddes av den tjeckiska vetenskapsstiftelsen under Forskningsbidraget 13-00243S och 19-16554S tilldelade till K. Š. respektive D. S.. Denna artikel stöddes också av projektet "Biomanipulation som ett verktyg för att förbättra vattenkvaliteten i dammen reservoarer" (nr CZ. 02.1.01/0.0/0.0/16_025/0007417), finansierat av Europeiska regionala utvecklingsfonden, inom verksamhetsprogrammet forskning, utveckling och utbildning.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2-µm pore-size filters | SPI supplies, https://www.2spi.com/ | B0225-MB | Black, polycarbonate track etch membrane filters, diameter approprite for filtering apparatus used |
| 5-(4,6-dichlorotriazin-2-yl) aminofluorescein (DTAF) | Any brand | ||
| Automatic pipettes with adjustable volumes | Any brand, various sizes | ||
| Centrifuge | 22 000 x g | ||
| Cryovials | Any brand, 2 mL size | ||
| DAPI (4´,6-Diamidino-2´-phenylindole dihydrochloride) | Any brand | 1 mg ml-1 | |
| Epiflorescence microscope | Magnification from 400 x up to 1000 x | ||
| Filters appropriate for viewing in the DAPI and DTAF range | |||
| Counting grid in one of the oculars | |||
| Filtering apparatus | Usually with a diameter of 25 mm | ||
| Formaldehyde | A brand for microscopy | ||
| Glutaraldehyde | A brand for microscopy | ||
| Immersion oil for microscopy | Specific oil with low fluorescence | ||
| Lugol´s solution | Any brand or see comment | Make an alkaline Lugol' solution as follows: Solution 1 - dissolve 10 g of potassium iodide in 20 ml in MQ water, then add 5 g of iodine. Solution 2 - add 5 g of sodium acetate to 50 ml of MQ water. Add the solution 2 to the solution 1 and thoroughly mix | |
| Methanol stabilized formalin | Any brand available for microscopy purposes | ||
| Microscope slides and cover slips | Any brand produced for microscopy purposes | ||
| MQ water for diluting samples | Any brand |
||
| Phosphate-buffered saline (PBS; pH = 9) | Any brand | 0.05 M Na2HPO4-NaCl solution, adjusted to pH 9 | |
| PPi-saline buffer | Any brand | 0.02 M Na4P2O7-NaCl solution. Add 0.53 g Na4P2O7 to 100 ml of MQ water plus 0.85 g NaCl | |
| Sampling device | Appropriate for obtaining representative sample | e.g. Friedinger sampler for lake plankton | |
| Sodium thiosulfate solution | Any brand | 3% solution is used in the protocol | |
| Sonicator | Any brand | 30 W | |
| Vortex | Any brand allowing thorough mixing of the solutes and samples | ||
| Water bath | Any brand allowing temperature to be maintained at 60 °C |
References
- Azam, F., et al. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series. 10, 257-263 (1983).
- Šimek, K., et al. A finely tuned symphony of factors modulates the microbial food web of a freshwater reservoir in spring. Limnology & Oceanography. 59, 1477-1492 (2014).
- Šimek, K., et al. Bacterial prey food characteristics modulate community growth response of freshwater bacterivorous flagellates. Limnology & Oceanography. 63, 484-502 (2018).
- Šimek, K., et al. Changes in bacterial community composition, dynamics and viral mortality rates associated with enhanced flagellate grazing in a meso-eutrophic reservoir. Applied & Environmental Microbiology. 67, 2723-2733 (2001).
- Jürgens, K., Matz, C. Predation as a shaping force for the phenotypic and genotypic composition of planktonic bacteria. Antonie Van Leeuwenhoek. 81, 413-434 (2002).
- Pernthaler, J. Predation on prokaryotes in the water column and its ecological implications. Nature Reviews Microbiology. 3, 537-546 (2005).
- Berninger, U. B., Finlay, J., Kuuppo-Leinikki, P. Protozoan control of bacterial abundances in freshwaters. Limnology and Oceanography. 36, 139-147 (1991).
- Sherr, E. B., Sherr, B. F. Protistan grazing rates via uptake of fluorescently labeled prey. Handbook of Methods in Aquatic Microbial Ecology. Kemp, P. F., Sherr, B. F., Sherr, E. B., Cole, J. J. , Lewis Publishers. Boca Raton, Florida. 695-701 (1993).
- Vazquez-Dominguez, E., Peters, F., Gasol, J. M., Vaqué, D. Measuring the grazing losses of picoplankton: methodological improvements in the use of fluorescently tracers combined with flow cytometry. Aquatic Microbial Ecology. 20, 119-128 (1999).
- Šimek, K., et al. Ecological role and bacterial grazing of Halteria spp.: Small oligotrichs as dominant pelagic ciliate bacterivores. Aquatic Microbial Ecology. 22, 43-56 (2000).
- Montagnes, D. J. S., et al. Selective feeding behaviour of key free-living protists: avenues for continued study. Aquatic Microbial Ecology. 53, 83-98 (2008).
- Kirchman, D. L. Processes in Microbial Ecology. 2nd Edition. , Oxford University Press. Oxford, UK. (2018).
- Porter, K. G., Feig, Y. S. The use of DAPI for identifying and counting aquatic microflora. Limnology and Oceanography. 25, 943-948 (1980).
- Foissner, W., Berger, H. A user-friendly guide to the ciliates (Protozoa, Ciliophora) commonly used by hydrobiologists as bioindicators in rivers, lakes, and waste waters, with notes on their ecology. Freshwater Biology. 35, 375-482 (1996).
- Foissner, W., Berger, H., Schaumburg, J. Identification and ecology of limnetic plankton ciliates. Informationsberichte des Bayer Landesamtes für Wasserwirtschaft Heft. , 3-99 (1999).
- Šimek, K., et al. Ciliate grazing on picoplankton in a eutrophic reservoir during the summer phytoplankton maximum: a study at the species and community level. Limnology & Oceanography. 40, 1077-1090 (1995).
- Skibbe, O. An improved quantitative protargol stain for ciliates and other planktonic protists. Archiv für. Hydrobiolgie. 130, 339-347 (1994).
- Macek, M., et al. Growth rates of dominant planktonic ciliates in two freshwater bodies of different trophic degree. Journal of Plankton Research. 18, 463-481 (1996).
- Šimek, K., et al. Microbial food webs in hypertrophic fishponds: omnivorous ciliate taxa are major protistan bacterivores. Limnology & Oceanography. , in press (2019).
- Jezbera, J., et al. Major freshwater bacterioplankton groups: Contrasting trends in distribution of Limnohabitans and Polynucleobacter lineages along a pH gradient of 72 habitats. FEMS Microbiology Ecology. 81, 467-479 (2012).
- Kasalický, V., et al. The diversity of the Limnohabitans genus, an important group of freshwater bacterioplankton, by characterization of 35 isolated strains. PLoS One. 8, 58209 (2013).
- Stabell, T. Ciliate bacterivory in epilimnetic waters. Aquatic Microbial Ecology. 10, 265-272 (1996).
- Zingel, P., et al. Ciliates are the dominant grazers on pico- and nanoplankton in a shallow, naturally highly eutrophic lake. Microbial Ecology. 53, 134-142 (2007).
- Bickel, S. L., Tang, K. W., Grossart, H. P. Ciliate epibionts associated with crustacean zooplankton in german lakes: distribution, motility, and bacterivory. Frontiers in Microbiology. 3 (243), (2012).
- Sirová, D., et al. Hunters or gardeners? Linking community structure and function of trap-associated microbes to the nutrient acquisition strategy of a carnivorous plant. Microbiome. 6, 225 (2018).
- Šimek, K., et al. Ecological traits of a zoochlorellae-bearing Tetrahymena sp. (Ciliophora) living in traps of the carnivorous aquatic plant Utricularia reflexa. Journal of Eukaryotic Microbiology. 64, 336-348 (2017).
- Pitsch, G., et al. The green Tetrahymena utriculariae n. sp. (Ciliophora, Oligohymenophorea) with its endosymbiotic algae (Micractinium sp.), living in the feeding traps of a carnivorous aquatic plant. Journal of Eukaryotic Microbiology. 64, 322-335 (2017).
- Nielsen, J. M., Clare, E. L., Hayden, B., Brett, M. T., Kratina, P. Diet tracing in ecology: Method comparison and selection. Methods in Ecology and Evaluation. 9, 278-291 (2018).
- Beisner, B. E., Grossart, H. P., Gasol, J. M. A guide to methods for estimating phago-mixotrophy in nanophytoplankton. Journal of Plankton Research. , 1-13 (2019).
- Dolan, J. D., Šimek, K. Processing of ingested matter in Strombidium sulcatum, a marine ciliate (Oligotrichida). Limnology and Oceanography. 42, 393-397 (1997).
- Massana, R., et al. Grazing rates and functional diversity of uncultured heterotrophic flagellates. The ISME Journal. 3, 588-596 (2009).
- Grujčić, V., et al. Cryptophyta as major freshwater bacterivores in experiments with manipulated bacterial prey. The ISME Journal. 12, 1668-1681 (2018).



