Summary
Presentert her er en protokoll for en enkelt celle, epifluorescence mikroskopi-basert teknikk for å kvantifisere beite priser i akvatiske ROV Landplantenes med høy presisjon og taksonomisk oppløsning.
Abstract
Elucidating trofiske interaksjoner, som predasjon og dens virkninger, er en hyppig oppgave for mange forskere i økologi. Studiet av mikrobielle samfunn har mange begrensninger, og bestemme et rovdyr, byttedyr, og ROV priser er ofte vanskelig. Presentert her er en optimalisert metode basert på tillegg av fluorescensmerkete merket byttedyr som en Tracer, som gir pålitelig kvantifisering av beite priser i akvatiske ROV Landplantenes og estimering av næringsstoffer overføre til høyere trofiske nivåer.
Introduction
Heterotrofe prokaryoter er en viktig biologisk komponent i akvatiske systemer og utgjør en betydelig brøkdel av plankton biomasse1,2,3. Faktorer som kontrollerer sin overflod, mangfold og aktivitet er avgjørende for å forstå deres rolle i biokjemiske sykling (dvs. skjebnen til organisk karbon og andre næringsstoffer og flyt av energi fra prokaryoter til høyere trofiske nivåer). Protozoan beite er en av disse viktige faktorene. Bacterivory av heterotrofe nanoflagellates og flimmerdyr pålegger en sterk top-down kontroll over prokaryote overflod, samfunnet funksjon, struktur, mangfold, og til og med cellulære morfologi og vekstrate av bestemte bakterielle grupper4, 5,6. I noen systemer, protister tjene som den viktigste årsaken til bakteriell dødelighet6,7.
Standarden tilnærmingen brukes til å vurdere protozoan bacterivory, som har vært brukt i noen tid nå, innebærer bruk av fluorescensmerkete merket bakterier (FLB) som byttedyr analoger og epifluorescence mikroskopi. Celle-spesifikke opptak priser kan bestemmes ved kvantifisere antall merkede byttedyr partikler i protistan mat vakuoler over en valgt tid kurs8. Det er flere fordeler med denne tilnærmingen. Tracer er lagt til naturlige prøver med naturlig rovdyr og byttedyr samlinger. Det er minimum sample manipulasjon før inkubasjons, minimum prøve endring av den ekstra FLB Tracer, og inkubasjons tider er korte for å sikre lyd resultater oppnådd under nær in situ forhold. Alternativt, i miljøer med lavt antall bacterivorous protister eller dyreplankton (f. eks offshore Marine systemer), forsvinning utbredelsen av FLB lagt til prøver i lave mengder (2%-3% Tracer) kan oppdages via Flow flowcytometri på lang sikt (12-24 h) inkubasjons eksperimenter. Deretter blir antall FLB ved start-og sluttpunktene (som integrerer virkningen av alle bacterivores) kvantifisert ved flyt flowcytometri (for detaljer, se forrige publikasjon9). En slik parameter representerer imidlertid bare samlet bacterivory rater som ikke kan tilskrives noen bestemt protistan og dyreplankton Grazer grupper eller arter.
Total, Kvantifisere det protistan art-eller morphotype-spesifikk bakteriell dødelighet ratene inne det vann omgivelsene akkurat og med økologisk betydning kan utfordrende. Noen protister er selektive grazers, og størrelsen og celle formen på den ekstra FLB Tracer kan forvrenge naturlige utbredelsen av byttedyr inntak10,11. Videre er protistan aktivitet og metabolisme svært temperaturfølsomme12; Derfor må mengden ekstra FLB Tracer være nøye manipulert for hver enkelt prøve type (ikke bare basert på den naturlige overflod, størrelse, og morfologi av bakterier og rådende typer bacterivores, men også på temperatur). De fleste studier fokus på bulk protistan beite aktivitet; Imidlertid, bacterivory av spesifikk protistan Art ofte avholde en mange høyere beskjed salgsverdi og kanskje være å foretrekke. I dette tilfellet er det behov for taksonomisk kunnskap om de protist artene som finnes i en prøve og forståelse av atferden deres. Derfor er det nødvendig med betydelige mengder tid og arbeid for å få lyd resultater på arter-spesifikke utbredelsen av bacterivory som kan tilskrives en bestemt protistan gruppe eller art.
Til tross for disse vanskelighetene, er denne tilnærmingen det mest hensiktsmessige verktøyet for tiden tilgjengelig for å vurdere protistan bacterivory i naturlige innstillinger. Presentert her er en omfattende, lett-å-følge metode for å bruke FLB som en Tracer i akvatiske mikrobielle økologi studier. Alle de nevnte problematiske aspektene av tilnærmingen er beregnet for og en forbedret arbeidsflyt er beskrevet, med to eksperimenter fra kontrasterende miljøer samt kontrasterende ciliate arter som eksempler.
Den første studien ble gjennomført i et epilimnetic miljø fra mesotrophic Římov vannreservoar i den tsjekkiske republikk, som viser Grazer og bakteriell forekomster kan sammenlignes med de fleste overflaten ferskvann organer (jf.5,7). Det andre tilfellet studien ble gjennomført i svært spesifikke miljøet inne feller av akvatiske kjøttetende anlegget Blærerot reflexa, som er vert for ekstremt høye antall både beite mixotrophic Flimmerdyr (Tetrahymena utriculariae) og bakterielle celler. Beregninger av celle-spesifikke beite priser og bakterielle stående aksjer i begge prøvetyper vises. En rekke økologiske tolkninger av resultatene blir deretter diskutert, og eksempler på mulige oppfølgingsstudier er endelig foreslått.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
1. samling av eksempler
-
Samling av reservoaret vannprøve: den første studien (exp i, lavere naturlig in situ Predator og byttedyr overflod system)
- Samle vann prøver fra ønsket sted på en passende dybde. Oppbevar prøvene i en temperatur kontrollert kjøler fylt på in situ-temperaturen (unngå temperatursjokk, det bør bemerkes at opptaks rater for protister er temperatur avhengig) under transport til laboratoriet.
Merk: våre prøvetaking ble gjennomført i Meso-eutrophic Canyon-formede Římov reservoaret (South Bohemia, volum 34,5 x 106 m3, maksimal dybde 43 m, betyr oppbevaring tid 100 dager, dimictic). Prøvetaking stedet var plassert på en 30 m dybde, nær demningen. En blandet prøve på en 0,5 m dybde ble samlet inn av en 2-l Friedinger sampler. - Fortsett til seksjon 1,2 så snart som mulig.
- Samle vann prøver fra ønsket sted på en passende dybde. Oppbevar prøvene i en temperatur kontrollert kjøler fylt på in situ-temperaturen (unngå temperatursjokk, det bør bemerkes at opptaks rater for protister er temperatur avhengig) under transport til laboratoriet.
-
Innsamling av væske fra fellene av kjøttetende Blærerot reflexa planter: den andre studien (exp II; et system med høyt rovdyr og byttedyr forekomster, ekstremt liten prøvevolum)
- Rist plantene forsiktig under vann, Fjern fra dyrking beholderen, og plasser dem på absorberende materiale for å absorbere overflødig vann. Avhengig av robusthet av plantene og størrelsen på fellene, velger 8-10 plante individer.
- Dividere hvert skudd i omtrent like deler ved å telle blad noder bærende fangst organer. Hver Shoot segmentet vil tjene til å samle blandede prøver som representerer unge, middelaldrende, og gamle feller.
- Fest et tynt glass kapillær og Eppendorf hetteglass for prøvetaking samling til en peristaltisk pumpe. Fortsett med å sette kapillær spissen inn i felle åpningen. Bruk vakuumpumpen til å suge ut all væsken fra hver felle til 900 ± 100 μL av felle væske samles inn for hver felle alderskategori.
- Bruk tre eksemplarer underutvalg på 200 μL av den sammenslåtte felle væsken for protistan beite eksperimenter. Behandle disse umiddelbart som beskrevet i avsnitt 3. Bevar de resterende ± 300 μL av prøven for alle andre analyser av mikrobielle komponenter som lever i væsken, som beskrevet nedenfor (avsnitt 2).
- Fortsett umiddelbart til del 2.
2. fiksering av innsamlede prøver
- Exp I og II: fikse vann/felle Fluid sub-prøver for bakteriell opplisting (henholdsvis § 4; ca. 20 mL og 0,3 mL) med formaldehyd i minst 1 time for å få en 2% endelig volum: volum konsentrasjon i hver prøve.
Merk: Håndter formaldehyd utelukkende i avtrekks panseret, og bruk hansker til enhver tid mens du manipulerer prøvene.
3. prøve filtrering
- Eksempel fortynning (exp I): det er ikke behov for fortynning for reservoar vannprøvene. (Exp II): fortynne eksempel på felle væsken 10x-100 ganger med partikkel fritt MQ-vann for å oppnå en passende fordeling av mål mikrober på filter overflater før telling via epifluorescence mikroskopi.
- Filter 1-2 mL (exp I) av reservoaret vann eller 10-30 μL (exp II) av subsample av fellen væske for bakteriell telling på svart 0,2 μm pore-størrelse filtre, ved hjelp av en filtrerings trakt (25 mm diameter).
- Flekk filtrene med DAPI (4 ', 6-diamidino-2'-phenylindole dihydrochloride, 0,2% endelig konsentrasjon) i 4 min.
Merk: unngå hud-og arbeidsflate kontaminering, og bruk hansker. - Plasser filteret med konsentrerte mikrober på en dråpe av nedsenking olje (for fluorescerende mikroskopi) på et mikroskop lysbilde. Plasser en annen olje dråpe på midten av filteret og dekk med en dekkglass, slik at oljen fordeles jevnt.
- På dette punktet, fortrinnsvis behandle prøver umiddelbart, eller alternativt, lagre dem i fryseren (-20 ° c) i flere uker til måneder inntil videre analyse.
4. opplisting av bakterielle tall på filtrene
- Plasser lysbildet under det epifluorescence mikroskopet (med filtersettet som tilsvarer fluorokromkonjugert DAPI). Plasser en 10 x 10 telle gitter i en av okulars. Flytt lysbildet til en tilfeldig posisjon.
- Kvantifisere bakterieceller (blå fluorescens) i området av telling rutenettet (under forstørrelsen 1000x). I tellingen inkluderer du cellene som krysser venstre og øvre kant av opptellings rutenettet, mens du ekskluderer dem som ligger over høyre og nedre kant.
- Flytte til en annen tilfeldig posisjon og gjenta opplisting på minst 10-15 teller rutenett, beløper seg til 500 celler telles totalt.
- Etablere en omregningsfaktor for et gitt mikroskop og forstørrelse, basert på kunnskap om forholdet mellom arealet av et rutenett til det totale effektive filtreringsområdet av filteret. Deretter deler du det totale antallet celler som telles med antall rutenett som telles, noe som gir et gjennomsnittlig antall bakterier per rutenett.
- Multipliser sistnevnte parameter ved omregningsfaktoren som er opprettet og normalisere det resulterende tallet per mL av et utvalg (avhengig av volumet av prøven filtrert) for å få den totale bakterielle overflod per mL.
5. fastsettelse av protistan overflod
- Fest vann prøven (exp I) eller felle væske (exp II) underutvalg med enten glutaraldehyde (1% endelig konsentrasjon, mer egnet for prøver med tilstedeværelsen av klorofyll som inneholder partikler som skal behandles dager til uker etter fiksering) eller ved hjelp av formol-tiosulfat dekolorisering teknikk angitt nedenfor.
Merk: begge bevarings teknikkene forhindrer egestion av svelget materiale fra mat vakuoler av protister8. - Når det gjelder formol-tiosulfat dekolorisering teknikk, tilsett 100 μL/1 μL av Lugol løsning i 20 mL/200 μL av vann/felle væske subsample (exp I/exp II, henholdsvis).
- Følg umiddelbart med tilsetning av 0,5 mL/50 μL av borate-bufrede formalin deretter 20 μL/2 μL av 3% natrium AmmoniumThioSulfat (exp I/exp II, henholdsvis).
Merk: natrium AmmoniumThioSulfat decolorizes den gule fargen på Lugol for å muliggjøre observasjon av celler under epifluorescence mikroskop8. - Filtrer et kjent volum av prøven (avhengig av antall mål protister) til 1 μm pore-størrelse svart polykarbonat filtre.
- Anslå antall protist arter er ved å telle minst 200 celler under forstørrelse 600x ved hjelp av telling rutenettet (se ovenfor).
- Reduser volumet av prøven under et vakuum i filtrerings trakten ved lav vakuum til ca. 2 mL. Slipp deretter under trykket og Legg til DAPI-fluorokromkonjugert (4 ', 6-diamidino-2-phenylindole dihydrochloride13, 0,2% endelig konsentrasjon) i 2 minutter.
6. fastsettelse av flimmerdyr i plankton prøver
Merk: Ciliate samfunn i ferskvann habitater er svært varierte14,15,16, 18, og deres mikroskopiske besluttsomhet er utfordrende. Sortering av ciliate grupper i funksjonell laug10,14,16,tillater17 for mer detaljert analyse av ulike ciliate grupper som pelagisk bacterivores.
- Evaluer ciliate fellesskaps struktur ved å kombinere følgende:
- DAPI prøver i epifluorescence mikroskopi (å lokalisere ciliate celler med lyse fluorescens av makro-og mikro-kjerner av forskjellige størrelser og morfologi) kombinert med opptak av fluorescensmerkete merket bakterier (FLB8; for detaljer, se nedenfor), sporing av evnen til flimmerdyr å mate på bakterier.
- Live sample observasjon i Utvalgte tilfeller17,19. For mer informasjon om de ovennevnte tilnærminger og kriterier som brukes for gruppering flimmerdyr i ulike taksonomisk kategorier, se tidligere publikasjoner16,17.
Merk: sitert studier har indikert at blant flimmerdyr, altetende arter fra Stichotrichia (slekter Halteria og Pelagohalteria) og Oligotrichia (nemlig Rimostrombidium spp.) er de viktigste pelagisk forbrukere av bacterioplankton i et stort flertall av ferskvannshabitater10,17,18.
7. estimering ciliate beite priser
- Beregn opptaket utbredelsen av flimmerdyr på bakterier basert på endringer i gjennomsnittlig antall Tracer [dvs. FLB8 per ciliate relatert til tid for inkubasjons (5-15 min)] og Tracer mengden FLB lagt, regnskap på de fleste for 5%-15% av totale bakterier.
- For å sammenligne opptak priser blant ulike protistan arter, normalisere opptaket priser som antall bakterier per ciliate per time, med beregninger basert på den faktiske inkubasjonstid og andel av Tracer FLB lagt.
Merk: den generelle ordningen med FLB metoden programmet til å anslå både celle-eller arter-spesifikke og bulk bacterivory priser i naturlige prøver er avbildet i figur 1. - Utarbeidelse av FLB fra bakteriell stammer urfolk til et ferskvann miljø8
- Velg en passende størrelse (gjennomsnittlig celle volum = MCV) og morfologi av bakterier slik at de effektivt etterligner de typiske størrelsene av bacterioplankton/bakterieceller i vannsystemet som undersøkes.
Merk: for exp I, en blanding av isolerte stammer fra studien plasseringen av slekten Limnohabitans og Polynucleobacter ble brukt (dvs. typisk, svært rikelig bacterioplankton i innsjøer og dammer)20. For detaljer om morfologi og størrelser av stammene, se tidligere publikasjoner3,17,18,21. - Harvest bakterielle celler fra kultur av sentrifugering (5 000 x g) i 15 min ved tidlig stasjonær fase og bland dem på et numerisk forhold som gir MCV ± SD av cellene i blandingen som tilsvarer den typiske MCV av bakterier på det valgte stedet.
- Suspendere pellets i 10 mL av fosfat-bufret saltvann (PBS; pH = 9).
- Tilsett 2 mg av gul-grønn fluorescerende Dye 5-(4, 6-dichlorotriazin-2-YL) aminofluorescein (DTAF, binder seg til proteiner) til cellen suspensjonen i fosfat-Saline buffer, og ruge i en 60 ° c vannbad for 2 h.
- Etter inkubasjons, sentrifuger cellene ned, Dekanter den DTAF løsningen, og vask og sentrifuger 3x med PBS.
- Etter den siste vasken, må du suspendere cellene i 20 mL av PPi-Saline buffer.
- Vortex FLB-fjæringen og pipette 1,5 mL alikvoter i 2 mL fryse flasker, og deretter holde frosset (ved-20 ° c) iPP i-Saline buffer til bruk.
- Pre-filter PPi-Saline buffer gjennom et 0,2 μm polykarbonat filter for bruk i neste trinn.
- For å bestemme FLB konsentrasjon, overføre en liten alikvot (vanligvis 20-40 μL) til 2 mL partikkelfri PPi-Saline buffer, sonikere ved 30 W for flere 2 s sprekker, og filtrere på 0,2 μm polykarbonat svart filter for opplisting via epifluorescence mikroskopi (1, 000X forstørrelse) under optiske filterinnstillinger for DTAF (448 NM/520-540 NM).
- Velg en passende størrelse (gjennomsnittlig celle volum = MCV) og morfologi av bakterier slik at de effektivt etterligner de typiske størrelsene av bacterioplankton/bakterieceller i vannsystemet som undersøkes.
- Tracer teknikk for estimering av ciliate bacterivory
- For beite eksperimenter i naturlige planktoniske habitater, dispensere 300 mL prøver i godt skylt 1 L flasker og ruge ved in situ temperatur i 15 min (for å tillate protister å gjenopprette fra håndterings sjokk).
- Legg FLB Bevegelsesuskarphet å utgjøre 5%-15% av totale bakterier, med beløpene lagt avhengig av sesong og vanntemperatur.
Merk: det er en svært bred, sesong avhengig spektrum i ciliate arter-spesifikke opptaket priser som spenner over flere størrelsesordener (dvs. fra 101-104 bakterier ciliate-1 per time)10,16, 17,18,22,23,24. - I perioder med økt forekomst av flimmerdyr med høy opptakshastighet (vanligvis i løpet av sommeren), også kjøre en parallell inkubasjons med svært lave FLB tillegg, utgjør bare 2%-4% av totale bakterier for å unngå overdreven lasting av ciliate vakuoler av Tracer FLB (se eksempler i figur 2).
- Ruge ciliate/plankton prøver med FLB for 5-15 min.
- Det er to muligheter for prøve fiksering for å forhindre egestion av svelget materiale fra mat vakuoler av protister8. Avslutte incubations ved tilsetning av 1% glutaraldehyde (endelig konsentrasjon som er mer egnet for prøver med klorofyll-inneholdende partikler, for eksempel alger). Du kan også bruke 100 μL/10 μL av Lugol oppløsning i 20 mL/200 μL av vann/felle væske subsample, etterfulgt umiddelbart ved tilsetning av 0,5 mL/10 μL av borate formalin og deretter 200 μL/2 μL av 3% natrium AmmoniumThioSulfat (exp I/exp II, henholdsvis).
- Etter å ha lagt bindemiddel, la prøvene hvile i minst 1 t i mørket ved 4 ° c for å sikre grundig bevaring av ciliate celler.
- Ta naturlige plankton underutvalg fra 4-30 mL/10-30 μL (exp I/exp II, henholdsvis, volumet avhenger av ciliate overflod) og beis med DAPI (siste konsentrasjon 0,2% WT/Vol; for detaljer, se trinn 3,2 ovenfor).
- Passere gjennom 1 μm svarte filtre og inspisere via epifluorescence mikroskopi å telle flimmerdyr (600x forstørrelse) og nummerere antall FLB Bevegelsesuskarphet inntatt (for det meste ved 1000x forstørrelse) som beskrevet i tidligere publikasjoner2,17 . Undersøk prøvene innen 7 dager etter bevaring.
- Å anslå total protozoan/arter-spesifikke beite, multiplisere gjennomsnittlig opptak priser av alle flimmerdyr, eller bare ciliate arter som oppdages av in situ overflod.
- Eksempel på beregning av opptaks rater per celle fra in situ-data fra Římov vannreservoar beskrives som følger:
- Anta at den bakterielle konsentrasjonen er 3,55 x 106 bakterier/ml og Tracer FLB lagt er 0,25 x 106 FLB/ml, som gir en sum av 3,8 x 106 bakterier/ml av totalt BAKTERIELLE partikler (naturlige bakterier + FLB = 100% av byttedyr partikler) tilgjengelig for phagotrophic protister i den naturlige prøven.
Merk: FLB Bevegelsesuskarphet lagt dermed representerer 6,58% (et prosjekt på 0,25/0.038) av totalt bakterielle partikler. Gjennomsnittlig antall FLB per Halteria Sp. er 6,2 FLB i 5 min incubations. - Hvis du vil normalisere opptaket per time, bruker du følgende beregning: (6,2 x 12)/(6.58/100) = 1131 bakterier per Halteria Cell/h.
Merk: for flere eksempler på distribusjoner av individuelle opptak hastigheter på Halteria Sp. oppdaget under variable vanntemperaturer, mengder (som prosentene) av Tracer FLB lagt til, og ulike inkubasjons ganger med FLB, se Figur 3.
- Anta at den bakterielle konsentrasjonen er 3,55 x 106 bakterier/ml og Tracer FLB lagt er 0,25 x 106 FLB/ml, som gir en sum av 3,8 x 106 bakterier/ml av totalt BAKTERIELLE partikler (naturlige bakterier + FLB = 100% av byttedyr partikler) tilgjengelig for phagotrophic protister i den naturlige prøven.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Eksempel eksperiment jeg ble kjørt i Římov vannreservoar (South Bohemia, cz), som er et naturlig område med lavere naturlig in situ Predator og byttedyr overflod. Representative data rapporteres for altetende ciliate Art Halteria grandinella, som er et rikt og effektivt Grazer av picoplankton (< 2 μm) partikler10,16,17,18 ,22. Figur 3 viser boks-og-whisker plott av antall FLB per celle av Halteria Sp. fra Římov reservoaret (Figur 3A), som ble beregnet på utbredelsen av bakteriell opptak per time (Figur 3B) påvist i fire individuelle eksperimenter utført i april, mai, august og september. Det var høy variasjon i ciliate opptaket priser, hovedsakelig forårsaket av timelige forskjeller i vanntemperatur.
Det bør bemerkes at Q10 parameter reflekterer det faktum at mikrobiell prosessene kjøre ca 2.5 x raskere med en temperaturøkning på 10 ° c12, som også holder for ciliate opptak priser på bakterier. Med denne fysiologiske regelen i tankene, ble det brukt betraktelig forskjellige proporsjoner av FLB og inkubasjons tider for ulike sesonger (for detaljer, se Figur 3A). Således, den forventede temperatur effekten ble kompensert for, og den eksperimentelle innstillingen gitt optimalisert gjennomsnitt og median verdier av opptaket priser ca mellom 5-10 FLB per ciliate celle. Vanligvis er disse mengdene inntatt FLB lett countable (se eksempler i figur 2, to venstre fotografier), genererer presise estimater av Tracer (hovedsakelig mellom 1-15 FLB per ciliate) opptak priser. Men på grunn av modifisert FLB Tracer lagt (%) og forskjellige tider av prøven inkubasjons den absolutte verdier (uttrykt som antall bakterier beiter ciliate per time) skilte betydelig (p < 0,01, Kruskal-Wallis test, etterfulgt av Dunn ' s Multiple-sammenligning test, p < 0,05; se eksempler i figur 3B) blant eksperimentene. Dataene illustrerer typisk naturlig variasjon i absolutte bacterivory rater i planktoniske populasjoner av Halteria grandinella, med en nærkamp av deres middelverdi og mellom store verdier (Figur 3).
I nærvær av svært effektive bacterivorous flimmerdyr i prøver, slik som peritrichous flimmerdyr, kan de bli tungt "over-merket" av FLB i typiske Tracer mengder 5%-10% av totale bakterier (se høyre side fotografi i figur 2). Dette kan sterkt begrense den nøyaktige kvantifisering av svelget FLB. I slike tilfeller er det foreslått å kjøre flere parallelle incubations med bare lave mengder FLB regnskap for bare 1,5%-3% av totale bakterier. Generelt kan både sporings beløpene og inkubasjons tidene manipuleres for å optimalisere antall FLB per celle (figur 2).
Eksempel eksperiment II: vises er dataene fra et system med store rovdyr og byttedyr forekomster, der bare et ekstremt lite utvalg volum er tilgjengelig for eksperimentelt anslå bacterivory utbredelsen av ciliate Tetrahymena utriculariae 25. det er en moderat bakteriell Grazer lever i høy overflod utelukkende i feller av kjøttetende Blærerot reflexa planter26,27. Figur 4 viser boks-og-whisker plott av antall FLB per celle i T. utriculariae under forskjellige eksperimentelle innstillinger (Figur 4A, B) som beregnes på nytt i utbredelsen av bakteriell opptak per time (Figur 4 C, D) påvist i unge, modne og gamle feller. Interessant i feller, chloroplast-bærende bestander av ciliate t. utriculariae ble oppdaget, mens apochloric bestander av t. utriculariae ble isolert fra feller og vedlikeholdes på blandet bakteriell suspensjon vokser på hvete korn i mørket (for detaljer, se figur 1 i en tidligere publikasjon26).
De chloroplast bestandene lever i lys-opplyste feller; Dermed kan Chloroplasts gi en ekstra organisk karbon kilde og oksygen til ciliate verten. En av hypoteser testet var at apochloric ciliate populasjoner beiter bakterier betydelig raskere, som bakteriene representerer den eneste partikler kilde til organisk karbon tilgjengelig for mørk dyrket isolert subpopulasjoner av ciliate.
Faktisk, mens det var ingen vesentlige forskjeller i bacterivory utbredelsen av flimmerdyr bor i unge, modne og gamle feller av Blærerot reflexa (Figur 4A, C), apochloric populasjoner av T. utriculariae beiter bakterier signifikant (p < 0,01, Kruskal-Wallis test, etterfulgt av Dunn ' s Multiple-sammenligning test, p < 0,05), ca 3x raskere enn chloroplast-bærende flimmerdyr lever i unge, modne, og gamle feller (Figur 4C, D). Merk at igjen, både Tracer mengder samt inkubasjons ganger (Figur 4A, B, topp) ble endret for å optimalisere antall FLB per celle (vanligvis mellom 1-15), med gjennomsnittlig og median verdier rundt 5 FLB/ciliate. Disse tallene kan skilles i ciliate mat vakuoler og tillatt nøyaktig Tracer telling. Men uttrykt i absolutte antall bakterier beiter per time, den chloroplast-bærende og apochloric bestander beiter ca 350 og 1 000 bakterier ciliate per time, henholdsvis. Dette eksperimentelle satt opp brakte ny innsikt i metabolsk og fysiologiske trekk av to distinkte subpopulasjoner av samme ciliate arter lever under påfallende ulike miljømessige begrensninger25,26, 27i det.
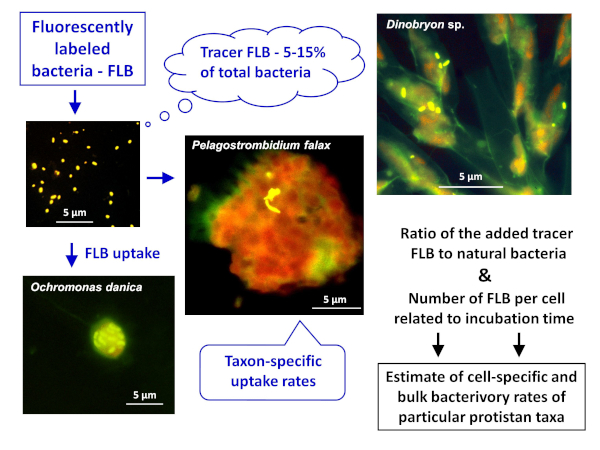
Figur 1 : Arbeidsflyt for å bruke fluorescensmerkete merket bakterier (FLB) å anslå celle-og arter-spesifikke beite priser fra forholdet til inntatt Tracer FLB til totalt antall naturlige bakterier i utvalget. Hvis du vil ha mer informasjon, se punkt 7 i protokollen. Vennligst klikk her for å se en større versjon av dette tallet.

Figur 2 : Eksempler på ciliate celler fra plankton i en eutrophic fiskedam. Eksempler er vist fra dammen med countable FLB i ciliate celler (vanligvis 1-10 Tracer FLB per celle, venstre to microphotograps) sammenlignet med en peritrichous ciliate Pelagovorticella Natans (høyre side microphotograph). Selv under en kort, 5 min inkubasjonsperiode, ble det "over-merket" av Tracer FLB, noe som gjør kvantifisering av svelget FLB unøyaktig eller nesten umulig. I dette tilfellet er det foreslått å redusere Tracer beløpet til 1,5%-3% av totale bakterier. Vanligvis kan både sporings beløpene og inkubasjons tidene manipuleres for å optimalisere antallet FLB som svelges per celle. Hvis du vil ha mer informasjon, se punkt 7 i protokollen. Vennligst klikk her for å se en større versjon av dette tallet.

Figur 3 : Boks-og-whisker plott av antall FLB per celle av Halteria Sp. fra Římov reservoaret (exp I) (A), beregnes på nytt til utbredelsen av bakteriell opptak per time (B). Dataene ble oppdaget under forskjellige sesongmessige innstillinger, representert av fire eksempler fra april til september. Toppen av panel A viser informasjon om vanntemperatur, ulike FLB Bevegelsesuskarphet lagt til (%), og ulike tider av prøven inkubasjons. Det bør bemerkes at de to sistnevnte parametrene kan endres for å optimalisere antall FLB per celler, med gjennomsnittlig (full linje) og median (stiplet linje) verdier ca mellom 5-10 FLB per ciliate celle (A). Stolpene viser den 25. og 75th prosentiler av alle data (50-180 celler inspisert) og kinnskjegg står for 1th og 99nde prosentiler. (B) forskjellige små bokstaver indikerer signifikante forskjeller i celle spesifikke bacterivory rater på Halteria Sp. i løpet av den studerte perioden. Vennligst klikk her for å se en større versjon av dette tallet.

Figur 4 : Box-og-whisker plott av antall FLB per celle. Tomter er vist av chloroplast-bærende Tetrahymena utriculariae fra tre eksemplarer behandlinger av unge, modne og gamle feller av Blærerot REFLEXA (exp II) (A), omregnet til utbredelsen av bakteriell opptak per time (C). Dataene ble sammenlignet med bakteriell opptak utbredelsen av duplikat apochloric populasjoner av T. utriculariae (B, D) isolert fra feller, men opprettholdt på blandet bakteriell suspensjon vokser på hvete korn i mørket. På toppen av panelene A og B ble forskjellige FLB-Bevegelsesuskarphet lagt til (%) og forskjellige tider av prøve inkubasjons vises. Det bør bemerkes at de to sistnevnte parametrene ble endret for å optimalisere antall FLB per celler, med gjennomsnittlig (full linje) og median (stiplet linje) verdier ca mellom 5-10 FLB per ciliate celle (A, B). Barene viser den femte og 95te prosentiler av alle data (50-100 celler inspisert), og kinnskjegg stå for 1th og 99nde prosentiler. Vennligst klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Tyde trofiske interaksjon i akvatiske systemer er alltid utfordrende28, spesielt på nano-plankton skalaer som involverer protister og deres byttedyr, bakterier. Når det gjelder næringsopptak trasé og kvantifisering, anvendelse av metoder hell brukes på høyere trofiske nivåer er mindre mulig, på grunn av den høye kompleksiteten av biotiske interaksjoner. Disse inkluderer for eksempel stabile isotop merking tilnærminger. Denne protokollen viser fordelene ved å bruke epifluorescence mikroskopi og fluorescensmerkete merket bakterier som Tracer å spore og semi-kvantifisere/anslå karbon strømmen (bakteriell byttedyr: ulike protistan grazers inkludert mixotrophic grazers29) stier gjennom bunnen av mikrobielle mat duk. En slik fordel er den høye nøyaktigheten av single-celle tilnærming, og den andre er den enestående oppløsning om Grazer samfunnet struktur og skille mellom ulike funksjonelle laug, arter (exp I), og selv subpopulasjoner av samme arter (exp II).
Kritiske trinn i protokollen
Det er flere kritiske trinn i protokollen, som kan sikre at fordelene ved metodikken utnyttes til sitt fulle potensiale. Først en grunnleggende forståelse av studert miljøet før oppstart av eksperimentet er alltid gunstig. Dette inkluderer mikroskopisk screening av mangfoldet og overflod av potensielle grazers tilstede, bakterielle byttedyr størrelser, og byttedyr distribusjon både 1) i vannsøylen (f. eks en vertikal profil fra epilimnion til hypolimnion) og 2) i tilfelle av i Canyon-formede reservoarer, på demningen-tilsig kontinuerlig. For det andre vil forsiktig manipulering med innsamlede prøver sikre representative resultater. Temperatur er en svært viktig faktor som påvirker de fleste mikrobielle prosesser12, inkludert protist beite priser (Figur 3).
For det tredje, manipulere mengden av Tracer lagt basert på kvantifisering av bakterielle celler eller type Grazer i prøven vil sikre at problemer med over-merking (figur 2) er eliminert. Det bør bemerkes at det er et svært bredt spekter i ciliate arter-spesifikke opptaket priser (for detaljer, se trinn 7,2); Derfor, for å bruke protokollen på riktig måte, før kunnskap om store ciliate arter med sin tid-kurs opptak priser er avgjørende. Det anbefales på det sterkeste å kjøre foreløpige eksperimenter med ulike Tracer mengder for å unngå mulige ciliate under merking (ingen eller for få FLB er tatt opp per ciliate celle, gir statistisk usunne data) eller over-merking (vises som et stort antall FLB forming "kondensere FLB skyer" eller flokker i ciliate mat vakuoler pakket av bevegelsesuskarphet, og dermed sterkt begrense deres presise kvantifisering; se øvre høyre eksempel i figur 2). Det bør også bemerkes at inkubasjons ganger med FLB er generelt kortere enn 30 min, siden den gjennomsnittlige fordøyelsen tiden av picoplankton av flimmerdyr er rundt 1,5 h, og fordøyelsen starter (inntatt picoplankton celler mister sin typiske form og farge) ca etter 45-60 min30. På samme måte må det oppnås optimal fortynning og distribusjon av prøver på filteret før mikroskopisk visning for å oppnå nøyaktige resultater.
Modifikasjoner og feilsøking
De viktigste trinnene, mulige modifikasjoner, og feilsøking modifikasjoner av teknikken er illustrert i figur 1 og figur 2. I tillegg bør det bemerkes at i tilfeller av høye konsentrasjoner av avsiltede partikler, planteplankton celler, eller deres kolonier i plankton, slike prøver 1) bør være tilsvarende fortynnet for å oppnå et stadium der individuelle Grazer celler kan være skilles på filteroverflaten og 2) bli utsatt for kvantifisering av mat vacuole innhold.
Begrensninger
Den viktigste begrensningen for vellykket anvendelse av denne metoden ligger i nærvær av ulike organiske detritus eller rikelig uorganisk/organiske partikler med vedlagte bakterier eller aggregater i mengder som hindrer klar prøve visning under epifluorescence mikroskop og presis estimering av et sporings beløp lagt til. Det bør bemerkes at den presenterte Tracer teknikken fungerer først og fremst med gratis (dvs. suspendert) bakterier som ikke er festet til partikler. Basert på våre egne erfaringer og litteratur referanser (se tidligere publikasjoner2,4,8,10,16,18,21 ,26), den presenterte metodikk er egnet for de fleste akvatiske miljøer. Eksempler på to naturlige, kontrasterende systemer ulik trofiske status, detritus innhold og Grazer mangfold og tall er gitt (Figur 3 og Figur 4).
Betydningen av tilnærmingen med hensyn til eksisterende metoder
Viktigere, fra kunnskap om overflod av en takson/arter av bacterivores og deres arter-spesifikke bacterivory priser, bulk bacterivory rate av protistan takson (eller total ciliate samling) kan beregnes. Hvis denne tilnærmingen brukes på naturlige plankton miljøer samtidig for både heterotrofe flagellates og flimmerdyr (som representerer de store grazers av bacterioplankton2,6,7), protistan beite-indusert omsetning tid av bakterielle populasjoner i et gitt miljø kan anslås16,17,18,22. Slike data holder grunnleggende betydning for estimering av karbon flyt dynamikk i mikrobielle mat duk.
Fremtidige applikasjoner
Det finnes andre spesifikke miljøer der denne metoden, med noen endringer, kan brukes med hell. Disse inkluderer aktiverte slam systemer, rumen økosystemer, akvatiske sedimenter, og hypertrofisk fishponds17. Imidlertid krever anvendelse i disse nærings-og mikrober-rike miljøer foreløpige tester for å optimalisere protokollen om riktig størrelse, morfologi, og antall Tracer FLB som kan etterligne den typiske størrelsesfordelingen og andre egenskaper av byttedyr bakterier som ligger i miljøet.
For tiden er det økende interesse for å kombinere denne tilnærmingen med katalysert reporter deponering fluorescens in situ hybridisering (kort-fisk), hvor identiteten til Grazer cellen (f. eks heterotrofe flagellate) oppdages med en bestemt FISH-probe og opptakshastigheten er basert på FLB innhold i mat vakuoler av flagellate cellen på samme mikroskopiske lysbilde31. En sofistikert, ny tilnærming kalt dobbel hybridisering32 er en kombinasjon av fiske sonder på nivåene av Predator celle og byttedyr bakterier (som også er merket spesielt ved en Fylogenetiske belastning, en bakteriell avstamning-spesifikk Fish sonde). Tilnærmingen er elegant, men også tidkrevende og krever spesifikke ferdigheter og erfaring31,32, mens anvendelse av ulike FLB opptak tilnærming modifikasjoner kan lettere vedtatt for rutinemessig bruk i laboratorier.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ingenting å avsløre.
Acknowledgments
Denne studien ble støttet av den tsjekkiske Science Foundation under forskningsstipend 13-00243S og 19-16554S tildeles K. s. og D. S., henholdsvis. Denne artikkelen ble også støttet av prosjektet "Biomanipulation som et verktøy for å forbedre vannkvaliteten på demningen reservoarer" (ingen CZ. 02.1.01/0,0/0,0/16_025/0007417), finansiert av den europeiske Regional Development Fund, i operasjonell program forskning, utvikling og utdanning.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2-µm pore-size filters | SPI supplies, https://www.2spi.com/ | B0225-MB | Black, polycarbonate track etch membrane filters, diameter approprite for filtering apparatus used |
| 5-(4,6-dichlorotriazin-2-yl) aminofluorescein (DTAF) | Any brand | ||
| Automatic pipettes with adjustable volumes | Any brand, various sizes | ||
| Centrifuge | 22 000 x g | ||
| Cryovials | Any brand, 2 mL size | ||
| DAPI (4´,6-Diamidino-2´-phenylindole dihydrochloride) | Any brand | 1 mg ml-1 | |
| Epiflorescence microscope | Magnification from 400 x up to 1000 x | ||
| Filters appropriate for viewing in the DAPI and DTAF range | |||
| Counting grid in one of the oculars | |||
| Filtering apparatus | Usually with a diameter of 25 mm | ||
| Formaldehyde | A brand for microscopy | ||
| Glutaraldehyde | A brand for microscopy | ||
| Immersion oil for microscopy | Specific oil with low fluorescence | ||
| Lugol´s solution | Any brand or see comment | Make an alkaline Lugol' solution as follows: Solution 1 - dissolve 10 g of potassium iodide in 20 ml in MQ water, then add 5 g of iodine. Solution 2 - add 5 g of sodium acetate to 50 ml of MQ water. Add the solution 2 to the solution 1 and thoroughly mix | |
| Methanol stabilized formalin | Any brand available for microscopy purposes | ||
| Microscope slides and cover slips | Any brand produced for microscopy purposes | ||
| MQ water for diluting samples | Any brand |
||
| Phosphate-buffered saline (PBS; pH = 9) | Any brand | 0.05 M Na2HPO4-NaCl solution, adjusted to pH 9 | |
| PPi-saline buffer | Any brand | 0.02 M Na4P2O7-NaCl solution. Add 0.53 g Na4P2O7 to 100 ml of MQ water plus 0.85 g NaCl | |
| Sampling device | Appropriate for obtaining representative sample | e.g. Friedinger sampler for lake plankton | |
| Sodium thiosulfate solution | Any brand | 3% solution is used in the protocol | |
| Sonicator | Any brand | 30 W | |
| Vortex | Any brand allowing thorough mixing of the solutes and samples | ||
| Water bath | Any brand allowing temperature to be maintained at 60 °C |
References
- Azam, F., et al. The ecological role of water-column microbes in the sea. Marine Ecology Progress Series. 10, 257-263 (1983).
- Šimek, K., et al. A finely tuned symphony of factors modulates the microbial food web of a freshwater reservoir in spring. Limnology & Oceanography. 59, 1477-1492 (2014).
- Šimek, K., et al. Bacterial prey food characteristics modulate community growth response of freshwater bacterivorous flagellates. Limnology & Oceanography. 63, 484-502 (2018).
- Šimek, K., et al. Changes in bacterial community composition, dynamics and viral mortality rates associated with enhanced flagellate grazing in a meso-eutrophic reservoir. Applied & Environmental Microbiology. 67, 2723-2733 (2001).
- Jürgens, K., Matz, C. Predation as a shaping force for the phenotypic and genotypic composition of planktonic bacteria. Antonie Van Leeuwenhoek. 81, 413-434 (2002).
- Pernthaler, J. Predation on prokaryotes in the water column and its ecological implications. Nature Reviews Microbiology. 3, 537-546 (2005).
- Berninger, U. B., Finlay, J., Kuuppo-Leinikki, P. Protozoan control of bacterial abundances in freshwaters. Limnology and Oceanography. 36, 139-147 (1991).
- Sherr, E. B., Sherr, B. F. Protistan grazing rates via uptake of fluorescently labeled prey. Handbook of Methods in Aquatic Microbial Ecology. Kemp, P. F., Sherr, B. F., Sherr, E. B., Cole, J. J. , Lewis Publishers. Boca Raton, Florida. 695-701 (1993).
- Vazquez-Dominguez, E., Peters, F., Gasol, J. M., Vaqué, D. Measuring the grazing losses of picoplankton: methodological improvements in the use of fluorescently tracers combined with flow cytometry. Aquatic Microbial Ecology. 20, 119-128 (1999).
- Šimek, K., et al. Ecological role and bacterial grazing of Halteria spp.: Small oligotrichs as dominant pelagic ciliate bacterivores. Aquatic Microbial Ecology. 22, 43-56 (2000).
- Montagnes, D. J. S., et al. Selective feeding behaviour of key free-living protists: avenues for continued study. Aquatic Microbial Ecology. 53, 83-98 (2008).
- Kirchman, D. L. Processes in Microbial Ecology. 2nd Edition. , Oxford University Press. Oxford, UK. (2018).
- Porter, K. G., Feig, Y. S. The use of DAPI for identifying and counting aquatic microflora. Limnology and Oceanography. 25, 943-948 (1980).
- Foissner, W., Berger, H. A user-friendly guide to the ciliates (Protozoa, Ciliophora) commonly used by hydrobiologists as bioindicators in rivers, lakes, and waste waters, with notes on their ecology. Freshwater Biology. 35, 375-482 (1996).
- Foissner, W., Berger, H., Schaumburg, J. Identification and ecology of limnetic plankton ciliates. Informationsberichte des Bayer Landesamtes für Wasserwirtschaft Heft. , 3-99 (1999).
- Šimek, K., et al. Ciliate grazing on picoplankton in a eutrophic reservoir during the summer phytoplankton maximum: a study at the species and community level. Limnology & Oceanography. 40, 1077-1090 (1995).
- Skibbe, O. An improved quantitative protargol stain for ciliates and other planktonic protists. Archiv für. Hydrobiolgie. 130, 339-347 (1994).
- Macek, M., et al. Growth rates of dominant planktonic ciliates in two freshwater bodies of different trophic degree. Journal of Plankton Research. 18, 463-481 (1996).
- Šimek, K., et al. Microbial food webs in hypertrophic fishponds: omnivorous ciliate taxa are major protistan bacterivores. Limnology & Oceanography. , in press (2019).
- Jezbera, J., et al. Major freshwater bacterioplankton groups: Contrasting trends in distribution of Limnohabitans and Polynucleobacter lineages along a pH gradient of 72 habitats. FEMS Microbiology Ecology. 81, 467-479 (2012).
- Kasalický, V., et al. The diversity of the Limnohabitans genus, an important group of freshwater bacterioplankton, by characterization of 35 isolated strains. PLoS One. 8, 58209 (2013).
- Stabell, T. Ciliate bacterivory in epilimnetic waters. Aquatic Microbial Ecology. 10, 265-272 (1996).
- Zingel, P., et al. Ciliates are the dominant grazers on pico- and nanoplankton in a shallow, naturally highly eutrophic lake. Microbial Ecology. 53, 134-142 (2007).
- Bickel, S. L., Tang, K. W., Grossart, H. P. Ciliate epibionts associated with crustacean zooplankton in german lakes: distribution, motility, and bacterivory. Frontiers in Microbiology. 3 (243), (2012).
- Sirová, D., et al. Hunters or gardeners? Linking community structure and function of trap-associated microbes to the nutrient acquisition strategy of a carnivorous plant. Microbiome. 6, 225 (2018).
- Šimek, K., et al. Ecological traits of a zoochlorellae-bearing Tetrahymena sp. (Ciliophora) living in traps of the carnivorous aquatic plant Utricularia reflexa. Journal of Eukaryotic Microbiology. 64, 336-348 (2017).
- Pitsch, G., et al. The green Tetrahymena utriculariae n. sp. (Ciliophora, Oligohymenophorea) with its endosymbiotic algae (Micractinium sp.), living in the feeding traps of a carnivorous aquatic plant. Journal of Eukaryotic Microbiology. 64, 322-335 (2017).
- Nielsen, J. M., Clare, E. L., Hayden, B., Brett, M. T., Kratina, P. Diet tracing in ecology: Method comparison and selection. Methods in Ecology and Evaluation. 9, 278-291 (2018).
- Beisner, B. E., Grossart, H. P., Gasol, J. M. A guide to methods for estimating phago-mixotrophy in nanophytoplankton. Journal of Plankton Research. , 1-13 (2019).
- Dolan, J. D., Šimek, K. Processing of ingested matter in Strombidium sulcatum, a marine ciliate (Oligotrichida). Limnology and Oceanography. 42, 393-397 (1997).
- Massana, R., et al. Grazing rates and functional diversity of uncultured heterotrophic flagellates. The ISME Journal. 3, 588-596 (2009).
- Grujčić, V., et al. Cryptophyta as major freshwater bacterivores in experiments with manipulated bacterial prey. The ISME Journal. 12, 1668-1681 (2018).



