ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
وقد ثبت أن هذا الإجراء يستخدم لتطوير ثقافات كبدية ثلاثية الأبعاد متقدمة في المختبر، والتي يمكن أن توفر تقييما أكثر ملاءمة من الناحية الفسيولوجية للمخاطر الجينية المرتبطة بالتعرض للمواد النانوية على حد سواء على المدى الحاد أو الطويل، نظم الجرعة المتكررة.
Abstract
نظرا للتطور السريع والتنفيذ لمجموعة متنوعة من المواد النانوية المهندسة (ENM) ، فإن التعرض ل ENM أمر لا مفر منه وتطوير أنظمة اختبار قوية وتنبئية في المختبر أمر ضروري. علم السموم الكبدي هو المفتاح عند النظر في التعرض ENM، كما الكبد يخدم دورا حيويا في التوازن الأيضي وإزالة السموم، فضلا عن كونها موقعا رئيسيا لتراكم ENM بعد التعرض. وبناء على هذا والفهم المقبول بأن نماذج خلايا الكبد 2D لا تحاكي بدقة تعقيدات التفاعلات المعقدة متعددة الخلايا والنشاط الأيضي الملاحظ في الجسم الحي ، هناك تركيز أكبر على تطوير نماذج الكبد ثلاثية الأبعاد ذات الصلة من الناحية الفسيولوجية المصممة لأغراض تقييم مخاطر ENM في المختبر. وتمشيا مع مبادئ 3Rs لاستبدال وتقليل وصقل التجارب على الحيوانات ، وقد تم تطوير نموذج الكبد 3D HepG2 خط الخلية القائمة ، وهو نظام سهل الاستخدام وفعالة من حيث التكلفة التي يمكن أن تدعم كل من نظم التعرض الموسعة والمتكررة ENM (≤14 يوما). تحتفظ هذه النماذج الكروية (قطرها ≥500 ميكرومتر) بقدرتها التكاثرية (أي تقسيم نماذج الخلايا) مما يسمح لها بالاقترن بمسيح النوى الدقيق "القياسي الذهبي" لتقييم السمية الجينية في المختبر بشكل فعال. وقد تميزت قدرتها على الإبلاغ عن مجموعة من نقاط النهاية السمية (مثل وظائف الكبد والاستجابة الالتهابية (المؤيدة) والسمية الخلوية والسمية الجينية باستخدام عدة تدابير تحديد النمس عبر كل من نظم التعرض الحادة (24 ساعة) وطويلة الأجل (120 ساعة). هذا النموذج الكبدي ثلاثي الأبعاد في المختبر لديه القدرة على الاستفادة منه لتقييم التعرض ل ENM أكثر واقعية ، وبالتالي توفير نهج مستقبلي في المختبر لدعم تقييم مخاطر ENM بشكل أفضل بطريقة روتينية وسهلة الوصول إليها.
Introduction
نظرا للتطور السريع والتنفيذ السريع لمجموعة متنوعة من المواد النانوية المهندسة (ENM) عبر عدد كبير من التطبيقات البشرية (مثل الطعام ومستحضرات التجميل والملابس والمعدات الرياضية والإلكترونيات والنقل والطب) ، فمن المحتم أن يتعرض البشر لENM على أساس منتظم. مع هذا، هناك مخاوف متزايدة من أن الرواية، وحجم الخصائص الفيزيائية الكيميائية المحددة التي تعتبر هذه المواد مفيدة في العديد من التطبيقات يمكن أن يسبب آثارا سلبية على صحة الإنسان والبيئة في الوقت المناسب. ويوجد حاليا العديد من الأنشطة الدولية التي تعكس بفعالية التعرض الأكثر أهمية من الناحية الفسيولوجية لهذه المعدات وتقييم السمية المحتملة لهذه المواد على سيناريوهات التعرض الحاد والطويل الأجل والمتكررة للجرعات المنخفضة.
السموم الكبدية هو المفتاح عند النظر في التعرض ENM، كما هو معروف على نطاق واسع أن الكبد هو موقع رئيسي لتراكم ENM بعد التعرض1،2. وعلاوة على ذلك، فإن الكبد هو الجهاز الأساسي لنظام التمثيل الغذائي وإزالة السموم من المواد التي تدخل الدورة الدموية الجهازية3. استنادا إلى الفهم المقبول بأن نماذج خلايا الكبد 2D لا تحاكي بدقة تعقيدات التفاعلات المعقدة متعددة الخلايا أو تمثل بشكل مناسب النشاط الأيضي الملاحظ في الجسم الحي ، فقد تم إنشاء تركيز أكبر على تطوير نماذج كبد 3D قوية و ذات صلة فسيولوجية في المختبر لتقنيات استبدال الجسم الحي4،5. إن استخدام تقنيات متطورة في مجال الثقافة ثلاثية الأبعاد يحسن من طول عمر النماذج الكبدية في المختبر مما يسمح بإجراء دراسة لأنظمة التعرض المتكررة على المدى الطويل. بالإضافة إلى ذلك، هذا الشكل ثقافة متقدمة يعزز تشكيل تعزيز الفسيولوجية، والميزات العضوية مثل canaliculi الصفراء، وعمليات النقل النشط وتحسين قدرات استقلاب المخدرات CYP450، وبالتالي تحسين التنبؤية للنماذج6. نماذج الكبد ثلاثية الأبعاد الحالية في المختبر التي تتكون من ثقافات أحادية (خلايا الكبد فقط) أو الثقافات المشتركة (خلايا الكبد مع الخلايا غير الحيوية) موجودة في عدة أشكال، بدءا من microtissues أو كرويات في لوحات التصاق فائقة التوهج، شنقا قطرة كرويدات، والخلايا جزءا لا يتجزأ من المصفوفات و / أو السقالات ومنصات ثقافة الخلايا microfluidic، وكلها تعتبر فعالة متقدمة في نماذج المختبر لتقييم السمية الكبدية6،7. ومع ذلك، فإن غالبية هذه النظم النموذجية هي صيانة عالية، وتتطلب معدات متخصصة ومكلفة. وعلاوة على ذلك، فإن هذه النماذج غالبا ما تكون ثابتة (أي نماذج الخلايا الناندية) التي تمنع استخدامها في تقييم نقاط نهاية الخطر، مثل اختبار السمية الجينية باستخدام أساليب تحدد حجم تلف الحمض النووي الثابت. السمية الجينية هي شرط أساسي في علم السموم التنظيمي ، وهو عنصر حيوي في تقييم المخاطر لأيمادة سامة 8. لا يوجد أي فحص واحد يمكن تطبيقه لتحديد جميع أشكال تلف الحمض النووي التي قد تنشأ بعد التعرض لعامل خارجي. ومع ذلك ، فإن المكون الأساسي لبطارية اختبار السمية الجينية في المختبر هو المقايسة النووية الدقيقة ، وهي تقنية موثوقة ومتعددة الأوجه تقيس الضرر الكروموسومي الإجمالي9. وهو تقنية معيار الذهب التي وصفها اختبار منظمة التعاون والتنمية في الميدان الاقتصادي المبدأ التوجيهي 487، لتقييم تلف الحمض النووي في المختبر والسمية الجينية وجزء من متطلبات بطارية الاختبار لتقييم المخاطر التنظيمية10،11.
يستخدم خط الخلية السرطانية الكبدية البشرية ، HepG2 ، على نطاق واسع لفحص تقييم المخاطر الأولي حيث أن الخلايا متاحة بسهولة ، وغير مكلفة نسبيا للمصدر ، وبسيطة للثقافة وقابلة لفحص الإنتاجية العالية12،13. عندما مثقف في الهياكل كروية 3D، وقد ثبت أن تلخيص البيئة الدقيقة الكبد بشكل جيد وتقديم نموذج كبدي مع قدرات الانتشار كافية لدعم المقايسة micronucleus3. 10- وقد أنشئ مزيد من التطوير لنماذج كروية HepG2 لتحسين طول العمر والأداء الوظيفي الشبيه بالكبد للنموذج من أجل دعم تقييم مخاطر السمية الجينية على مدى نظم التعرض المتكررة الطويلة الأجل (≤14 يوما). وهكذا، وتمشيا مع مبادئ 3Rs لاستبدال وتقليل وصقل التجارب على الحيوانات، تم وضع هذا البروتوكول لتوفير نموذج متقدم ثلاثي الأبعاد في المختبر الكبدي قادر على تقييم نقاط النهاية السمية المتعددة بشكل موثوق (على سبيل المثال، وظائف الكبد، (المؤيدة) علامات الالتهاب، السمية الخلوية والسمية الجينية) بعد التعرض الحاد والطويل الأجل والمتكرر للمواد الكيميائية وENM بطريقة روتينية وسهلة الوصول إليها.
هنا، نقدم طريقة لإنشاء خط خلايا كبدية ثلاثية الأبعاد ذات صلة من الناحية الفسيولوجية تستند إلى نظام نموذج المختبر لتقييم مخاطر السمية الجينية بعد التعرض الحاد أو الطويل الأجل ل ENM المتكرر. يمكن تقسيم البروتوكول إلى 6 مراحل رئيسية: زراعة خلايا HepG2 المبردة؛ وزراعة خلايا 10000000000000000000000000000000000000000000000000 إعداد كروية HepG2; نقل كروية HepG2 من إسقاط شنقا لتعليق agarose; حصاد كروية HepG2; المقايسة micronucleus والتهديف؛ وتحليل البيانات.
Protocol
1.Culturing cryopreserved خلايا HepG2
ملاحظة: تم استزراع خلايا HepG2، التي تم الحصول عليها من مجموعة ثقافة النوع الأمريكي (ATCC) في متوسط النسر المعدل (DMEM) من Dulbecco مع 4.5g/L D-glucose وL-glutamine المكمل بمصل بقري الجنين 10٪ (FBS) و1٪ من مضاد البنسلين/الستريبتومايسين الحيوي.
- قبل الدافئة DMEM الخلية ثقافة المتوسطة (بما في ذلك المكملات الغذائية) في حمام مائي 37 درجة مئوية لمدة 30 دقيقة.
- إزالة قارورة واحدة من خلايا HepG2 من النيتروجين السائل وتذوب في حمام مائي 37 درجة مئوية لمدة 2-3 دقائق، في حين يحوم بلطف القارورة للسماح لذوبان موحد للتعليق الخلية. الحرص على عدم غمر القارورة فوق حلقة O من أجل الحد من احتمال التلوث.
- بمجرد إذابة القنينة من حمام الماء ورشها بسخاء مع الإيثانول بنسبة 70٪ لإزالة التلوث من السطح الخارجي للقارورة قبل وضعها تحت غطاء زراعة الأنسجة الملمين من الفئة الثانية العقيم.
- ماصة بعناية محتويات cryovial من خلايا HepG2 في أنبوب الطرد المركزي التي تحتوي على 9 مل من قبل الدافئة DMEM الخلية ثقافة المتوسطة (مع المكملات الغذائية).
- باستخدام 10 مل strippette، نقل 10 مل من تعليق الخلية إلى قارورة25 سم 2 خلية ثقافة المتاح واحتضان الثقافة لمدة 3 أيام (من البذر) في 5٪ CO2 و 37 درجة مئوية حتى يتم التوصل إلى ~ 80٪ التقاء قبل الخضوع لثقافة فرعية في أكبر 75 سم2 قارورة ثقافة الخلية المتاح.
- مرة واحدة يتم التوصل إلى التقاء 80٪، والخلايا دون الثقافة في ظل ظروف معقمة عن طريق التجربتين مع 0.05٪ trypsin / EDTA حل مسبقا تدفأ في حمام مائي 37 درجة مئوية لمدة 30 دقيقة. لا ينبغي في أي وقت من الأوقات السماح للخلايا بالجفاف.
- كما تشكل الخلايا أحادية الطبقة الملتصقة، وإزالة وسائل الإعلام عن طريق البقشيش في وعاء النفايات مطهر. ثم غسل على الفور monolayer لإزالة جميع آثار وسائل الإعلام الموجودة عن طريق شطف قارورة مرتين مع 3 مل من محلول بي بي إس 1x العقيمة التي يحتفظ بها في درجة حرارة الغرفة. أيضا، تجاهل برنامج تلفزيوني في وعاء النفايات المطهرة.
- مرة واحدة يتم إزالة غسل برنامج تلفزيوني, إضافة 5 مل من قبل تدفئة 0.05٪ trypsin-EDTA الحل, ضمان لتغطية كامل سطح الخلايا واحتضان الخلايا لمدة 6-8 دقيقة في 37 °C و 5٪ CO2.
- بلطف اضغط على قارورة لطرد الخلايا من أسفل القارورة ومن ثم إضافة 5 مل من DMEM خلية الثقافة المتوسطة (مع ملاحق) لتحييد انزيم التربسين.
- نقل تعليق الخلية إلى أنبوب الطرد المركزي 50 مل وماصة تعليق الخلية صعودا وهبوطا تماما لضمان أن الخلايا هي فصل تماما.
- الطرد المركزي تعليق الخلية المخفف في 230 × ز لمدة 5 دقائق. تجاهل supernatant في مطهر وإعادة تعليق بيليه الخلية في 25mL من DMEM خلية ثقافة المتوسطة (مع المكملات الغذائية).
- نقل تعليق الخلية إلى قارورة زراعة الخلية القابل للتصرف 75 سم2 واحتضان في 37 درجة مئوية و 5٪ CO2 لمدة 3 أيام أخرى قبل الخضوع لإعداد كروية. مرة واحدة وقد HepG2s الوقت للتأقلم ومرة أخرى تصل إلى ~ 80٪ التقاء، وتحديد تركيز الخلية استعدادا للبذر كروية.
2. إعداد كروية HepG2
- كرر خطوات الثقافة الفرعية المذكورة أعلاه، إلا بعد الطرد المركزي، وإعادة تعليق بيليه الخلية في 1 مل من DMEM ثقافة متوسطة قبل تسخينها في حمام مائي 37 درجة مئوية. تعليق خلية ماصة صعودا وهبوطا بدقة.
- تسجيل صلاحية الخلية باستخدام المقايسة استبعاد الأزرق تريبان (انظر OSHA SOP 3.21 السموم الإنجابية, موتاجنس, Teratogens والسموم الجنينية – إجراءات المناولة الآمنة والتخزين (2019) للصحة والسلامة التوجيه)14 مع نسبة 1:1 من تعليق الخلية إلى ما قبل تصفيتها 0.4٪ الحل الأزرق تريبان.
- قبل عد الخلايا، خذ 1 مل من محلول تريبان الأزرق باستخدام حقنة وتصفية 1 مل مع وحدة تصفية 0.45 ميكرومتر في أنبوب معقم 1 مل.
- نقل 10 ميكرولتر من المحلول الأزرق المصفى، تريبان إلى أنبوب 0.2 مل وإضافة 10 ميكرولتر من تعليق الخلية. يمكن تخزين المتبقية تصفية الحل الأزرق تريبان تصل إلى 3 أشهر في درجة حرارة الغرفة للاستخدام في المستقبل.
- رش مقياس الدم جيدا مع الإيثانول 70٪ ومسح الجافة مع منشفة ورقية معقمة قبل تأمين غطاء على رأس باستخدام بخار التنفس. انزلاق الغطاء عبر سطح مبلل التنفس يحفز قوى متماسكة عن طريق توليد حلقات نيوتن.
- ماصة بلطف تعليق الخلايا الزرقاء تريبان صعودا وهبوطا باستخدام ماصة 1000 ميكرولتر (للحد من الإجهاد الهائل) قبل إضافة 10 ميكرولتر إلى مقياس الدم. تأكد من أن الحل مشتت تحت زلة الغطاء ويغطي الشبكة بأكملها دون فقاعات الهواء.

الشكل 1: عد الخلايا باستخدام مقياس الدم. تمثيل تخطيطي لمقياس الهيموسيكلات الذي يسلط الضوء على الربع الذي يجب عد الخلايا منه. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تحت المجهر، عد حية (غير ملطخة) والميتة (الأزرق الملون) الخلايا الموجودة في المربعات الزاوية الأربعة الكبيرة(الشكل 1). استبعاد أي خلايا وجدت لتداخل أو الجلوس على الحواف الداخلية اثنين من المربعات الزاوية الكبيرة (أي، على خطوط) في العد.
- باستخدام الحساب التالي، احسب متوسط عدد الخلايا الحية القابلة للحياة (غير الملطخة) الموجودة في العينة:
العدد الإجمالي للخلايا/مل = عدد الخلايا الحية x x 10,000
الحية x x 10,000
حيث يشير التخفيف إلى عدد المرات التي تم فيها تخفيف محلول المخزون باللون الأزرق Trypan (2x في هذه الحالة) ويشير # المربعات التي تم عدها إلى المربعات الأربعة الكبيرة في الزاوية من مقياس الدم الذي تم عده - استنادا إلى عدد خلايا HepG2 القابلة للتطبيق واستخدام الصيغة التالية:
C1V1= C2V2
حيث C1 = تركيز خلايا قابلة للحياة حاليا،
V1 = حجم تعليق الخلية حاليا،
C2 = تركيز تعليق الخلية المطلوبة،
V2 = حجم تعليق الخلية المطلوب - إعداد محلول مخزون 10 مل من تعليق الخلية HepG2 مع متوسط ثقافة الخلية DMEM بتركيز 2.0 × 105 خلايا / مل من أجل تحقيق 4000 خلايا HepG2 لكل قطرة معلقة 20 ميكرولتر. اخلط تعليق الخلية جيدا عن طريق الأنابيب برفق صعودا وهبوطا باستخدام ماصة 1000 ميكرولتر لضمان تعليق جميع الخلايا بالكامل داخل الوسائط.
- إلى آبار لوحة ثقافة الخلايا 96 جيدا، إضافة 100 ميكروغرام من العقيمة، ودرجة حرارة الغرفة PBS لمنع قطرات شنقا من الجفاف أثناء الحضانة.
- تأخذ غطاء من مستوى أسفل شقة 96 جيدا لوحة ثقافة الخلية، عكس ذلك وماصة بعناية 20 قطرات μL من تعليق الخلية في وسط كل الأخدود جيدا من الغطاء، كما هو مبين في الشكل 2. استخدام ماصة متعددة القنوات ولكن إضافة فقط 2-4 قطرات في وقت واحد كما البذر متعددة يمكن أن تؤثر على دقة ووضع قطرات.
- مركز قطرات داخل الأخاد من الآبار المنصوص عليها على الغطاء؛ وإلا فإنها لن شنق في وسط الآبار عندما يتم تشغيل غطاء لوحة أكثر من وخطر السقوط في لوحة. الوجه بلطف غطاء لوحة 96 جيدا، لذلك قطرات معلقة الآن ووضع بعناية على رأس لوحة 96 جيدا.
- ضع لوحة البئر ال 96 بأكملها مع الغطاء برفق في حاضنة عند درجة حرارة 37 درجة مئوية و5٪من ثاني أكسيد الكربون لمدة 3 أيام قبل نقل كروي إلى الآغاروز.
ملاحظة: يجب توخي المزيد من الحذر ليس فقط عند نقل اللوحات إلى / من الحاضنات ، ولكن عند فتح وإغلاق الحاضنة بشكل عام حيث يمكن أن تتسبب الحركة المفرطة في تحول اللوحات وتساقط الكرويات أو تشكيلها بشكل غير صحيح.

الشكل 2: 3D HepG2 في المختبر إعداد نموذج كروي. (أ) خلايا HepG2 المصنفة في قطرات 20 ميكرولتر على غطاء لوحة 96 جيدا. (ب) خلايا HepG2 بعد البذر في نموذج قطرة معلقة للسماح لتشكيل كروية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. نقل كروية HepG2 من إسقاط شنقا إلى تعليق agarose
ملاحظة: في اليوم 3 آخر البذر في قطرات معلقة، يتم نقل كرويدات في آبار من نفس لوحة 96 جيدا وكلها كانت مغلفة سابقا مع طبقة غرامة من هلام agarose 1.5٪.
- إعداد المواد الهلامية agarose وautclave (أي، يوم 2 بعد البذر) قبل يوم طلاء لوحة (أي، يوم 3 بعد البذر).
- لإعداد هلام agarose 1.5٪، تزن 0.30 غرام من الآغاروز في زجاجة نظيفة، ثم إضافة 20 مل من المتوسط DMEM الحرة الفينول الأحمر. أوتوكلاف الآغاروز لمدة ساعة واحدة في 230 درجة مئوية للتعقيم. يمنع طلاء الآغروز كرويدات HepG2 من التمسك بقاعدة الآبار وتشكيل طبقة أحادية خلوية بدلا من الاحتفاظ بهيكل كروية ثلاثي الأبعاد.
- في اليوم الثالث بعد البذر ، قم بإزالة لوحة 96 جيدا التي تحتوي على كرويدات قطرة HepG2 المعلقة من الحاضنة وقلب الغطاء بعناية حتى لا تعد الكرويات معلقة.
- باستخدام ماصة متعددة القنوات، قم بإزالة وتجاهل 100 ميكرولتر من برنامج تلفزيوني تمت إضافته سابقا إلى قاعدة لوحة 96 بئرا. السماح للوحات لairdry لمدة 2-3 دقائق في حين تسخين agarose استعدادا للطلاء.
تنبيه: ينتج عن هذا الإجراء agarose سائل ساخن جدا إذا سكب على الجلد قد يحترق ويسبب إصابة. وعلاوة على ذلك، يجب توخي الحذر عند التعامل مع زجاجة تحتوي على agarose السائل لأن هذا أيضا يمكن أن تكون ساخنة جدا. - باستخدام المواد الهلامية agarose 1.5٪ التي تم إعدادها مسبقا، سخني الزجاجة التي تحتوي على هلام الآغاروز سعة 20 مل لمدة 30 s في الميكروويف بحد أقصى واط (أي 900 واط). لمعطف اثنين من لوحات 96 جيدا، زجاجة واحدة 20 مل من هلام agarose المعدة مسبقا 1.5٪ ينبغي أن تكون كافية.
- مرة واحدة ذابت، دوامة بلطف agarose عن طريق تدوير زجاجة لإزالة أي فقاعات ومن ثم إضافة 50 ميكروغرام من الآغاروز في قاعدة كل بئر.
ملاحظة: عند إضافة agarose، تأكد من عدم زاوية لوحة > 45 درجة كما agarose مجموعات بسرعة، وسوف لا تشكل شقة، طبقة المستوى التي يمكن أن تعطل نمو كروية. من المهم العمل بكفاءة في هذه المرحلة لمنع الآغروز من الترسخ قبل أن يتم طلاء الطبق بالكامل. - السماح للوح للوقوف لمدة 2 دقيقة في درجة حرارة الغرفة قبل إضافة 100 ميكرولتر من قبل الدافئة DMEM الخلية ثقافة المتوسطة (مع المكملات الغذائية) على رأس طبقة agarose الصلبة في كل بئر.
- الوجه غطاء لوحة 96 جيدا ومكان مرة أخرى على رأس لوحة 96 جيدا حتى كرويدات معلقة الآن مرة أخرى.
- الطرد المركزي لوحة لمدة 3 دقائق في 200 × ز من أجل نقل كرويدات من قطرة معلقة في الآبار الفردية من لوحة 96 جيدا. بعد النقل، يجب الآن تعليق كرويدات HepG2 في وسيطة ثقافة الخلية. السماح لهم لتسوية ل 24 ساعة في الحاضنة في 37 درجة مئوية و 5٪ CO2.
- تعريض كرويدات HepG2 بهذا الحجم إما للعلاجات الكيميائية أو علاجات ENM في اليوم الرابع بعد البذر (أي 24 ساعة بعد نقلها إلى الأطباق المغلفة بال أغاروز).
- من أجل الحفاظ على صلاحية الخلية على مدى فترات الثقافة الموسعة، قم بتحديث وسط ثقافة الخلية كل 3 أيام. للقيام بذلك، يستنشق بلطف 50 ميكرولتر من الخلايا ثقافة المتوسطة من سطح البئر واستبدالها مع 50 ميكرولتر جديدة من المتوسطة ثقافة الخلية DMEM. الحرص على عدم إزالة أو إزعاج كروية عند إجراء تغيير متوسط.
4. التعرض للمواد النانوية / الكيميائية
ملاحظة: يمكن لنموذج كروية الكبد HepG2 دعم كل من نظم التعرض القائمة على ENM والمواد الكيميائية، ولكن التركيز الأساسي لهذا البروتوكول هو التعرض ل ENM. قبل التعرض، يجب أن يكون اختبار ENM مشتتا بشكل مناسب؛ ويمكن تنفيذ ذلك وفقا لتوجيهات بروتوكول التشتت NanoGenoTox (اتفاقية المنح رقم 20092101، 2018)15.
- بعد التشتت وفقا لبروتوكول تشتت NanoGenoTox ، قم بتخفيف تعليق ENM من التركيز الأساسي البالغ 2.56 ملغم / مل إلى التركيز النهائي المطلوب في وسط ثقافة الخلية DMEM الدافئ مسبقا (بما في ذلك المكملات الغذائية). مطلوب حجم إجمالي قدره 5 مل لجرعة واحدة 96 لوحة بئر.
- لتعريض كروية HepG2 إما إلى مادة كيميائية أو ENM ، باستخدام ماصة 200 ميكرولتر ، تستنشق 50 ميكرولتر من وسط زراعة الخلية من سطح كل بئر (تاركة 50 ميكرولتر في البئر حتى لا تزعج الكرويات) واستبدالها بوسط 50 ميكرولتر يحتوي على مادة سمية الاختبار بالجرعة المطلوبة.
- بمجرد تطبيق مادة الاختبار، قم باحتضان اللوحات لوقت التعرض المطلوب عند 37 درجة مئوية و5٪ CO2.
- إذا تم إجراء نظام التعرض على المدى الطويل (≥24 ساعة)، ثم مباشرة بعد انقضاء الإطار الزمني للتعرض المطلوب، حصاد كرويدات لتحليل نقطة النهاية النووية الدقيقة على النحو المبين أدناه في الخطوات 6.1 - 6.4.
- ومع ذلك، مع أنظمة التعرض الحاد (على سبيل المثال، ≤24 ساعة)، وبمجرد انتهاء فترة التعرض، والحصاد، وتجمع، وتخزين 50 ميكروغرام من الناتات من كل بئر في لوحة بئر 96 في -80 درجة مئوية لمزيد من التحليل الكيميائي الحيوي في وقت لاحق. استبدال الخلايا ثقافة المتوسطة مع 50 ميكرولتر من المتوسطة الطازجة التي تحتوي على 6 ميكروغرام / مل من Cytochalasin B وترك لاحتضان لدورات الخلية 1-1.5 (أي 24 - 26 ساعة لHpG2) استعدادا لحصاد المقايسة النيوكليونية كتلة السيتوكينسيس.
ملاحظة: بالنسبة لأنظمة التعرض الحادة (≤24 ساعة)، يمكن تطبيق المقايسة الميكروتوكينوسية كتلة السيتوكينات مع Cytochalasin B ولكن على المدى الطويل (≥24 ح) نظم التعرض، يجب استخدام النسخة أحادية النواة (دون Cytochalasin B) من المقايسة على النحو المبين أدناه في الشكل 4.
5. حصاد كروي HepG2
ملاحظة: بعد العلاجات الكيميائية أو التعرض ENM، يمكن حصاد كل من الأنسجة المتوسطة أو الكروية زراعة الخلايا لتحليل نقطة النهاية متعددة. اعتمادا على تحليل نقطة النهاية، يمكن حصاد كرويدات إما بشكل فردي (على سبيل المثال، لتحليل الصور) أو تجميعها معا (على سبيل المثال، من أجل فحص الخلايا الميكروتونية كتلة).
- إزالة لوحة 96 جيدا من الحاضنة.
- باستخدام ماصة 200 ميكرولتر، يستنشق 100 ميكرولتر من الخلايا المتوسطة بما في ذلك الأنسجة الكروية من كل بئر وجمع في أنبوب الطرد المركزي العقيمة، 15 مل. الحرص على تجنب الاتصال مع الآغاروز.
- وبمجرد جمعها، طرد مركزي تعليق كروي في 230 × ز لمدة 5 دقائق. قم بإزالة الناتنات وخزنه عند -80 درجة مئوية لإجراء مزيد من التحليل النهائي (مثل اختبارات وظائف الكبد) لاحقا.
- إعادة تعليق بيليه من كرويدات في 1 مل من عقيمة، ودرجة حرارة الغرفة PBS (1x).
- مرة واحدة غسلها، الطرد المركزي تعليق كروية مرة أخرى في 230 × ز لمدة 3 دقائق. تجاهل supernatant، وإعادة تعليق في 500 ميكرولتر من 0.05٪ حل تريبسين-EDTA واحتضان لمدة 6-8 دقيقة في 37 درجة مئوية و 5٪ CO2.
- بعد الحضانة، ماصة بلطف الخلايا المثقبة صعودا وهبوطا لفصل تماما وإعادة تعليق خلايا HepG2 قبل تحييد مع 1 مل من المتوسطة ثقافة الخلية DMEM.
- الطرد المركزي تعليق الخلية المخفف في 230 × ز لمدة 5 دقائق. تجاهل supernatant في مطهر وإعادة تعليق بيليه الخلية في 2mL من درجة حرارة الغرفة PBS (1x).
- الطرد المركزي تعليق الخلية في 230 × ز لمدة 5 دقائق. تجاهل supernatant في مطهر ومن ثم إعادة تعليق بيليه الخلية مرة أخرى في 2 مل من برنامج تلفزيوني الباردة (1x). تأكد من أن الخلايا مشتتة بشكل جيد لمنع كتل من الخلايا تحجب مجال الرؤية عند تركيبها على شرائح المجهر.
6. المقايسة Micronucleus وسجل
بالنسبة للطريقة اليدوية لمقايسة النوى الدقيقة ، يلزم جهاز طرد مركزي للخلايا لإنتاج السيتودوت (منطقة محددة ومركزة من الخلايا) في وسط شريحة المجهر. تدعم هذه العملية تسجيل أكثر كفاءة للشريحة لأنها تسمح للهادح بتحديد موقع الخلايا ذات الاهتمام بسهولة ، بدلا من تقييم شريحة كاملة حيث يمكن نشر الخلايا على نطاق واسع.
- تراجع الشرائح المجهر متجمد (ثلاثة لكل جرعة) في الإيثانول 70٪ تليها DDH2O وترك للهواء الجاف لمدة 5 دقائق.
- ضع شرائح المجهر المعدة في قمع cuvette كما هو موضح في الشكل 3A، حيث يتم وضع الشريحة الزجاجية (iii) في الدعم المعدني (iv) مع بطاقة تصفية (ii) وقمع cuvette (i) المضمون على القمة.
- ترتيب القمع cuvette في جهاز الطرد الخلوي مع القمع التي تواجه، لذلك يمكن إضافة 100 ميكرولتر من تعليق الخلية مباشرة في كل واحد.
- Cytospin لمدة 5 دقائق في 500 × ز لضمان توزيع الخلايا بالتساوي على سطح الشريحة.

الشكل 3: إعداد Cytospin لإعداد الخلايا المعالجة على شرائح المجهر. (A) يعرض المكونات الفردية، (1) قمع cuvette، (2) بطاقة التصفية، (3) شريحة المجهر الزجاجي و (4) الدعم المعدني المطلوب لخلايا السيتوسبين HepG2 على شرائح المجهر. (ب) تم إعداد قمع cuvette النهائي. (ج)الموضع الصحيح لمسار cuvette داخل جهاز الطرد الخلوي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- اترك الشرائح لتجف الهواء قبل التثبيت في الميثانول البارد، 90٪ لمدة 10 دقائق.
- مرة واحدة ثابتة، وترك الشرائح للهواء الجاف بين عشية وضحاها في درجة حرارة الغرفة قبل تخزينها في -20 درجة مئوية لمدة تصل إلى 6 أشهر.
- عند الحاجة، قم بإزالة شرائح المجهر المعدة مسبقا من الثلاجة -20 درجة مئوية واتركها دافئة لدرجة حرارة الغرفة قبل إجراء تلطيخ Giemsa.
تنبيه: وفقا للائحة رقم (EC) رقم 1272/2008 [CLP] ، فإن محلول تلطيخ Giemsa هو سائل شديد الاشتعال يمكن أن يكون ساما إذا ابتلع ويسبب تلفا عند ملامسة العينين أو الجلد أو إذا تم استنشاقه. راجع ورقة SDS المرتبطة بها للحصول على نصائح مفصلة بشأن التخزين والمناولة والصحة والسلامة حول هذه المادة الكيميائية قبل الاستخدام. - في حين أن الشرائح هي تذويب، وإعداد محلول تلطيخ غيمسا 20٪ (25 مل المطلوبة لصبغ ~ 30 الشرائح) المخفف في العازلة فوسفاتاز (الرقم الحموضة 6.8). اخلط جيدا عن طريق تدوير الحل برفق قبل التصفية باستخدام ورق فلتر مطوي يوضع في قمع.
- باستخدام ماصة باستور، إضافة 3 - 5 قطرات من حل Giemsa تصفيتها إلى السيتودوت على كل شريحة وترك لمدة 8 - 10 دقيقة.
- غسل الشرائح في اثنين من يغسل العازلة فوسفاتاز المتعاقبة قبل الشطف لفترة وجيزة تحت الماء البارد لإزالة أي بقايا وصمة عار الزائدة. اترك الشرائح لتجف الهواء.
- مرة واحدة جافة، في غطاء محرك السيارة الدخان، تراجع الشرائح الملطخة في إكسيلين لمدة 10 ثانية قبل إضافة قطرة من المتوسطة المتصاعدة إلى وسط السيتودوت ومكان غطاء زجاجي على القمة.
- ترك الشرائح المجهر في غطاء الدخان بين عشية وضحاها لتجف قبل التهديف اليدوي; يمكن تخزينها إلى أجل غير مسمى في درجة حرارة الغرفة.
7. تحليل البيانات
- كما هو موضح في المبادئ التوجيهية اختبار منظمة التعاون والتنمية في الميدان الاقتصادي 487 (2014)11، لتقييم وقياس الأضرار الناجمة عن الحمض النووي نتيجة التعرض لENM أو عامل كيميائي ، واستخدام المجهر الخفيف (100x الهدف مع زيت الغمر) 2000 أحادية النواة أو 1000 خلية ثنائية الاختزال لكل تكرار البيولوجية ليسجل لوجود النونيوكلي ، كما هو مبين في الشكل 4.

الشكل 4: ميكرونوكلوس المقايسة تسجيل شجرة القرار. شجرة قرار تخطيطي لتسليط الضوء على ضرورة مختلف التهديف وإجراءات تقييم السمية الخلوية عند استخدام المقايسة النووية الدقيقة مع نماذج 3D بعد نظم التعرض الحادة أو طويلة الأجل. وتسمح حالات التعرض الحادة (≤24 ساعة) باستخدام المقايسة الميكروتونية المحظورة للسيتوكينات، في حين أن التعرض الطويل الأجل (≥24 ساعة) يتطلب النسخة الأحادية النووية من المقايسة؛ وكلاهما موصوف في المبدأ التوجيهي 487 لاختبار منظمة التعاون والتنمية في الميدان الاقتصادي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- استنادا إلى نسبة النوكل الدقيق الموجودة لكل عدد من الخلايا أحادية النواة أو الثنائية المسجلة، احسب نسبة مئوية من قيمة السمية الجينية.
- من أجل تقييم تلف الحمض النووي لوحظ ليس نتيجة لحطام الخلية الناجمة عن نسبة عالية من الخلايا المبرمج، واتخاذ مقياس للسمية الخلوية جنبا إلى جنب. في هذه الحالة، اعتمادا على وجود Cytochalasin B، استخدم إما CPBI أو حساب RVCC (كما هو موضح في الشكل 4). يجب تقييم السمية الجينية فقط في العينات التي تكون فيها السمية الخلوية أقل من 55٪ ± 5٪ كما هو محدد في المبدأ التوجيهي اختبار منظمة التعاون والتنمية في الميدان الاقتصادي 48711.
Representative Results
تم تقييم مدى ملاءمة نموذج كروية الكبد ثلاثي الأبعاد القائم على خط الخلية للثقافة طويلة الأجل وتقييم المخاطر الجينية من خلال إجراء توصيف أساسي لتحديد صلاحية النموذج ووظائفه الشبيهة بالكبد على مدى 14 يوما في الثقافة بالإضافة إلى إمكانية تطبيقه على فحص الميكرونوكليوس.
التوصيف الأساسي لنموذج كرويد الكبد ثلاثي الأبعاد HepG2
قبل أي تقييم سمية في المختبر، من المهم التحقق من أن كرويدات HepG2 ثلاثية الأبعاد قد تشكلت بشكل صحيح قبل إجراء نقل الآغاروز أو العلاج الكيميائي/ENM. عادة ما تستغرق كرويات HepG2 المنتجة باستخدام طريقة الإسقاط المعلق 2 - 3 أيام بعد البذر (4000 خلية / كروية) لتشكيل كرويات صغيرة كروية الشكل يبلغ متوسط قطرها 495.52 ميكرومتر W × 482.69 ميكرومتر H كما هو موضح في الشكل 5A-5C. يجب أن يكون للشفرات HepG2 التي تشكلت بشكل صحيح ومقبولة لاستخدامها في التقييم السمية المختبرية هيكل صغير على شكل كروي مع سطح أملس ولا توجد إسقاطات بصرية. الشكل 5 يقدم أمثلة من نوعية جيدة (الشكل 5D -F) ونوعية رديئة (الشكل 5G-I) كرويدات. وينبغي التخلص من هذه الأخيرة. عادة، 90-95٪ من كرويات شكلت لكل لوحة سوف تشكل بشكل صحيح وتكون قابلة للحياة لمزيد من التجارب.

الشكل 5: صور المجهر الخفيفة التي تعرض مورفولوجيا الطبيعية للكرويدات HepG2 شكلت عن طريق طريقة إسقاط شنقا. (A-C) تظهر اليوم 2 و (D-I) اليوم 4 كرويدات الكبد HepG2 بعد البذر. (D-F) هي أمثلة على نوعية جيدة من كرويدات HepG2 بينما (G-I) يظهر كرويات سيئة التشكيل. تم التقاط جميع الصور على هدف X20 باستخدام المجهر. يمثل شريط المقياس 20 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
لمزيد من تأكيد قدرة هيب جي 2 على البقاء، يمكن إجراء فحص بروموبريسول الأخضر للألبومين (BCG) أو تقييم اليوريا لتقييم وظائفها الشبيهة بالكبد. تم تقييم وظائف تشبه الكبد بما يتماشى مع الجدوى باستخدام المقايسة استبعاد الأزرق تريبان على مدى فترة الثقافة 14 يوما لتحديد طول عمر نموذج كروية الكبد وتحديد ما إذا كان يمكن أن تدعم على المدى الطويل أو المتكرر ENM / تقييم المخاطر الكيميائية القائمة (الشكل 6). وظل تركيز الألبومين ثابتا طوال فترة الثقافة. إنتاج اليوريا يعرض زيادة في تركيز اليوريا المنتجة لكل كروية على مدى أسبوع في الثقافة قبل الوصول إلى هضبة بحلول اليوم 7. من المهم ملاحظة أن مستويات الألبومين واليوريا المنتجة في كرويات HepG2 ثلاثية الأبعاد أعلى بكثير من تلك التي لوحظت في نفس خط الخلية المستزرع في شكل 2D. في الواقع، كانت الثقافات 2D من خلايا HepG2، ذروة مستويات الألبومين واليوريا 0.001 ملغم / مل و 0.010 نانوغرام / ميكرولتر على التوالي. وعلاوة على ذلك، في العمل السابق الذي نشرته شاه وآخرون باستخدام نظام كروي HepG2 متطابقة تقريبا، والكتاب تسليط الضوء على تحسن ملحوظ في النشاط الأيضي (CYP1A1 و CYP1A2) في 3D HepG2 في أنظمة نموذج المختبر بالمقارنة مع خلايا 2D مثقف HepG25.

الشكل 6: بيانات توصيف خط الأساس لمدة 14 يوما ل كرويات الكبد HepG2. بعد نقل من قطرة شنقا،(أ)يسلط الضوء على جدوى نموذج كروية HepG2 على مدى فترة 14 يوما في حين (ب) و (ج) تسليط الضوء على وظائف الزلال واليوريا تشبه الكبد على التوالي. متوسط البيانات ± SEM المقدمة، n = 4. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
مع التطور الحتمي لنواة نخرية ، وهو قيد معروف من ثقافات كروية الكبد ثلاثية الأبعاد ، كان لا بد من تأسيس صلاحية هذا النموذج القائم على HepG2 لإثبات أنه قادر على الحفاظ على أنظمة التعرض طويلة الأجل (5-10 أيام) مع الحفاظ على القدرة التكاثرية المطلوبة لدعم المقايسة الدقيقة5. في الواقع، وقد ثبت هذا النموذج كروية الكبد 3D للاحتفاظ > 70٪ الجدوى على مدى 10 أيام في الثقافة. وبناء على ذلك وبالتزامن مع الأداء الوظيفي المستمر الشبيه بالكبد الذي لوحظ خلال فترة الثقافة ≥14 يوما، يمكن لهذا النموذج الكروي للكبد ثلاثي الأبعاد أن يدعم أنظمة التعرض المتكررة ل ENM على المدى الطويل لمدة تصل إلى 10 أيام (أي قبل أن تنخفض صلاحية الكرويات إلى أقل من 70٪). كمرجع، ينصح بأن تكون مستويات الألبومين ل كرويدات HepG2 المصنفة في 4000 خلية /كروية ≥20.0 نانوغرام/ميكرولتر بينما يجب أن يكون إنتاج اليوريا ≥0.25 نانوغرام/ميكرولتر قبل إجراء تقييم سمية في المختبر مع هذا النموذج.
تقييم السمية الجينية للمواد النانوية المهندسة
10- وفيما يتعلق بتقييم السمية الجينية، استخدم المقايسة النووية الدقيقة لتحديد وجود النوى الدقيقة في أعقاب التعرض الحاد (24 ساعة) والتعرض الطويل الأجل (120 ساعة) للنواقص النمومية. أفلاتوشين B1 هو مادة مسرطنة معروفة للكبد16،17 وهو عنصر تحكم إيجابي موصى به لإجراء فحص النوى الدقيقة. وقد أظهرت تجارب التحسين أن 0.1 ميكرومتر من الفاتوشين B1 يحفز إيجابية كبيرة (≥2.0 أضعاف زيادة) استجابة جنوة في كرويدات الكبد 3D HepG2 وبالتالي يستخدم في كل المقايسة النويدات الدقيقة التي أجريت مع هذا النموذج. لضمان صحة نتائج فحص النويدات الدقيقة باستخدام نموذج كروية HepG2 ، يجب أن يقع تردد النوى الدقيق الخلفي لخلايا HepG2 المستخدمة في هذا النموذج ثلاثي الأبعاد في المختبر ضمن نطاق 0.6٪ - 1.2٪. ونتيجة لذلك، ينبغي أن يؤدي الفاتوكسيين B1 إلى استجابة سمية جينية أعلى مرتين على الأقل من تلك التي شوهدت مع السيطرة السلبية؛ وبالتالي، فإن 0.1 ميكرومتر من الفاتوكسيين B1 يجب أن تحفز تردد النوكل الدقيق بين 1.5٪ - 3.0٪. وباستخدام معلمات التحكم هذه، يمكن بعد ذلك تقييم السمية الجينية المرتبطة ب ENM في المختبر تقييما موثوقا به. استنادا إلى المبدأ التوجيهي 487 اختبار منظمة التعاون والتنمية في الميدان الاقتصادي، من المهم أن نلاحظ أنه عند اختبار ENM أو مادة كيميائية، والتركيزات المختارة لا ينبغي أن تحفز أكثر من 55٪ ± 5٪ السمية الخلوية (المشار إليها من خلال انخفاض في القيم CPBI أو RVCC فيما يتعلق بالسيطرة السلبية)11. ويوضح الشكل 7 البيانات التي تم توليدها عندما تم تقييم الأفلاتوكسيين B1 واثنين من ENMs (ثاني أكسيد التيتانيوم (TiO2)والشظية (Ag)) بعد التعرض الحاد والطويل الأجل في كرويدات HepG2 ، وتم تحليل إمكانات السمية الجينية اللاحقة باستخدام اختبار النوكلية الدقيقة. وقد تم اختبار كل من ENMs تقييمها في غير السموم، جرعة منخفضة من 5.00 ميكروغرام / مل على التعرض الحاد (24 ساعة) وطويلة الأجل (120 ساعة) نظام التعرض. ويمكن ملاحظة اتجاه مماثل للسمية الجينية عبر كل من TiO2 وAg ENMs ، حيث لم تكن الاستجابة المرتفعة للسمية الجينية التي نتجت عن التعرض لمدة 24 ساعة واضحة بعد التعرض لمدة 5 أيام على المدى الطويل. وكان هذا على الرغم من السمية الجينية المستمرة الناجمة عن السيطرة الإيجابية Aflatoxin B1 في كلتا النقطتين الزمنيتين.

الشكل 7: تقييم السمية الجينية بعد التعرض TiO2 وAG ENM على كرويدات الكبد HepG2. تقييم السمية الجينية (تردد النويدات الدقيقة) باستخدام وظيفة المقايسة النووية الدقيقة(A)الحادة (24 ساعة) و(ب)التعرض طويل الأجل (120 ساعة) إلى 5.00 ميكروغرام / مل من TiO2 وAg ENM. السيطرة السلبية هي وسائل الإعلام فقط، في حين أن السيطرة الإيجابية هي 0.1 ميكرومتر من أفلاتوشين B1. متوسط البيانات (n=2) المقدمة ± SD. الأهمية المشار إليها فيما يتعلق بالتحكم السلبي: * = p≤ 0.05. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تختلف تطبيقات النماذج الكبدية ثلاثية الأبعاد بشكل كبير اعتمادا على نقطة النهاية الكيميائية الحيوية الخاصة أو مسار النتائج السلبية المستهدف. كل نموذج له فوائده وحدوده، من الاختلاف بين الدونور في الخلايا الكبدية البشرية الأولية (PHH) نماذج لخفض نشاط السيتوكروم P450 في النماذج القائمة على خط الخلية، ولكن كلها قيمة في حد ذاتها6،12،18،19. عند تقييم السمية الجينية هناك قيود في النماذج التوافق مع نقاط النهاية المعتمدة التنظيمية مثل المقايسة النووية الدقيقة في المختبر، كما هو مطلوب الانتشار النشط. وهذا ضروري، حيث يتطلب تقييم السمية الجينية تقييم كمية تلف الحمض النووي الثابت بعد انقسام الخلايا عندما تكون هناك فرصة لإصلاح الحمض النووي لتصحيح الآفات العابرة. لسوء الحظ، خلايا الكبد المتباينة للغاية (أي هيبارج) القائمة على كرويدات أو الخلايا المجهرية PHH، والتي تعتبر لإظهار الخصائص الأكثر صلة من الناحية الفسيولوجية تشبه الكبد تشكل نماذج ثابتة (غير التكاثرية)12،19،20. ونتيجة لذلك، يوفر نموذج كروية HepG2 ثلاثي الأبعاد المعروض هنا نموذجا بديلا مناسبا قادرا على دعم اختبار السمية الجينية. HepG2 الخلية خط القائم على كرويدات لديها ما يكفي من الخلايا تقسيم بنشاط على السطح الخارجي للسفيرويدات مع الحفاظ على خصائص أساسية تشبه الكبد، مثل إنتاج الألبومين واليوريا وبعض النشاط CYP4505،12،19. أساسا هذا النموذج في الكبد المختبر وقد وضعت لاستكمال المقايسة micronucleus، وهذا هو واحد من اثنين في المختبر المقايسات الموصى بها في البطارية لاختبار السمية الجينية8،10،11،21. ومع ذلك، يمكن تطبيق النموذج بسهولة على تحليل تسلسل الحمض النووي وتقنيات التعبير الجيني (RNA)، في حين أن لديه القدرة على زيادة تكييفه واستخدامه لنقاط نهائية أخرى لتلف الحمض النووي، مثل فحص المذنب. ومع ذلك، من المهم النظر في الدور الذي يلعبه تدخل ENM في بعض تحليلات نقاط النهاية. على سبيل المثال، قد لا تكون التحليلات المستندة إلى قياس التدفق الخلوي مناسبة لتقييم السمية الجينية ENM على وجه التحديد بسبب تداخل الجسيمات22.
أحد العوامل المقيدة لنماذج كروية تخضع بنشاط لتقسيم الخلايا هو حجمها. تحسين كثافة البذر أمر بالغ الأهمية حيث يجب أن يكون هناك ما يكفي من الخلايا التي تسمح للنموذج بالاستمرار في الانتشار؛ ولكن ليس عدد الخلايا عالية جدا، مما يؤدي إلى كروية تصبح مدمجة بشكل مفرط، مما يؤدي إلى زيادة النواة النخرية. ويعتقد أن سبب هذا النخر هو تقييد الأكسجين ونشر المواد الغذائية ، حيث يعتقد أن الحد الأقصى لهذا الانتشار هو حوالي 100 - 150 ميكرومتر من الأنسجة23،24. ومع ذلك، هذا يعتمد على نوع الخلية، رقم الخلية، التفاعلات سقالة وظروف الثقافة25. منذ ذلك الحين ، فقد ثبت أن قطرها حوالي 700 ميكرومتر هو الحد الأقصى لتجنب ظهور مبكر للنخر في وسط كرويدات C3A ، البذر 4000 خلايا HepG2 لكل كروية يضمن قطر النموذج في وقت التعرض هو ≤500 ميكرومتر26. وعلاوة على ذلك، أثبت شاه وآخرون أن خلايا HepG2 المصنفة فوق 5000 خلية لكل كروية أظهرت انخفاضا بنسبة 25٪ في الجدوى بعد 7 أيام في الثقافة، والتي يمكن أن تتعلق بمتوسط قطر 680 ميكرومتر والتوافر المحدود للمغذيات في قطرة معلقة 20 ميكرولتر5. للتغلب على ذلك ، يخضع النموذج الذي تم وضعه في البروتوكول الحالي لخطوة حاسمة حيث يتم نقل قطرة الشنق إلى آبار مغلفة ب agarose بعد التكوين الأولي للسفيرويد. وهذا يضمن وجود حجم أكبر من وسيط الثقافة للحفاظ على العدد المتزايد من الخلايا داخل كرويدات. ونتيجة لذلك، فإن نموذج كروية HepG2 لا يزال أكثر من 70٪ قابلة للحياة بعد 10 أيام في الثقافة ويمكن استخدامها لتقييم المخاطر على المدى الطويل في المختبر.
في حين أن نموذج كروية HepG2 يمكن أن يدعم أنظمة التعرض الحادة والطويلة الأجل ، فإن متوسط ثقافة الخلايا المنعشة خلال فترات الثقافة الممتدة مقيد لهذا النموذج حيث لا ينصح باستبدال الوسط بالكامل بسبب الخسارة المحتملة للشفرات. ومن المفترض أنه مع التعرض ل ENM، فإن الميل إلى تشتت ENM متجانس للتكتجمعات والرواسب مرتفع. ومع ذلك، فمن الجدير بالذكر أن المعدل الذي يمكن أن تختلف به رواسب ENM اعتمادا على معلمات الجسيمات (على سبيل المثال، الحجم والشكل والكثافة) ويمكن تحديده نظريا باستخدام نموذج الترسيب في المختبر ونشره وقياس الجرعات (ISDD)، أو مشتقاته الحديثة، والتي يشار إليها غالبا عند اقتراب التعرض ل ENM (التعليق)من 27و28. مع هذا هو العقل, ومن المفترض أنه إذا كان فقط 50٪ من الخلايا ثقافة المتوسطة تتم إزالتها بعناية من سطح ثقافة الخلية, وينبغي تعطيل وإزالة لاحقة من جرعة ENM يكون الحد الأدنى من الناحية النظرية. ومع ذلك ، مع الحركة براونيان في اللعب ، وهذا قد لا يكون هو الحال تماما ، وينبغي القيام بمزيد من العمل في ترسب وترسب كل ENM معينة لاختبارها لضمان الاحتفاظ قياس الجرعات الصحيح في جميع أنحاء أنظمة التعرض على المدى الطويل27. وهذا أساسا قيد محتمل ينبغي النظر فيه عند تنفيذ نظم الزم المتكررة لأن ذلك يمكن أن يكون حاسما بالنسبة للتركيز النهائي المتراكم. التعرض على أساس المواد الكيميائية من ناحية أخرى، في حين لا يخلو من القيود الخاصة بهم للنظر، وتقديم نهج أكثر تبسيطا في أن المواد الكيميائية تميل إلى البقاء في الحل، وبالتالي استبدال مباشر للتركيز الكيميائي الأصلي بالإضافة إلى تركيز المضافة حديثا يضمن أن يتم استبدال أي مادة كيميائية فقدت خلال المرطبات وسائل الإعلام وفقا لذلك29. وتشمل التطبيقات المستقبلية تقييم مدى ملاءمة النموذج لنظم التعرض المتكررة على مدى فترات الثقافة الطويلة الأجل، حيث أن استراتيجيات التعاطي المتكررة ذات أهمية حاسمة لتقييم قدرة نظام عضوي معين على تحسين أو التغلب على الآثار الضارة، إن وجدت، الناجمة عن التراكم البيولوجي لمادة زينوبيوتية.
وفي الختام، فإن هذا النموذج الكبدي ثلاثي الأبعاد في المختبر لديه القدرة على الاستفادة منه لتقييم مجموعة من سيناريوهات التعرض الواقعية، وبالتالي توفير نهج مستقبلي في المختبر لدعم أفضل لكل من ENM وتقييم المخاطر الكيميائية بطريقة روتينية وسهلة الوصول إليها.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgments
ويود المؤلفون أن يعترفوا بأن هذا البحث قد تلقى تمويلا من برنامج الاتحاد الأوروبي للأبحاث والابتكار في أفق 2020 لمشروع PATROLS، بموجب اتفاق المنح رقم 760813
Materials
| Name | Company | Catalog Number | Comments |
| Aflotoxin B1 | Sigma Aldrich, UK | A6636-5MG | |
| Agarose | Sigma Aldrich, UK | A9539-50G | |
| Autoclave Tape | |||
| BCG Albumin Assay | Sigma Aldrich, UK | MAK124 | |
| Bovine Serum Albumin Powder | Sigma Aldrich, UK | A9418 | |
| Cell Freezing Aid | Thermo Fisher Scientific, UK | 5100-0001 - Mr Frosty | |
| Centrifuge | Eppendorf | 5810 R | |
| Cytochalasin B | Merck, UK | 250233 | |
| Cytology Metal Clips | |||
| Cytospin 4 Centrifuge | ThermoFisher Scientific, UK | CM00730202 | |
| DMEM with 4.5g/L D-Glucose, L-Glutamine | GIBCO, Paisley, UK | 41965-039 | |
| DMEM, phenol-red free with 4.5g/L D-Glucose, L-Glutamine with Hepes | GIBCO, Paisley, UK | 21063-029 | |
| DPX Mounting Medium | FisherScientific, UK | D/5330/05 | |
| Ethanol | FisherScientific, UK | 10048291 | |
| FBS | GIBCO, Paisley, UK | 10270-106 | |
| Filter Cards for Shandon Cytospin | FisherScientific, UK | 15995742 | |
| Frosted Glass Slides | ThermoFisher Scientific, UK | ||
| Giemsa's Stain Improved R66 Solution, Gurr | VWR Chemicals, UK | MFCD00081642 | |
| Glass Coverslips (24 x 60) | Deckglaser, VWR | ECN631-1575 | |
| Haemocytometer and Coverslip | |||
| Immersion Oil for Microscope | Zeiss, UK | 518F, ISO8034 | |
| Laminar Class II Tissue Culture Hood | Scanlaf Mars | ||
| Light Microscope | Zeiss, UK | Axiovert 40C | |
| Liquid Nitrogen | |||
| Methanol | FisherScientific, UK | 10284580 | |
| Microwave | |||
| Non-Filtered, Sterile 200µl and 1000µl Pipette tips | Greiner-Bio-One, UK | ||
| NuncMicroWell 96-Well Microplates | ThermoFisher Scientific, Denmark | 167008 | |
| P1000 and P200 micropipettes | |||
| P300 and P50 multi-channel pipettes | |||
| PBS pH 7.4 1X, MgCl2 and CaCl2 Free | GIBCO, Paisley, UK | 14190-094 | |
| Pen/Strep | GIBCO, Paisley, UK | 15140-122, Penicillin/Strepmyocin 100X or 10,000U/ml | |
| Phosphatase Buffer Tablets | GIBCO, Paisley, UK | 10582-013 | |
| Pipette Boy | |||
| Simport Scientific CytoSep Funnels for Shandon Cytospin 4 Centrifuges | FisherScientific, UK | 11690581 | |
| Sonifier SFX 550 240V CE 1/2" - Probe | Branson, USA | 101-063-971R | |
| T-25 and T-75 Tissue Culture Flask | Greiner-Bio-One, UK | T-25 (690175) and T-75 (660175) | |
| Trypan Blue Solution | Sigma Aldrich, UK | T8154-100mL | |
| Urea Assay Kit | Sigma Aldrich, UK | MAK006 | |
| Virkon Disinfectant | DuPont, UK | Rely+On Virkon | |
| Water Bath (37?C) | Grant JBNova 18 | ||
| Weighing Balance | |||
| Xylene | FisherScientific, UK | 10588070 | |
| 0.05% Trypsin-EDTA | GIBCO, Paisley, UK | 5300-054 | |
| 0.2mL and 1.0mL Eppendorf Tubes | Greiner-Bio-One, UK | ||
| 0.45µm Filter Unit | Millex HA, MF-Millipore, UK | SLHA033SS | |
| 1.0mL Syringe | BD Plastipak, FisherScientific, UK | 300185 | |
| 20mL LS Scintillation Glass Vials, 22-400 Foil Lined PP Caps | DWK Life Sciences GmbH, Germany | WHEA986581 | |
| 37?C and 5% CO2 ISO Class 5 Hepa Filter Incubator | NUAIRE DHD Autoflow | ||
| 3mL Pasteur Pipette | Greiner-Bio-One, UK | ||
| 50mL Conical Falcon Tubes | Greiner-Bio-One, UK | ||
| 50mL or 100mL Glass Bottles | |||
| 50mL Skirted Falcon Tubes | Greiner-Bio-One, UK | ||
| 5mL, 10mL and 25mL Pipettes | Greiner-Bio-One, UK | ||
| 9.4cm Square, Petri Dish | Greiner-Bio-One, UK | 688161 |
References
- Geiser, M., Kreyling, W. G. Deposition and biokinetics of inhaled nanoparticles. Particle and Fibre Toxicology. 7, 2 (2010).
- Modrzynska, J. Toxicological effects of nanoparticle deposition in the liver. Kgs. Lyngby, Denmark: Technical University of Denmark. , (2018).
- Elje, E., et al. The comet assay applied to HepG2 liver spheroids. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 845, 403033 (2019).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18, 240-249 (2013).
- Shah, U. -K., et al. A three-dimensional in vitro HepG2 cells liver spheroid model for genotoxicity studies. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 825, 51-58 (2018).
- Lauschke, V. M., Hendriks, D. F. G., Bell, C. C., Andersson, T. B., Ingelman-Sundberg, M. Novel 3D Culture Systems for Studies of Human Liver Function and Assessments of the Hepatotoxicity of Drugs and Drug Candidates. Chemical Research in Toxicology. 29, 1936-1955 (2016).
- van Grunsven, L. A. 3D in vitro models of liver fibrosis. Advanced Drug Delivery Reviews. 121, 133-146 (2017).
- Corvi, R., Madia, F. In vitro genotoxicity testing - can the performance be enhanced. Food and Chemical Toxicology. 106, 600-608 (2017).
- Doak, S. H., Manshian, B., Jenkins, G. J. S., Singh, N. In vitro genotoxicity testing strategy for nanomaterials and the adaptation of current OECD guidelines. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 745, 104-111 (2012).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2, 1084-1104 (2007).
- OECD. OECD Guidelines. Test 489: In vivo Mammalian Alkaline Comet Assay. , (2016).
- Gerets, H. H. J., et al. Characterization of primary human hepatocytes, HepG2 cells, and HepaRG cells at the mRNA level and CYP activity in response to inducers and their predictivity for the detection of human hepatotoxins. Cell Biology and Toxicology. 28, 69-87 (2012).
- Sison-Young, R. L., et al. A multicenter assessment of single-cell models aligned to standard measures of cell health for prediction of acute hepatotoxicity. Archives of Toxicology. 91, 1385-1400 (2017).
- European Guidelines 2019. European Agency for Safety and Health at Work. , Available from: https://osha.europa.eu/en/safety-and-health-legislation/european-guidelines (2019).
- Jensen, K. A. The NANOGENOTOX Dispersion Protocol for NANoREG. European Union Grant Agreement n° 2009. 21, 01 (2014).
- Marchese, S., et al. Aflatoxin B1 and M1: Biological Properties and Their Involvement in Cancer Development. Toxins. 10, 214 (2018).
- Rushing, B. R., Selim, M. I. Aflatoxin B1: A review on metabolism, toxicity, occurrence in food, occupational exposure, and detoxification methods. Food and Chemical Toxicology. 124, 81-100 (2019).
- Kermanizadeh, A., Brown, D. M., Moritz, W., Stone, V. The importance of inter-individual Kupffer cell variability in the governance of hepatic toxicity in a 3D primary human liver microtissue model. Scientific Reports. 9, 7295 (2019).
- Berger, B., et al. Comparison of Liver Cell Models Using the Basel Phenotyping Cocktail. Frontiers in Pharmacology. 7, 443 (2016).
- Ramaiahgari, S. C., et al. A 3D in vitro model of differentiated HepG2 cell spheroids with improved liver-like properties for repeated dose high-throughput toxicity studies. Archives of Toxicology. , (2014).
- Li, Y., et al. Factors affecting the in vitro micronucleus assay for evaluation of nanomaterials. Mutagenesis. 32 (1), 151-159 (2016).
- Kirkland, D., Reeve, L., Gatehouse, D., Vanparys, P. A core in vitro genotoxicity battery comprising the Ames test plus the in vitro micronucleus test is sufficient to detect rodent carcinogens and in vivo genotoxins. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 721 (1), 27-73 (2011).
- Curcio, E., et al. Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials. 28, 5487-5497 (2007).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86, 672-680 (2004).
- Asthana, A., Kisaalita, W. S. Microtissue size and hypoxia in HTS with 3D cultures. Drug Discovery Today. 17, 810-817 (2012).
- Gaskell, H., et al. Characterization of a functional C3A liver spheroid model. Toxicology Research. 5, 1053-1065 (2016).
- Cho, E. C., Zhang, Q., Xia, Y. The effect of sedimentation and diffusion on cellular uptake of gold nanoparticles. Nature Nanotechnology. 6, 385-391 (2011).
- Hinderliter, P. M., et al. ISDD: A computational model of particle sedimentation, diffusion and target cell dosimetry for in vitro toxicity studies. Particle and Fiber Toxicology. 7, 36 (2010).
- Kramer, N. I., di Consiglio, E., Blaauboer, B. J., Testai, E. Biokinetics in repeated-dosing in vitro drug toxicity studies. Toxicology in vitro. 30, 217-224 (2015).
Tags
الهندسة الحيوية، العدد 160، في نماذج الكبد المختبر، المواد النانوية، تقييم المخاطر، التعرض على المدى الطويل، نانو (جينو) السموم، تلف الحمض النوويErratum
Formal Correction: Erratum: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure
Posted by JoVE Editors on 01/26/2021.
Citeable Link.
An erratum was issued for: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure. The Representative Results section was updated.
Figure 6 in the Representative Results section was updated from:
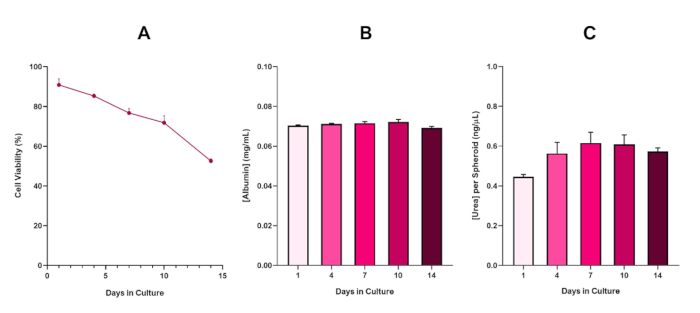
to:
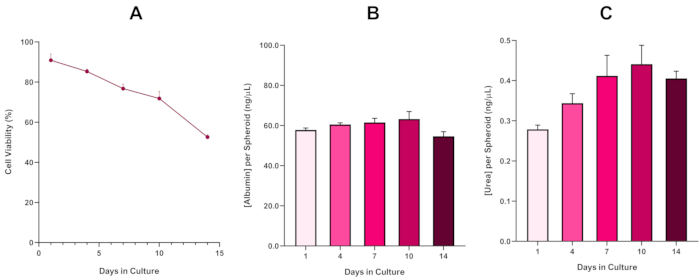
The fourth paragraph in the Representative Results section was updated from:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥0.06 mg/mL whilst urea production should be ≥0.4 ng/µL before conducting an in vitro toxicological assessment with this model.
to:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥50.0 ng/μL whilst urea production should be ≥0.25 ng/µL before conducting an in vitro toxicological assessment with this model.



 الحية x x 10,000
الحية x x 10,000