ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Deze procedure werd vastgesteld om te worden gebruikt voor de ontwikkeling van geavanceerde 3D-leverculturen in vitro, die een meer fysiologisch relevante beoordeling kunnen bieden van de genotoxische gevaren die gepaard gaan met blootstelling aan nanomaterialen gedurende zowel acute als langdurige, herhaalde dosisschema's.
Abstract
Door de snelle ontwikkeling en implementatie van een breed scala aan engineered nanomaterialen (ENM) is blootstelling aan ENM onvermijdelijk en is de ontwikkeling van robuuste, voorspellende in vitro testsystemen essentieel. Levertoxicologie is de sleutel bij het overwegen van ENM-blootstelling, omdat de lever een vitale rol speelt bij metabole homeostase en ontgifting en een belangrijke plaats is van ENM-accumulatie na blootstelling. Op basis hiervan en het aanvaarde begrip dat 2D-hepatocytmodellen de complexiteit van ingewikkelde multicellulaire interacties en metabole activiteit die in vivo worden waargenomen niet nauwkeurig nabootsen, is er een grotere focus op de ontwikkeling van fysiologisch relevante 3D-levermodellen die zijn afgestemd op ENM-gevarenbeoordelingsdoeleinden in vitro. In overeenstemming met de principes van de 3Rs om dierproeven te vervangen, te verminderen en te verfijnen, is een 3D HepG2-cellijn gebaseerd levermodel ontwikkeld, een gebruiksvriendelijk, kosteneffectief systeem dat zowel uitgebreide als herhaalde ENM-blootstellingsregimes kan ondersteunen (≤14 dagen). Deze sferoïde modellen (≥500 μm in diameter) behouden hun proliferatieve capaciteit (d.w.z. celmodellen delen) waardoor ze kunnen worden gekoppeld aan de 'gouden standaard' micronucleustest om de genotoxiciteit in vitro effectief te beoordelen. Hun vermogen om te rapporteren over een reeks toxicologische eindpunten (bijv. leverfunctie, (pro-)inflammatoire respons, cytotoxiciteit en genotoxiciteit) is gekarakteriseerd met behulp van verschillende ENM's in zowel acute (24 uur) als langdurige (120 uur) blootstellingsregimes. Dit 3D-in vitro hepatische model heeft de capaciteit om te worden gebruikt voor het evalueren van meer realistische ENM-blootstellingen, waardoor een toekomstige in vitro benadering wordt geboden om de ENM-gevarenbeoordeling op een routinematige en gemakkelijk toegankelijke manier beter te ondersteunen.
Introduction
Door de snelle ontwikkeling en implementatie van een breed scala aan ontworpen nanomaterialen (ENM) in een overvloed aan menselijke toepassingen (bijv. voedsel, cosmetica, kleding, sportuitrusting, elektronica, transport en geneeskunde), is het onvermijdelijk dat mensen regelmatig aan ENM worden blootgesteld. Hiermee zijn er verhoogde zorgen dat de nieuwe, groottespecifieke fysiochemische kenmerken die deze materialen in tal van toepassingen voordelig achten, tegelijkertijd nadelige effecten op de menselijke gezondheid en het milieu kunnen veroorzaken. Momenteel zijn er veel internationale activiteiten om actief meer fysiologisch relevante blootstellingen aan dit ENM weer te geven en de potentiële toxiciteit van deze materialen te beoordelen in acute, langdurige en herhaalde blootstellingsscenario's met een lage dosis.
Levertoxicologie is van cruciaal belang bij het overwegen van ENM-blootstelling, aangezien algemeen bekend is dat de lever een belangrijke plaats is van ENM-accumulatie na blootstelling1,2. Bovendien is de lever het primaire orgaansysteem voor metabolisme en ontgifting van stoffen die in de systemische circulatie komen3. Op basis van het aanvaarde inzicht dat 2D-hepatocytmodellen de complexiteit van ingewikkelde meercellige interacties niet nauwkeurig nabootsen of op passende wijze de in vivo waargenomen metabole activiteit vertegenwoordigen , is een grotere focus gelegd op het ontwikkelen van robuuste en fysiologisch relevante in vitro 3D-levermodellen voor in vivo substitutietechnologieën4,5. Het gebruik van geavanceerde 3D-cultuurtechnologieën verbetert de levensduur van in vitro levermodellen, waardoor langdurige, herhaalde blootstellingsregimes kunnen worden onderzocht. Bovendien bevordert dit geavanceerde kweekformaat de vorming van verbeterde fysiologische, organotypische kenmerken zoals gal canaliculi, actieve transporterprocessen en verbeterde CYP450-drugmetaboliseringsmogelijkheden, waardoor de voorspelbaarheid van de modellen wordt verbeterd6. De huidige 3D-in vitro hepatische modellen bestaande uit monoculturen (alleen hepatocyten) of coculturen (hepatocyten met niet-parenchymale cellen) bestaan in verschillende formaten, variërend van microtissues of sferoïden in ultralage hechtplaten, hangende druppelsferoïden, cellen ingebed in matrices en/of steigers en microfluïdische celkweekplatforms, die allemaal worden beschouwd als effectieve geavanceerde in vitro modellen voor hepatische toxiciteitsbeoordeling6,7. De meeste van deze modelsystemen zijn echter zeer onderhoudsarm, vereisen gespecialiseerde apparatuur en zijn duur. Bovendien zijn deze modellen vaak statisch (d.w.z. niet-dividerende celmodellen) die het gebruik ervan bij de beoordeling van gevareneindpunten voorkomen, zoals genotoxiciteitstests met behulp van methoden die vaste DNA-schade kwantificeren. Genotoxiciteit is een essentiële voorwaarde in de regulerende toxicologie en is een essentieel onderdeel van de risicobeoordeling van een toxicant8. Er is geen enkele test die kan worden toegepast om alle vormen van DNA-schade te kwantificeren die kunnen ontstaan na blootstelling aan een exogene agent. Een kerncomponent van de in vitro genotoxiciteitstestbatterij is echter de micronucleustest, een betrouwbare en veelzijdige techniek die grove chromosomale schade meet9. Het is een gouden standaardtechniek beschreven in oeso-testrichtsnoer 487, voor de beoordeling van in vitro DNA-schade en genotoxiciteit en maakt deel uit van de testbatterijvereiste voor de beoordeling van de regelgevingsgevaar10,11.
De menselijke hepatocellulaire carcinoomcellijn, HepG2, wordt veel gebruikt voor initiële risicobeoordelingsscreening omdat de cellen gemakkelijk beschikbaar zijn, relatief goedkoop om te vinden, eenvoudig te culteren en vatbaar voor screening met hoge doorvoer12,13. Wanneer gekweekt in 3D bolvormige structuren, is aangetoond dat ze de levermicromilieu goed samenvatten en een levermodel bieden met voldoende proliferatieve capaciteiten om de micronucleustest te ondersteunen3. Verdere ontwikkeling van de HepG2-sferoïdemodellen werd vastgesteld om de levensduur en leverachtige functionaliteit van het model te verbeteren om de beoordeling van de genotoxiciteitsgevaar tijdens langdurige, herhaalde blootstellingsregimes (≤14 dagen) te ondersteunen. In overeenstemming met de principes van de 3Rs voor het vervangen, verminderen en verfijnen van dierproeven, is dit protocol dus vastgesteld om een geavanceerd 3D-in vitro levermodel te bieden dat in staat is om meerdere toxicologische eindpunten (bv. leverfunctionaliteit, (pro-)inflammatoire markers, cytotoxiciteit en genotoxiciteit) betrouwbaar te evalueren na acute, langdurige en herhaalde blootstellingen aan chemische en ENM's op een routinematige en gemakkelijk toegankelijke manier.
Hier presenteren we een methode om een fysiologisch relevant 3D hepatocytcellijn gebaseerd in vitro modelsysteem vast te stellen voor de beoordeling van genotoxiciteitsgevaar na acute of langdurige, herhaalde ENM-blootstellingen. Het protocol kan worden onderverdeeld in 6 belangrijke fasen: het cultiveren van cryopreserved HepG2-cellen; HepG2 sferoïde voorbereiding; HepG2 sferoïde overdracht van hangende druppel naar agarose suspensie; HepG2 sferoïde oogst; micronucleustest en -score; en gegevensanalyse.
Protocol
1.Culturing cryopreserved HepG2 cellen
OPMERKING: HepG2-cellen, verkregen uit American Type Culture Collection (ATCC), werden gekweekt in 1x Dulbecco's Modified Eagle Medium (DMEM) met 4,5 g/L D-glucose en L-glutamine aangevuld met 10% foetale runderserum (FBS) en 1% penicilline/streptomycine antibioticum.
- Pre-warm DMEM celkweekmedium (inclusief de supplementen) in een waterbad van 37 °C gedurende 30 minuten.
- Verwijder een flacon HepG2-cellen uit vloeibare stikstof en ontdooi gedurende 2-3 minuten in een waterbad van 37 °C, terwijl u de flacon voorzichtig wervelt om een gelijkmatige ontdooiing van de celsuspensie mogelijk te maken. Zorg ervoor dat u de flacon niet boven de O-ring onderdompelt om de kans op besmetting te verminderen.
- Eenmaal ontdooid, verwijdert u de flacon uit het waterbad en spuit u royaal met 70% ethanol om het buitenoppervlak van de flacon te ontsmetten voordat u deze onder een steriele, klasse II laminaire weefselkweekkap plaatst.
- Pipetteer de inhoud van het cryovial van HepG2-cellen zorgvuldig in een centrifugebuis met 9 ml voorverwarmd DMEM-celkweekmedium (met supplementen).
- Breng met behulp van een 10 ml strippette 10 ml van de celsuspensie over in een 25 cm2 wegwerpcelkweekkolf en incubeer de cultuur gedurende 3 dagen (vanaf het zaaien) bij 5% CO2 en 37 °C totdat ~80% samenvloeiing wordt bereikt voordat de subcultuur wordt ondergaan in een grotere 75 cm2 wegwerpcelkweekkolf.
- Zodra 80% samenvloeiing is bereikt, subkweekcellen onder steriele omstandigheden door trypsinisatie met 0,05% trypsine/EDTA-oplossing voorverwarmd in een waterbad van 37 °C gedurende 30 minuten. Op geen enkel moment mogen de cellen uitdrogen.
- Als cellen een aanhangend monolaag vormen, verwijdert u de media door ze in een desinfecterende afvalpot te kantelen. Was vervolgens onmiddellijk de monolaag om alle sporen van bestaande media te verwijderen door de kolf tweemaal te spoelen met 3 ml steriele 1x PBS-oplossing die op kamertemperatuur wordt bewaard. Gooi PBS ook weg in een desinfecterende afvalpot.
- Zodra PBS-was is verwijderd, voegt u 5 ml voorverwarmde 0,05% trypsine-EDTA-oplossing toe, zodat het hele oppervlak van de cellen wordt bedekt en cellen gedurende 6-8 minuten bij 37 °C en 5% CO2worden geïncubeerd.
- Tik voorzichtig op de kolf om de cellen van de bodem van de kolf los te maken en voeg vervolgens 5 ml DMEM-celkweekmedium (met supplementen) toe om het trypsine-enzym te neutraliseren.
- Breng de celsuspensie over in een centrifugebuis van 50 ml en pipetteer de celsuspensie grondig op en neer om ervoor te zorgen dat cellen volledig worden losgekoppeld.
- Centrifugeer de verdunde celsuspensie gedurende 5 minuten op 230 x g. Gooi het supernatant weg in ontsmettingsmiddel en schors celkorrels opnieuw in 25 ml DMEM-celkweekmedium (met supplementen).
- Breng de celsuspensie over in een75 cm 2 wegwerpcelkweekkolf en incubeer bij 37 °C en 5% CO2 gedurende nog eens 3 dagen voordat u een bolvormig preparaat ondergaat. Zodra de HepG2's tijd hebben gehad om te acclimatiseren en opnieuw ~ 80% samenvloeiing te bereiken, bepaal je de celconcentratie ter voorbereiding op sferoïde zaaien.
2. HepG2 sferoïde voorbereiding
- Herhaal de hierboven beschreven subcultuurstappen, behalve na centrifugeren, en hang de celkorrel opnieuw op in 1 ml DMEM-kweekmedium dat vooraf is opgewarmd in een waterbad van 37 °C. Pipetcelsuspensie grondig op en neer.
- Scoor de levensvatbaarheid van cellen met behulp van de Trypan Blue Exclusion Assay (zie OSHA SOP 3.21 Reproductive Toxins, Mutagens, Teratogens and Embryotoxins – Procedures for Safe Handling and Storage (2019) for health and safety guidance)14 met een 1:1 verhouding van celsuspensie tot voorgefilterde 0,4% Trypan blauwe oplossing.
- Neem vóór het tellen van de cellen 1 ml Trypan blauwe oplossing met een spuit van 1 ml en filtreer met een filtereenheid van 0,45 μm in een steriele buis van 1 ml.
- Breng 10 μL gefilterde, Trypan blauwe oplossing over in een buis van 0,2 ml en voeg 10 μL celsuspensie toe. Resterende gefilterde Trypan blauwe oplossing kan tot 3 maanden bij kamertemperatuur worden bewaard voor toekomstig gebruik.
- Besproei de hemocytometer grondig met 70% ethanol en veeg droog met een steriele papieren handdoek voordat u de afdeklip erop vastzet met ademdamp. Het schuiven van de dekenslip over het door de adem bevochtigde oppervlak veroorzaakt samenhangende krachten door Newtonringen te genereren.
- Pipetteer de Trypan blauwe celsuspensie voorzichtig op en neer met behulp van een pipet van 1000 μL (om pure stress te verminderen) voordat u 10 μL aan de hemocytometer toevoegt. Zorg ervoor dat de oplossing onder de afdekslip wordt gedispergeerd en het hele rooster bedekt zonder luchtbellen.

Figuur 1: Cellen tellen met behulp van een hemocytometer. Schematische weergave van een hemocytometer die aanmarkering geeft uit welk kwadrant cellen moeten worden geteld. Klik hier om een grotere versie van deze afbeelding te bekijken.
- Tel onder de microscoop de levende (onbevlekte) en dode (blauw gekleurd) cellen die in de vier grote hoekvierkanten zijn gevonden (figuur 1). Sluit cellen uit die elkaar overlappen of zitten aan de binnenkant van twee randen van de grote hoekvierkanten (d.w.z. op de lijnen) in de telling.
- Bereken met behulp van de volgende berekening het gemiddelde aantal levende, levensvatbare cellen (niet-bedorven) in het monster:
Totaal aantal cellen/ml = aantal levende cellen x x 10.000
x 10.000
waarbij verdunning verwijst naar hoe vaak de stamoplossing werd verdund in Trypan blauw (2x in dit geval) en het aantal geteld vierkanten verwijst naar de vier grote hoekvierkanten van de hemocytometer geteld - Gebaseerd op het levensvatbare aantal HepG2-cellen en met behulp van de volgende formule:
C1V1=C2V2
waarbij C1 = de concentratie van levensvatbare cellen momenteel;
V1 = het volume van de celsuspensie op dit moment,
C2 = de gewenste concentratie celsuspensie,
V2 = het gewenste volume celsuspensie - Bereid een 10 ml voorraadoplossing van HepG2-celsuspensie met DMEM-celkweekmedium in een concentratie van 2,0 x10 5 cellen/ml om 4000 HepG2-cellen per 20 μL hangende druppel te bereiken. Meng de celsuspensie grondig door voorzichtig op en neer te pipetten met behulp van een pipet van 1000 μL om ervoor te zorgen dat alle cellen volledig in de media zijn opgehangen.
- Voeg aan de putten van een 96-put celkweekplaat 100 μL steriele PBS op kamertemperatuur toe om te voorkomen dat de hangende druppels uitdrogen tijdens de incubatie.
- Neem het deksel van een standaard platte bodem 96-put celkweekplaat, keer deze om en pipetteer voorzichtig 20 μL druppels van de celsuspensie in het midden van elke putgroef van het deksel, zoals weergegeven in figuur 2. Gebruik een meerkanaals pipet, maar voeg slechts 2 - 4 druppels tegelijk toe, omdat meerdere seeding de nauwkeurigheid en plaatsing van de druppels kan beïnvloeden.
- Centreer de druppels in de groeven van de putten die op het deksel zijn aangelegd; anders hangen ze niet in het midden van de putten wanneer het deksel van de plaat wordt omgedraaid en lopen ze het risico in de plaat te vallen. Draai voorzichtig het deksel van de 96-well plaat om, zodat de druppels nu hangen en voorzichtig op de 96-well plaat worden plaats.
- Plaats de hele 96 putplaat met deksel voorzichtig in een incubator bij 37 °C en 5% CO2 gedurende 3 dagen voorafgaand aan de overdracht van sferoïden op agarose.
OPMERKING: Er moet niet alleen extra voorzichtig worden omgegaan bij het transport van de platen van/naar de incubators, maar ook bij het openen en sluiten van de incubator in het algemeen, omdat overmatige beweging ertoe kan leiden dat de platen verschuiven en de sferoïden vallen of zich verkeerd vormen.

Figuur 2: 3D HepG2 in vitro sferoïde modelpreparaat. (A) De HepG2 cellen gezaaid in 20 μL druppels op het deksel van een 96-put plaat. (B) De HepG2-cellen post-seeding in het hangende druppelmodel om sferoïde vorming mogelijk te maken. Klik hier om een grotere versie van deze afbeelding te bekijken.
3. HepG2 sferoïde overdracht van hangende druppel naar agarose suspensie
OPMERKING: Op dag 3 na het zaaien in hangende druppels worden de sferoïden overgebracht naar de putten van dezelfde 96-putplaat die allemaal eerder zijn bedekt met een fijne laag van 1,5% agarosegel.
- Bereid agarosegels en autoclaaf (d.w.z. dag 2 na het zaaien) vóór de dag van plaatcoating (d.w.z. dag 3 na het zaaien).
- Om een 1,5% agarosegel te bereiden, weeg je 0,30 g agarose in een schone, glazen fles en voeg je vervolgens 20 ml fenolrood vrij DMEM-medium toe. Autoclaaf de agarose gedurende 1 uur bij 230 °C voor sterilisatie. De agarose coating voorkomt dat de HepG2 sferoïden zich aan de basis van putten vastkleven en een cellulaire monolaag vormen in plaats van hun 3D sferoïde structuur te behouden.
- Verwijder op dag 3 na het zaaien de 96-putplaat met de HepG2-hangende druppelsferoïden uit de incubator en draai het deksel voorzichtig om zodat de sferoïden niet meer hangen.
- Verwijder en gooi met behulp van een meerkanaals pipet de 100 μL PBS die eerder aan de basis van de 96-putplaat is toegevoegd, weg. Laat de platen 2-3 minuten luchten tijdens het verwarmen van de agarose ter voorbereiding op de coating.
LET OP: Deze procedure resulteert in zeer hete, vloeibare agarose die, indien gemorst op de huid, kan verbranden en letsel kan veroorzaken. Bovendien moet voorzichtig worden omgegaan met de glazen fles met de vloeibare agarose, omdat ook deze erg heet kan zijn. - Verwarm met behulp van de eerder bereide 1,5% agarosegels de glazen fles met de 20 ml agarosegel gedurende 30 s in een magnetron met een maximale watt (d.w.z. 900 W). Om twee 96-well platen te coaten, moet één fles van 20 ml voorgeprepareerde 1,5% agarosegel voldoende zijn.
- Eenmaal gesmolten, wervel de agarose voorzichtig door de glazen fles te draaien om eventuele bubbels te verwijderen en voeg vervolgens 50 μL agarose toe aan de basis van elke put.
OPMERKING: Let er bij het toevoegen van de agarose op dat u de plaat niet schuin houdt ,gt;45° omdat de agarose snel ondergaat en geen vlakke, vlakke laag vormt die de sferoïdegroei kan verstoren. Het is belangrijk om in dit stadium efficiënt te werken om te voorkomen dat de agarose stolt voordat de plaat volledig is gecoat. - Laat de plaat 2 minuten op kamertemperatuur staan voordat u 100 μL voorverwarmd DMEM-celkweekmedium (met supplementen) bovenop de vaste agaroselaag in elke put toevoegt.
- Draai het deksel van de 96-put plaat om en plaats deze terug op de 96-well plaat zodat de sferoïden nu weer hangen.
- Centrifugeer de plaat gedurende 3 minuten op 200 x g om de sferoïden van de hangende druppel over te brengen naar de afzonderlijke putten van de 96-putplaat. Na de overdracht moeten de HepG2-sferoïden nu worden opgehangen in het celkweekmedium. Laat ze 24 uur in de incubator bij 37 °C en 5% CO2bezinken .
- Stel HepG2-sferoïden van deze grootte bloot aan chemische of ENM-behandelingen op dag 4 na het zaaien (d.w.z. 24 uur na overdracht naar met agarose bedekte platen).
- Om de levensvatbaarheid van cellen gedurende langere kweekperioden te behouden, ververst u het celkweekmedium om de 3 dagen. Om dit te doen, aspireert u voorzichtig 50 μL van het celkweekmedium van het oppervlak van de put en vervangt u door een vers DMEM-celkweekmedium van 50 μL. Zorg ervoor dat u de sferoïde niet verwijdert of verstoort bij het uitvoeren van een mediumwissel.
4. Blootstelling aan nanomaterialen/chemische stoffen
OPMERKING: Het HepG2-leversferoïdemodel kan zowel ENM- als chemische blootstellingsregimes ondersteunen, maar de primaire focus van dit protocol is ENM-blootstellingen. Vóór blootstelling moet de test-ENM op passende wijze worden gedispergeerd; dit kan worden uitgevoerd zoals voorgeschreven door het NanoGenoTox Dispersion Protocol (Grant Agreement No. 20092101, 2018)15.
- Verdun na dispersie volgens het NanoGenoTox Dispersion Protocol de ENM-suspensie van de startconcentratie van 2,56 mg/ml tot de uiteindelijke gewenste concentratie in het voorverwarmde DMEM-celkweekmedium (inclusief de supplementen). Een totaal volume van 5 ml is vereist om een 96 putplaat te doseren.
- Om de HepG2-sferoïde bloot te stellen aan een chemische stof of ENM, met behulp van een pipet van 200 μL, aspireert u 50 μL celkweekmedium van het oppervlak van elke put (waarbij 50 μL in de put achterblijft om de sferoïden niet te verstoren) en vervangt u het door een medium van 50 μL dat de testtoxische stof in de vereiste dosis bevat.
- Nadat het testmateriaal is aangebracht, incubeert u de platen gedurende de gewenste blootstellingstijd bij 37 °C en 5% CO2.
- Als een langetermijnblootstellingsregime (≥24 uur) wordt uitgevoerd, oogst u onmiddellijk nadat het gewenste blootstellingstijdframe is verstreken de sferoïden voor micronucleus eindpuntanalyse zoals hieronder beschreven in de stappen 6.1 – 6.4.
- Bij acute blootstellingsregimes (bijv. ≤24 uur) wordt echter, zodra de blootstellingsperiode is afgelopen, 50 μL supernatant uit elke put in de putplaat van 96 bij -80 °C opgeslagen voor verdere biochemische analyse later. Vervang het celkweekmedium door 50 μL vers medium met 6 μg/ml Cytochalasine B en laat het 1 – 1,5 celcycli (d.w.z. 24 – 26 uur voor HepG2) incuberen ter voorbereiding op de cytokineseblok micronucleustestoogst.
OPMERKING: Voor acute (≤24 uur) blootstellingsregimes kan de cytokineseblokmicronucleustest met Cytochalasine B worden toegepast, maar voor langdurige (≥24 uur) blootstellingsregimes moet de mononucleaire versie (zonder Cytochalasine B) van de test worden gebruikt zoals hieronder beschreven in figuur 4.
5. HepG2 sferoïde oogsten
OPMERKING: Na chemische of ENM-blootstellingsbehandelingen kunnen zowel celkweekmedium als bolvormig weefsel worden geoogst voor meervoudige eindpuntanalyse. Afhankelijk van de eindpuntanalyse kunnen sferoïden afzonderlijk worden geoogst (bijvoorbeeld voor beeldanalyse) of worden samengevoegd (bijvoorbeeld voor cytokineseblokmicronucleustest).
- Verwijder de 96-putplaat uit de incubator.
- Met behulp van een pipet van 200 μL aspireert u het 100 μL celkweekmedium inclusief het bolvormige weefsel uit elke put en verzamelt u zich in een steriele centrifugebuis van 15 ml. Zorg ervoor dat u contact met de agarose vermijdt.
- Eenmaal verzameld, centrifugeer de sferoïde suspensie gedurende 5 minuten op 230 x g. Verwijder het supernatant en bewaar het bij -80 °C voor verdere eindpuntanalyse (bijv. leverfunctietests) later.
- Hang de pellet van sferoïden opnieuw op in 1 ml steriele PBS bij kamertemperatuur (1x).
- Eenmaal gewassen, centrifugeer de sferoïde suspensie opnieuw op 230 x g gedurende 3 min. Gooi het supernatant weg, schors opnieuw in 500 μL van 0,05% trypsine-EDTA-oplossing en incubeer gedurende 6-8 minuten bij 37 °C en 5% CO2.
- Na incubatie, pipetteer de trypsinized cellen voorzichtig op en neer om de HepG2-cellen volledig te ontkoppelen en opnieuw op te schorten voordat ze neutraliseren met 1 ml DMEM-celkweekmedium.
- Centrifugeer de verdunde celsuspensie gedurende 5 minuten op 230 x g. Gooi het supernatant weg in ontsmettingsmiddel en hang de celkorrel opnieuw op in PBS bij 2 ml kamertemperatuur (1x).
- Centrifugeer de celsuspensie gedurende 5 min op 230 x g. Gooi het supernatant weg in ontsmettingsmiddel en hang de celkorrel vervolgens opnieuw op in 2 ml koude PBS (1x). Zorg ervoor dat de cellen goed zijn verspreid om te voorkomen dat klonten cellen het gezichtsveld verduisteren wanneer ze op microscoopglaasjes worden gemonteerd.
6. Micronucleus test en scoren
Voor de handmatige methode van de micronucleustest is een cytocentrifuge nodig om een cytodot (een gedefinieerd, geconcentreerd gebied van cellen) in het midden van de microscoopschuif te produceren. Dit proces ondersteunt een efficiëntere score van de dia, omdat de scorer de cellen van belang gemakkelijk kan lokaliseren, in tegenstelling tot het evalueren van een hele dia waar de cellen op grote schaal kunnen worden verspreid.
- Dompel berijpte microscoopglaasjes (drie per dosis) in 70% ethanol gevolgd door ddH2O en laat 5 minuten aan de lucht drogen.
- Plaats voorbereide microscoopglaasjes in de cuvettetrechter zoals afgebeeld in figuur 3A, waar de glazen schuif (iii) in de metalen steun (iv) wordt geplaatst met een filterkaart (ii) en cuvettetrechter (i) erop bevestigd.
- Schik cuvette trechters in de cytocentrifuge met de trechter naar boven gericht, zodat 100 μL celsuspensie direct aan elke trechter kan worden toegevoegd.
- Cytospin gedurende 5 min bij 500 x g om ervoor te zorgen dat cellen gelijkmatig over het oppervlak van de dia worden verdeeld.

Figuur 3: Cytospinopstelling om behandelde cellen op microscoopdia's voor te bereiden. (A) Toont de afzonderlijke componenten, (i) cuvettetrechter, (ii) filterkaart, (iii) glasmicroscoopschuif en (iv) metaalondersteuning die nodig is om cytospin HepG2-cellen op microscoopdia's te plaatsen. (B) De laatste cuvette trechter ingesteld. (C) De juiste plaatsing van de cuvettetrechter in de cytocentrifuge. Klik hier om een grotere versie van deze afbeelding te bekijken.
- Laat dia's aan de lucht drogen voor fixatie in ijskoud, 90% methanol gedurende 10 minuten.
- Eenmaal bevestigd, laat u de dia's 's nachts aan de lucht drogen bij kamertemperatuur voordat u ze tot 6 maanden op -20 °C bewaart.
- Verwijder indien nodig de voorgeprepareerde microscoopglaasjes uit de vriezer van -20 °C en laat opwarmen tot kamertemperatuur voordat u Giemsa-vlekken uitvoert.
LET OP: Volgens Verordening (EG) nr. 1272/2008 [CLP] is Giemsa-kleuroplossing een licht ontvlambare vloeistof die giftig kan zijn bij inslikken en schade kan veroorzaken bij contact met de ogen, de huid of bij inademing. Raadpleeg het bijbehorende SDS-blad voor gedetailleerde opslag, hantering en gezondheids- en veiligheidsadviezen over deze chemische stof voor gebruik. - Terwijl de dia's ontdooien, bereidt u een Giemsa-kleuroplossing van 20% (25 ml nodig om ~ 30 dia's te beitsen) verdund in fosfatasebuffer (pH 6,8). Meng grondig door de oplossing voorzichtig te wervelen voordat u filtert met gevouwen filterpapier dat in een trechter is geplaatst.
- Voeg met behulp van een Pasteur pipet 3 – 5 druppels gefilterde Giemsa-oplossing toe aan het cytodot op elke dia en laat 8 – 10 minuten staan.
- Was dia's in twee opeenvolgende fosfatasebufferwassingen voordat u kort spoelt onder koud water om eventuele overtollige vlekken te verwijderen. Laat de dia's aan de lucht drogen.
- Eenmaal droog, in een zuurkast, dompelde u gebrandschilderde dia's 10 s in xyleen voordat u een druppel montagemedium aan het midden van het cytodot toevoegde en een glazen afdeklip erop plaatste.
- Laat microscoopglijbanen 's nachts in de zuurkast drogen voordat u handmatig scoort; ze kunnen voor onbepaalde tijd bij kamertemperatuur worden bewaard.
7. Gegevensanalyse
- Zoals beschreven in de OESO-testrichtsnoeren 487 (2014)11, om DNA-schade als gevolg van blootstelling aan een ENM of chemisch agens te beoordelen en te kwantificeren, gebruikt u een lichtmicroscoop (100x objectief met dompelolie) 2000 mononucleated of 1000 binucleated cellen per biologisch repliceren om te scoren op de aanwezigheid van micronuclei, zoals weergegeven in figuur 4.

Figuur 4: Micronucleus test scoring beslissingsboom. Schematische beslissingsboom om de noodzaak van verschillende scorings- en cytotoxiciteitsbeoordelingsprocedures te benadrukken bij het gebruik van de micronucleustest met 3D-modellen na acute of langdurige blootstellingsregimes. Acute blootstellingen (≤24 uur) maken het gebruik van de cytokinese geblokkeerde micronucleustest mogelijk, terwijl langdurige blootstellingen (≥24 uur) de mononucleaire versie van de test vereisen; beide zijn beschreven in OESO-testrichtsnoer 487. Klik hier om een grotere versie van deze afbeelding te bekijken.
- Bereken een percentage van de genotoxiciteitswaarde op basis van het aandeel micronuclei dat aanwezig is per aantal gescoorde mononucleated of binucleated cellen.
- Om de waargenomen DNA-schade te beoordelen, is dit niet het gevolg van celresten veroorzaakt door een hoog percentage apoptotische cellen, neem naast een maat voor cytotoxiciteit. Gebruik in dit geval, afhankelijk van de aanwezigheid van Cytochalasine B, cpbi- of RVCC-berekening (zoals beschreven in figuur 4). Genotoxiciteit mag alleen worden geëvalueerd in monsters waarbij de cytotoxiciteit minder dan 55% ± 5% bedraagt zoals gedefinieerd in OESO-testrichtsnoer 48711.
Representative Results
De geschiktheid van dit op cellenlijn gebaseerde 3D-leversferoïdemodel voor de langetermijncultuur en de genotoxische gevarenbeoordeling werd geëvalueerd door baselinekarakterisering uit te voeren om de levensvatbaarheid en leverachtige functionaliteit van het model gedurende de duur van 14 dagen in cultuur te bepalen, evenals de toepasbaarheid ervan voor de micronucleustest.
Baseline karakterisering van het 3D HepG2 Lever Spheroid Model
Voorafgaand aan een in vitro toxicologische beoordeling is het belangrijk om te controleren of de 3D HepG2-sferoïden zich goed hebben gevormd voordat de agarose-overdracht of chemische/ENM-behandeling wordt uitgevoerd. HepG2-sferoïden die met behulp van de ophangdruppelmethode worden geproduceerd, doen er meestal 2 - 3 dagen na het zaaien (4000 cellen/sferoïde) over om compacte, bolvormige sferoïden te vormen met een gemiddelde diameter van 495,52 μm B x 482,69 μm H zoals weergegeven in figuur 5A-5C. HepG2-sferoïden die correct zijn gevormd en aanvaardbaar zijn om te worden gebruikt voor in-vitro toxicologische beoordeling, moeten een compacte, bolvormige structuur hebben met een glad oppervlak en geen visuele projecties. Figuur 5 geeft voorbeelden van goede kwaliteit (Figuur 5D-F) en een slechte kwaliteit ( Figuur5G-I) sferoïden. De laatste moet worden weggegooid. Meestal zal 90-95% van de sferoïden gevormd per plaat zich correct vormen en levensvatbaar zijn voor verdere experimenten.

Figuur 5: Lichte microscopiebeelden met de natuurlijke morfologie van de HepG2-sferoïden gevormd via de hangende druppelmethode. (A-C) toon Dag 2 en (D-I) Dag 4 HepG2 lever sferoïden na het zaaien. (D-F) zijn voorbeelden van hepG2-sferoïden van goede kwaliteit, terwijl (G-I) slecht gevormde sferoïden vertoont. Alle foto's zijn gemaakt op een X20 objectief met behulp van een microscoop. De schaalbalk vertegenwoordigt 20 μm. Klik hier om een grotere versie van deze afbeelding te bekijken.
Om de levensvatbaarheid van HepG2-sferoïde verder te bevestigen, kan een basis colorimetrische Bromocresol Green Albumin (BCG) Assay of Ureum Assay worden uitgevoerd om hun leverachtige functionaliteit te beoordelen. Leverachtige functionaliteit werd beoordeeld in overeenstemming met de levensvatbaarheid met behulp van de Trypan Blue Exclusion Assay over een 14-daagse kweekperiode om de levensduur van het leversferoïdemodel te bepalen en vast te stellen of het een langetermijn- of herhaalde ENM/chemische risicobeoordeling kon ondersteunen (Figuur 6). Albumineconcentratie bleef consistent gedurende de duur van de cultuurperiode. Ureumproductie vertoont een toename van de concentratie ureum geproduceerd per sferoïde gedurende een week in cultuur voordat het een plateau bereikt op dag 7. Het is belangrijk op te merken dat de niveaus van albumine en ureum geproduceerd in de 3D HepG2 sferoïden aanzienlijk hoger zijn dan die waargenomen in dezelfde cellijn gekweekt in een 2D-formaat. Inderdaad, 2D-culturen van HepG2-cellen, piekalbumine- en ureumspiegels waren respectievelijk 0,001 mg/ml en 0,010 ng/μL. Bovendien benadrukken de auteurs in eerder werk gepubliceerd door Shah et al. met behulp van een bijna identiek HepG2-sferoïdesysteem een opmerkelijke verbetering van de metabolische activiteit (CYP1A1 en CYP1A2) in de 3D HepG2 in vitro modelsystemen in vergelijking met de 2D-gekweekte HepG2-cellen5.

Figuur 6: 14-daagse baseline karakteriseringsgegevens voor HepG2 leversferoïden. Na overdracht van hangende daling, (A) benadrukt de levensvatbaarheid van de HepG2 sferoïde model over een periode van 14 dagen, terwijl (B) en (C) benadrukken de lever-achtige albumine en ureum functionaliteit respectievelijk. Gemiddelde gegevens ± SEM gepresenteerd, n = 4. Klik hier om een grotere versie van deze afbeelding te bekijken.
Met de onvermijdelijke ontwikkeling van een necrotische kern, een bekende beperking van 3D-leversferoïdeculturen, moest de levensvatbaarheid van dit op HepG2 gebaseerde model worden vastgesteld om aan te tonen dat het in staat was om langdurige (5-10 dagen) blootstellingsregimes te ondersteunen met behoud van het proliferatieve vermogen dat nodig is om de micronucleustest te ondersteunen5. Inderdaad, dit 3D lever sferoïde model is aangetoond dat behouden >70% levensvatbaarheid over 10 dagen in cultuur. Op basis hiervan en in combinatie met de aanhoudende leverachtige functionaliteit die gedurende de ≥ 14-daagse kweekperiode wordt waargenomen, kan dit 3D-leversferoïdemodel dus langdurige, herhaalde ENM-blootstellingsregimes tot 10 dagen lang ondersteunen (d.w.z. voordat de levensvatbaarheid van de sferoïden onder de 70% daalt). Ter referentie wordt geadviseerd dat de albuminespiegels voor HepG2-sferoïden die op 4000 cellen/sferoïde zijn gezaaid, moeten worden ≥ 20,0 ng/μL, terwijl de productie van ureum moet worden ≥0,25 ng/μL voordat een in-vitro toxicologische beoordeling met dit model wordt uitgevoerd.
Genotoxiciteitsbeoordeling van gemanipuleerde nanomaterialen
Voor de beoordeling van de genotoxiciteit werd de micronucleustest gebruikt om de aanwezigheid van micronuclei te bepalen na zowel acute (24 uur) als langdurige (120 uur) ENM-blootstellingen. Aflatoxine B1 is een bekende leververwekkendestof 16,17 en is een aanbevolen positieve controle voor de micronucleustest. Optimalisatie-experimenten hebben aangetoond dat 0,1 μM Alfatoxine B1 een significante positieve (≥2,0-voudige toename) genotoxische respons induceert in 3D HepG2-leversferoïden en dus wordt gebruikt in elke micronucleustest die met dit model wordt uitgevoerd. Om de validiteit van de resultaten van de micronucleustest te garanderen met behulp van het HepG2-sferoïdemodel, moet de achtergrondmicronucleusfrequentie voor HepG2-cellen die in dit 3D-in-vitromodel worden gebruikt, binnen een bereik van 0,6% - 1,2% liggen. Dientengevolge moet Alfatoxine B1 een genotoxische respons veroorzaken die ten minste twee keer hoger is dan die welke bij de negatieve controle wordt waargenomen; 0,1 μM Alfatoxine B1 moet dus een micronucleifrequentie tussen 1,5% – 3,0% veroorzaken. Met behulp van deze controleparameters kan de met ENM geassocieerde genotoxiciteit in vitro vervolgens betrouwbaar worden beoordeeld. Op basis van OESO-testrichtsnoer 487 is het belangrijk op te merken dat bij het testen van een ENM of chemische stof de gekozen concentraties niet meer dan 55% ± cytotoxiciteit van 5% mogen veroorzaken (aangegeven door een verlaging van de CPBI- of RVCC-waarden ten opzichte van de negatieve controle)11. Figuur 7 illustreert de gegevens die werden gegenereerd toen Aflatoxine B1 en twee ENM's (titaandioxide (TiO2) en splinter (Ag)) werden geëvalueerd na zowel acute als langdurige blootstellingen in de HepG2-sferoïden, en het daaropvolgende genotoxische potentieel werd geanalyseerd met behulp van de micronucleustest. Beide beoordeelde ENM's werden getest met een noncytotoxische, lage dosis van 5,00 μg/ml bij een acute blootstelling (24 uur) en een blootstellingsschema op lange termijn (120 uur). Een vergelijkbare trend voor genotoxiciteit tussen zowel TiO2 als Ag ENMs kan worden waargenomen, waarbij de verhoogde genotoxiciteitsrespons die resulteerde na blootstelling van 24 uur niet duidelijk was na een langdurige blootstelling van 5 dagen. Dit ondanks aanhoudende genotoxiciteit veroorzaakt door de Positieve Controle van Aflatoxine B1 op beide tijdstippen.

Figuur 7: Genotoxiciteitsbeoordeling na blootstelling van TiO2 en Ag ENM aan HepG2-leversferoïden. Genotoxiciteit (micronucleusfrequentie) beoordeling met behulp van de micronucleustestpost (A) acute (24 uur) en (B) langdurige (120 uur) blootstelling aan 5,00 μg/ml TiO2 en Ag ENM. Negatieve controle is slechts een medium, terwijl de positieve controle 0,1 μM Aflatoxine B1 is. Gemiddelde gegevens (n=2) gepresenteerd ± SD. Significantie aangegeven in relatie tot de negatieve controle: * = p≤ 0,05. Klik hier om een grotere versie van deze afbeelding te bekijken.
Discussion
Toepassingen voor 3D-levermodellen variëren aanzienlijk, afhankelijk van het specifieke biochemische eindpunt of de ongunstige uitkomstroute die wordt gericht. Elk model heeft zijn voordelen en beperkingen, van interdonorvariatie in primaire menselijke hepatocytmodellen (PHH) tot verminderde cytochroom p450-activiteit in cellijngebaseerde modellen, maar ze zijn allemaal op zichzelf waardevol6,12,18,19. Bij het beoordelen van genotoxiciteit zijn er beperkingen in de compatibiliteit van de modellen met door de regelgeving goedgekeurde eindpunten zoals de in vitro micronucleustest, omdat actieve proliferatie vereist is. Dit is noodzakelijk, omdat de genotoxiciteitsbeoordeling vereist dat de kwantificering van vaste DNA-schade na celdeling wordt beoordeeld wanneer er mogelijkheden zijn voor DNA-reparatie om voorbijgaande laesies te corrigeren. Helaas vormen sterk gedifferentieerde hepatocyt (d.w.z. hepaRG) gebaseerde sferoïden of PHH-microtissues, die worden geacht de meest fysiologisch relevante leverachtige kenmerken te vertonen statische (non-proliferatieve) modellen12,19,20. Als gevolg hiervan biedt het hier gepresenteerde 3D HepG2-sferoïdemodel een geschikt, alternatief model dat het testen van de genotoxiciteit kan ondersteunen. HepG2 cellijn gebaseerde sferoïden hebben voldoende actief delende cellen op het buitenoppervlak van de sferoïden met behoud van basisleverachtige kenmerken, zoals albumine- en ureumproductie en sommige CYP450-activiteit5,12,19. Voornamelijk is dit in vitro levermodel ontwikkeld als aanvulling op de micronucleustest, aangezien dit een van de twee in vitro tests is die in de batterij worden aanbevolen voor genotoxiciteitstests8,10,11,21. Het model kan echter gemakkelijk worden toegepast op DNA-sequencinganalyse en genexpressie (RNA)-technologieën, terwijl het het potentieel heeft om verder te worden aangepast en gebruikt voor andere DNA-schade-eindpunten, zoals de komeettest. Niettemin is het belangrijk om rekening te houden met de rol die ENM-interferentie speelt in sommige eindpuntanalyses. Op flowcytometrie gebaseerde analyses zijn bijvoorbeeld mogelijk niet geschikt voor enm-genotoxiciteitsbeoordeling, met name als gevolg van deeltjesinterferentie22.
Een beperkende factor van sferoïde modellen die actief celdeling ondergaan, is hun grootte. Optimalisatie van de seeding-dichtheid is van cruciaal belang omdat er voldoende cellen moeten zijn waarmee het model zich kan blijven verspreiden; maar niet te hoog celgetal, waardoor de sferoïde te compact wordt, wat leidt tot een verhoogde necrotische kern. De oorzaak van deze necrose wordt verondersteld beperkte zuurstof- en nutriëntendiffusie te zijn, aangezien de limiet van deze diffusie ongeveer 100 – 150 μm weefsel23,24zou zijn . Dit is echter afhankelijk van het celtype, celnummer, steigerinteracties en kweekomstandigheden25. Sindsdien is aangetoond dat ongeveer 700 μm diameter de limiet is voor het vermijden van voortijdig begin van necrose in het centrum van C3A-sferoïden, het zaaien van 4000 HepG2-cellen per sferoïde zorgt ervoor dat de diameter van het model op het moment van blootstelling wordt ≤500 μm26. Bovendien stelden Shah et al. vast dat HepG2-cellen die boven de 5000 cellen per sferoïde waren gezaaid, na 7 dagen in cultuur een vermindering van de levensvatbaarheid met 25% vertoonden, wat zou kunnen leiden tot de gemiddelde diameter van 680 μm en beperkte beschikbaarheid van voedingsstoffen in een hangende druppel van 20 μL5. Om dit te overwinnen, ondergaat het model dat in dit protocol is bedacht een kritieke stap waarbij de hangende druppel wordt overgebracht naar met agarose gecoate putten na de eerste vorming van de sferoïde. Dit zorgt ervoor dat er een groter volume kweekmedium aanwezig is om het steeds groeiende aantal cellen in de sferoïden te ondersteunen. Als gevolg hiervan blijft het HepG2-sferoïdemodel meer dan 70% levensvatbaar na 10 dagen in cultuur en kan het worden gebruikt voor langetermijnrisicobeoordeling in vitro.
Hoewel het HepG2-sferoïdemodel zowel acute als langdurige blootstellingsregimes kan ondersteunen, is het vernieuwen van het celkweekmedium tijdens langere kweekperioden beperkt voor dit model, omdat volledige vervanging van het medium niet wordt geadviseerd vanwege het potentiële verlies van de sferoïden. Aangenomen wordt dat bij blootstelling aan ENM de neiging tot homogene ENM-dispersies tot agglomeraat en sediment hoog is. Het is echter opmerkelijk dat de snelheid waarmee een ENM-sediment kan variëren afhankelijk van de deeltjesparameters (bv. grootte, vorm en dichtheid) en theoretisch kan worden bepaald met behulp van het in vitro sedimentatie-, diffusie- en dosimetriemodel (ISDD) of de recente derivaten daarvan, waarnaar vaak wordt verwezen wanneer de blootstelling aan ENM (suspensie)nadert 27,28. Hierbij wordt aangenomen dat als slechts 50% van het celkweekmedium zorgvuldig van het oppervlak van de celkweek wordt verwijderd, de verstoring en daaropvolgende verwijdering van de ENM-dosis in theorie minimaal zou moeten zijn. Met browniaanse beweging in het spel is dit echter mogelijk niet strikt het geval en moet verder worden gewerkt aan de afzetting en sedimentatie van elk specifiek ENM dat moet worden getest om ervoor te zorgen dat de juiste dosimetrie gedurende de langetermijnblootstellingsregimes wordt behouden27. In de eerste plaats is dit een mogelijke beperking om rekening mee te houden bij het uitvoeren van herhaalde doseringsschema's, omdat dit van cruciaal belang kan zijn voor de uiteindelijke, geaccumuleerde concentratie. Blootstellingen op basis van chemische stoffen daarentegen bieden, hoewel niet zonder hun eigen beperkingen om te overwegen, een meer simplistische benadering in die manier dat chemische stoffen de neiging hebben in oplossing te blijven en dus zorgt een directe vervanging van de oorspronkelijke chemische concentratie naast de nieuw toegevoegde concentratie ervoor dat elke chemische stof die verloren gaat tijdens de verfrissing van de media dienovereenkomstig wordt vervangen29. Toekomstige toepassingen omvatten het evalueren van de geschiktheid van het model voor herhaalde blootstellingsregimes gedurende lange-termijnkweekperioden, aangezien herhaalde doseringsstrategieën van cruciaal belang zijn voor het beoordelen van het vermogen van een bepaald orgaansysteem om de eventuele nadelige effecten van bioaccumulatie van een xenobiotische stof te verbeteren of te overwinnen.
Concluderend kan worden gesteld dat dit 3D-in-vitro hepatische model de capaciteit heeft om te worden gebruikt voor het evalueren van een reeks realistische blootstellingsscenario's, waardoor een toekomstige in-vitrobenadering wordt geboden om zowel de enm- als de chemische gevarenbeoordeling op een routinematige en gemakkelijk toegankelijke manier beter te ondersteunen.
Disclosures
De auteurs hebben niets bekend te maken.
Acknowledgments
De auteurs willen erkennen dat dit onderzoek financiering heeft ontvangen uit het horizon 2020-onderzoek- en innovatieprogramma van de Europese Unie voor het PATROLS-project, in het kader van subsidieovereenkomst nr.
Materials
| Name | Company | Catalog Number | Comments |
| Aflotoxin B1 | Sigma Aldrich, UK | A6636-5MG | |
| Agarose | Sigma Aldrich, UK | A9539-50G | |
| Autoclave Tape | |||
| BCG Albumin Assay | Sigma Aldrich, UK | MAK124 | |
| Bovine Serum Albumin Powder | Sigma Aldrich, UK | A9418 | |
| Cell Freezing Aid | Thermo Fisher Scientific, UK | 5100-0001 - Mr Frosty | |
| Centrifuge | Eppendorf | 5810 R | |
| Cytochalasin B | Merck, UK | 250233 | |
| Cytology Metal Clips | |||
| Cytospin 4 Centrifuge | ThermoFisher Scientific, UK | CM00730202 | |
| DMEM with 4.5g/L D-Glucose, L-Glutamine | GIBCO, Paisley, UK | 41965-039 | |
| DMEM, phenol-red free with 4.5g/L D-Glucose, L-Glutamine with Hepes | GIBCO, Paisley, UK | 21063-029 | |
| DPX Mounting Medium | FisherScientific, UK | D/5330/05 | |
| Ethanol | FisherScientific, UK | 10048291 | |
| FBS | GIBCO, Paisley, UK | 10270-106 | |
| Filter Cards for Shandon Cytospin | FisherScientific, UK | 15995742 | |
| Frosted Glass Slides | ThermoFisher Scientific, UK | ||
| Giemsa's Stain Improved R66 Solution, Gurr | VWR Chemicals, UK | MFCD00081642 | |
| Glass Coverslips (24 x 60) | Deckglaser, VWR | ECN631-1575 | |
| Haemocytometer and Coverslip | |||
| Immersion Oil for Microscope | Zeiss, UK | 518F, ISO8034 | |
| Laminar Class II Tissue Culture Hood | Scanlaf Mars | ||
| Light Microscope | Zeiss, UK | Axiovert 40C | |
| Liquid Nitrogen | |||
| Methanol | FisherScientific, UK | 10284580 | |
| Microwave | |||
| Non-Filtered, Sterile 200µl and 1000µl Pipette tips | Greiner-Bio-One, UK | ||
| NuncMicroWell 96-Well Microplates | ThermoFisher Scientific, Denmark | 167008 | |
| P1000 and P200 micropipettes | |||
| P300 and P50 multi-channel pipettes | |||
| PBS pH 7.4 1X, MgCl2 and CaCl2 Free | GIBCO, Paisley, UK | 14190-094 | |
| Pen/Strep | GIBCO, Paisley, UK | 15140-122, Penicillin/Strepmyocin 100X or 10,000U/ml | |
| Phosphatase Buffer Tablets | GIBCO, Paisley, UK | 10582-013 | |
| Pipette Boy | |||
| Simport Scientific CytoSep Funnels for Shandon Cytospin 4 Centrifuges | FisherScientific, UK | 11690581 | |
| Sonifier SFX 550 240V CE 1/2" - Probe | Branson, USA | 101-063-971R | |
| T-25 and T-75 Tissue Culture Flask | Greiner-Bio-One, UK | T-25 (690175) and T-75 (660175) | |
| Trypan Blue Solution | Sigma Aldrich, UK | T8154-100mL | |
| Urea Assay Kit | Sigma Aldrich, UK | MAK006 | |
| Virkon Disinfectant | DuPont, UK | Rely+On Virkon | |
| Water Bath (37?C) | Grant JBNova 18 | ||
| Weighing Balance | |||
| Xylene | FisherScientific, UK | 10588070 | |
| 0.05% Trypsin-EDTA | GIBCO, Paisley, UK | 5300-054 | |
| 0.2mL and 1.0mL Eppendorf Tubes | Greiner-Bio-One, UK | ||
| 0.45µm Filter Unit | Millex HA, MF-Millipore, UK | SLHA033SS | |
| 1.0mL Syringe | BD Plastipak, FisherScientific, UK | 300185 | |
| 20mL LS Scintillation Glass Vials, 22-400 Foil Lined PP Caps | DWK Life Sciences GmbH, Germany | WHEA986581 | |
| 37?C and 5% CO2 ISO Class 5 Hepa Filter Incubator | NUAIRE DHD Autoflow | ||
| 3mL Pasteur Pipette | Greiner-Bio-One, UK | ||
| 50mL Conical Falcon Tubes | Greiner-Bio-One, UK | ||
| 50mL or 100mL Glass Bottles | |||
| 50mL Skirted Falcon Tubes | Greiner-Bio-One, UK | ||
| 5mL, 10mL and 25mL Pipettes | Greiner-Bio-One, UK | ||
| 9.4cm Square, Petri Dish | Greiner-Bio-One, UK | 688161 |
References
- Geiser, M., Kreyling, W. G. Deposition and biokinetics of inhaled nanoparticles. Particle and Fibre Toxicology. 7, 2 (2010).
- Modrzynska, J. Toxicological effects of nanoparticle deposition in the liver. Kgs. Lyngby, Denmark: Technical University of Denmark. , (2018).
- Elje, E., et al. The comet assay applied to HepG2 liver spheroids. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 845, 403033 (2019).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18, 240-249 (2013).
- Shah, U. -K., et al. A three-dimensional in vitro HepG2 cells liver spheroid model for genotoxicity studies. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 825, 51-58 (2018).
- Lauschke, V. M., Hendriks, D. F. G., Bell, C. C., Andersson, T. B., Ingelman-Sundberg, M. Novel 3D Culture Systems for Studies of Human Liver Function and Assessments of the Hepatotoxicity of Drugs and Drug Candidates. Chemical Research in Toxicology. 29, 1936-1955 (2016).
- van Grunsven, L. A. 3D in vitro models of liver fibrosis. Advanced Drug Delivery Reviews. 121, 133-146 (2017).
- Corvi, R., Madia, F. In vitro genotoxicity testing - can the performance be enhanced. Food and Chemical Toxicology. 106, 600-608 (2017).
- Doak, S. H., Manshian, B., Jenkins, G. J. S., Singh, N. In vitro genotoxicity testing strategy for nanomaterials and the adaptation of current OECD guidelines. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 745, 104-111 (2012).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2, 1084-1104 (2007).
- OECD. OECD Guidelines. Test 489: In vivo Mammalian Alkaline Comet Assay. , (2016).
- Gerets, H. H. J., et al. Characterization of primary human hepatocytes, HepG2 cells, and HepaRG cells at the mRNA level and CYP activity in response to inducers and their predictivity for the detection of human hepatotoxins. Cell Biology and Toxicology. 28, 69-87 (2012).
- Sison-Young, R. L., et al. A multicenter assessment of single-cell models aligned to standard measures of cell health for prediction of acute hepatotoxicity. Archives of Toxicology. 91, 1385-1400 (2017).
- European Guidelines 2019. European Agency for Safety and Health at Work. , Available from: https://osha.europa.eu/en/safety-and-health-legislation/european-guidelines (2019).
- Jensen, K. A. The NANOGENOTOX Dispersion Protocol for NANoREG. European Union Grant Agreement n° 2009. 21, 01 (2014).
- Marchese, S., et al. Aflatoxin B1 and M1: Biological Properties and Their Involvement in Cancer Development. Toxins. 10, 214 (2018).
- Rushing, B. R., Selim, M. I. Aflatoxin B1: A review on metabolism, toxicity, occurrence in food, occupational exposure, and detoxification methods. Food and Chemical Toxicology. 124, 81-100 (2019).
- Kermanizadeh, A., Brown, D. M., Moritz, W., Stone, V. The importance of inter-individual Kupffer cell variability in the governance of hepatic toxicity in a 3D primary human liver microtissue model. Scientific Reports. 9, 7295 (2019).
- Berger, B., et al. Comparison of Liver Cell Models Using the Basel Phenotyping Cocktail. Frontiers in Pharmacology. 7, 443 (2016).
- Ramaiahgari, S. C., et al. A 3D in vitro model of differentiated HepG2 cell spheroids with improved liver-like properties for repeated dose high-throughput toxicity studies. Archives of Toxicology. , (2014).
- Li, Y., et al. Factors affecting the in vitro micronucleus assay for evaluation of nanomaterials. Mutagenesis. 32 (1), 151-159 (2016).
- Kirkland, D., Reeve, L., Gatehouse, D., Vanparys, P. A core in vitro genotoxicity battery comprising the Ames test plus the in vitro micronucleus test is sufficient to detect rodent carcinogens and in vivo genotoxins. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 721 (1), 27-73 (2011).
- Curcio, E., et al. Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials. 28, 5487-5497 (2007).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86, 672-680 (2004).
- Asthana, A., Kisaalita, W. S. Microtissue size and hypoxia in HTS with 3D cultures. Drug Discovery Today. 17, 810-817 (2012).
- Gaskell, H., et al. Characterization of a functional C3A liver spheroid model. Toxicology Research. 5, 1053-1065 (2016).
- Cho, E. C., Zhang, Q., Xia, Y. The effect of sedimentation and diffusion on cellular uptake of gold nanoparticles. Nature Nanotechnology. 6, 385-391 (2011).
- Hinderliter, P. M., et al. ISDD: A computational model of particle sedimentation, diffusion and target cell dosimetry for in vitro toxicity studies. Particle and Fiber Toxicology. 7, 36 (2010).
- Kramer, N. I., di Consiglio, E., Blaauboer, B. J., Testai, E. Biokinetics in repeated-dosing in vitro drug toxicity studies. Toxicology in vitro. 30, 217-224 (2015).
Tags
Bioengineering In Vitro Liver Models Nanomaterialen Hazard Assessment Langdurige blootstelling Nano(geno)toxicologie DNA-schadeErratum
Formal Correction: Erratum: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure
Posted by JoVE Editors on 01/26/2021.
Citeable Link.
An erratum was issued for: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure. The Representative Results section was updated.
Figure 6 in the Representative Results section was updated from:
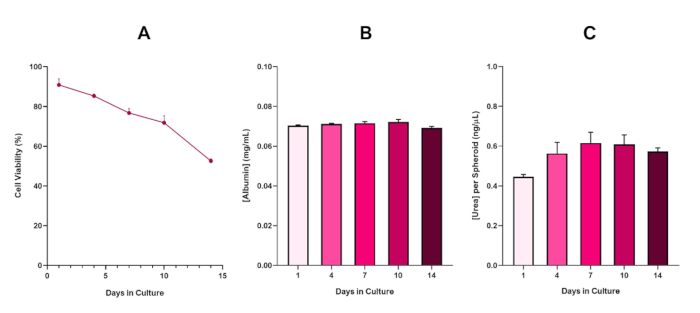
to:
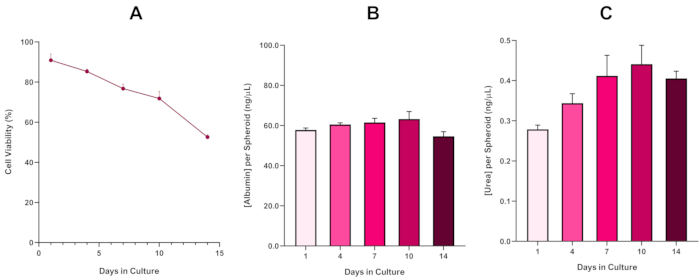
The fourth paragraph in the Representative Results section was updated from:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥0.06 mg/mL whilst urea production should be ≥0.4 ng/µL before conducting an in vitro toxicological assessment with this model.
to:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥50.0 ng/μL whilst urea production should be ≥0.25 ng/µL before conducting an in vitro toxicological assessment with this model.



 x 10.000
x 10.000