ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
この手順は、急性または長期の反復用量レジーム上のナノ物質暴露に関連する遺伝子毒性有害性のより生理学的に関連する評価を提供することができるインビトロで高度な3D肝培養物を開発するために使用されるように確立された。
Abstract
多様なエンジニアリングナノ材料(ENM)の急速な開発と実装により、ENMへの暴露は避けられず、堅牢で予測的なインビトロ試験システムの開発が不可欠です。肝臓は代謝性恒常性および解毒に重要な役割を果たすだけでなく、ENM蓄積後の暴露の主要な部位であるため、肝臓毒性学はENM曝露を考慮する際に重要である。このことと、2D肝細胞モデルが生体内で観察される複雑な多細胞相互作用および代謝活性の複雑さを正確に模倣していないという理解に基づいて、生体外でのENMハザード評価目的に合わせた生理学的に関連する3D肝モデルの開発に大きな焦点が当てられています。動物実験を置き換え、低減、改良する3Rの原理に沿って、3D HepG2細胞株ベースの肝臓モデルが開発され、拡張および繰り返しENM暴露体制(≤14日)の両方をサポートできるユーザーフレンドリーで費用対効果の高いシステムです。これらのスフェロイドモデル(直径500μm≥)は、増殖能力(すなわち、細胞モデルの分割)を保持し、体外での遺伝毒性を効果的に評価するために「ゴールドスタンダード」マイクロ核アッセイと結合することができます。毒性学的エンドポイントの範囲(例えば、肝機能、(プロ)炎症反応、細胞毒性および遺伝毒性)の両方にわたっていくつかのEnMを使用して、急性(24時間)および長期(120時間)曝露療法を報告する能力が特徴付けられている。この3D in vitro肝モデルは、より現実的なENM暴露を評価するために利用される能力を有し、それによってENMハザード評価をより適切にサポートするための将来のin vitroアプローチを提供し、ルーチン的かつ容易にアクセス可能な方法でENMハザード評価を提供する。
Introduction
人間ベースのアプリケーション(食品、化粧品、衣料品、スポーツ用品、電子機器、輸送、医薬品など)を通じて、多様なエンジニアリングナノ材料(ENM)の急速な開発と実装により、人間が定期的にENMにさらされることは避けられません。これにより、これらの材料が多数の用途で有利であると考える新しいサイズ固有のフィジオ化学的特性が、人間の健康と環境に付随する悪影響を引き起こす可能性があるという懸念が高まっている。現在、多くの国際的な活動は、積極的にこれらのENMへのより生理学的に関連する暴露を反映し、急性、長期、および繰り返し低用量暴露シナリオにわたってこれらの材料の潜在的な毒性を評価するために実施されています。
肝毒性学は、ENM曝露を考慮する際に重要であり、肝臓が曝露後のENM蓄積の主要部位であることを広く知られている1,2。また、肝臓は全身循環に入る物質の代謝と解毒のための第一次臓器系である。2D肝細胞モデルは、複雑な多細胞相互作用の複雑さを正確に模倣しない、または生体内で観察される代謝活性を適切に表さないという受け入れられた理解に基づいて、生体内代替技術のための堅牢で生理学的に関連する3D肝モデルの開発に大きく焦点を当てて4,5が確立されている。高度な3D培養技術を利用することで、インビトロ肝モデルの寿命が向上し、長期にわたる反復暴露体制の調査が可能になります。さらに、この高度な培養フォーマットは、胆汁カナリキュリ、活性トランスポータープロセスおよび改良されたCYP450薬物代謝能力などの強化された生理学的、organotypicの特徴の形成を促進し、モデル6の予測性を向上させる。現在の3Dインビトロ肝モデルは、単一培養物(肝細胞のみ)または共培養(非パレンキサイト細胞を有する肝細胞)からなるいくつかの形式で存在し、 超低接着板のマイクロ組織またはスフェロイド、吊り下げドロップスフェロイド、マトリックスおよび/または足場および微小流体細胞培養プラットフォームに埋め込まれた細胞に及ぶ、それらのすべては、肝毒性評価6、7のための効果的な高度なインビトロモデルとみなされる。しかし、これらのモデルシステムの大半は、高いメンテナンス、特殊な機器を必要とし、高価です。さらに、これらのモデルは、固定DNA損傷を定量化する方法を用いた遺伝毒性試験などのハザードエンドポイントの評価における使用を妨げる静的(すなわち、非分割細胞モデル)であることが多い。遺伝毒性は、規制毒性学の中核的前提条件であり、任意の毒性物質のリスク評価の重要な構成要素である8.外因性物質への暴露後に生じる可能性のあるDNA損傷のすべての形態を定量化するために適用できる単一のアッセイはありません。しかし、インビトロ遺伝子毒性試験用電池のコア成分は、微小核アッセイであり、これは総染色体損傷9を測定する信頼性の高い多面的な技術である。これは、OECD試験ガイドライン487によって記述された金標準技術であり、インビトロDNA損傷および遺伝毒性を評価するための、および規制ハザード評価10、11のための試験電池要件の一部である。
ヒト肝細胞癌細胞株HepG2は、細胞が容易に入手可能であるように初期ハザード評価スクリーニングに広く使用され、比較的安価にソース化し、培養が容易で、高スループットスクリーニング12,13に適している。3D球形構造に培養した場合、それらは肝臓微小環境を良好に再現し、微小核アッセイ3を支持するのに十分な増殖能力を有する肝モデルを提供することが示されている。HepG2スフェロイドモデルのさらなる開発は、長期にわたる反復暴露体制(≤14日間)における遺伝毒性ハザード評価をサポートするために、モデルの長寿および肝臓様機能性を向上させるために確立された。したがって、動物実験を置き換え、低減、改良する3Rの原理に沿って、本プロトコルは、複数の毒物学的エンドポイント(例えば、肝臓機能、(炎症マーカー、細胞毒性および遺伝毒性)に続く、急性および反復的な化学的およびENM暴露を確実に評価することができる高度な3Dインビトロ肝モデルを提供するために確立された。
ここでは、急性または長期にわたるENM曝露後の遺伝毒性ハザード評価のためのインビトロモデルシステムに基づく生理的に関連する3D肝細胞細胞株を確立する方法を提示する。プロトコルは6つの重要な段階に分けることができます:凍結保存HepG2細胞を培養する。ヘプG2スフェロイド製剤;ヘプG2スフェロイド転写は、吊り下げからアガロース懸濁液へ。ヘプG2スフェロイド収穫;マイクロ核アッセイとスコアリング;データ分析を行います。
Protocol
1.凍結保存ヘプ2細胞の培養
注:アメリカンタイプカルチャーコレクション(ATCC)から得られたHepG2細胞は、1xダルベッコの修飾イーグル培地(DMEM)で4.5g/ L DグルコースとL-グルタミンで10%の胎児ウシ血清(FBS)および1%ペニシリン/ストレプマイシン抗生物質を添加して培養した。
- 37°Cの水浴中の予熱DMEM細胞培養培地(サプリメントを含む)を30分間使用する。
- 液体窒素からHepG2細胞のバイアルを1本取り除き、37°Cの水浴で2〜3分間解凍し、バイアルを穏やかに渦巻いて細胞懸濁液の均一な解凍を可能にします。汚染の可能性を減らすために、Oリングの上にバイアルを沈めないように注意してください。
- 一度解凍し、水浴からバイアルを取り出し、70%エタノールで寛大にスプレーして、無菌、クラスIIの層組織培養フードの下に置く前にバイアルの外表面を除染します。
- 慎重にヘプ2細胞の凍結細胞の内容物を、9 mLの予熱DMEM細胞培養培地(サプリメント付き)を含む遠心管にピペットする。
- 10 mLストレットを使用して、細胞懸濁液10mLを25cm2使い捨て細胞培養フラスコに移し、5%CO2および37°Cで3日間培養を培養し、より大きな75cm2使い捨て細胞培養フラスコにサブカルチャーを受ける前に約80%の合流が得られるまで(播種から)培養を行う。
- 80%の合流度に達すると、37°Cの水浴で30分間前温め0.05%トリプシン/EDTA溶液でトリプシン化することにより、滅菌条件下でのサブ培養細胞。どの時点でも細胞を乾燥させてはならない。
- 細胞が付着性単層を形成する場合、消毒廃棄物ポットに転落して培地を取り除く。その後、すぐに単層を洗浄し、フラスコを室温に保った無菌1xPBS溶液の3mLで2回洗浄することにより、既存の培地の痕跡をすべて除去する。また、PBSを消毒廃鍋に捨てます。
- PBS洗浄を除去したら、5 mLのプリウォームド0.05%トリプシン-EDTA溶液を加え、細胞の全表面をカバーし、細胞を37°Cおよび5%CO2で6〜8分間培養することを保証する。
- フラスコを軽くタップしてフラスコの底部から細胞を外し、5 mLのDMEM細胞培養培地(サプリメント付き)を加えてトリプシン酵素を中和します。
- 細胞懸濁液を50 mL遠心管に移し、細胞懸濁液を完全に上下にピペットし、細胞が完全に関連付けられていないことを確認します。
- 希釈した細胞懸濁液を230xgで5分間遠心分離する。上清を消毒剤に捨て、25mLのDMEM細胞培養培地で細胞ペレットを再懸濁する(サプリメント付き)。
- 細胞懸濁液を75cm2 使い捨て細胞培養フラスコに移し、スフェロイド製剤を受ける前にさらに3日間、37°Cおよび5%CO2でインキュベートする。 HepG2sが順応する時間を持ち、再び約80%の合流度に達したら、スフェロイド播種に備えて細胞濃度を決定する。
2. HepG2スフェロイド製剤
- 上記のサブカルチャーステップを繰り返し、遠心分離後を除き、37°Cの水浴で予熱したDMEM培地の1mLで細胞ペレットを再懸濁する。ピペットセルサスペンションを徹底的に上下に。
- トリパンブルー排除アッセイ(OSHA SOP 3.21生殖毒素、ムタゲン、テラトゲン、胚毒素- 安全および安全ガイダンスのための手順(2019)を使用して細胞生存率をスコアリングする14 細胞懸濁液と事前にフィルタリングされた 0.4% Trypan blue ソリューション。
- セルカウントの前に、1 mLシリンジを使用してトリパンブルー溶液を1 mL、0.45 μmフィルターユニットを用いたフィルターを無菌、1 mLチューブに取り込みます。
- 10 μLの濾過したトリパンブルー溶液を0.2 mLチューブに移し、10 μLのセルサスペンションを追加します。残りのフィルターされたトリパンブルー溶液は、将来の使用のために室温で3ヶ月まで保存することができます。
- 血体血細胞計を70%エタノールで十分にスプレーし、滅菌ペーパータオルで乾かしてから、呼吸蒸気を使用してカバースリップを上に固定します。呼吸を湿らせた表面を横切ってカバースリップを滑らせ、ニュートンリングを生成することによって凝集力を誘発する。
- 1000 μL ピペット(完全なストレスを軽減するため)を使用してトリパンブルーセルサスペンションを上下に軽くピペットしてから、血球計に10 μLを加えます。溶液がカバースリップの下に分散され、気泡なしでグリッド全体を覆っていることを確認してください。

図1: 血球計を用いた細胞数計 血球細胞計の図示表現は、どの象限から細胞を数えるかを強調する。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- 顕微鏡下では、四つの大きな角の四角に見られる生きた(染色されていない)細胞と死んだ(青い染色)細胞を数える(図1)。重なり合うか、または大きな角の正方形の内側の2つのエッジ(すなわち、線上)に座っているセルを除外します。
- 次の計算を使用して、サンプルに存在する生存中の生存可能なセル (染色されていない) の平均数を計算します。
セル/mL の総数 = ライブセル数 x x 10,000
x 10,000
ここで希釈は、ストック溶液がトリパンブルー(この場合は2倍)で希釈された回数を指し、数えられた正方形の数の数は、血球計の4つの大きな角の正方形を数えることを指します - 実行可能な HepG2 セル数に基づいて、次の数式を使用します。
C1V1=C2V2
ここで C1 = 現在生存可能な細胞の濃度、
V1=現在の細胞懸濁液の体積、
C2=望む細胞懸濁液の濃度、
V2 = 望むセルサスペンションの体積 - 20 μL の吊り下げ落ちる 4000 HepG2 細胞を達成するために、DMEM 細胞培地を用いた HepG2 細胞懸濁液の 10 mL ストック溶液を 2.0 x 105 細胞/mL の濃度で調製します。1000 μL ピペットを使用して上下に軽くピペットを使用して細胞懸濁液を十分に混合し、すべての細胞がメディア内で完全に懸濁されるようにします。
- 96ウェルの細胞培養プレートのウェルに、100 μLの無菌、室温PBSを加えて、潜伏中の吊り下げ液が乾燥するのを防ぎます。
- 標準的な平底96ウェル細胞培養板の蓋を取り、それを反転し、 慎重に図2に示すように、蓋の各ウェル溝の中央に細胞懸濁液のピペット20μL滴を。マルチチャンネルピペットを使用しますが、複数のシード処理が滴の精度と配置に影響を与える可能性があるため、一度に2〜4滴しか追加できません。
- 蓋にレイアウトされた井戸の溝の中に滴を中央に置きます。それ以外の場合は、プレートの蓋がひっくり返され、プレートに落ちる危険性があるとき、彼らは井戸の中央にハングアップしません。96ウェルプレートの蓋をそっとひっくり返して、滴がぶら下がって96ウェルプレートの上に慎重に置きます。
- 96ウェルプレート全体を蓋付きで37°Cのインキュベーターに、5%CO2を3日間、アガロースにスフェロイド移管する前に静かに入れます。
注:プレートをインキュベーターとの間で輸送する場合だけでなく、過度の動きがプレートをシフトさせ、回転楕円体が誤って落下したり形成したりする可能性があるため、インキュベーターを開閉する際には特別な注意が必要です。

図2:3D HepG2インビトロスフェロイドモデル調製物(A)20μLに播種したHepG2細胞を96ウェルプレートの蓋に滴下する。(B) ヘプG2細胞は、スフェロイド形成を可能にする吊り下げ低下モデルでの播種後。この図の大きなバージョンを表示するには、ここをクリックしてください。
3. ヘプG2スフェロイド転写からアガロースサスペンションへの吊り下げ
注:3日目のポストシーディングドロップに播種すると、スフェロイドは同じ96ウェルプレートのウェルに移され、そのすべてが以前に1.5%アガロースゲルの微細な層でコーティングされています。
- プレートコーティングの日(すなわち、3日目のポストシード)の前にアガロースゲルおよびオートクレーブ(すなわち、2日目ポストシード)を準備する。
- 1.5%のアガロースゲルを調製するには、0.30gのアガロースを清潔なガラス瓶に計量し、20mLのフェノールレッドフリーDMEM培地を加えます。230°Cで1時間アガロースをオートクレーブして殺菌する。アガロースコーティングは、HepG2スフェロイドが3Dスフェロイド構造を保持する代わりに、ウェルの基部に付着し、細胞単層を形成することを防ぎます。
- 3日目のポストシードでは、HepG2ハンティングドロップスフェロイドをインキュベーターから取り出した96ウェルプレートを取り出し、スフェロイドがぶら下がらなくなったように蓋を慎重に反転させます。
- マルチチャンネルピペットを使用して、96ウェルプレートのベースに追加したPBSの100 μLを取り外して廃棄します。コーティングに備えてアガロースを加熱しながら、プレートを2〜3分間エアドライさせます。
注意:この手順は、皮膚にこぼれた場合に火傷や怪我を引き起こす可能性があり、非常に熱い、液体アガロースをもたらします。さらに、液体アガロースを含むガラス瓶も非常に熱くなる可能性がありますので、注意が必要です。 - 以前に調製した1.5%のアガロースゲルを使用して、20mLアガロースゲルを含むガラス瓶を最大ワット(すなわち、900W)の電子レンジで30s加熱します。2つの96ウェルプレートをコーティングするには、事前に調製された1.5%アガロースゲルの1つの20 mLボトルで十分である必要があります。
- 溶けたら、ガラス瓶を回転して気泡を取り除き、50μLのアガロースを各ウェルの基部に加えて、アガロースをそっと渦巻きます。
注: アガロースを追加する場合は、プレートを角度付けしないように注意してください > 45° アガロースは、迅速に設定し、平らな、平らなレベルの層を形成しないスフェロイドの成長を破壊することができます。プレートが完全にコーティングされる前にアガロースが固化するのを防ぐために、この段階で効率的に作業することが重要です。 - プレートを室温で2分間放置してから、各ウェルの固体アガロース層の上に100 μLのあらかじめ温められたDMEM細胞培養培地(サプリメント付き)を加えます。
- 96ウェルプレートの蓋をめくり、96ウェルプレートの上に戻して、回転楕円体が再びぶら下がるようにします。
- 吊り下げ液滴から96ウェルプレートの個々のウェルに回転楕円体を移動させるために、200 x gで3分間プレートを遠心する。転写後、HepG2スフェロイドは細胞培養培地中に懸濁する必要があります。彼らは37 °Cと5%CO 2でインキュベーターで24時間の決済を許可します。
- このサイズのHepG2スフェロイドを、4日目のポストシードで化学的またはENM処理(すなわち、アガロースコーティングプレートに移してから24時間)に公開します。
- 培養期間の延長にわたって細胞生存率を維持するために、3日ごとに細胞培養培地をリフレッシュする。これを行うには、ウェルの表面から細胞培養培地の50μLを軽く吸引し、新鮮な50μLのDMEM細胞培養培地に交換する。中程度の変更を行う場合は、回転楕円体を除去または乱さないので注意してください。
4. ナノ材料/化学物質暴露
注:HepG2肝臓スフェロイドモデルは、ENMと化学ベースの暴露レジームの両方をサポートすることができますが、このプロトコルの主な焦点はENM露光です。暴露する前に、テストENMは適切に分散されなければならない。これは、NanoGenoTox分散プロトコル(交付契約第20092101、2018年)15の指示に従って行うことができます。
- NanoGenoTox分散プロトコルに従って分散液に続いて、ENM懸濁液を2.56mg/mLの開始濃度から、事前に温めたDMEM細胞培養培地(サプリメントを含む)中の最終所望濃度まで希釈する。1 96ウェルプレートを投与するには、5 mLの総体積が必要です。
- HepG2スフェロイドを化学またはENMのいずれかに曝露するには、200μLピペットを用いて、各ウェルの表面から50μLの細胞培養培地を吸引し(50μLをウェルに残して、スフェロイドを乱さないように)、試験用毒性物質を含む50μL培地に交換する。
- 試験材料が適用されたら、37°Cおよび5%CO2で所望の露光時間のためにプレートをインキュベートする。
- 長期(≥24時間)露光体制が実施された場合、目的の露光時間が経過した直後に、ステップ6.1~6.4で以下のように、マイクロ核エンドポイント解析用のスフェロイドを収穫します。
- しかし、急性暴露レジーム(例≤24時間)では、露光期間が終了すると、収穫、プール、96ウェルプレートから50μLの上澄み液を-80°Cで保存し、後で生化学的分析を行います。細胞培養培地を、6 μg/mLのサイトカラシンBを含む新鮮な培地に置き換え、細胞内細菌の採取に備えて、1 ~1.5細胞周期(HepG2の場合は24 ~26時間)の培養を行います。
注:急性(≤24h)曝露レジームの場合、サイトカラシンBを用いたサイトカネシスブロック小核アッセイを適用することができるが、長期(≥24時間)暴露レジームでは、アッセイの単核バージョン(≥チャラシンBなし)を下記の 図4に記載するように利用しなければならない。
5. ヘプG2スフェロイド収穫
注:化学的またはENM曝露処理の後、細胞培養培地またはスフェロイド組織の両方を複数のエンドポイント分析のために収穫することができます。エンドポイント解析に応じて、スフェロイドは個別に収穫されるか(例えば、画像分析のために)、または一緒にプール(例えば、サイトカネシスブロック微小核アッセイのために)することができる。
- インキュベーターから96ウェルプレートを取り出します。
- 200 μL ピペットを使用して、各ウェルからスフェロイド組織を含む細胞培養培地の 100 μL を吸引し、滅菌した 15 mL 遠心分離管に集めます。アガロースとの接触を避けるように注意してください。
- 一度採取したら、5分間230xgでスフェロイド懸濁液を遠心分離する。上清を取り除き、後でさらなるエンドポイント分析(例えば、肝機能検査)のために-80°Cで保存します。
- スフェロイドのペレットを滅菌の1 mL、室温PBS(1x)に再懸濁させる。
- 洗浄したら、230xgで再び回転楕円体懸濁液を3分間遠心する。上清を捨て、0.05%トリプシン-EDTA溶液の500 μLで再中断し、37°Cおよび5%CO2で6〜8分間インキュベートする。
- インキュベーション後、トリプシン化された細胞を上下に軽くピペットし、1 mLのDMEM細胞培養培地で中和する前にHepG2細胞を完全に関連付け解除し、再中断する。
- 希釈した細胞懸濁液を230xgで5分間遠心分離する。上清を消毒剤に捨て、室温PBS(1x)の2mLで細胞ペレットを再懸濁します。
- 細胞懸濁液を230xgで5分間遠心分離する。上清を消毒剤に捨て、2mLの冷たいPBS(1x)で細胞ペレットをもう一度再中断します。顕微鏡スライドに取り付けられたときに細胞の塊が視野を隠すことを防ぐために、細胞が十分に分散していることを確認してください。
6. ミクロ核アッセイとスコアリング
マイクロ核アッセイの手動法では、細胞遠心分離機が顕微鏡スライドの中央に細胞のサイトドット(細胞の定義された、濃縮領域)を生成するために必要とされる。このプロセスは、セルが広く広がるスライド全体を評価するのではなく、スコアラーが関心のあるセルを簡単に見つけることができるため、スライドのより効率的なスコア付けをサポートします。
- 70%エタノールに浸す曇った顕微鏡スライド(1回当たり3回)にddH2Oを続け、5分間空気乾燥させた。
- ガラススライド(iii)をフィルターカード(ii)とキュベットファネル(i)を上部に固定して金属支持体(iv)に配置する、図3Aに示すように、準備された顕微鏡スライドをキュベット漏斗に入れます。
- 細胞遠心分離機にキュヴェットの漏斗を並べ、じょうごを上に向けて、100 μLの細胞懸濁液を直接それぞれに加えることができます。
- 細胞がスライドの表面に均等に分布していることを確認するために500 x g で5分間の細胞スピン。

図3:顕微鏡スライド上で処理された細胞を調製するためのCytospinセットアップ.(A)個々の成分、(i)キュベット漏斗、(ii)フィルターカード、(iii)ガラス顕微鏡スライドおよび(iv)細胞を顕微鏡スライドに細胞スピンするために必要な金属支持を表示する。(B) 最終的なキュベットファネルのセットアップ。(C)細胞遠心分離機内のキュヴェット漏斗の正しい配置。この図の大きなバージョンを表示するには、ここをクリックしてください。
- 氷冷で固定する前にスライドを空気乾燥させてから、90%メタノールを10分間放置します。
- 一度固定したら、スライドを室温で一晩空気乾燥させてから、-20°Cで最大6ヶ月間保存します。
- 必要に応じて、事前に準備された顕微鏡スライドを-20°C冷凍庫から取り出し、Giemsa染色を行う前に室温まで温めます。
注意:規制(EC)No.1272/2008[CLP]によると、Giemsa染色溶液は、飲み込むと有毒であり、眼、皮膚、または吸入した場合に損傷を引き起こす可能性のある非常に可燃性の液体です。使用前に、この化学物質の詳細な保管、取り扱い、および安全衛生に関するアドバイスについては、関連するSDSシートを参照してください。 - スライドが解凍されている間に、ホスファターゼバッファー(pH 6.8)で希釈した20%ギームサ染色液(染色〜30枚のスライドに必要な25 mL)を調製します。漏斗に入れた折り紙を使って濾過する前に、溶液をそっと旋回して十分に混ぜます。
- パスツールピペットを使用して、各スライドのサイトドットに3〜5滴のフィルターギムサ溶液を追加し、8〜10分間放置します。
- 2つの連続したホスファターゼバッファー洗浄でスライドを洗浄してから、冷たい水の下で一時的にすすいで残った余分な汚れを取り除きます。スライドを空気乾燥にしておきます。
- 一度乾燥したら、ヒュームフードで、シレンに10分間浸着したスライドを10分間浸し、シトドットの中央に取り付け媒体の滴を加え、上にガラスカバースリップを置きます。
- 手動採点の前に乾燥するために一晩ヒュームフードに顕微鏡スライドを残します。それらは室温で無期限に貯えることができる。
7. データ分析
- OECD試験ガイドライン487(2014)11に記載されているように、ENMまたは化学薬品への暴露の結果として誘発されるDNA損傷を評価および定量化するために、光顕微鏡(浸漬油による100x目的)2000単核または1000個の二核細胞を使用して、マイクロ核の存在をスコア化する。

図4:微小核アッセイ採点決定木急性または長期の暴露体制に従って3Dモデルで微小核アッセイを使用する場合の異なるスコアリングおよび細胞毒性評価手順の必要性を強調する模式的意思決定ツリー。急性(≤24時間)暴露はサイトカネシスブロックされた微小核アッセイの使用を可能にし、長期(≥24時間)暴露は単核バージョンのアッセイを必要とする。どちらもOECDテストガイドライン487に記載されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
- スコア付けされた単核または二核化された細胞の数当たりのミクロ核の割合に基づいて、遺伝毒性値の割合を計算する。
- 観察されたDNA損傷を評価するためには、アポトーシス細胞の高い割合によって生じる細胞デブリの結果ではなく、細胞毒性の尺度を併せ取る。この場合、サイトカラシンBの存在に応じて、CPBIまたはRVCC計算のいずれかを使用する( 図4を参照)。遺伝子毒性は、OECD試験ガイドライン48711で定義された5%±細胞毒性が55%未満であるサンプルでのみ評価されなければならない。
Representative Results
この細胞系ベースの3D肝スフェロイドモデルの長期培養および遺伝毒性ハザード評価の適合性を、ベースライン特性評価を行い、培養中の14日間のモデルの生存率および肝臓様機能性および微小核アッセイに対するその適用性を決定することによって評価した。
3D HepG2肝臓回転楕円体モデルのベースライン特性
インビトロ毒物学的評価の前に、アガロース転移または化学/ENM処理を行う前に、3D HepG2スフェロイドが正しく形成されていることを確認することが重要です。吊り下げ液法を用いて製造されたHepG2スフェロイドは、通常、図5 A-5Cに示すように、平均直径495.52 μmのHを有するコンパクトな球形の球状スフェロイドを形成するのに2〜3日の播種後(4000細胞/スフェロイド)を要する。正しく形成され、体外毒性評価に使用できるHepG2スフェロイドは、滑らかな表面と視覚的な投影のないコンパクトな球形の構造を持っている必要があります。図 5に、品質の良さと品質の悪さ (図 5G-I)スフェロイドの例を示します。後者は破棄する必要があります。通常、プレートごとに形成されたスフェロイドの90〜95%が正しく形成され、さらなる実験のために実行可能である。

図5:吊り下げ液法を介して形成されたHepG2スフェロイドの自然形態を示す光顕微鏡画像。(A-C)ショー2日目と(D-I)4日目HepG2肝臓スフェロイドポストシード。(D-F) は良質 HepG2 スフェロイドの例であり、 (G-I) は形成不良のスフェロイドを示しています。すべての画像は、顕微鏡を使用してX20目的で撮影した。スケールバーは20 μmを表します。
HepG2スフェロイド生存率をさらに確認するために、基本的な着色ブロモクレゾールグリーンアルブミン(BCG)アッセイまたはウレアアッセイを行い、肝臓様の機能性を評価することができる。肝臓様の機能性は、14日間の培養期間にわたってトリパンブルー排除アッセイを使用して生存率に沿って評価され、肝臓スフェロイドモデルの寿命を決定し、長期的または繰り返しENM/化学的ハザードアセスメントをサポートできるかどうかを確立した(図6)。アルブミン濃度は培養期間にわたって一貫した状態を保った。尿素生産は、7日目までに高原に到達する前に、培養で1週間にわたってスフェロイド当たりの尿素の濃度の増加を表示します。3D HepG2スフェロイドで産生されるアルブミンおよび尿素のレベルは、2D形式で培養された同じ細胞株で観察されたものよりも実質的に高い点に注意することが重要である。実際、HepG2細胞、ピークアルブミンおよび尿素レベルの2D培養は、それぞれ0.001mg/mLおよび0.010 ng/μLであった。さらに、ほぼ同一のHepG2スフェロイド系を用いてShahらが発表した以前の研究では、2D培養HepG2細胞5と比較した場合の3D HepG2インビトロモデル系における代謝活性(CYP1A1およびCYP1A2)の顕著な改善を強調した。

図6: HepG2肝スフェロイドの14日間ベースライン特性データ吊り下げからの移し換えの後、(A)は14日間にわたってHepG2スフェロイドモデルの生存率を強調し、(B)および(C)は肝臓のようなアルブミンおよび尿素の機能をそれぞれ強調する。SEM±提示された平均データ、n = 4。 この図の大きなバージョンを表示するには、ここをクリックしてください。
壊死性コアの必然的な発達に伴い、3D肝スフェロイド培養の既知の限界であり、このHepG2ベースのモデルの生存率は、微小核アッセイ5を支持するために必要な増殖能力を維持しながら、長期(5〜10日)の暴露レジームを維持できることを実証するために確立されなければならなかった。実際、この3D肝スフェロイドモデルは、培養で10日間にわたって70%の生存率を保持することが示されています。このことから、≥14日間の培養期間に観察された持続的な肝臓様の機能と組み合わせて、この3D肝スフェロイドモデルは、10日間の長さ(すなわち、スフェロイドの生存率が70%を下回る前)の長期にわたる反復ENM曝露レジームをサポートすることができる。参考までに、4000細胞/スフェロイドに播種されたHepG2スフェロイドのアルブミンレベルは≥20.0 ng/μL で、尿素生産は≥0.25 ng/μLであるべきである。
工学ナノ材料の遺伝毒性評価
遺伝毒性評価のために、微小核アッセイを用いて、急性(24時間)および長期(120時間)の両方のENM曝露に続く小核の存在を決定した。アフラトキシンB1は、既知の肝発がん性物質16、17であり、小核アッセイに推奨される陽性対照である。最適化実験では、0.1 μMのアルファトキシンB1が3D HepG2肝スフェロイドにおいて有意な陽性(≥2.0倍の増加)の遺伝毒性応答を誘導し、このモデルで行われるすべての微小核アッセイに使用することが示されています。HepG2スフェロイドモデルを用いたマイクロ核アッセイ結果の有効性を保証するために、この3Dインビトロモデルで使用されるHepG2細胞のバックグラウンドマイクロ核周波数は0.6%~1.2%の範囲内にある必要があります。その結果、アルファトキシンB1は、陰性対照で見られるものよりも少なくとも2倍高い遺伝子毒性応答を誘導すべきである。したがって、0.1 μMのアルファトキシン B1 は、1.5% ~ 3.0% の間のマイクロ核周波数を誘導する必要があります。これらの制御パラメータを用いて、ENMに関連する遺伝子毒性インビトロを、確実に評価することができる。OECD試験ガイドライン487に基づいて、ENMまたは化学薬品を試験する際に、選択された濃度が5%以上±5%以上の細胞傷害性を誘発してはならないことに注意することが重要である(負の対照に関連してCPBIまたはRVCC値の低下によって示される)11。図7は、アフラトキシンB1および2つのENM(二酸化チタン(TiO2)およびスライバー(Ag))がHepG2スフェロイドにおける急性および長期曝露の両方に続いて評価された場合に生成されたデータを示し、その後の遺伝子毒性電位をミクロ核アッセイを用いて分析した。評価された両方のENMは、急性(24時間)暴露および長期(120時間)曝露体制に対する非細胞毒性、低用量5.00μg/mLで試験された。TiO2およびAg Enmsの両方にわたって遺伝毒性の同様の傾向が観察され、それによって24時間暴露後に生じた遺伝毒性応答の上昇は、長期5日間の暴露後に明らかではなかった。これは、両方の時点でアフラトキシンB1陽性対照によって誘導された持続的な遺伝毒性にもかかわらずであった。

図7: HepG2肝スフェロイドに対するTiO2およびAg ENM曝露に続く遺伝毒性評価微小核アッセイポスト(A)急性(24時間)および(B)を用いた遺伝毒性(微小核頻度)評価(A)および(B)TiO2およびAg ENMの5.00 μg/mLへの長期(120時間)曝露。ネガティブコントロールはメディアのみであり、正のコントロールはAflatoxin B1の0.1 μMです。平均データ(n=2)は、SD±提示され、負のコントロールに関連して示された有意性:* = p≤0.05。この図の大きなバージョンを表示するには、ここをクリックしてください。
Discussion
3D肝モデルの適用は、標的にされる特定の生化学的エンドポイントまたは有害な結果経路によってかなり異なる。各モデルには、一次ヒト肝細胞(PHH)モデルのドナー間変動から細胞系モデルにおけるチトクロームp450活性の低下まで、その利点と限界があるが、すべて独自の権利6、12、18、19において価値がある。遺伝毒性を評価する場合、モデルには、能動増殖が必要なため、インビトロ小核アッセイなどの規制承認エンドポイントとの適合性が制限される。遺伝子毒性評価は、DNA修復が一過性の病変を矯正する機会がある場合に細胞分裂後に評価される固定DNA損傷の定量化を必要とするため、これが必要である。残念なことに、高度に分化した肝細胞(すなわち、hepaRG)ベースのスフェロイドまたはPHHマイクロ組織は、最も生理学的に関連する肝臓様特性を示すものと考えられるが、これは静的(不増殖)モデル12、19、20を形成する。その結果、ここで提示される3D HepG2スフェロイドモデルは、遺伝毒性試験をサポートできる適切な代替モデルを提供します。HepG2細胞系スフェロイドは、アルブミンや尿素産生などの基本的な肝臓様特性を維持しながら、スフェロイドの外表面に十分な積極的に細胞を分割し、CYP450活性5、12、19を有する。このインビトロ肝モデルは、この小核アッセイを補完するために開発されており、これは、遺伝毒性試験8、10、11、21の電池で推奨される2つのインビトロアッセイのうちの1つである。しかし、このモデルはDNAシーケンシング解析および遺伝子発現(RNA)技術に容易に適用することができ、彗星アッセイのような他のDNA損傷エンドポイントにさらに適応して利用される可能性がある。しかし、一部のエンドポイント解析において、ENM干渉が果たす役割を考慮することが重要です。例えば、フローサイトメトリーベースの解析は、特に粒子干渉22によるENM遺伝子毒性評価には適さない場合がある。
細胞分裂を活発に行うスフェロイドモデルの制限要因の1つは、その大きさです。シード密度の最適化は、モデルが増殖し続ける十分なセルが必要であるため、重要です。しかし、あまりにも高い細胞数, スフェロイドが過度にコンパクトになる結果, 壊死コアの増加につながります.この壊死の原因は、酸素および栄養拡散を制限していると考えられており、この拡散の限界は、組織23、24の約100〜150μmであると考えられている。しかし、これは細胞型、細胞数、足場相互作用および培養条件25に依存する。以来、直径約700μmがC3Aスフェロイドの中心における壊死の早期発症を避けるための限界であることを示されており、スフェロイド当たり4000HepG2細胞を播種すると、露光時のモデルの直径が≤500μm26であることを保証する。さらに、Shah et al. は、ヘプG2細胞が球状体1個当たり5000細胞を超える播種が培養7日後に生存率の25%減少を示したことを確立した。これを克服するために、本プロトコルで考案されたモデルは、スフェロイドの初期形成に続いて、吊り下げ低下がアガロース被覆井戸に移される重要なステップを経る。これにより、スフェロイド内で増え続ける細胞数を維持するために、より多くの培養培地が存在することを保証する。その結果、HepG2スフェロイドモデルは培養で10日後に70%以上生存し続け、インビトロでの長期ハザード評価に利用することができる。
HepG2スフェロイドモデルは急性および長期の曝露レジーレジーをサポートできるが、培地の完全な置換がスフェロイドの潜在的な損失のために推奨されないとして、培養期間中の細胞培養培地のリフレッシュは、このモデルに対して制限される。ENM露光では、均質なENM分散液が凝集・沈殿する傾向が高いと推測されます。しかし、ENM堆積物が粒子パラメータ(例えば、大きさ、形状および密度)に応じて変化し得る速度は、IN体外沈下、拡散および線量測定(ISDD)モデル、またはその最近の誘導体を使用して理論的に決定できることが注目に値する。この心を用いて、細胞培養液の50%のみが細胞培養の表面から慎重に除去されれば、ENM用量の破壊およびその後の除去は理論的には最小限に抑えられるべきである。しかし、ブラウン運動が遊びで、これは厳密にはそうではないかもしれないし、テストされる各特定のENMの堆積および沈下へのさらなる作業は、長期的な暴露体制27を通じて正しい量体測定が保持されることを確実にするために行われるべきである。主に、これは最終的な蓄積された濃度に不可欠である可能性があり、繰り返し投ずる体制を実行する際に考慮すべき潜在的な制限です。一方、化学物質ベースの暴露は、考慮すべき独自の制限がないわけではないが、化学物質が溶液中に残る傾向があり、新たに添加された濃度に加えて元の化学物質濃度を直接交換するという点でより単純なアプローチを提供し、メディアリフレッシュ中に失われた化学物質をそれに応じて29に置き換えることを保証する。将来の応用には、特定の臓器系が異種生物物質の生物蓄積によって誘発される副作用を改善または克服する能力を評価するために、長期培養期間にわたる反復暴露体制に対するモデルの適合性を評価することが含まれる。
結論として、この3Dインビトロ肝モデルは、現実的な暴露シナリオの範囲を評価するために利用される能力を有し、それによってENMと化学的ハザード評価の両方をより良くサポートするための将来のインビトロアプローチをルーチンで容易にアクセス可能な方法で提供する。
Disclosures
著者らは開示するものは何もない。
Acknowledgments
著者らは、この研究が補助金契約No.760813の下で、欧州連合(EU)のHorizon 2020研究およびイノベーションプログラムから資金を受け取っていることを認めたいと思います
Materials
| Name | Company | Catalog Number | Comments |
| Aflotoxin B1 | Sigma Aldrich, UK | A6636-5MG | |
| Agarose | Sigma Aldrich, UK | A9539-50G | |
| Autoclave Tape | |||
| BCG Albumin Assay | Sigma Aldrich, UK | MAK124 | |
| Bovine Serum Albumin Powder | Sigma Aldrich, UK | A9418 | |
| Cell Freezing Aid | Thermo Fisher Scientific, UK | 5100-0001 - Mr Frosty | |
| Centrifuge | Eppendorf | 5810 R | |
| Cytochalasin B | Merck, UK | 250233 | |
| Cytology Metal Clips | |||
| Cytospin 4 Centrifuge | ThermoFisher Scientific, UK | CM00730202 | |
| DMEM with 4.5g/L D-Glucose, L-Glutamine | GIBCO, Paisley, UK | 41965-039 | |
| DMEM, phenol-red free with 4.5g/L D-Glucose, L-Glutamine with Hepes | GIBCO, Paisley, UK | 21063-029 | |
| DPX Mounting Medium | FisherScientific, UK | D/5330/05 | |
| Ethanol | FisherScientific, UK | 10048291 | |
| FBS | GIBCO, Paisley, UK | 10270-106 | |
| Filter Cards for Shandon Cytospin | FisherScientific, UK | 15995742 | |
| Frosted Glass Slides | ThermoFisher Scientific, UK | ||
| Giemsa's Stain Improved R66 Solution, Gurr | VWR Chemicals, UK | MFCD00081642 | |
| Glass Coverslips (24 x 60) | Deckglaser, VWR | ECN631-1575 | |
| Haemocytometer and Coverslip | |||
| Immersion Oil for Microscope | Zeiss, UK | 518F, ISO8034 | |
| Laminar Class II Tissue Culture Hood | Scanlaf Mars | ||
| Light Microscope | Zeiss, UK | Axiovert 40C | |
| Liquid Nitrogen | |||
| Methanol | FisherScientific, UK | 10284580 | |
| Microwave | |||
| Non-Filtered, Sterile 200µl and 1000µl Pipette tips | Greiner-Bio-One, UK | ||
| NuncMicroWell 96-Well Microplates | ThermoFisher Scientific, Denmark | 167008 | |
| P1000 and P200 micropipettes | |||
| P300 and P50 multi-channel pipettes | |||
| PBS pH 7.4 1X, MgCl2 and CaCl2 Free | GIBCO, Paisley, UK | 14190-094 | |
| Pen/Strep | GIBCO, Paisley, UK | 15140-122, Penicillin/Strepmyocin 100X or 10,000U/ml | |
| Phosphatase Buffer Tablets | GIBCO, Paisley, UK | 10582-013 | |
| Pipette Boy | |||
| Simport Scientific CytoSep Funnels for Shandon Cytospin 4 Centrifuges | FisherScientific, UK | 11690581 | |
| Sonifier SFX 550 240V CE 1/2" - Probe | Branson, USA | 101-063-971R | |
| T-25 and T-75 Tissue Culture Flask | Greiner-Bio-One, UK | T-25 (690175) and T-75 (660175) | |
| Trypan Blue Solution | Sigma Aldrich, UK | T8154-100mL | |
| Urea Assay Kit | Sigma Aldrich, UK | MAK006 | |
| Virkon Disinfectant | DuPont, UK | Rely+On Virkon | |
| Water Bath (37?C) | Grant JBNova 18 | ||
| Weighing Balance | |||
| Xylene | FisherScientific, UK | 10588070 | |
| 0.05% Trypsin-EDTA | GIBCO, Paisley, UK | 5300-054 | |
| 0.2mL and 1.0mL Eppendorf Tubes | Greiner-Bio-One, UK | ||
| 0.45µm Filter Unit | Millex HA, MF-Millipore, UK | SLHA033SS | |
| 1.0mL Syringe | BD Plastipak, FisherScientific, UK | 300185 | |
| 20mL LS Scintillation Glass Vials, 22-400 Foil Lined PP Caps | DWK Life Sciences GmbH, Germany | WHEA986581 | |
| 37?C and 5% CO2 ISO Class 5 Hepa Filter Incubator | NUAIRE DHD Autoflow | ||
| 3mL Pasteur Pipette | Greiner-Bio-One, UK | ||
| 50mL Conical Falcon Tubes | Greiner-Bio-One, UK | ||
| 50mL or 100mL Glass Bottles | |||
| 50mL Skirted Falcon Tubes | Greiner-Bio-One, UK | ||
| 5mL, 10mL and 25mL Pipettes | Greiner-Bio-One, UK | ||
| 9.4cm Square, Petri Dish | Greiner-Bio-One, UK | 688161 |
References
- Geiser, M., Kreyling, W. G. Deposition and biokinetics of inhaled nanoparticles. Particle and Fibre Toxicology. 7, 2 (2010).
- Modrzynska, J. Toxicological effects of nanoparticle deposition in the liver. Kgs. Lyngby, Denmark: Technical University of Denmark. , (2018).
- Elje, E., et al. The comet assay applied to HepG2 liver spheroids. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 845, 403033 (2019).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18, 240-249 (2013).
- Shah, U. -K., et al. A three-dimensional in vitro HepG2 cells liver spheroid model for genotoxicity studies. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 825, 51-58 (2018).
- Lauschke, V. M., Hendriks, D. F. G., Bell, C. C., Andersson, T. B., Ingelman-Sundberg, M. Novel 3D Culture Systems for Studies of Human Liver Function and Assessments of the Hepatotoxicity of Drugs and Drug Candidates. Chemical Research in Toxicology. 29, 1936-1955 (2016).
- van Grunsven, L. A. 3D in vitro models of liver fibrosis. Advanced Drug Delivery Reviews. 121, 133-146 (2017).
- Corvi, R., Madia, F. In vitro genotoxicity testing - can the performance be enhanced. Food and Chemical Toxicology. 106, 600-608 (2017).
- Doak, S. H., Manshian, B., Jenkins, G. J. S., Singh, N. In vitro genotoxicity testing strategy for nanomaterials and the adaptation of current OECD guidelines. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 745, 104-111 (2012).
- Fenech, M. Cytokinesis-block micronucleus cytome assay. Nature Protocols. 2, 1084-1104 (2007).
- OECD. OECD Guidelines. Test 489: In vivo Mammalian Alkaline Comet Assay. , (2016).
- Gerets, H. H. J., et al. Characterization of primary human hepatocytes, HepG2 cells, and HepaRG cells at the mRNA level and CYP activity in response to inducers and their predictivity for the detection of human hepatotoxins. Cell Biology and Toxicology. 28, 69-87 (2012).
- Sison-Young, R. L., et al. A multicenter assessment of single-cell models aligned to standard measures of cell health for prediction of acute hepatotoxicity. Archives of Toxicology. 91, 1385-1400 (2017).
- European Guidelines 2019. European Agency for Safety and Health at Work. , Available from: https://osha.europa.eu/en/safety-and-health-legislation/european-guidelines (2019).
- Jensen, K. A. The NANOGENOTOX Dispersion Protocol for NANoREG. European Union Grant Agreement n° 2009. 21, 01 (2014).
- Marchese, S., et al. Aflatoxin B1 and M1: Biological Properties and Their Involvement in Cancer Development. Toxins. 10, 214 (2018).
- Rushing, B. R., Selim, M. I. Aflatoxin B1: A review on metabolism, toxicity, occurrence in food, occupational exposure, and detoxification methods. Food and Chemical Toxicology. 124, 81-100 (2019).
- Kermanizadeh, A., Brown, D. M., Moritz, W., Stone, V. The importance of inter-individual Kupffer cell variability in the governance of hepatic toxicity in a 3D primary human liver microtissue model. Scientific Reports. 9, 7295 (2019).
- Berger, B., et al. Comparison of Liver Cell Models Using the Basel Phenotyping Cocktail. Frontiers in Pharmacology. 7, 443 (2016).
- Ramaiahgari, S. C., et al. A 3D in vitro model of differentiated HepG2 cell spheroids with improved liver-like properties for repeated dose high-throughput toxicity studies. Archives of Toxicology. , (2014).
- Li, Y., et al. Factors affecting the in vitro micronucleus assay for evaluation of nanomaterials. Mutagenesis. 32 (1), 151-159 (2016).
- Kirkland, D., Reeve, L., Gatehouse, D., Vanparys, P. A core in vitro genotoxicity battery comprising the Ames test plus the in vitro micronucleus test is sufficient to detect rodent carcinogens and in vivo genotoxins. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 721 (1), 27-73 (2011).
- Curcio, E., et al. Mass transfer and metabolic reactions in hepatocyte spheroids cultured in rotating wall gas-permeable membrane system. Biomaterials. 28, 5487-5497 (2007).
- Glicklis, R., Merchuk, J. C., Cohen, S. Modeling mass transfer in hepatocyte spheroids via cell viability, spheroid size, and hepatocellular functions. Biotechnology and Bioengineering. 86, 672-680 (2004).
- Asthana, A., Kisaalita, W. S. Microtissue size and hypoxia in HTS with 3D cultures. Drug Discovery Today. 17, 810-817 (2012).
- Gaskell, H., et al. Characterization of a functional C3A liver spheroid model. Toxicology Research. 5, 1053-1065 (2016).
- Cho, E. C., Zhang, Q., Xia, Y. The effect of sedimentation and diffusion on cellular uptake of gold nanoparticles. Nature Nanotechnology. 6, 385-391 (2011).
- Hinderliter, P. M., et al. ISDD: A computational model of particle sedimentation, diffusion and target cell dosimetry for in vitro toxicity studies. Particle and Fiber Toxicology. 7, 36 (2010).
- Kramer, N. I., di Consiglio, E., Blaauboer, B. J., Testai, E. Biokinetics in repeated-dosing in vitro drug toxicity studies. Toxicology in vitro. 30, 217-224 (2015).
Tags
バイオエンジニアリング、課題160、インビトロ肝臓モデル、ナノ材料、ハザードアセスメント、長期暴露、ナノ(ジェノ)毒物学、DNA損傷Erratum
Formal Correction: Erratum: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure
Posted by JoVE Editors on 01/26/2021.
Citeable Link.
An erratum was issued for: Advanced 3D Liver Models for In vitro Genotoxicity Testing Following Long-Term Nanomaterial Exposure. The Representative Results section was updated.
Figure 6 in the Representative Results section was updated from:
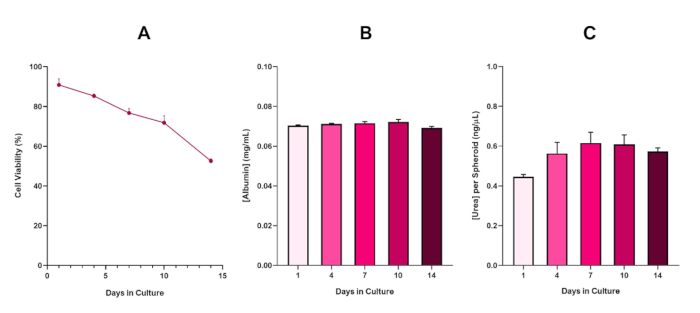
to:
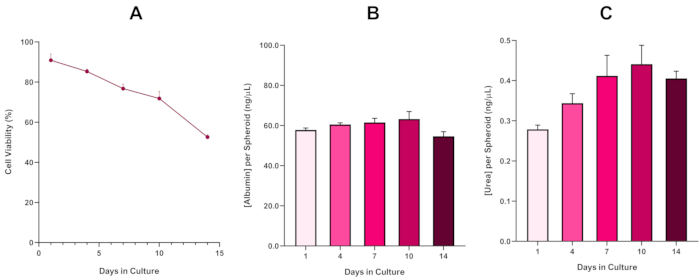
The fourth paragraph in the Representative Results section was updated from:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥0.06 mg/mL whilst urea production should be ≥0.4 ng/µL before conducting an in vitro toxicological assessment with this model.
to:
With the inevitable development of a necrotic core, a known limitation of 3D liver spheroid cultures, the viability of this HepG2 based model had to be established to demonstrate it was able to sustain long-term (5-10 day) exposure regimes whilst maintaining the proliferative capability required to support the micronucleus assay5. Indeed, this 3D liver spheroid model has been shown to retain >70% viability over 10 days in culture. Based on this and in conjunction with the sustained liver-like functionality observed over the ≥14 day culture period, this 3D liver spheroid model can thus support long-term, repeated ENM exposure regimes up to 10 days long (i.e., before viability of the spheroids drop below 70%). For reference, it is advised that albumin levels for HepG2 spheroids seeded at 4000 cells/spheroid should be ≥50.0 ng/μL whilst urea production should be ≥0.25 ng/µL before conducting an in vitro toxicological assessment with this model.



 x 10,000
x 10,000