ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Descrito aqui é um método de litografia de nanosfera para fabricação paralela de guias de onda de modo zero, que são matrizes de nanoaperaturas em uma microscopia de vidro revestida de metal para imagens de moléculas únicas em concentrações de nano-a-micromolar de fluoroforos. O método aproveita a automontagem de cristal coloidal para criar um modelo de guia de onda.
Abstract
Na enzimologia da fluorescência de molécula única, a fluorescência de fundo de substratos rotulados em solução muitas vezes limita a concentração de fluoróforos a faixas de pico a nanomolar, várias ordens de magnitude menos do que muitas concentrações fisiológicas de ligantes. Nanoestruturas ópticas chamadas de guias de onda de modo zero (ZMWs), que são de 100 a 200 nm de diâmetro, fabricadas em um fino metal condutor, como alumínio ou ouro, permitem a imagem de moléculas individuais em concentrações micromolares de fluoroforos confinando a excitação da luz visível aos volumes eficazes do zeptolitro. No entanto, a necessidade de equipamentos de nanofabização caros e especializados tem impedido o uso generalizado de ZMWs. Normalmente, nanoestruturas como ZMWs são obtidas por escrita direta usando litografia de feixe de elétrons, que é sequencial e lenta. Aqui, coloidal, ou nanosfera, a litografia é usada como estratégia alternativa para criar máscaras em escala de nanômetros para fabricação de guias de ondas. Este relatório descreve detalhadamente a abordagem, com considerações práticas para cada fase. O método permite que milhares de ZMWs de alumínio ou ouro sejam feitos em paralelo, com diâmetros finais de guia de onda e profundidades de 100-200 nm. Apenas equipamentos de laboratório comuns e um evaporador térmico para deposição metálica são necessários. Ao tornar as ZMWs mais acessíveis à comunidade bioquímica, esse método pode facilitar o estudo de processos moleculares em concentrações e taxas celulares.
Introduction
Técnicas de correlação de fluorescência de molécula única, como a transferência de energia de ressonância de fluorescência de molécula única (smFRET) ou espectroscopia de correlação de fluorescência de moléculas únicas (FCS) são ferramentas poderosas para biofísica molecular, permitindo o estudo de movimentos dinâmicos, conformações e interações de biomoléculas individuais em processos como transcrição1,2,3, tradução4,5,6, e muitos outros7. Para a smFRET, a microscopia de reflexão interna total (TIRF) é um método comum porque muitas moléculas amarradas podem ser seguidas ao longo do tempo, e a onda evanescente gerada pelo TIR é limitada a uma região de 100-200 nm adjacente ao deslizamento de cobertura8. No entanto, mesmo com essa restrição no volume de excitação, fluoroforos de interesse ainda precisam ser diluídos para faixas pM ou nM, a fim de detectar sinais de molécula única acima da fluorecência de fundo9. Uma vez que as constantes michaelis-menten de enzimas celulares estão tipicamente na faixa μM a mM10, reações bioquímicas em estudos de moléculas únicas são geralmente muito mais lentas do que as da célula. Por exemplo, a síntese proteica ocorre a 15-20 aminoácidos por segundo em E. coli11,12, enquanto a maioria dos ribossomos procarióticos em experimentos smFRET traduzem em 0,1-1 aminoácido por segundo13. Na síntese proteica, estruturas cristalinas e smFRET em ribossomos parados mostraram que a transferência RNAs (tRNAs) flutua entre estados 'híbridos' e 'clássicos' antes da translocação tRNA-mRNA passo14,15. Entretanto, quando foram observadas concentrações fisiológicas do fator TRANSLOCação GTPase, EF-G, observou-se uma conformação diferente, intermediária entre os estados híbridos e clássicos, no smFRET6. Estudar processos moleculares dinâmicos a taxas e concentrações semelhantes às da célula é importante, mas continua sendo um desafio técnico.
Uma estratégia para aumentar a concentração de substrato fluorescente é o uso de aberturas de comprimento de onda subvendidais baseadas em metal, chamadas de guias de onda de modo zero (ZMWs), para gerar campos de excitação confinados que excitam seletivamente biomoléculas localizadas dentro das aberturas16 (Figura 1). As aberturas são tipicamente de 100-200 nm de diâmetro e 100-150 nm de profundidade17. Acima de um comprimento de onda de corte relacionado ao tamanho e forma dos poços (λc ≈ 2,3 vezes o diâmetro para guias de ondas circulares com água como o meio dielétrico18), nenhum modo de propagação é permitido no guia de ondas, daí o termo modo zero guias de onda. No entanto, um campo eletromagnético oscilante, chamado de onda evanescente, exponencialmente em decomposição em intensidade ainda cava uma curta distância no guia de ondas18,19. Embora semelhante às ondas evanescentes TIR, as ondas evanescentes ZMW têm uma constante de decaimento mais curta, resultando em uma região de excitação eficaz de 10-30 nm dentro do guia de ondas. Em concentrações micromolar de ligantes fluorescentes rotulados, apenas uma ou algumas moléculas estão simultaneamente presentes dentro da região de excitação. Essa restrição do volume de excitação e consequente redução da fluorescência de fundo permite a fluorescência de imagens de moléculas únicas em concentrações biologicamente relevantes. Isso tem sido aplicado a muitos sistemas20, incluindo medições de FCS de difusão de proteína única21,medidas fret de molécula única de baixa afinidade ligante-proteína22 e interações proteína-proteína23, e medições espectro-eletroquímicas de eventos de rotatividade molecular único24.
Os ZMWs foram produzidos padronizando diretamente uma camada metálica usando a fresagem de feixe deíons 25,26 ou litografia de feixe de elétrons (EBL), seguida por gravação de plasma16,27. Esses métodos de litografia sem máscara criam guias de onda em série e normalmente requerem acesso a instalações especializadas de nanofabização, impedindo a adoção generalizada da tecnologia ZMW. Outro método, a decolagem de litografia de nanoimimposto ultravioleta28,usa um molde de slide de quartzo para pressionar um modelo ZMW inverso em um filme de resistência como um selo. Embora este método seja mais simplificado, ele ainda requer EBL para fabricação do molde de quartzo. Este artigo apresenta o protocolo para um método de fabricação modelado simples e barato que não requer fresagem EBL ou íon-feixe e é baseado em embalagem próxima de nanosferas para formar uma máscara litográfica.
A nanosfera ou litografia "natural", que foi proposta pela primeira vez em 1982 por Deckman e Dunsmuir29,30, usa a auto-montagem de partículas coloidais monodisperse, que vão de dezenas de nanômetros a dezenas de micrômetros31,para criar modelos para padronização superficial através de gravura e/ou deposição de materiais. As matrizes periódicas bidimensionais (2D) ou tridimensionais (3D) estendidas de partículas coloidais, referidas como cristais coloidais, são caracterizadas por uma iridescência brilhante da dispersão e difração32. Embora menos amplamente utilizada do que o feixe de elétrons ou fotolitografia, esta metodologia de mascaramento é simples, de baixo custo e facilmente dimensionada para baixo para criar tamanhos de características abaixo de 100 nm.
Direcionar a auto-montagem de partículas coloidais determina o sucesso do uso de cristais coloidais como máscaras para padronização superficial. Se o tamanho e a forma das partículas forem homogêneos, as partículas coloidais podem ser prontamente auto-montadas com embalagem hexagonal, impulsionadas pelo esgotamento entropico33. A evaporação da água após o revestimento de gotas é uma rota eficaz para sedimentar as partículas coloidais, embora outros métodos incluam o revestimento de mergulho34,o revestimento de spin35,a deposição eletroforética36e a consolidação em uma interface ar-água37. O protocolo apresentado abaixo baseia-se no método de sedimentação de evaporação, que foi o mais simples de implementar. Os interstícios triangulares entre contas de poliestireno estreitas formam aberturas nas quais emplacar um metal sacrificial, formando postes(Figura 2 e Figura Suplementar 1). Breve ressaramento das contas antes que esta etapa ajuste a forma e o diâmetro desses postes. As contas são removidas, uma camada metálica final é depositada ao redor dos postes e, em seguida, os postes são removidos. Após os dois passos de deposição metálica no nanomasco coloidal, remoção dos postes intermediários e modificação da química da superfície para passivação e amarração, as matrizes ZMW estão prontas para uso para imagens de molécula única. Uma caracterização mais extensa das propriedades ópticas ZMW após a fabricação pode ser encontrada em um artigo38. Além de um evaporador térmico para deposição de vapor dos metais, não são necessárias ferramentas especializadas.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
NOTA: Todas as etapas podem ser concluídas em espaço de laboratório geral.
1. Limpeza de tampas de vidro
- Para fornecer uma superfície limpa para a deposição evaporativa de partículas coloidais, coloque tampas de vidro borossilicato óptico de 24 x 30 mm (0,16-0,19 mm de espessura) dentro das pastilhas ranhuradas de um frasco de coloração de vidro coplin para limpeza.
NOTA: Certifique-se de que as tampas fiquem eretas e bem separadas para que todas as superfícies sejam claramente expostas durante o processo de limpeza. - Despeje acetona suficiente no frasco de coloração para cobrir as tampas, coloque a tampa e sonicate por 10 min a 40 °C.
- Despeje a acetona e enxágue as tampas preenchendo o frasco de coloração com H2O destilado e derramando a água. Repita mais 2 vezes.
- Repita a sônica acetona (passos 1.2 e 1.3) mais uma vez.
- Despeje suficientes 200 mM KOH no frasco para cobrir as tampas e sonicato, coberto, por 20 min a 40 °C.
NOTA: O KOH grava ligeiramente o vidro. - Enxágüe as tampas com H 2 O6vezes destiladas.
- Adicione etanol para cobrir as tampas, adicione a tampa e sonicate por 10 min a 40 °C.
- Enxágüe as tampas com H 2 O3vezes destiladas.
- Pegue cada tampa na borda usando fórceps suaves e seque as tampas com gás N2. Toque apenas nas bordas do deslizamento de tampa. Coloque cada uma das tampas secas e limpas em uma placa de Petri limpa individualmente.
2. Deposição evaporativa de contas de poliestireno
- Para criar a máscara de cristal coloidal para a matriz ZMW, centrífuga 50 μL de diâmetro de 1 μm de diâmetro, contas de poliestireno não funcionalizadas (2,5% w/v em água) a 15.000 x g,25 °C por 5 min.
NOTA: Antes de encanar as contas, a solução de estoque deve ser brevemente vórtice no caso de as contas terem se acomodado no fundo da garrafa. - Descarte o supernaspeuta, deixando o mínimo de água restante possível.
NOTA: A água residual pode alterar as propriedades de evaporação da ressuspensão do etanol39,por isso a remoção de uma pequena quantidade de contas para remover toda a água é aceitável. - Resuspenque as contas da etapa 2.2 em 50 μL de 1:400 TritonX-100:etanol solvente. Pipeta para cima e para baixo várias vezes para misturar completamente as contas com o solvente.
NOTA: TritonX-100:o solvente de etanol deve ser selado com filme de parafina após o uso e preparado fresco uma vez por mês. As contas tendem a aderir às laterais de um vaso plástico, como um tubo de microcentrifuuge, de modo a pipeta ao longo dos lados para garantir que todas as contas sejam resuspendidas. - Para montar uma câmara de umidade para deposição, coloque 6 pratos de Petri, cada um com um tapa de cobertura, em um banco em uma linha com tampas ligeiramente entreabertas. Em cada prato, mova a mancha para a região aberta para que as manchas sejam expostas ao ambiente quando a umidade for aumentada na próxima etapa.
- Coloque um higrômetro e um pequeno ventilador elétrico centrado atrás das placas de Petri.
- Regisso da umidade relativa do ar inicial (RH) no laboratório. Encha um béquer de 200 mL com 150-200 mL de água ~75 °C e coloque-o atrás do ventilador.
- Ligue o ventilador e cubra as placas de Petri, ventilador, béquer e higrômetro com um recipiente de armazenamento plástico transparente e virado (66 cm x 46 cm x 38 cm).
- Deixe o RH na câmara subir para 70-75%, o que normalmente leva 5-10 min.
NOTA: Se o rh do laboratório ambiente estiver baixo (abaixo de ~50%), deixe a câmara atingir um RH maior, mas não superior a 80%, para compensar a perda de umidade durante o depoimento (veja abaixo). - Quando o RH atingir 70-75%, registo o RH e levante ligeiramente o recipiente de armazenamento plástico para colocar rapidamente as tampas nas placas de Petri, o que evita o excesso de molhar as tampas.
NOTA: A temperatura na câmara será ligeiramente mais quente que a temperatura ambiente, tipicamente 25-26 °C, como resultado da umidificação. Se a umidade é visível nas tampas, então as superfícies de vidro estão muito molhadas. Um porta-luvas comercial pode simplificar essa parte do protocolo. - Que o RH na câmara continue subindo para 85%. Nesse ponto, registe o RH na câmara de umidade e a pipeta 5 μL da suspensão da conta no centro de cada deslizamento de cobertura.
- Feche a câmara e as placas de Petri após cada depoimento para minimizar a perda de umidade. Objetivo de terminar todos os 6 depoimentos dentro de 2 minutos.
- Grave o RH na câmara após o depoimento.
NOTA: O RH após o depoimento ajudará a medir a rapidez com que a umidade foi perdida durante o depoimento, o que depende das condições do laboratório ambiente. Para uma corrida típica de sucesso, a câmara começará em 85% de RH antes do depoimento e terminará em 70-75% de RH após o depoimento. - Deixe as gotículas de contas se espalharem e secar por 5 minutos.
NOTA: Se os cristais coloidais têm muitos orifícios ou regiões multicamadas, então a câmara provavelmente estava muito úmida ou seca, respectivamente. Ajuste a umidade relativa do ar para fechar as placas de Petri e comece os depoimentos (veja a seção de resultados para maior discussão de otimização).
3. Ressarem as contas para reduzir o tamanho dos poros no modelo de cristal coloidal
- Para fornecer uma superfície de temperatura uniforme para a ressarição das contas de poliestireno, que estreita os interstícios entre contas e contorna os cantos dos interstícios, coloque uma placa de alumínio plana e moída em cima de uma placa quente de cerâmica padrão.
- Coloque a temperatura da placa quente para 107 °C, a temperatura de transição de vidro do poliestireno40.
NOTA: Para obter temperatura estável e precisa, uma sonda termopar foi mantida em um orifício de 2-3 mm de largura e 4−5 mm de profundidade na placa de alumínio. - Coloque uma mancha contendo o modelo de contas na placa de alumínio quente e anneal para 20 s (consulte a seção de discussão para explicação do tempo de fusão).
- Após o aquecimento, remova a tampa da placa de alumínio e coloque-a prontamente em outra superfície de alumínio de temperatura ambiente para esfriá-la.
NOTA: É útil ter as tampas penduradas ligeiramente sobre a borda da placa ou canais rasos do moinho (veja o vídeo que acompanha) na placa para facilitar a captação das tampas.
4. Nanofabricação de guias de onda de modo zero de alumínio usando o modelo de cristal coloidal
- Usando deposição evaporativa térmica ou de feixe de elétrons, deposite 300 nm de cobre a 2 Å/s sobre o modelo de cristal coloidal para gerar postes nos interstícios entre as contas.
- Remova o excesso de metal em cima das contas pressionando suavemente a superfície com fita. Descasque lentamente a fita para retirar o metal.
NOTA: Algumas pequenas manchas de excesso de metal reflexivo podem permanecer após a tração da fita, e estas podem muitas vezes ser removidas por um fluxo de gás N2. Se remendos substanciais de excesso de metal reflexivo permanecerem após a tração da fita, tente absorver os modelos em tolueno por 2h para dissolver parcialmente as contas de poliestireno. Lave as tampas com água destilada, seque com N2e repita a fita. O molho adicional não deve dissolver completamente as contas, pois as contas ajudam a proteger os postes de danos durante a tração da fita. - Para dissolver as contas de poliestireno, coloque os modelos de contas em tolueno e mergulhe durante a noite.
ATENÇÃO: A fumaça do tolueno pode ser tóxica. Trabalhe com tolueno sob um capô bem ventilado e use equipamentos de proteção pessoal, incluindo luvas, óculos de segurança e um jaleco. O tolueno deve ser armazenado em armários ventilados designados para líquidos inflamáveis. - Após a incubação do tolueno, enxágue os modelos uma vez com clorofórmio e duas vezes com etanol. As tampas da alça se aproximam cuidadosamente neste ponto porque os delicados postes de metal de 200-300 nm de altura estão agora expostos. Seque os modelos com N2 e remova polímeros residuais e contaminantes em um limpador de plasma de oxigênio por 30 minutos.
ATENÇÃO: Os vapores de clorofórmio podem ser tóxicos. Trabalhe com clorofórmio sob um capô bem ventilado e use equipamentos de proteção pessoal, incluindo luvas, óculos de segurança e um jaleco. O clorofórmio deve ser armazenado em armários ventilados longe de outros solventes inflamáveis. - Usando deposição evaporativa térmica ou de feixe de elétrons, deposite 3 nm de uma camada de adesão de titânio a 1 Å/s seguido por 100-150 nm de alumínio a 4 Å/s ao redor e em cima dos postes de cobre.
NOTA: Pode-se usar revestimentos mais grossos para obter guias mais profundos e melhor atenuação da fluorescência de fundo, mas isso também diminui o rendimento após expor e dissolver os postes na próxima etapa (veja a seção de discussão). - Para dissolver os postes metálicos, mergulhe as tampas em etchant de cobre (à base de ácido cítrico; Tabela de Materiais) por 2h.
ATENÇÃO: O etchant metálico pode causar queimaduras na pele. Trabalhe com etchants sob um capô bem ventilado e use equipamento de proteção. Lave bem as mãos após o manuseio. O etchant metálico deve ser armazenado em armários ventilados designados para líquidos corrosivos. - Enxágüe as tampas com água destilada, seque com N2, e polir suavemente a superfície do revestimento metálico com papel de lente para expor quaisquer postes que ainda estejam cobertos de revestimento. Coloque as tampas de volta em etchant de cobre por mais 2h, depois enxágue novamente com água destilada e seque com N2.
NOTA: Os slides ZMW devem ser armazenados em placas de Petri cobertas e limpas para mantê-los livres de contaminantes.
5. Nanofabricação de guias de onda do modo ouro zero usando o modelo de cristal coloidal
NOTA: O método para fabricar ZMWs de ouro(Figura Suplementar 1),que espelha o protocolo para fabricar ZMWs de alumínio, é fornecido nesta seção.
- Usando deposição evaporativa de feixe térmico ou elétron, deposite 3 nm de uma camada de adesão de titânio a 1 Å/s seguido por 300 nm de alumínio a 4 Å/s.
- Remova o excesso de metal em cima das contas pressionando suavemente a superfície com fita. Descasque lentamente a fita para retirar o metal.
- Para dissolver as contas de poliestireno, coloque os modelos de contas em tolueno e mergulhe durante a noite.
- Após a incubação do tolueno, enxágue os modelos uma vez com clorofórmio e duas vezes com etanol. Seque os modelos com N2 e remova contaminantes residuais em um limpador de plasma de oxigênio por 30 minutos.
- Usando deposição evaporativa de feixe térmico ou elétron, deposite 100-150 nm de ouro a 5 Å/s ao redor e em cima dos postes de alumínio.
- Para dissolver os postes metálicos, mergulhe as tampas em etchant de alumínio (à base de ácido fosfórico; Tabela de Materiais) por 1h.
- Enxágüe as tampas com água destilada, seque com N2, e polir suavemente a superfície do revestimento metálico com papel de lente para expor quaisquer postes que ainda estejam cobertos de revestimento. Coloque as tampas de volta em gravura de alumínio por 1h, depois enxágue novamente com água destilada e seque com N2.
NOTA: Os slides ZMW devem ser armazenados em placas de Petri cobertas e limpas.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
A automontagem das partículas coloidais de poliestireno através de sedimentação evaporativa (etapas 2.1−2.13) pode produzir uma série de resultados, uma vez que requer o controle da taxa de evaporação do solvente. No entanto, como os depoimentos são rápidos (10-15 min por rodada), o procedimento pode ser rapidamente otimizado para diferentes condições de laboratório ambiente. A Figura 3A mostra um modelo coloidal bem formado após deposição e evaporação. Macroscopicamente, a região das contas é circular, com bordas definidas por um anel opaco e multicamadas de contas. As regiões translúcidas, mas não brancas na imagem são as áreas de monocamadas desejadas. A Figura 3B mostra um modelo coloidal que foi embalado em um ambiente excessivamente úmido (80% de RH quando as placas de Petri foram fechadas). Esses modelos tendem a não ter um limite circular limpo e têm tendões multicamadas se estendendo para fora. A deposição é aceitável e pode ser usada em fases subsequentes, mas os orifícios na rede reduzem o número de áreas de matriz ZMW utilizáveis para imagem de molécula única. A Figura 3C mostra um modelo coloidal que foi embalado em um ambiente excessivamente seco (65% de RH quando as placas de Petri foram fechadas). Esses modelos são geralmente menores de diâmetro em comparação com os modelos ideais e bem divulgados. O depoimento pode ser usado, mas as regiões brancas multicamadas, que se espalham para dentro, reduzem a área utilizável para imagens. Assim, não recomendamos a realização de mais de 6 depoimentos de cada vez, uma vez que os depoimentos no final do processo ocorrerão em menor umidade à medida que a câmara for aberta e fechada. A Figura 3D mostra o padrão arco-íris produzido pela difração da luz refletida do cristal de poliestireno. Este padrão pode ser usado para confirmar o sucesso e a qualidade da embalagem de cristal por olho. A Figura 3E,F mostra imagens de microscopia de força atômica (AFM) de modelos coloidais bem embalados. Os defeitos entre os grãos decorrem de interferência durante a sedimentação evaporativa41, e grãos distintos podem ser vistos com um objetivo de 10x. Assim, examinar os depoimentos coloides com um microscópio de luz de baixa potência também pode ser usado para avaliar a embalagem.
Após a deposição de cobre nos modelos coloidais realados (etapa 4.1), o padrão de difração arco-íris ainda deve ser visível e aprimorado pelo revestimento metálico reflexivo dos topos das contas(Figura 4A,B). Os modelos perdem o padrão de difração do arco-íris reflexivo após a tração da fita escocesa (etapa 4.2) que remove o excesso de cobre(Figura 4C). A Figura 4D,E mostra imagens AFM de um campo típico de postes de cobre após a deposição metálica. Os defeitos entre os grãos de cristal coloidais na Figura 3E são visíveis nas imagens do posto de cobre como regiões maiores de cobre. A análise das imagens da AFM mostra que, para uma espessura de deposição de cobre de 300 nm, os postes de cobre eventuais têm média de 255 nm(Figura 4F)em altura e 121 nm de diâmetro(Figura 4G).
Deposição do revestimento de alumínio (etapa 4.5) onde as contas estavam e em cima dos postes de cobre, e dissolução subsequente dos postes (etapas 4.6 e 4.7) resultam nas ZMWs de alumínio mostradas na Figura 5A−C. Defeitos entre os grãos de cristal coloidais são visíveis como aberturas maiores(Figura 5B). A distância média entre os centros ZMW na Figura 5C é de 559 nm, consistente com o espaçamento definido pela geometria de embalagem próxima hexagonal das contas de 1 μm (  Utilizando modelos de poliestireno que foram álvias para 20 s resulta em guias de onda que têm em média 118 nm de diâmetro(Figura 5D,E),consistentes com os diâmetros do poste e suficientemente pequenos para cortar a propagação da luz visível. Um perfil de altura de um guia de onda da Figura 5D também mostra que ele tem ~120 nm de profundidade.
Utilizando modelos de poliestireno que foram álvias para 20 s resulta em guias de onda que têm em média 118 nm de diâmetro(Figura 5D,E),consistentes com os diâmetros do poste e suficientemente pequenos para cortar a propagação da luz visível. Um perfil de altura de um guia de onda da Figura 5D também mostra que ele tem ~120 nm de profundidade.
A única molécula FRET foi realizada nos ZMWs para testar a funcionalidade(Figura 6A). Um campo típico de ZMWs para imagens é mostrado na Figura 6B, que contém >3000 guias de onda em um campo de visão de 40 x 80 μm. Os ZMWs foram primeiro passivados usando protocolos descritos anteriormente42,43. Resumidamente, os ZMWs de alumínio foram passivados com poli (ácido fosfônico vinil) para revestir o revestimento de alumínio seguido de polietileno glicol (PEG) com PEG com biotina para revestir os fundos de vidro dos ZMWs. ZMWs dourados podem ser passivados com PEG derivado de thiol para revestir o revestimento de ouro seguido de um tratamento peg semelhante para o fundo do vidro. As câmaras de fluxo, ~20 μL volume, foram então construídas para imagem de molécula única44. A imagem fret de molécula única dos duplexes de DNA foi realizada como descrito anteriormente38. Resumidamente, 100 pM-1 nM de cianeina-3/cianeina-5 (Cy3/Cy5), duplexes de DNA biotinína (33 comprimentos de par de base) foram incubados por 10 minutos em canais de fluxo funcionalizados com streptavidina (incubação de 5 min, solução de 0,5 mg/mL). A concentração de macromoléculas rotuladas pode ser titulada para alcançar ~20% de carregamento dos guias de onda com uma molécula, levando a <5% de guias de onda carregados com mais de uma molécula, com base no carregamento distribuído poisson (a maioria dos guias de onda, ~75%, não terá moléculas)45. O DNA não vinculado foi lavado com tampão duplex sem nuclease seguido de tampão de iluminação (0,3% [w/v] glicose, 300 μg/mL de glicose oxidase, 120 μg/mL catalase e 1,5 mM Trolox [6-hidroxi-2,5,7,8-tetrametil-cromano-2-ácido carboxílico]). Duplexes de DNA não biotinínilados de Cy5 (33 comprimentos de par base) estavam presentes no buffer de iluminação em 0, 50, 100 e 500 nM como fluoroforos de fundo na solução. Traços fret de molécula única das moléculas de DNA duplex Cy3/Cy5 imobilizadas foram registrados com um microscópio TIRF personalizado ajustado a condições de epi-fluorescência. Os filmes foram gravados com uma abertura numérica de 1,48 (NA) objetivo de imersão em óleo de 100x com uma excitação alternada de 532 nm e 640 nm (exposição de 100 ms) e um divisor espectral de visão dupla para registrar a emissão de Cy3 e Cy5 simultaneamente em uma câmera de dispositivo acoplado por carga multiplicadora de elétrons (EMCCD). Traços fret de molécula única com delvejantes de passo único no canal Cy5 foram detectáveis em todas as concentrações do Ambiente Cy5 testado(Figura 6C−F). Em comparação, moléculas únicas só seriam detectáveis na iluminação TIRF com concentrações de fluoróforos de solução de nM a baixas46.

Figura 1: Esquema de guias de onda de modo zero. Diagrama da matriz ZMW com diagrama transversal expandido de um único ZMW à direita. Enzimas de interesse marcadas fluorescentes únicas (ribossomo marrom com círculo vermelho para representar corante fluorescente) quimicamente imobilizadas (através do mRNA neste exemplo) para o fundo de vidro dos ZMWs (tipicamente funcionalizadas com biotininged-PEG) podem ser imagens com uma configuração típica de microscopia de epifluorescência baseada a laser. A luz de excitação de 532 nm (setas verdes) é refletida no limite de vidro-metal devido ao pequeno tamanho da abertura (100-200 nm de diâmetro), mas uma onda evanescente não propagadora que decai exponencialmente em intensidade está presente dentro do ZMW. Isso resulta em uma profundidade de iluminação eficaz de 10-30 nm (sombreamento verde na abertura). Ligantes fluorescentes individuais (tRNAs azuis com círculos verdes como tags fluorescentes) em concentrações nM a μM são adicionados. Um ligante individual que se difunde na abertura e interage com a enzima é imageado sem fluorescência de fundo proibitiva. Clique aqui para ver uma versão maior desta figura.

Figura 2: Esquema do método de templating coloidal desenvolvido para fabricar matrizes ZMW de alumínio. As contas de poliestireno, de 1 μm de diâmetro, são depositadas e auto-montadas em uma mancha de vidro limpa, conforme descrito na seção 2 do protocolo. As contas são então resmadas para reduzir o tamanho dos poros (seção 3), seguidas pela deposição de cobre e dissolução de contas em tolueno. O alumínio é depositado ao redor e em cima dos postes de cobre, que são então seletivamente gravados para deixar para trás uma matriz hexagonal de nanoaperaturas (seção 4). Para os últimos três passos, as visualizações transversais são fornecidas à direita das visualizações do plano para mostrar as larguras e alturas dos postes de cobre e ZMWs de alumínio. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3: Resultados representativos da deposição evaporativa de coloides. (A) Exemplo de deposição coloide ideal. (B) Exemplo de um depoimento coloide aceitável em que as condições eram mais úmidas (80% de RH) do que o ideal. Buracos na monocameira de cristal são aparentes. (C) Exemplo de uma deposição coloide aceitável em que as condições eram mais secas (65% de RH) do que a ideal. As regiões da monocamada são ligeiramente translúcidas, enquanto as áreas multicamadas são brancas e opacas (perímetro e listras para dentro). (D) Um cristal coloidal iluminado com luz branca para destacar a difração do arco-íris dos cristais. (E) Imagem AFM (sonda de toque AFM no ar) de uma monocamada de contas de poliestireno hexagonalmente embaladas a partir de uma deposição coloida bem sucedida (barra de escala = 10 μm). (F) Imagem AFM expandida de contas embaladas (barra de escala = 2 μm). Clique aqui para ver uma versão maior desta figura.

Figura 4: Imagens macroscópicas e microscópicas dos modelos ZMW após a deposição de cobre. (A) Imagem de slides após evaporação física de cobre em cima dos modelos de contas. (B) Padrão de difração arco-íris a partir de modelos de contas após deposição de cobre. (C) Imagem de um modelo (à direita) após uma fita puxar para remover o excesso de cobre e a fita (esquerda). (D) Imagem AFM de postes de cobre após a tração da fita e a dissolução completa das contas de poliestireno (barra de escala = 5 μm). (E) Imagem AFM de ampliação mais elevada do painel D (barra de escala = 2 μm). (F) Histograma das alturas dos postes de cobre (definidas como medida de altura máxima dentro de cada poste), n = 534. (G) Histograma do pós de cobre Diâmetros feret, n = 201. O diâmetro de Feret é a distância máxima entre duas linhas paralelas tangentes ao limite pós(quantificado em ImageJ47). Para identificar partículas para análise, foi utilizado um limiar no meio do caminho entre o topo do revestimento e a superfície de vidro inferior. Clique aqui para ver uma versão maior desta figura.

Figura 5: Imagens macroscópicas e microscópicas de ZMWs de alumínio. (A) Imagem de slides após deposição evaporativa física de 150 nm de alumínio ao redor e em cima dos postes de cobre. (B) Imagem AFM de ZMWs de alumínio após a dissolução pós(barra de escala = 5 μm). (C) Imagem de ampliação mais elevada do painel B (barra de escala = 0,2 μm). (D) Perfil de profundidade típico de um ZMW individual do painel C. Perfil retirado da linha verde desenhada no painel C. (E) Histograma de diâmetros ZMW Feret, n = 240. Os diâmetros de Feret foram medidos como na Figura 4. Clique aqui para ver uma versão maior desta figura.

Figura 6: Imagem FRET de molécula única em ZMWs. (A) Esquema (para não escalar) de imagem fret de molécula única de Cy3, duplexes de DNA rotulados cy5 em ZMWs com duplexes rotulados Cy5 em segundo plano. (B) Campo de exemplo de ZMWs sob iluminação de luz branca (barra de escala = 10 μm). (C−F) Gravações fret de molécula única de duplexes de DNA imobilizados nos ZMWs na presença de duplexes rotulados 0 (C),50 (D),100 (E)e 500 nM (F) duplexes rotulados cy5 na solução. Para cada concentração, o painel superior mostra a intensidade de fluorescência Cy3 (verde) e Cy5 (vermelho) sob a iluminação laser de 532 nm (imagem FRET), o painel médio mostra a intensidade de fluorescência Cy5 sob a iluminação laser de 640 nm (excitação direta do aceitador), e o painel mais baixo mostra a eficiência DO FRET  () calculada a partir das fluorescências cy3 crua(ID) e Cy5(IA). Durante a imagem, o comprimento de onda de excitação alternava entre 532 e 640 nm a cada 100 ms. Por favor clique aqui para ver uma versão maior desta figura.
() calculada a partir das fluorescências cy3 crua(ID) e Cy5(IA). Durante a imagem, o comprimento de onda de excitação alternava entre 532 e 640 nm a cada 100 ms. Por favor clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Esquema do método de templating coloidal desenvolvido para fabricar matriz ZMW de ouro. O protocolo para fabricar o array ZMW de ouro é análogo ao protocolo para fabricar matriz ZMW dealumínio (Figura 2). Em vez de depositar cobre em cima das contas de poliestireno, o alumínio é depositado. Depois de dissolver as contas em tolueno, o ouro é depositado em vez de alumínio em cima dos postes. Os postes de alumínio são, então, gravados seletivamente para deixar para trás a matriz ZMW de ouro. Para as últimas três etapas, as visualizações transversais são fornecidas à direita das visualizações do plano para mostrar as larguras e alturas dos posts de alumínio e ZMWs dourados. Por favor, clique aqui para baixar este arquivo.
Figura Suplementar 2: Modelagem de elementos finitos de propagação de campo eletromagnético em ZMWs. (A−D) Seções transversais da magnitude do vetor Poynting mediano (W/m2) através de um guia de onda feito a partir de um modelo não-alizado (A,C) e um modelo enrugado (B,D). Ondas de plano eletromagnético polarizadas linearmente (1 W distribuídas sobre a área do slide) nos comprimentos de onda listados na figura (400 nm ou 1.000 nm) foram projetadas sobre a superfície inferior, e o modo mais baixo (fundamental), que tem o menor número de ondas, foi calculado usando software de modelagem(Tabela de Materiais)com o método de elemento finito para resolver as equações de Maxwell e condições de limites apropriadas. Os limites dos guias de onda foram assumidos como condutores elétricos perfeitos, que é bem aproximado por paredes de alumínio ou ouro. A seção transversal do modelo de guia de onda nãoannealado foi determinada pela embalagem hexagonal de círculos de 1 μm de diâmetro, e as pontas de três pontas da forma triangular resultante foram cortadas para ~60 nm de largura para modelar uma abertura física realista. A seção transversal dos modelos enaltados foi aproximada como um círculo de 130 nm de diâmetro. Ambos os guias de onda tinham uma profundidade de 130 nm, semelhante à profundidade do revestimento após a fabricação. (E,F) Além dos comprimentos de onda de excitação de 400 nm e 1.000 nm, os modelos foram resolvidos em 100 comprimentos de onda de excitação espaçados uniformemente entre 400 nm e 1.000 nm, e o índice de modo eficaz (definido como  , onde kz é o número de ondas no guia de onda, que é diminuído devido à restrição no plano transversal, e k é o número de onda de luz de excitação no vácuo) foi plotado contra o comprimento de onda de excitação para os guias de onda triangulares (E) e circular (F). Para comprimentos de onda mais curtos, modos mais altos são animados, e o índice de modo eficaz aumenta (o índice de modo efetivo máximo é 1, que é o caso limitante onde a onda de avião eletromagnético viaja sem limites na dimensão transversal). Os comprimentos de onda de corte efetivos dos guias de onda foram estimados como o comprimento de onda no qual o índice de modo efetivo cai para 0. Note que o corte deguia circular λ = 221 nm da modelagem de elementos finitos (F) é consistente com a previsão teórica do comprimento de onda de corte de um guia de onda circular (corte λ,analítica = 1,7d = 221 nm, onde d é o diâmetro do guia de onda). Clique aqui para baixar este arquivo.
, onde kz é o número de ondas no guia de onda, que é diminuído devido à restrição no plano transversal, e k é o número de onda de luz de excitação no vácuo) foi plotado contra o comprimento de onda de excitação para os guias de onda triangulares (E) e circular (F). Para comprimentos de onda mais curtos, modos mais altos são animados, e o índice de modo eficaz aumenta (o índice de modo efetivo máximo é 1, que é o caso limitante onde a onda de avião eletromagnético viaja sem limites na dimensão transversal). Os comprimentos de onda de corte efetivos dos guias de onda foram estimados como o comprimento de onda no qual o índice de modo efetivo cai para 0. Note que o corte deguia circular λ = 221 nm da modelagem de elementos finitos (F) é consistente com a previsão teórica do comprimento de onda de corte de um guia de onda circular (corte λ,analítica = 1,7d = 221 nm, onde d é o diâmetro do guia de onda). Clique aqui para baixar este arquivo.
Figura Suplementar 3: Resultados representativos da fabricação de Au ZMW. (A) Imagem macroscópica das matrizes ZMW de ouro. (B−D) Imagens AFM de postagens de alumínio de um modelo de contas que não foi ressarcido (B), um modelo que foi entubado a 107 °C para 20 s (C), e um modelo que foi entubado a 107 °C para 25 s (D). (E) Imagem AFM de ZMWs de ouro após dissolução de postes de alumínio. (F) Imagem AFM de ampliação mais alta do painel E. (G) Perfil de profundidade típico de um ZMW dourado. Perfil retirado da linha verde desenhada no painel F (barra de escala = 1 μm em B, C, De F; 5 μm em E). Clique aqui para baixar este arquivo.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Para o automontagem coloidal (seção de protocolo 2), o uso de etanol em vez de água à medida que o solvente de suspensão acelera o processo de evaporação para que os modelos estejam prontos em 2-3 minutos após a deposição em vez de 1−2 h como nos métodos anteriores48,49. O protocolo de sedimentação evaporativa apresentado aqui também é mais simples do que os protocolos de sedimentação anteriores que requerem o controle da inclinação da superfície, temperatura e volume de ar acima da suspensão49,50,51. A fração de volume de partículas utilizada neste protocolo é de 2,4%, superior à de 0,2-0,5% utilizada nos métodos de sedimentação anteriores48, que resuspended coloides em misturas de glicerol de água para escalas de tempo de liquidação muito mais longas. No entanto, a qualidade dos depoimentos é robusta para mudanças na fração de volume de partículas, com estudos anteriores descobrindo que ela pode ser variada entre 2-10%49,50,51. Os tamanhos de grãos dos cristais coloidais obtidos em um depoimento bem sucedido deste protocolo têm 20-30 μm de diâmetro, maiores que os grãos de métodos de sedimentação anteriores (tipicamente várias centenas de nanômetros de diâmetro)48,49. Macroscopicamente, as áreas de diâmetro de aproximadamente 2 cm de monocamadas coloidais também são comparáveis às áreas de 1 cm produzidas pelos métodos anteriores49. O grande tamanho dos modelos de cristal coloidais produzidos neste método também permite que 3-5 câmaras de fluxo separadas44, cada uma com cerca de 3-4 mm de largura, sejam feitas em cada slide ZMW. Assim, vários experimentos independentes de molécula única podem ser realizados em cada slide.
A correção dos modelos de contas coloidais (seção de protocolo 3) após a automontagem é um passo simples, mas crucial para reduzir suficientemente a fluorescência de fundo com os ZMWs. Como mostra a Figura Suplementar 2, o comprimento de onda de corte efetivo para um guia de onda com a seção transversal triangular de um modelo não-alado é de 894 nm. Em comparação, o comprimento de onda de corte efetivo para um guia de onda circular de 130 nm de diâmetro de um modelo enlatado é de 221 nm, conforme determinado analiticamente (1,7 vezes o diâmetro da guia18) e numericamente. O uso de contas menores para deposição também poderia reduzir o tamanho dos poros de modelo, mas os guias de onda seriam então espaçados mais perto de 200 nm, que é em torno do limite de difração da luz visível. Além disso, os guias de onda permaneceriam triangulares na seção transversal, o que leva à propagação de energia nãosemmétrica através do guia de ondas(Figura Suplementar 2A-D). Uma desvantagem da etapa de ressarem é que a variabilidade no tempo de fusão pode introduzir flutuações no diâmetro do guia de onda, de modo que o tempo preciso ajuda a minimizar a variação entre os lotes. Os interstícios começam a fechar em tempos de ressarcimento maiores que 25 s, e os pós-diâmetros não diminuem muito entre 20-25 s(Figura Suplementar 3B-D). Um teste rápido para o fechamento do interstício é verificar se os modelos ressarcidos ainda produzem um padrão de difração arco-íris quando iluminados com luz e vistos em um ângulo. Se não, a maioria dos interstícios provavelmente se fecharam. A relação entre o tempo de ressaramento e os diâmetros típicos dos poros foi apresentada anteriormente38.
Depois de atingir o tamanho dos poros desejado durante a etapa de ressaramento, o cobre é depositado (passo 4.1) nos modelos para criar uma sombra da máscara. É importante usar a linha de deposição de visão, com o metal se aproximando do modelo o mais perpendicularmente possível. Assim, aumentar a distância entre a amostra e a fonte metálica, bem como garantir que a placa que segura os modelos não esteja girando, como é feito automaticamente em algumas máquinas de deposição de vapor, ajudará a minimizar a deposição lateral de metal no substrato de poliestireno. No entanto, algum depoimento lateral é inevitável, o que reduz o tamanho do orifício intersticicial e, portanto, o pós-seção transversal à medida que mais metal é depositado52. Isso resulta em postes de metal piramiológico em vez de estruturas semelhantes aprismas 52.
Como os postes de cobre são provavelmente piramidais em vez de prisma, a deposição de alumínio (passo 4.5) em cima dos postes também cobre alguns dos lados inclinados, bloqueando a acessibilidade do etchant de cobre para alguns dos postes. Assim, a etapa de polimento do papel da lente (passo 4.7 ou 5.7) foi adicionada após o primeiro mergulho em etchant para interromper mecanicamente quaisquer postes de cobre ainda cobertos de alumínio. Depositar mais cobre para criar postagens mais altas também torna os posts mais suscetíveis à interrupção mecânica durante a polimento do papel da lente. No entanto, mais de 500 nm de cobre não devem ser depositados, uma vez que o objetivo da deposição é projetar o buraco intersticicial na linha média de 500 nm das contas de 1 μm.
Outra dificuldade potencial é a remoção não intencional do revestimento de alumínio durante a polimento do papel da lente (passo 4.7 ou 5.7). Verificou-se que a perda de revestimento de alumínio durante a polimento tornou-se mais frequente depois que a etapa de ressarcimento foi adicionada, provavelmente devido ao aumento do resíduo de poliestireno, que pode interferir na adesão do alumínio ao vidro (seção de protocolo 3). No entanto, o tolueno noturno soak (passo 4.3 ou 5.3) após a tração da fita resolveu este problema. Na imagem AFM na Figura 4E,alguns anéis residuais de poliestireno podem ser vistos entre os postes, mas o revestimento de alumínio ainda resistia a vários buffs na etapa 4.7. Se a perda do revestimento de alumínio continuar sendo um problema após o banho de tolueno durante a noite, uma lavagem RCA-1 (padrão limpo-1), lavagem de piranha ou limpeza adicional de plasma de oxigênio pode ser adicionada ao passo 4.4 ou 5.4. Estas etapas de lavagem também podem ser adicionadas após a etapa final de etch (passo 4.7 ou 5.7) e antes da passivação, a fim de limpar ainda mais os ZMWs.
O desempenho dos ZMWs em experimentos fret de molécula única foi semelhante ao dos ZMWs fabricados com EBL. Em um estudoanterior, 53 realizando uma única molécula FRET em Cy3 rotulada DNA único encalhado com proteína carregador de DNA cy5 rotulada em solução (o mesmo arranjo doador-aceitador como o da Figura 6A), os eventos FRET eram claramente perceptíveis em 100 nM Cy5 fundo, eram menos claros (menor sinal de rastreamento de aceitação ao ruído) a 1 μM, e não perceptíveis a 10 μM. Notamos que um estudo anterior com ZMWs comerciais relatou sinais de aceitadores fret de molécula única em concentrações de fundo de até 1 mM54, maior do que nós e outros estudos anteriores42,53 com ZMWs fabricados internamente. Mais discussão sobre o desempenho do sinal-para-fundo entre os ZMWs é dada em Jamiolkowski et al.38. A interação não específica da amostra fluorescente com as superfícies ZMW53 é um desafio comum que limita o acesso a concentrações mais altas, especialmente se a difusão de espécies fluorescentes em solução for uma grande macromolécula. Estudos com ZMWs em sistemas bioquímicos complexos, como a tradução, limitaram tipicamente concentrações de substrato fluorescentes livres a 100-250 nM55,56,57,58. Independentemente da aplicação pretendida dos ZMWs, a otimização dos métodos de passivação para diferentes sistemas provavelmente será necessária para manter o sinal aceitável ao ruído em altas concentrações.
No geral, o método aqui apresentado não requer habilidades ou equipamentos especializados, permite a fabricação paralela de muitos modelos ao mesmo tempo, e pode ser adaptado para fabricar ZMWs em diferentes metais. Neste trabalho, o cobre e o alumínio foram substituídos por alumínio e ouro, respectivamente, para fabricação de ZMWs de ouro (Figura Suplementar 3). Isso é vantajoso para laboratórios que usam métodos de passivação de ouro em vez de alumínio. Além disso, as ZMWs de ouro têm sido demonstradas para aumentar a emissão de fluoroforos que absorvem na região vermelha do espectro visível, enquanto os ZMWs de alumínio aumentam a emissão de fluoroforos que absorvem na região verde59. No futuro, a intensidade do sinal fluorescente de ZMWs fabricadas com este método pode ser aumentada por gravura no vidro abaixo do revestimento metálico ZMW usando HF16,26,60. Isso traz as biomoléculas imobilizadas mais longe das paredes metálicas, que podem saciar fluoroforos61. Além disso, há uma intensidade máxima de iluminação de excitação abaixo da entrada da abertura, e isso tem sido explorado anteriormente para aumentar a emissão de molécula única26,60.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Os autores não têm nada a revelar.
Acknowledgments
Este trabalho foi apoiado pelas bolsas NIH R01GM080376, R35GM118139 e NSF Center for Engineering MechanoBiology CMMI: 15-48571 a Y.E.G., e por uma bolsa de pré-doutorado da NIAID F30AI114187 a R.M.J.
Materials
| Name | Company | Catalog Number | Comments |
| 1. Glass Coverslip Cleaning | |||
| Acetone | Sigma | 32201 | 1 L |
| Coplin glass staining jar | Fisher Scientific | 08-817 | Staining jar with 8 grooves and molded glass cover |
| Coverslips | VWR | 48404-467 | 24 mm x 30 mm (No.1½, Rectangular) |
| Ethanol | Sigma | E7023 | 1 L |
| KOH | Sigma | 30603 | Potassium hydroxide |
| Petri dishes | Fisher Scientific | R80115TS | 100 mm diameter, 15 mm deep |
| Sonicator | Branson | Z245143 | Tabletop ultrasonic cleaner, 5510 |
| 2. Evaporative Deposition of Polystyrene Beads | |||
| Clear storage container | Fisher Scientific | 50-110-8222 | 26 x 18 x 15 in. |
| Desk fan | O2Cool | FD05001A | Any small desk (~5 in.) fan will work |
| Glass beaker | Fisher Scientific | 02-555-25B | 250 mL |
| Humidity meter | Fisher Scientific | 11-661-19 | |
| Microcentrifuge tubes | Fisher Scientific | 21-402-903 | 1.5 mL |
| Polystyrene microspheres | Polysciences | 18602-15 | 1.00 µm diameter, non-functionalized |
| Triton X-100 deturgent | Sigma | X100 | 100 mL |
| 3. Bead Annealing for Reducing Pore Size in the Colloidal Crystal Template | |||
| Aluminum plate | Fisher Scientific | AA11062RY | Customized in-house to 14 cm x 14 cm |
| Ceramic hotplate | Fisher Scientific | HP88857100 | 13 x 8.2 x 3.8 in. |
| Temperature controller | McMaster-Carr | 38615K71 | Read temperature with thermocouple probe |
| Thermocouple probe | McMaster-Carr | 9251T93 | Type K, surface probe |
| 4/5. Nanofabrication of Zero Mode Waveguides Using the Colloidal Crystal Template | |||
| Aluminum etchant | Transene | Type A | |
| Aluminum pellets | Kurt J. Lesker | EVMAL40QXHB | For electron beam evaporation |
| Chloroform | Sigma | 288306 | 1 L |
| Copper etchant | Transene | 49-1 | |
| Copper pellets | Kurt J. Lesker | EVMCU40QXQA | For electron beam evaporation |
| Gold pellets | Kurt J. Lesker | EVMAUXX40G | For electron beam evaporation |
| Lens paper | Thorlabs | MC-5 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Scotch tape | Staples | MMM119 | |
| Thin film deposition system | Kurt J. Lesker | PVD-75 | Tabletop thermal evaporation system will also work |
| Titanium pellets | Kurt J. Lesker | EVMTI45QXQA | For electron beam evaporation |
| Toluene | Sigma | 244511 | 1 L |
| Representative Results | |||
| COMSOL Multiphysics Modeling Software | COMSOL, Inc. | ||
| Dual View spectral splitter | Photometrics, Inc. |
References
- Kapanidis, A. N., et al. Initial transcription by RNA polymerase proceeds through a DNA-scrunching mechanism. Science. 314 (5802), 1144-1147 (2006).
- Santoso, Y., et al. Conformational transitions in DNA polymerase I revealed by single-molecule FRET. Proceedings of the National Academy of Sciences of the United States of America. 107 (2), 715-720 (2010).
- Herbert, K. M., Greenleaf, W. J., Block, S. M. Single-molecule studies of RNA polymerase: motoring along. Annual Review of Biochemistry. 77, 149-176 (2008).
- Chen, C., et al. Dynamics of translation by single ribosomes through mRNA secondary structures. Nature Structural & Molecular Biology. 20 (5), 582-588 (2013).
- Chen, C., et al. Single-molecule fluorescence measurements of ribosomal translocation dynamics. Molecular Cell. 42 (3), 367-377 (2011).
- Jamiolkowski, R. M., Chen, C., Cooperman, B. S., Goldman, Y. E. tRNA Fluctuations Observed on Stalled Ribosomes Are Suppressed during Ongoing Protein Synthesis. Biophysical Journal. 113 (11), 2326-2335 (2017).
- Myong, S., Stevens, B. C., Ha, T. Bridging Conformational Dynamics and Function Using Single-Molecule Spectroscopy. Structure. 14 (4), 633-643 (2006).
- Martin-Fernandez, M. L., Tynan, C. J., Webb, S. E. A 'pocket guide' to total internal reflection fluorescence. Journal of Microscopy. 252 (1), 16-22 (2013).
- Holzmeister, P., Acuna, G. P., Grohmann, D., Tinnefeld, P. Breaking the concentration limit of optical single-molecule detection. Chemical Society Reviews. 43 (4), 1014-1028 (2014).
- Scheer, M., et al. BRENDA, the enzyme information system in 2011. Nucleic Acids Research. 39, 670-676 (2011).
- Kudva, R., et al. Protein translocation across the inner membrane of Gram-negative bacteria: the Sec and Tat dependent protein transport pathways. Research in Microbiology. 164 (6), 505-534 (2013).
- Talkad, V., Schneider, E., Kennell, D. Evidence for variable rates of ribosome movement in Escherichia coli. Journal of Molecular Biology. 104 (1), 299-303 (1976).
- Blanchard, S. C., Kim, H. D., Gonzalez, R. L., Puglisi, J. D., Chu, S. tRNA dynamics on the ribosome during translation. Proceedings of the National Academy of Sciences of the United States of America. 101 (35), 12893-12898 (2004).
- Dunkle, J. A., et al. Structures of the bacterial ribosome in classical and hybrid states of tRNA binding. Science. 332 (6032), 981-984 (2011).
- Kim, H. D., Puglisi, J. D., Chu, S. Fluctuations of transfer RNAs between classical and hybrid states. Biophysical Journal. 93 (10), 3575-3582 (2007).
- Levene, M. J., et al. Zero-mode waveguides for single-molecule analysis at high concentrations. Science. 299 (5607), 682-686 (2003).
- Zhu, P., Craighead, H. G. Zero-mode waveguides for single-molecule analysis. Annual Review of Biophysics. 41, 269-293 (2012).
- Pollack, G. L., Stump, D. R. Electromagnetism. , Addison-Wesley. Boston, MA. (2002).
- Jackson, J. D. Classical electrodynamics. Third edition. , Wiley. New York, NY. (1999).
- Crouch, G. M., Han, D., Bohn, P. W. Zero-mode waveguide nanophotonic structures for single molecule characterization. Journal of Physics D: Applied Physics. 51 (19), 193001 (2018).
- Wenger, J., et al. Dual-color fluorescence cross-correlation spectroscopy in a single nanoaperture: towards rapid multicomponent screening at high concentrations. Optics Express. 14 (25), 12206-12216 (2006).
- Goldschen-Ohm, M. P., et al. Structure and dynamics underlying elementary ligand binding events in human pacemaking channels. eLife. 5, 20797 (2016).
- Miyake, T., et al. Real-Time Imaging of Single-Molecule Fluorescence with a Zero-Mode Waveguide for the Analysis of Protein-Protein Interaction. Analytical Chemistry. 80 (15), 6018-6022 (2008).
- Zhao, J., Branagan, S. P., Bohn, P. W. Single-Molecule Enzyme Dynamics of Monomeric Sarcosine Oxidase in a Gold-Based Zero-Mode Waveguide. Applied Spectroscopy. 66 (2), 163-169 (2012).
- Fore, S., Yuen, Y., Hesselink, L., Huser, T. Pulsed-interleaved excitation FRET measurements on single duplex DNA molecules inside C-shaped nanoapertures. Nano Letters. 7 (6), 1749-1756 (2007).
- Rigneault, H., et al. Enhancement of single-molecule fluorescence detection in subwavelength apertures. Physical Review Letters. 95 (11), 117401 (2005).
- Foquet, M., et al. Improved fabrication of zero-mode waveguides for single-molecule detection. Journal of Applied Physics. 103 (3), 034301 (2008).
- Wada, J., et al. Fabrication of Zero-Mode Waveguide by Ultraviolet Nanoimprint Lithography Lift-Off Process. Japanese Journal of Applied Physics. 50 (6), 06 (2011).
- Fischer, U. C., Zingsheim, H. P. Submicroscopic pattern replication with visible light. Journal of Vacuum Science and Technology. 19 (4), 881-885 (1981).
- Deckman, H. W., Dunsmuir, J. H. Natural lithography. Applied Physics Letters. 41 (4), 377-379 (1982).
- Li, B., Zhou, D., Han, Y. Assembly and phase transitions of colloidal crystals. Nature Reviews Materials. 1 (2), 15011 (2016).
- Bohn, J. J., Tikhonov, A., Asher, S. A. Colloidal crystal growth monitored by Bragg diffraction interference fringes. Journal of Colloid and Interface Science. 350 (2), 381-386 (2010).
- Dimitrov, A. S., Nagayama, K. Continuous Convective Assembling of Fine Particles into Two-Dimensional Arrays on Solid Surfaces. Langmuir. 12 (5), 1303-1311 (1996).
- Pisco, M., et al. Nanosphere lithography for optical fiber tip nanoprobes. Light: Science & Applications. 6 (5), 16229 (2017).
- Chandramohan, A., et al. Model for large-area monolayer coverage of polystyrene nanospheres by spin coating. Scientific Reports. 7, 40888 (2017).
- Besra, L., Liu, M. A review on fundamentals and applications of electrophoretic deposition (EPD). Progress in Materials Science. 52 (1), 1-61 (2007).
- Yu, J., et al. Preparation of High-Quality Colloidal Mask for Nanosphere Lithography by a Combination of Air/Water Interface Self-Assembly and Solvent Vapor Annealing. Langmuir. 28 (34), 12681-12689 (2012).
- Jamiolkowski, R. M., et al. Nanoaperture fabrication via colloidal lithography for single molecule fluorescence analysis. PLoS ONE. 14 (10), 0222964 (2019).
- Innocenzi, P., et al. Evaporation of Ethanol and Ethanol-Water Mixtures Studied by Time-Resolved Infrared Spectroscopy. The Journal of Physical Chemistry A. 112 (29), 6512-6516 (2008).
- Rieger, J. The glass transition temperature of polystyrene. Journal of Thermal Analysis. 46 (3), 965-972 (1996).
- Donev, A., Torquato, S., Stillinger, F. H., Connelly, R. Jamming in hard sphere and disk packings. Journal of Applied Physics. 95 (3), 989-999 (2004).
- Kinz-Thompson, C. D., et al. Robustly Passivated, Gold Nanoaperture Arrays for Single-Molecule Fluorescence Microscopy. ACS Nano. 7 (9), 8158-8166 (2013).
- Korlach, J., et al. Selective aluminum passivation for targeted immobilization of single DNA polymerase molecules in zero-mode waveguide nanostructures. Proceedings of the National Academy of Sciences of the United States of America. 105 (4), 1176-1181 (2008).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. Journal of Visualized Experiments. (86), e50549 (2014).
- Plénat, T., Yoshizawa, S., Fourmy, D. DNA-Guided Delivery of Single Molecules into Zero-Mode Waveguides. ACS Applied Materials & Interfaces. 9 (36), 30561-30566 (2017).
- Kudalkar, E. M., Davis, T. N., Asbury, C. L. Single-Molecule Total Internal Reflection Fluorescence Microscopy. Cold Spring Harbor protocols. 2016 (5), 077800 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Hoogenboom, J. P., Derks, D., Vergeer, P., Blaaderen, A. v Stacking faults in colloidal crystals grown by sedimentation. The Journal of Chemical Physics. 117 (24), 11320-11328 (2002).
- Micheletto, R., Fukuda, H., Ohtsu, M. A Simple Method for the Production of a Two-Dimensional, Ordered Array of Small Latex Particles. Langmuir. 11 (9), 3333-3336 (1995).
- Denkov, N., et al. Mechanism of formation of two-dimensional crystals from latex particles on substrates. Langmuir. 8 (12), 3183-3190 (1992).
- Okubo, T. Convectional, sedimentation and drying dissipative patterns of colloidal crystals of poly(methyl methacrylate) spheres on a watch glass. Colloid and Polymer Science. 286 (11), 1307-1315 (2008).
- Ye, S., Routzahn, A. L., Carroll, R. L. Fabrication of 3D Metal Dot Arrays by Geometrically Structured Dynamic Shadowing Lithography. Langmuir. 27 (22), 13806-13812 (2011).
- Zhao, Y., et al. Dark-Field Illumination on Zero-Mode Waveguide/Microfluidic Hybrid Chip Reveals T4 Replisomal Protein Interactions. Nano Letters. 14 (4), 1952-1960 (2014).
- Goldschen-Ohm, M. P., White, D. S., Klenchin, V. A., Chanda, B., Goldsmith, R. H. Observing Single-Molecule Dynamics at Millimolar Concentrations. Angewandte Chemie International Edition. 56 (9), 2399-2402 (2017).
- Noriega, T. R., Chen, J., Walter, P., Puglisi, J. D. Real-time observation of signal recognition particle binding to actively translating ribosomes. eLife. 3, 04418 (2014).
- Uemura, S., et al. Real-time tRNA transit on single translating ribosomes at codon resolution. Nature. 464 (7291), 1012-1017 (2010).
- Choi, J., Puglisi, J. D. Three tRNAs on the ribosome slow translation elongation. Proceedings of the National Academy of Sciences of the United States of America. 114 (52), 13691-13696 (2017).
- Eid, J., et al. Real-Time DNA Sequencing from Single Polymerase Molecules. Science. 323 (5910), 133-138 (2009).
- Martin, W. E., Srijanto, B. R., Collier, C. P., Vosch, T., Richards, C. I. A Comparison of Single-Molecule Emission in Aluminum and Gold Zero-Mode Waveguides. The Journal of Physical Chemistry A. 120 (34), 6719-6727 (2016).
- Wenger, J., et al. Single molecule fluorescence in rectangular nano-apertures. Optics Express. 13 (18), 7035-7044 (2005).
- Pineda, A. C., Ronis, D. Fluorescence quenching in molecules near rough metal surfaces. The Journal of Chemical Physics. 83 (10), 5330-5337 (1985).
Tags
Bioengenharia Edição 159 guias de onda de modo zero nano-abertura fluorescência de molécula única litografia de nanosfera cristal coloidal auto-montagemErratum
Formal Correction: Erratum: Fabrication of Zero Mode Waveguides for High Concentration Single Molecule Microscopy
Posted by JoVE Editors on 08/10/2021.
Citeable Link.
An erratum was issued for: Fabrication of Zero Mode Waveguides for High Concentration Single Molecule Microscopy. A figure was updated.
Figure 3 was updated from:
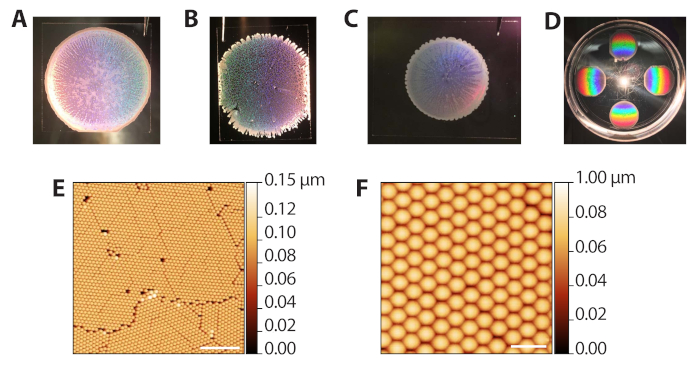
Figure 3: Representative results from evaporative deposition of colloids. (A) Example of optimal colloid deposition. (B) Example of an acceptable colloid deposition in which conditions were more humid (80% RH) than ideal. Holes in the crystal monolayer are apparent. (C) Example of an acceptable colloid deposition in which conditions were drier (65% RH) than optimal. The monolayer regions are slightly translucent while multilayered areas are white and opaque (perimeter and streaks inward). (D) A colloidal crystal illuminated with white light to highlight the rainbow diffraction from the crystals. (E) AFM image (tapping probe AFM in air) of a monolayer of hexagonally packed polystyrene beads from a successful colloid deposition (scale bar = 10 µm). (F) Expanded AFM image of packed beads (scale bar = 2 µm). Please click here to view a larger version of this figure.
to:
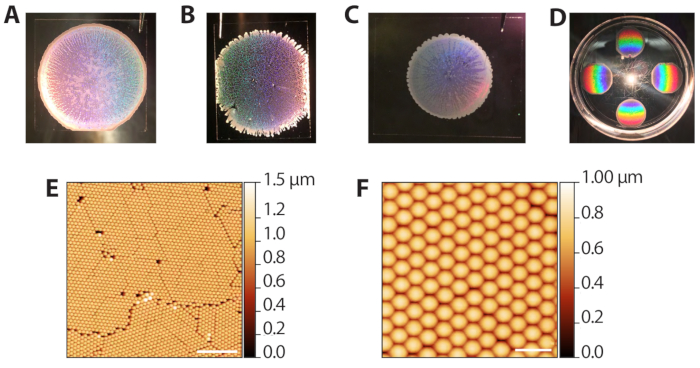
Figure 3: Representative results from evaporative deposition of colloids. (A) Example of optimal colloid deposition. (B) Example of an acceptable colloid deposition in which conditions were more humid (80% RH) than ideal. Holes in the crystal monolayer are apparent. (C) Example of an acceptable colloid deposition in which conditions were drier (65% RH) than optimal. The monolayer regions are slightly translucent while multilayered areas are white and opaque (perimeter and streaks inward). (D) A colloidal crystal illuminated with white light to highlight the rainbow diffraction from the crystals. (E) AFM image (tapping probe AFM in air) of a monolayer of hexagonally packed polystyrene beads from a successful colloid deposition (scale bar = 10 µm). (F) Expanded AFM image of packed beads (scale bar = 2 µm). Please click here to view a larger version of this figure.



