ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Aquí se describe un método de litografía de la nanoesfera para la fabricación paralela de guías de onda de modo cero, que son matrices de nanoaperturas en un cubrebocas de microscopía de vidrio revestido de metal para imágenes de una sola molécula en concentraciones nano a micromolar de fluoróforos. El método aprovecha el autoensamblaje de cristal coloidal para crear una plantilla de guía de onda.
Abstract
En la enzimología de fluorescencia de molécula única, la fluorescencia de fondo de sustratos etiquetados en solución a menudo limita la concentración de fluoróforos a rangos pico- a nanomolares, varios órdenes de magnitud menos que muchas concentraciones fisiológicas de ligandos. Las nanoestructuras ópticas llamadas guías de onda de modo cero (ZMWs), que son aperturas de 100−200 nm de diámetro fabricadas en un metal conductor delgado como el aluminio o el oro, permiten obtener imágenes de moléculas individuales a concentraciones micromolares de fluoróforos al limitar la excitación de la luz visible a volúmenes efectivos de zeptolitros. Sin embargo, la necesidad de equipos de nanofabricación costosos y especializados ha impedido el uso generalizado de ZMWs. Por lo general, las nanoestructuras como ZMWs se obtienen por escritura directa utilizando litografía de haz de electrones, que es secuencial y lenta. Aquí, la litografía coloidal o nanoesfera se utiliza como una estrategia alternativa para crear máscaras a escala nanométrica para la fabricación de guías de onda. Este informe describe el enfoque en detalle, con consideraciones prácticas para cada fase. El método permite que miles de ZMWs de aluminio u oro se hagan en paralelo, con diámetros de guía de onda finales y profundidades de 100−200 nm. Solo se requiere un equipo de laboratorio común y un evaporador térmico para la deposición de metales. Al hacer que los ZMWs sean más accesibles para la comunidad bioquímica, este método puede facilitar el estudio de los procesos moleculares a concentraciones y tasas celulares.
Introduction
Las técnicas de molécula única como la transferencia de energía de resonancia de fluorescencia de molécula única (smFRET) o la espectroscopia de correlación de fluorescencia de molécula única (FCS) son herramientas poderosas para la biofísica molecular, permitiendo el estudio de movimientos dinámicos, conformaciones e interacciones de biomoléculas individuales en procesos como la transcripción1,2,3,traducción4,5,6,y muchos otros7. Para smFRET, la microscopía de fluorescencia de reflexión interna total (TIRF) es un método común porque muchas moléculas atados pueden seguirse con el tiempo, y la onda evanescente generada por TIR se limita a una región de 100−200 nm adyacente a la cubierta8. Sin embargo, incluso con esta restricción en el volumen de excitación, los fluoróforos de interés todavía necesitan ser diluidos a rangos de pM o nM para detectar señales de una sola molécula por encima de la fluorecencia de fondo9. Dado que las constantes de Michaelis-Menten de las enzimas celulares están típicamente en el rango de μM a mM10,las reacciones bioquímicas en los estudios de moléculas individuales suelen ser mucho más lentas que las de la célula. Por ejemplo, la síntesis de proteínas ocurre a 15−20 aminoácidos por segundo en E. coli11,12,mientras que la mayoría de los ribosomas procariotas en experimentos smFRET se traducen a 0,1−1 aminoácidos por segundo13. En la síntesis de proteínas, las estructuras cristalinas y smFRET en ribosomas estancados mostraron que los ARN de transferencia (ARNt) fluctúan entre los estados 'híbrido' y 'clásico' antes de la etapa de translocación de ARNt-ARNm14,15. Sin embargo, cuando las concentraciones fisiológicas del factor de translocación GTPasa, EF-G, estuvo presente, se observó una conformación diferente, intermedia entre los estados híbrido y clásico, en smFRET6. El estudio de procesos moleculares dinámicos a tasas y concentraciones similares a las de la célula es importante, pero sigue siendo un desafío técnico.
Una estrategia para aumentar la concentración de sustrato fluorescente es el uso de aperturas de longitud de onda sub-visibles basadas en metal, llamadas guías de onda de modo cero (ZMWs), para generar campos de excitación confinados que excitan selectivamente las biomoléculas localizadas dentro de las aperturas16 (Figura 1). Las aperturas son típicamente 100−200 nm de diámetro y 100−150 nm de profundidad17. Por encima de una longitud de onda de corte relacionada con el tamaño y la forma de los pozos (λc ≈ 2,3 veces el diámetro para las guías de onda circulares con agua como el medio dieléctrico18),no se permiten modos de propagación en la guía de onda, de ahí el término guías de onda de modo cero. Sin embargo, un campo electromagnético oscilante, denominado onda evanescente, que decae exponencialmente en intensidad todavía hace túneles a corta distancia en la guía de onda18,19. Aunque son similares a las ondas evanescentes TIR, las ondas evanescentes ZMW tienen una constante de decaimiento más corta, lo que resulta en una región de excitación efectiva de 10−30 nm dentro de la guía de onda. En las concentraciones micromolares de ligands fluorescente etiquetados, solamente una o algunas moléculas están simultáneamente presentes dentro de la región de la excitación. Esta restricción del volumen de excitación y la consiguiente reducción de la fluorescencia de fondo permite la obtención de imágenes de fluorescencia de moléculas individuales a concentraciones biológicamente relevantes. Esto se ha aplicado a muchos sistemas20,incluyendo mediciones fcs de difusión de proteína única21,mediciones fret de molécula única de ligando de bajaafinidad-proteína 22 e interacciones proteína-proteína23,y mediciones espectro-electroquímicas de eventos de recambio molecular único24.
Los ZMWs se han producido modelando directamente una capa metálica utilizando fresado de haz de iones25,26 o litografía de haz de electrones (EBL) seguida de grabado por plasma16,27. Estos métodos de litografía sin máscara crean guías de onda en serie y normalmente requieren acceso a instalaciones especializadas de nanofabricación, lo que impide la adopción generalizada de la tecnología ZMW. Otro método, la litografía ultravioleta nanoimprint lift-off28, utiliza un molde de deslizamiento de cuarzo para presionar una plantilla ZMW inversa sobre una película de resistencia como un sello. Si bien este método es más simplificado, todavía requiere EBL para la fabricación del molde de cuarzo. Este artículo presenta el protocolo para un método de fabricación con plantilla simple y económico que no requiere EBL o fresado de haz de iones y se basa en el cierre de embalaje de nanoesferas para formar una máscara litográfica.
La nanoesfera o litografía "natural", que fue propuesta por primera vez en 1982 por Deckman y Dunsmuir29,30,utiliza el autoensamblaje de partículas coloidales monodisperse, que van desde decenas de nanómetros hasta decenas de micrómetros31,para crear plantillas para el modelado de superficies a través de grabado y / o deposición de materiales. Las matrices periódicas extendidas bidimensionales (2D) o tridimensionales (3D) de partículas coloidales, denominadas cristales coloidales, se caracterizan por una iridiscencia brillante de dispersión y difracción32. Aunque se utiliza menos que el haz de electrones o la fotolitografía, esta metodología de enmascaramiento es simple, de bajo costo y se reduce fácilmente para crear tamaños de entidad por debajo de 100 nm.
Dirigir el autoensamblaje de partículas coloidales determina el éxito del uso de cristales coloidales como máscaras para el modelado de superficies. Si el tamaño y la forma de las partículas son homogéneos, las partículas coloidales pueden autoensamblarse fácilmente con empaquetamiento hexagonal, impulsado por el agotamiento entrómico33. La evaporación del agua después del recubrimiento de gota es una ruta efectiva para sedimentar las partículas coloidales, aunque otros métodos incluyen el recubrimiento por inmersión34,el recubrimiento de espín35,la deposición electroforética36y la consolidación en una interfaz aire-agua37. El protocolo que se presenta a continuación se basa en el método de sedimentación por evaporación, que fue el más sencillo de implementar. Los intertices triangulares entre perlas de poliestireno empaquetadas de cerca forman aberturas en las que platear un metal de sacrificio, formando postes (Figura 2 y Figura suplementaria 1). El breve recocido de las cuentas antes de este paso ajusta la forma y el diámetro de estos postes. Se retiran las cuentas, se deposita una capa de metal final alrededor de los postes y luego se retiran los postes. Después de que los dos pasos de deposición de metal en la nanomáscara coloidal, la eliminación de los postes intermedios, y la modificación de la química de la superficie para la pasivación y el atado, matrices ZMW están listas para su uso para la obtención de imágenes de una sola molécula. Una caracterización más extensa de las propiedades ópticas de ZMW después de la fabricación se puede encontrar en un artículoadjunto 38. Además de un evaporador térmico para la deposición de vapor de los metales, no se requieren herramientas especializadas.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
NOTA: Todos los pasos se pueden completar en el espacio de laboratorio general.
1. Limpieza de cubrebocas de vidrio
- Para proporcionar una superficie limpia para la deposición evaporativa de partículas coloidales, coloque 24 x 30 mm de tapas de vidrio de borosilicato óptico (0,16−0,19 mm de espesor) dentro de las inserciones acanaladas de un frasco de tinción de vidrio coplin para su limpieza.
NOTA: Asegúrese de que las tapas estén erguidas y bien separadas para que todas las superficies estén claramente expuestas durante el proceso de limpieza. - Vierta suficiente acetona en el frasco de tinción para cubrir las cubiertas, coloque la cubierta y sonice durante 10 minutos a 40 ° C.
- Vierta la acetona y enjuague las tapas llenando el frasco de tinción con H2O destilado y vertiendo el agua. Repita 2 veces más.
- Repita la sonicación de acetona (pasos 1.2 y 1.3) una vez más.
- Vierta suficiente KOH de 200 mM en el frasco para cubrir los cubrebocas y sonicar, cubierto, durante 20 minutos a 40 ° C.
NOTA: El KOH graba ligeramente el vidrio. - Enjuague los cubrebocas con H2O destilado 6 veces.
- Agregue etanol para cubrir las cubiertas, agregue la tapa y sonice durante 10 minutos a 40 ° C.
- Enjuague los cubrebocas con H2O 3 veces destilado.
- Recoja cada cubrebocas en el borde usando pórceps suaves y seque las cubiertas con gas N2. Toque sólo los bordes de la cubierta. Coloque cada uno de los cubrebocas secos y limpios en una placa de Petri limpia individual.
2. Deposición evaporativa de perlas de poliestireno
- Para crear la máscara de cristal coloidal para la matriz ZMW, centrífuga 50 μL de 1 μm de diámetro, perlas de poliestireno no funcionalizadas (2,5% p/v en agua) a 15.000 x g,25 °C durante 5 min.
NOTA: Antes de pipetear las perlas, la solución común debe ser brevemente vórtice en caso de que las cuentas se hayan asentado en el fondo de la botella. - Deseche el sobrenadante, dejando la menor agua restante posible.
NOTA: El agua residual puede cambiar las propiedades de evaporación de la resuspensión de etanol39,por lo que la eliminación de una pequeña cantidad de perlas para eliminar toda el agua es aceptable. - Resuspend las cuentas del paso 2.2 en 50 μL de 1:400 TritonX-100:solvente de etanol. Pipetear hacia arriba y hacia abajo varias veces para mezclar a fondo las cuentas con el disolvente.
NOTA: TritonX-100: el disolvente de etanol debe sellado con película de parafina después de su uso y prepararse fresco una vez al mes. Las cuentas tienden a adherirse a los lados de un recipiente de plástico, como un tubo de microcentrífuga, por lo que la pipeta a lo largo de los lados para asegurarse de que todas las cuentas se resuspended. - Para configurar una cámara de humedad para la deposición, coloque 6 placas de Petri, cada una con un cubrebocas, en un banco en una línea con tapas ligeramente entreabiertas. En cada plato, mueva el cubrebocas a la región abierta para que los cubrebocas se expongan al ambiente cuando la humedad aumente en el siguiente paso.
- Coloque un higrómetro y un pequeño ventilador eléctrico centrado detrás de las placas de Petri.
- Registre la humedad relativa inicial (RH) en el laboratorio. Llene un beaker de 200 mL con 150−200 mL de agua de ~75 °C y colóquelo detrás del ventilador.
- Encienda el ventilador y cubra las placas de Petri, el ventilador, el casto y el higrómetro con un recipiente de almacenamiento de plástico transparente y volcado (66 cm x 46 cm x 38 cm).
- Deje que el DERECHO en la cámara se eleve a 70−75%, lo que típicamente toma 5−10 min.
NOTA: Si el RH del laboratorio ambiental es bajo (por debajo de ~ 50%), deje que la cámara alcance un RH más alto, pero no superior al 80%, para compensar la pérdida de humedad durante la deposición (ver más abajo). - Cuando el RH alcance el 70−75%, registre el RH y levante ligeramente el recipiente de almacenamiento de plástico para colocar rápidamente las cubiertas en las placas de Petri, lo que evita la humectación excesiva de los cubrebocas.
NOTA: La temperatura en la cámara será ligeramente más cálida que la temperatura ambiente, típicamente 25−26 °C, como resultado de la humidificación. Si la humedad es visible en las cubiertaslipos, entonces las superficies de vidrio están demasiado húmedas. Una guantera comercial podría simplificar esta parte del protocolo. - Que el RH en la cámara siga subiendo hasta el 85%. En ese momento, registre el RH en la cámara de humedad y la pipeta 5 μL de la suspensión de perlas en el centro de cada cubrebocas.
- Cierre la cámara y las placas de Petri después de cada deposición para minimizar la pérdida de humedad. Trate de terminar las 6 deposiciones dentro de 2 min.
- Registre el RH en la cámara después de la deposición.
NOTA: El RH después de la deposición ayudará a medir la rapidez con la que se perdió la humedad durante la deposición, lo que depende de las condiciones ambientales del laboratorio. Para una ejecución típicamente exitosa, la cámara comenzará en 85% HR antes de la deposición y terminará en 70−75% RH después de la deposición. - Deje que las gotas de cuentas se extiendan y se sequen durante 5 min.
NOTA: Si los cristales coloidales tienen muchos agujeros o regiones de varias capas, entonces la cámara era probablemente demasiado húmeda o seca, respectivamente. Ajuste la humedad relativa a la que cerrar las placas de Petri y comience las deposiciones (consulte la sección de resultados para obtener más información sobre la optimización).
3. Recocido de cuentas para reducir el tamaño de los poros en la plantilla de cristal coloidal
- Para proporcionar una superficie de temperatura uniforme para el recocido de las perlas de poliestireno, que estrecha los intercondidos de las inter-perlas y redondea las esquinas de los interstices, coloque una placa de aluminio plana y fresada en la parte superior de una placa caliente de cerámica estándar.
- Ajuste la temperatura de la placa caliente a 107 °C, la temperatura de transición vítrea de poliestireno40.
NOTA: Para obtener una temperatura estable y precisa, se mantuvo una sonda de termopar en un agujero de 2−3 mm de ancho y 4−5 mm de profundidad en la placa de aluminio. - Coloque un cubrebocas que contenga la plantilla de perlas en la placa de aluminio caliente y el recocido durante 20 s (consulte la sección de discusión para obtener una explicación del tiempo de fusión).
- Después de calentar, retire el cubrebocas de la placa de aluminio y colócalo rápidamente en otra superficie de aluminio a temperatura ambiente para enfriarlo.
NOTA: Es útil hacer que las cubiertas cuelguen ligeramente sobre el borde de la placa o fresar canales poco profundos (ver el video que lo acompaña) en la placa para facilitar la recogida de las cubiertas.
4. Nanofabricación de guías de onda de modo cero de aluminio utilizando la plantilla de cristal coloidal
- Usando la deposición evaporativa térmica o de haz de electrones, deposite 300 nm de cobre a 2 Å/s sobre la plantilla de cristal coloidal para generar postes en los interstices entre las perlas.
- Retire el exceso de metal en la parte superior de las cuentas presionando suavemente la superficie con cinta adhesiva. Pelar lentamente la cinta para sacar el metal.
NOTA: Algunos pequeños parches de exceso de metal reflectante pueden permanecer después de la extracción de la cinta, y estos a menudo pueden ser eliminados por una corriente de gas N2. Si quedan parches sustanciales de exceso de metal reflectante después de la extracción de la cinta, intente remojar las plantillas en tolueno durante 2 h para disolver parcialmente las perlas de poliestireno. Lavar las tapas con agua destilada, secar conN2, y repetir la cinta tire. El remojo adicional no debe disolver completamente las cuentas, ya que las cuentas ayudan a proteger los postes de daños durante la extracción de la cinta. - Para disolver las cuentas de poliestireno, coloque las plantillas de cuentas en tolueno y remoje durante la noche.
PRECAUCIÓN: Los humos de tolueno pueden ser tóxicos. Trabaje con tolueno bajo una capucha bien ventilada y use equipo de protección personal, incluidos guantes, anteojos de seguridad y una bata de laboratorio. El tolueno debe almacenarse en armarios ventilados designados para líquidos inflamables. - Después de la incubación de tolueno, enjuague las plantillas una vez con cloroformo y dos veces con etanol. Maneje los cubrebocas con cuidado en este punto porque los delicados postes de metal de 200-300 nm de altura ahora están expuestos. Seque las plantillas con N2 y elimine elpolímero residual y los contaminantes en un limpiador de plasma de oxígeno durante 30 min.
PRECAUCIÓN: Los humos de cloroformo pueden ser tóxicos. Trabaje con cloroformo bajo una capucha bien ventilada y use equipo de protección personal, incluidos guantes, gafas de seguridad y una bata de laboratorio. El cloroformo debe almacenarse en armarios ventilados lejos de otros disolventes inflamables. - Usando deposición evaporativa térmica o de haz de electrones, deposite 3 nm de una capa de adhesión de titanio a 1 Å/s seguida de 100−150 nm de aluminio a 4 Å/s alrededor y encima de los postes de cobre.
NOTA: Uno puede usar un revestimiento más grueso para obtener guías más profundas y una mejor atenuación de la fluorescencia de fondo, pero esto también disminuye el rendimiento después de exponer y disolver los postes en el siguiente paso (consulte la sección de discusión). - Para disolver los postes metálicos, remoje las cubiertas en grabador de cobre (a base de ácido cítrico; Tabla de Materiales) para 2 h.
PRECAUCIÓN: El grabador de metal puede causar quemaduras en la piel. Trabaje con grabados bajo una capucha bien ventilada y use equipo de protección. Lávese bien las manos después de manipular. El grabador metálico debe almacenarse en armarios ventilados designados para líquidos corrosivos. - Enjuague los cubrebocas con agua destilada, seque con N2,y enjuague suavemente la superficie del revestimiento metálico con papel de lente para exponer cualquier poste que todavía esté cubierto de revestimiento. Coloque las tapas de nuevo en grabador de cobre durante otras 2 h, luego enjuague de nuevo con agua destilada y seque conN2.
NOTA: Las diapositivas ZMW deben almacenarse en placas de Petri cubiertas y limpias para mantenerlas libres de contaminantes.
5. Nanofabricación de guías de onda de modo cero de oro utilizando la plantilla de cristal coloidal
NOTA: El método para fabricar ZMWs de oro(Figura suplementaria 1),que refleja el protocolo para fabricar ZMWs de aluminio, se proporciona en esta sección.
- Utilizando la deposición evaporativa térmica o de haz de electrones, deposite 3 nm de una capa de adhesión de titanio a 1 Å/s seguida de 300 nm de aluminio a 4 Å/s.
- Retire el exceso de metal en la parte superior de las cuentas presionando suavemente la superficie con cinta adhesiva. Pelar lentamente la cinta para sacar el metal.
- Para disolver las cuentas de poliestireno, coloque las plantillas de cuentas en tolueno y remoje durante la noche.
- Después de la incubación de tolueno, enjuague las plantillas una vez con cloroformo y dos veces con etanol. Seque las plantillas conN2 y elimine los contaminantes poliméricos residuales en un limpiador de plasma de oxígeno durante 30 min.
- Utilizando la deposición evaporativa térmica o de haz de electrones, deposite 100−150 nm de oro a 5 Å/s alrededor y encima de los postes de aluminio.
- Para disolver los postes metálicos, remoje las cubiertas en grabador de aluminio (a base de ácido fosfórico; Tabla de Materiales) para 1 h.
- Enjuague los cubrebocas con agua destilada, seque con N2,y enjuague suavemente la superficie del revestimiento metálico con papel de lente para exponer cualquier poste que todavía esté cubierto de revestimiento. Coloque las tapas de nuevo en grabador de aluminio durante 1 h, luego enjuague de nuevo con agua destilada y seque con N2.
NOTA: Las diapositivas ZMW deben almacenarse en placas de Petri cubiertas y limpias.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
El autoensamblaje de las partículas coloidales de poliestireno a través de la sedimentación evaporativa (pasos 2.1−2.13) puede producir una gama de resultados ya que requiere el control de la tasa de evaporación del disolvente. Sin embargo, debido a que las deposiciones son rápidas (10−15 min por ronda), el procedimiento se puede optimizar rápidamente para diferentes condiciones ambientales de laboratorio. La Figura 3A muestra una plantilla coloidal bien formada después de la deposición y la evaporación. Macroscópicamente, la región de las cuentas es circular, con bordes definidos por un anillo opaco y de varias capas de cuentas. Las regiones translúcidas, pero no blancas en la imagen son las áreas monocapa deseadas. La Figura 3B muestra una plantilla coloidal que fue embalada en un ambiente excesivamente húmedo (80% de RH cuando las placas de Petri estaban cerradas). Estas plantillas tienden a no tener un límite circular limpio y tienen zarcillos de varias capas que se extienden hacia afuera. La deposición es aceptable y se puede utilizar en fases posteriores, pero los agujeros en el enrejado reducen el número de áreas utilizables de la matriz ZMW para la proyección de imagen de una sola molécula. La Figura 3C muestra una plantilla coloidal que fue embalada en un ambiente demasiado seco (65% de RH cuando las placas de Petri estaban cerradas). Estas plantillas suelen ser de menor diámetro en comparación con las plantillas ideales y bien extendidas. La deposición se puede utilizar, pero las regiones blancas de varias capas, que rayan hacia adentro, reducen el área utilizable para la proyección de imagen. Por lo tanto, no recomendamos realizar más de 6 deposiciones a la vez, ya que las deposiciones hacia el final del proceso ocurrirán a una humedad más baja a medida que la cámara se abre y se cierra. La Figura 3D muestra el patrón de arco iris producido por la difracción de la luz reflejada del cristal de poliestireno. Este patrón se puede utilizar para confirmar el éxito y la calidad del embalaje de cristal a ojo. La Figura 3E,F muestra imágenes de microscopía de fuerza atómica (AFM) de plantillas coloidales bien empaquetadas. Los defectos entre granos surgen de la interferencia durante la sedimentación evaporativa41, y los granos distintos se pueden ver con un objetivo de 10x. Por lo tanto, el examen de las deposiciones coloides con un microscopio de luz de baja potencia también se puede utilizar para evaluar el embalaje.
Después de la deposición de cobre en las plantillas coloidales recocidas (paso 4.1), el patrón de difracción del arco iris todavía debe ser visible y mejorado por el metal reflectante que recubre las tapas de las perlas (Figura 4A, B). Las plantillas pierden el patrón de difracción del arco iris reflectante después de la extracción de la cinta escocesa (paso 4.2) que elimina el exceso de cobre (Figura 4C). La Figura 4D,E muestra imágenes AFM de un campo típico de postes de cobre después de la deposición de metales. Los defectos entre los granos de cristal coloidal en la Figura 3E son visibles en las imágenes del poste de cobre como regiones más grandes de cobre. El análisis de las imágenes AFM muestra que, para un espesor de deposición de cobre de 300 nm, los postes de cobre eventuales promedian 255 nm (Figura 4F) en altura y 121 nm de diámetro (Figura 4G).
La deposición del revestimiento de aluminio (paso 4.5) donde estaban las perlas y en la parte superior de los postes de cobre, y la posterior disolución de los postes (pasos 4.6 y 4.7) dan como resultado los ZMWs de aluminio que se muestran en la Figura 5A−C. Los defectos entre los granos de cristal coloidal son visibles como aberturas más grandes (Figura 5B). La distancia media entre los centros ZMW de la Figura 5C es de 559 nm, consistente con el espaciamiento establecido por la geometría hexagonal de embalaje cercano de las perlas de 1 μm (  El uso de plantillas de poliestireno que fueron recocidas durante 20 s da como resultado guías de onda que tienen en promedio 118 nm de diámetro ( Figura5D,E), consistentes con los diámetros del poste y lo suficientemente pequeñas como para cortar la propagación de la luz visible. Un perfil de altura de una guía de onda de la Figura 5D también muestra que tiene ~ 120 nm de profundidad.
El uso de plantillas de poliestireno que fueron recocidas durante 20 s da como resultado guías de onda que tienen en promedio 118 nm de diámetro ( Figura5D,E), consistentes con los diámetros del poste y lo suficientemente pequeñas como para cortar la propagación de la luz visible. Un perfil de altura de una guía de onda de la Figura 5D también muestra que tiene ~ 120 nm de profundidad.
Se realizó fret de molécula única en los ZMWs para probar la funcionalidad (Figura 6A). Un campo típico de ZMWs para imágenes se muestra en la Figura 6B,que contiene guías de onda >3000 en un campo de visión de 40 x 80 μm. Los ZMWs fueron pasivados por primera vez utilizando protocolos descritos anteriormente42,43. Brevemente, los ZMWs de aluminio fueron pasivados con poli (ácido vinilfosfónico) para recubrir el revestimiento de aluminio seguido de polietilenglicol terminado en metoxi (PEG) dopado con PEG terminado en biotina para recubrir los fondos de vidrio de los ZMWs. Los ZMWs de oro se pueden pasivar con PEG derivado de tiol para recubrir el revestimiento de oro seguido de un tratamiento peg similar para los fondos de vidrio. Las cámaras de flujo, ~ 20 μL de volumen, se construyeron para imágenes de una sola molécula44. La proyección de imagen del traste de una sola molécula de los dúplex de la DNA fue realizada según lo descritopreviamente 38. Brevemente, 100 pM−1 nM de cyanine-3/cyanine-5 (Cy3/Cy5), los dúplex biotinilados de la DNA (longitud de 33 pares de bases) fueron incubados por 10 minutos en los canales de flujo funcionalizados con la estreptavidina (incubación de 5 minutos, solución de 0,5 mg/mL). La concentración de macromoléculas etiquetadas se puede ajustar para lograr ~ 20% de carga de las guías de onda con una molécula, lo que lleva a <5% de guías de onda cargadas con más de una molécula, basadas en la carga distribuida de Poisson (la mayoría de las guías de onda, ~ 75%, no tendrán moléculas)45. La DNA unbound fue lavada lejos con el almacenador intermediario dúplex nucleasa-libre seguido por el almacenador intermediario de la iluminación (glucosa de 0,3% [w/v], oxidasis de la glucosa de 300 μg/mL, catalasa de 120 μg/mL, y ácido Trolox de 1,5 milímetros [ácido 6-hydroxy-2,5,7,8-tetramethyl-chromane-2-carboxylic]). Los dúplex de ADN no biotinilados marcados con Cy5 (33 pares de bases de longitud) estaban presentes en el tampón de iluminación a 0, 50, 100 y 500 nM como fluoróforos de fondo en solución. Los rastros del traste de una sola molécula de las moléculas dúplex inmovilizadas de la DNA Cy3/Cy5 fueron registrados con un microscopio de TIRF hecho a medida ajustado a las condiciones de la epi-fluorescencia. Las películas se grabaron con un objetivo de inmersión en aceite de 1,48 grados de apertura numérica (NA) de 100x con una excitación alterna de 532 nm y 640 nm (exposición de 100 ms) y un divisor espectral de doble vista para registrar la emisión de Cy3 y Cy5 simultáneamente en una cámara de dispositivo acoplado a carga multiplicadora de electrones (EMCCD). Las trazas de FRET de una sola molécula con blanqueadores de un solo paso en el canal Cy5 fueron detectables en todas las concentraciones de Cy5 ambiente probadas (Figura 6C−F). En comparación, las moléculas individuales sólo serían detectables en la iluminación TIRF con pM a bajas concentraciones de fluoróforo de la solución de nM46.

Figura 1: Esquema de guías de onda de modo cero. Diagrama de la matriz ZMW con diagrama transversal expandido de un solo ZMW a la derecha. Las solas enzimas fluorescentemente marcadas con etiqueta de interés (ribosoma marrón con círculo rojo para representar el tinte fluorescente) inmovilizadas químicamente (a través del ARNm en este ejemplo) en el fondo de vidrio de los ZMWs (típicamente funcionalizadas con CLAVIJA biotinilado) se pueden fotoficar con una configuración típica de microscopía de epifluorescencia basada en láser. La luz de excitación de 532 nm (flechas verdes) se refleja en el límite vidrio-metal debido al pequeño tamaño de la apertura (100−200 nm de diámetro), pero una onda evanescente no propagante que decae exponencialmente en intensidad está presente dentro del ZMW. Esto da como resultado una profundidad de iluminación efectiva de 10−30 nm (sombreado verde en la apertura). Se añaden ligandos fluorescentes individuales (ARNt azules con círculos verdes como etiquetas fluorescentes) a concentraciones de nM a μM. Un ligando individual que se difunde en la apertura e interactúa con la enzima se muestra sin fluorescencia de fondo prohibitiva. Haga clic aquí para ver una versión más amplia de esta figura.

Figura 2: Esquema del método de plantillas coloidales desarrollado para fabricar matrices ZMW de aluminio. Las perlas de poliestireno, de 1 μm de diámetro, se depositan y se autoensamblan en una cubierta de vidrio limpia, como se describe en la sección 2 del protocolo. Las perlas se recocen para reducir el tamaño de los poros (sección 3), seguidas de la deposición de cobre y la disolución de cuentas en tolueno. El aluminio se deposita alrededor y encima de los postes de cobre, que luego se grabarán selectivamente para dejar una matriz hexagonal de nanoaperturas (sección 4). Para los últimos tres pasos, se proporcionan vistas transversales a la derecha de las vistas en planta para mostrar los anchos y alturas de los postes de cobre y los ZMWs de aluminio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Resultados representativos de la deposición evaporativa de coloides. (A) Ejemplo de deposición coloide óptima. (B) Ejemplo de una deposición coloide aceptable en la que las condiciones eran más húmedas (80% RH) de lo ideal. Los agujeros en la monocapa de cristal son evidentes. (C) Ejemplo de una deposición coloide aceptable en la que las condiciones eran más secas (65% RH) que las óptimas. Las regiones monocapa son ligeramente translúcidas, mientras que las áreas multicapa son blancas y opacas (perímetro y rayas hacia adentro). (D) Un cristal coloidal iluminado con luz blanca para resaltar la difracción del arco iris de los cristales. (E) Imagen AFM (sonda de roscado AFM en el aire) de una monocapa de perlas de poliestireno hexagonalmente empaquetadas de una deposición coloide exitosa (barra de escala = 10 μm). (F) Imagen AFM expandida de cuentas empaquetadas (barra de escala = 2 μm). Haga clic aquí para ver una versión más amplia de esta figura.

Figura 4: Imágenes macroscópicas y microscópicas de plantillas ZMW después de la deposición de cobre. (A) Imagen de diapositivas después de la evaporación física de cobre en la parte superior de las plantillas de cuentas. (B) Patrón de difracción de arco iris de plantillas de cuentas después de la deposición de cobre. (C) Imagen de una plantilla (derecha) después de una extracción de cinta para eliminar el exceso de cobre y la cinta (izquierda). (D) Imagen AFM de postes de cobre después de la extracción de la cinta y disolución completa de las perlas de poliestireno (barra de escala = 5 μm). (E) Imagen AFM de mayor aumento del panel D (barra de escala = 2 μm). (F) Histograma de las alturas del poste de cobre (definido como la medición de altura máxima dentro de cada poste), n = 534. (G) Histograma de los diámetros de Feret del poste de cobre, n = 201. El diámetro de Feret es la distancia máxima entre dos líneas paralelas tangentes al límite del poste (cuantificada en ImageJ47). Para identificar las partículas para el análisis, se utilizó un umbral a medio camino entre la parte superior del revestimiento y la superficie inferior del vidrio. Haga clic aquí para ver una versión más amplia de esta figura.

Figura 5: Imágenes macroscópicas y microscópicas de ZMWs de aluminio. (A) Imagen de diapositivas después de la deposición física evaporativa de 150 nm de aluminio alrededor y encima de los postes de cobre. (B) Imagen AFM de ZMWs de aluminio después de la disolución posterior (barra de escala = 5 μm). (C) Imagen de mayor aumento del panel B (barra de escala = 0,2 μm). (D) Perfil de profundidad típico de un ZMW individual del panel C. Perfil tomado de la línea verde dibujada en el panel C. (E) Histograma de diámetros de Feret ZMW, n = 240. Los diámetros de feret se midieron como en la Figura 4. Haga clic aquí para ver una versión más amplia de esta figura.

Figura 6: Imágenes fret de una sola molécula en ZMWs. (A) Schematic (not to scale) of single molecule FRET imaging of Cy3, Cy5-labeled DNA duplex in ZMWs with Cy5 labeled duplexes in the background. (B) Campo de ejemplo de ZMWs bajo iluminación de luz blanca (barra de escala = 10 μm). (C−F ) Grabaciones fret de una sola molécula de dúplex de ADN inmovilizados en los ZMWs en presencia de 0 (C),50 (D),100 (E)y 500 nM (F) cy5-labeled duplex en solución. Para cada concentración, el panel superior muestra la intensidad de fluorescencia Cy3 (verde) y Cy5 (rojo) bajo iluminación láser de 532 nm (imágenes FRET), el panel central muestra la intensidad de fluorescencia Cy5 bajo iluminación láser De 640 nm (excitación aceptora directa), y el panel más bajo muestra la eficiencia FRET (  ) calculada a partir de las intensidades de fluorescencia Cy3(ID)y Cy5(IA)en bruto. Durante la toma de imágenes, la longitud de onda de excitación alternó entre 532 y 640 nm cada 100 ms. Haga clic aquí para ver una versión más grande de esta figura.
) calculada a partir de las intensidades de fluorescencia Cy3(ID)y Cy5(IA)en bruto. Durante la toma de imágenes, la longitud de onda de excitación alternó entre 532 y 640 nm cada 100 ms. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1: Esquema del método de plantillas coloidales desarrollado para fabricar la matriz ZMW de oro. El protocolo para fabricar la matriz ZMW de oro es análogo al protocolo para fabricar la matriz ZMW de aluminio (Figura 2). En lugar de depositar cobre en la parte superior de las perlas de poliestireno, se deposita aluminio. Después de disolver las cuentas en tolueno, el oro se deposita en lugar de aluminio en la parte superior de los postes. Los postes de aluminio se grabaron selectivamente para dejar atrás la matriz ZMW de oro. Para los últimos tres pasos, se proporcionan vistas transversales a la derecha de las vistas del plano para mostrar los anchos y alturas de los postes de aluminio y los ZMWs dorados. Haga clic aquí para descargar este archivo.
Figura suplementaria 2: Modelado de elementos finitos de propagación de campos electromagnéticos en ZMWs. (A−D ) Secciones transversales de la magnitud del vector de Poynting promediado en el tiempo (W/m2)a través de una guía de onda hecha de una plantilla sin límite (A,C) y una plantilla recocida (B,D). Las ondas planas electromagnéticas polarizadas linealmente (1 W distribuidas sobre el área de la diapositiva) en las longitudes de onda enumeradas en la figura (400 nm o 1.000 nm) se proyectaron sobre la superficie inferior, y el modo más bajo (fundamental), que tiene el número de onda más bajo, se calculó utilizando un software de modelado(Tabla de materiales)con el método de elementos finitos para resolver las ecuaciones de Maxwell y las condiciones de contorno apropiadas. Se asumió que los límites de las guías de onda eran conductores eléctricos perfectos, que están bien aproximados por paredes de aluminio o oro. La sección transversal de la plantilla de guía de onda sin numerar se determinó mediante el embalaje hexagonal de círculos de 1 μm de diámetro, y las puntas de tres puntas de la forma triangular resultante se recortaron a ~ 60 nm de ancho para modelar una apertura física realista. La sección transversal de las plantillas recocidas se aproximó como un círculo de 130 nm de diámetro. Ambas guías de onda tenían una profundidad de 130 nm, similar a la profundidad del revestimiento después de la fabricación. (E,F ) Además de las longitudes de onda de excitación de 400 nm y 1.000 nm, los modelos se resolvieron a 100 longitudes de onda de excitación espaciadas uniformemente entre 400 nm y 1.000 nm, y el índice de modo efectivo (definido como  , donde kz es el número de onda en la guía de onda, que se reduce debido a la restricción en el plano transversal, y k es el número de onda de luz de excitación en el vacío) se grafica contra la longitud de onda de excitación para las guías de onda triangulares (E) y circulares (F). Para longitudes de onda más cortas, los modos más altos se excitan, y el índice de modo efectivo aumenta (el índice de modo efectivo máximo es 1, que es el caso límite donde la onda del plano electromagnético viaja sin límites en la dimensión transversal). Las longitudes de onda de corte efectivas de las guías de onda se estimaron como la longitud de onda en la que el índice de modo efectivo cae a 0. Nótese que la guía circular λcutoff = 221 nm del modelado de elementos finitos (F) es consistente con la predicción teórica de la longitud de onda de corte de una guía de onda circular (λcutoff,analytical = 1.7d = 221 nm,donde d es el diámetro de la guía de onda). Haga clic aquí para descargar este archivo.
, donde kz es el número de onda en la guía de onda, que se reduce debido a la restricción en el plano transversal, y k es el número de onda de luz de excitación en el vacío) se grafica contra la longitud de onda de excitación para las guías de onda triangulares (E) y circulares (F). Para longitudes de onda más cortas, los modos más altos se excitan, y el índice de modo efectivo aumenta (el índice de modo efectivo máximo es 1, que es el caso límite donde la onda del plano electromagnético viaja sin límites en la dimensión transversal). Las longitudes de onda de corte efectivas de las guías de onda se estimaron como la longitud de onda en la que el índice de modo efectivo cae a 0. Nótese que la guía circular λcutoff = 221 nm del modelado de elementos finitos (F) es consistente con la predicción teórica de la longitud de onda de corte de una guía de onda circular (λcutoff,analytical = 1.7d = 221 nm,donde d es el diámetro de la guía de onda). Haga clic aquí para descargar este archivo.
Figura suplementaria 3: Resultados representativos de la fabricación de Au ZMW. (A) Imagen macroscópica de matrices ZMW de oro. (B−D) Imágenes AFM de postes de aluminio de una plantilla de cuentas que no fue recocida (B),una plantilla que fue recocida a 107 °C durante 20 s (C),y una plantilla que fue recocida a 107 °C durante 25 s (D). (E) Imagen AFM de ZMWs de oro después de la disolución de postes de aluminio. (F) Imagen AFM de mayor aumento del panel E.(G) Perfil de profundidad típico de un ZMW de oro. Perfil tomado de la línea verde dibujada en el panel F (barra de escala = 1 μm en B, C, Dy F; 5 μm en E). Haga clic aquí para descargar este archivo.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Para el autoensamblaje coloidal (sección de protocolo 2), el uso de etanol en lugar de agua como disolvente de suspensión acelera el proceso de evaporación para que las plantillas estén listas en 2−3 min después de la deposición en lugar de 1−2 h como en los métodos anteriores48,49. El protocolo de sedimentación evaporativa presentado aquí también es más simple que los protocolos de sedimentación anteriores que requieren controlar la inclinación de la superficie, la temperatura y el volumen de aire por encima de la suspensión49,50,51. La fracción de volumen de partículas utilizada en este protocolo es del 2,4%, superior al 0,2−0,5% utilizado en los métodos de sedimentación anteriores48,que resuspentó coloides en mezclas de agua-glicerol durante escalas de tiempo de sedimentación mucho más largas. Sin embargo, la calidad de las deposiciones es robusta a los cambios en la fracción de volumen de partículas, con estudios anteriores que encuentran que se puede variar entre 2-10%49,50,51. Los tamaños de grano de los cristales coloidales obtenidos en una deposición exitosa de este protocolo son de 20−30 μm de ancho, más grandes que los granos de métodos de sedimentación anteriores (típicamente varios cientos de nanómetros de ancho)48,49. Macroscópicamente, las áreas de aproximadamente 2 cm de diámetro de la monocapa coloidal también son comparables a las áreas de 1 cm producidas por métodos anteriores49. El gran tamaño de las plantillas de cristal coloidal producidas en este método también permite hacer 3−5 cámaras de flujo separadasde 44,cada una de unos 3−4 mm de ancho, en cada diapositiva ZMW. Por lo tanto, se pueden realizar múltiples experimentos independientes de una sola molécula en cada diapositiva.
Recocido de las plantillas de perlas coloidales (sección de protocolo 3) después del autoensamblaje es un paso simple, pero crucial para reducir suficientemente la fluorescencia de fondo con los ZMWs. Como muestra la Figura suplementaria 2, la longitud de onda de corte efectiva para una guía de onda con la sección transversal triangular de una plantilla sin límite es de 894 nm. En comparación, la longitud de onda de corte efectiva para una guía de onda circular de 130 nm de diámetro de una plantilla recocida es de 221 nm, según se determina tanto analíticamente (1,7 veces el diámetro de la guía18)como numéricamente. El uso de perlas más pequeñas para la deposición también podría reducir el tamaño de los poros de la plantilla, pero las guías de onda se espaciarían más cerca de 200 nm, que está alrededor del límite de difracción de la luz visible. Además, las guías de onda permanecerían triangulares en sección transversal, lo que conduce a la propagación de potencia no simétrica a través de la guía de onda (Figura suplementaria 2A−D). Un inconveniente de la etapa de recocido es que la variabilidad en el tiempo de fusión puede introducir fluctuaciones en el diámetro de la guía de onda, por lo que la sincronización precisa ayuda a minimizar la variación entre lotes. Los interstices comienzan a cerrarse en tiempos de recocido superiores a 25 s, y los diámetros de los postes no disminuyen mucho entre 20−25 s (Figura suplementaria 3B−D). Una prueba rápida para el cierre intersticio es comprobar si las plantillas recocidas todavía producen un patrón de difracción de arco iris cuando se iluminan con luz y se ven en un ángulo. Si no, la mayoría de los interstices probablemente se han cerrado. La relación entre el tiempo de recocido y los diámetros típicos de los poros se ha presentado anteriormente38.
Después de lograr el tamaño de poro deseado durante el paso de recocido, el cobre se deposita (paso 4.1) en las plantillas para crear una sombra de la máscara. Es importante utilizar la deposición de la línea de visión, con el metal acercándose a la plantilla tan perpendicularmente como sea posible. Por lo tanto, aumentar la distancia entre la muestra y la fuente de metal, así como garantizar que la placa que contiene las plantillas no esté girando, como se hace automáticamente en algunas máquinas de deposición de vapor, ayudará a minimizar la deposición lateral de metal sobre el sustrato de poliestireno. Sin embargo, es inevitable alguna deposición lateral, lo que reduce el tamaño del orificio intersticial y por lo tanto la sección transversal posterior a medida que se deposita más metal52. Esto da lugar a postes de metal piramidales en lugar de estructuras en forma deprisma 52.
Debido a que los postes de cobre son probablemente piramidales en lugar de en forma de prisma, la deposición de aluminio (paso 4.5) en la parte superior de los postes también cubre algunos de los lados inclinados, bloqueando la accesibilidad del grabador de cobre para algunos de los postes. Por lo tanto, el paso de pulir el papel de la lente (paso 4.7 o 5.7) se agregó después del primer remojo en grabado para interrumpir mecánicamente cualquier poste de cobre todavía cubierto de aluminio. Depositar más cobre para crear postes más altos también hace que los postes sean más susceptibles a la interrupción mecánica durante el pulcro del papel de la lente. Sin embargo, no se deben depositar más de 500 nm de cobre, ya que el objetivo de la deposición es proyectar el agujero intersticial en la línea media de 500 nm de las perlas de 1 μm.
Otra dificultad potencial es la eliminación involuntaria del revestimiento de aluminio durante el pulcro del papel de la lente (paso 4.7 o 5.7). Se encontró que la pérdida de revestimiento de aluminio durante el lavado se hizo más frecuente después de que se agregó la etapa de recocido, probablemente debido al aumento de residuos de poliestireno, que puede interferir con la adherencia del aluminio al vidrio (sección de protocolo 3). Sin embargo, el remojo de tolueno durante la noche (paso 4.3 o 5.3) después de la extracción de cinta resolvió este problema. En la imagen AFM de la Figura 4E,se pueden ver algunos anillos residuales de poliestireno entre los postes, pero el revestimiento de aluminio todavía resistió múltiples buffs en el paso 4.7. Si la pérdida del revestimiento de aluminio sigue siendo un problema después del remojo de tolueno durante la noche, se puede agregar un lavado RCA-1 (limpieza estándar-1), un lavado de pirañas o una limpieza adicional por plasma de oxígeno al paso 4.4 o 5.4. Estos pasos de lavado también se pueden agregar después del paso de grabado final (paso 4.7 o 5.7) y antes de la pasivación para limpiar aún más los ZMWs.
El rendimiento de los ZMWs en experimentos fret de una sola molécula fue similar al de los ZMWs fabricados con EBL. En un estudio anterior53 realizando fret de molécula única en Cy3 etiquetado ADN monocatenario con Cy5 etiquetado proteína cargadora de helicasa de ADN en solución (la misma disposición donante-aceptor que en la Figura 6A),los eventos FRET fueron claramente discernibles a 100 nM cy5 fondo, fueron menos claros (señal de traza aceptor inferior al ruido) a 1 μM, y no discernible a 10 μM. Observamos que un estudio anterior con ZMWs comerciales informó señales aceptores fret de molécula única a concentraciones de fondo tan altas como 1 mM54,más alto que nosotros y otros estudios anteriores42,53 con ZMWs fabricados internamente han logrado. En Jamiolkowski et al.38se da una discusión más detallada del rendimiento de la señal al fondo entre los ZMWs. La interacción inespecífica de la muestra fluorescente con las superficies ZMW53 es un desafío común que limita el acceso a concentraciones más altas, especialmente si la especie fluorescente difusora en solución es una macromolécula grande. Los estudios con ZMWs en sistemas bioquímicos complejos tales como traducción han limitado típicamente concentraciones libres del substrato fluorescente a 100−250 nanales55,56,57,58. Independientemente de la aplicación prevista de los ZMWs, la optimización de los métodos de pasivación para diferentes sistemas probablemente será necesaria para mantener una señal aceptable al ruido a altas concentraciones.
En general, el método presentado aquí no requiere habilidades o equipos especializados, permite la fabricación paralela de muchas plantillas a la vez y se puede adaptar para fabricar ZMWs en diferentes metales. En este trabajo, el cobre y el aluminio fueron sustituidos por aluminio y oro, respectivamente, para fabricar ZMWs de oro(Figura Suplementaria 3). Esto es ventajoso para los laboratorios que utilizan métodos de pasivación de oro en lugar de aluminio. Además, se ha demostrado que los ZMWs de oro mejoran la emisión de fluoróforos que se absorben en la región roja del espectro visible, mientras que los ZMWs de aluminio mejoran la emisión de fluoróforos que absorben en la región verde59. En el futuro, la intensidad de la señal fluorescente de ZMWs fabricados con este método podría mejorarse mediante el grabado en el vidrio debajo del revestimiento metálico ZMW utilizando HF16,26,60. Esto lleva las biomoléculas inmovilizadas más lejos de las paredes metálicas, lo que puede apagar los fluoróforos61. Además, hay un máximo en intensidad de iluminación de excitación por debajo de la entrada de la apertura, y esto se ha explotado previamente para mejorar la emisión de una sola molécula26,60.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Los autores no tienen nada que revelar.
Acknowledgments
Este trabajo fue apoyado por las subvenciones R01GM080376, R35GM118139 de los NISF y el Centro de Mecanobiología de Ingeniería CMMI: 15-48571 a Y.E.G., y por una beca predoctoral nrsa del NIAID F30AI114187 a R.M.J.
Materials
| Name | Company | Catalog Number | Comments |
| 1. Glass Coverslip Cleaning | |||
| Acetone | Sigma | 32201 | 1 L |
| Coplin glass staining jar | Fisher Scientific | 08-817 | Staining jar with 8 grooves and molded glass cover |
| Coverslips | VWR | 48404-467 | 24 mm x 30 mm (No.1½, Rectangular) |
| Ethanol | Sigma | E7023 | 1 L |
| KOH | Sigma | 30603 | Potassium hydroxide |
| Petri dishes | Fisher Scientific | R80115TS | 100 mm diameter, 15 mm deep |
| Sonicator | Branson | Z245143 | Tabletop ultrasonic cleaner, 5510 |
| 2. Evaporative Deposition of Polystyrene Beads | |||
| Clear storage container | Fisher Scientific | 50-110-8222 | 26 x 18 x 15 in. |
| Desk fan | O2Cool | FD05001A | Any small desk (~5 in.) fan will work |
| Glass beaker | Fisher Scientific | 02-555-25B | 250 mL |
| Humidity meter | Fisher Scientific | 11-661-19 | |
| Microcentrifuge tubes | Fisher Scientific | 21-402-903 | 1.5 mL |
| Polystyrene microspheres | Polysciences | 18602-15 | 1.00 µm diameter, non-functionalized |
| Triton X-100 deturgent | Sigma | X100 | 100 mL |
| 3. Bead Annealing for Reducing Pore Size in the Colloidal Crystal Template | |||
| Aluminum plate | Fisher Scientific | AA11062RY | Customized in-house to 14 cm x 14 cm |
| Ceramic hotplate | Fisher Scientific | HP88857100 | 13 x 8.2 x 3.8 in. |
| Temperature controller | McMaster-Carr | 38615K71 | Read temperature with thermocouple probe |
| Thermocouple probe | McMaster-Carr | 9251T93 | Type K, surface probe |
| 4/5. Nanofabrication of Zero Mode Waveguides Using the Colloidal Crystal Template | |||
| Aluminum etchant | Transene | Type A | |
| Aluminum pellets | Kurt J. Lesker | EVMAL40QXHB | For electron beam evaporation |
| Chloroform | Sigma | 288306 | 1 L |
| Copper etchant | Transene | 49-1 | |
| Copper pellets | Kurt J. Lesker | EVMCU40QXQA | For electron beam evaporation |
| Gold pellets | Kurt J. Lesker | EVMAUXX40G | For electron beam evaporation |
| Lens paper | Thorlabs | MC-5 | |
| Plasma cleaner | Harrick Plasma | PDC-32G | |
| Scotch tape | Staples | MMM119 | |
| Thin film deposition system | Kurt J. Lesker | PVD-75 | Tabletop thermal evaporation system will also work |
| Titanium pellets | Kurt J. Lesker | EVMTI45QXQA | For electron beam evaporation |
| Toluene | Sigma | 244511 | 1 L |
| Representative Results | |||
| COMSOL Multiphysics Modeling Software | COMSOL, Inc. | ||
| Dual View spectral splitter | Photometrics, Inc. |
References
- Kapanidis, A. N., et al. Initial transcription by RNA polymerase proceeds through a DNA-scrunching mechanism. Science. 314 (5802), 1144-1147 (2006).
- Santoso, Y., et al. Conformational transitions in DNA polymerase I revealed by single-molecule FRET. Proceedings of the National Academy of Sciences of the United States of America. 107 (2), 715-720 (2010).
- Herbert, K. M., Greenleaf, W. J., Block, S. M. Single-molecule studies of RNA polymerase: motoring along. Annual Review of Biochemistry. 77, 149-176 (2008).
- Chen, C., et al. Dynamics of translation by single ribosomes through mRNA secondary structures. Nature Structural & Molecular Biology. 20 (5), 582-588 (2013).
- Chen, C., et al. Single-molecule fluorescence measurements of ribosomal translocation dynamics. Molecular Cell. 42 (3), 367-377 (2011).
- Jamiolkowski, R. M., Chen, C., Cooperman, B. S., Goldman, Y. E. tRNA Fluctuations Observed on Stalled Ribosomes Are Suppressed during Ongoing Protein Synthesis. Biophysical Journal. 113 (11), 2326-2335 (2017).
- Myong, S., Stevens, B. C., Ha, T. Bridging Conformational Dynamics and Function Using Single-Molecule Spectroscopy. Structure. 14 (4), 633-643 (2006).
- Martin-Fernandez, M. L., Tynan, C. J., Webb, S. E. A 'pocket guide' to total internal reflection fluorescence. Journal of Microscopy. 252 (1), 16-22 (2013).
- Holzmeister, P., Acuna, G. P., Grohmann, D., Tinnefeld, P. Breaking the concentration limit of optical single-molecule detection. Chemical Society Reviews. 43 (4), 1014-1028 (2014).
- Scheer, M., et al. BRENDA, the enzyme information system in 2011. Nucleic Acids Research. 39, 670-676 (2011).
- Kudva, R., et al. Protein translocation across the inner membrane of Gram-negative bacteria: the Sec and Tat dependent protein transport pathways. Research in Microbiology. 164 (6), 505-534 (2013).
- Talkad, V., Schneider, E., Kennell, D. Evidence for variable rates of ribosome movement in Escherichia coli. Journal of Molecular Biology. 104 (1), 299-303 (1976).
- Blanchard, S. C., Kim, H. D., Gonzalez, R. L., Puglisi, J. D., Chu, S. tRNA dynamics on the ribosome during translation. Proceedings of the National Academy of Sciences of the United States of America. 101 (35), 12893-12898 (2004).
- Dunkle, J. A., et al. Structures of the bacterial ribosome in classical and hybrid states of tRNA binding. Science. 332 (6032), 981-984 (2011).
- Kim, H. D., Puglisi, J. D., Chu, S. Fluctuations of transfer RNAs between classical and hybrid states. Biophysical Journal. 93 (10), 3575-3582 (2007).
- Levene, M. J., et al. Zero-mode waveguides for single-molecule analysis at high concentrations. Science. 299 (5607), 682-686 (2003).
- Zhu, P., Craighead, H. G. Zero-mode waveguides for single-molecule analysis. Annual Review of Biophysics. 41, 269-293 (2012).
- Pollack, G. L., Stump, D. R. Electromagnetism. , Addison-Wesley. Boston, MA. (2002).
- Jackson, J. D. Classical electrodynamics. Third edition. , Wiley. New York, NY. (1999).
- Crouch, G. M., Han, D., Bohn, P. W. Zero-mode waveguide nanophotonic structures for single molecule characterization. Journal of Physics D: Applied Physics. 51 (19), 193001 (2018).
- Wenger, J., et al. Dual-color fluorescence cross-correlation spectroscopy in a single nanoaperture: towards rapid multicomponent screening at high concentrations. Optics Express. 14 (25), 12206-12216 (2006).
- Goldschen-Ohm, M. P., et al. Structure and dynamics underlying elementary ligand binding events in human pacemaking channels. eLife. 5, 20797 (2016).
- Miyake, T., et al. Real-Time Imaging of Single-Molecule Fluorescence with a Zero-Mode Waveguide for the Analysis of Protein-Protein Interaction. Analytical Chemistry. 80 (15), 6018-6022 (2008).
- Zhao, J., Branagan, S. P., Bohn, P. W. Single-Molecule Enzyme Dynamics of Monomeric Sarcosine Oxidase in a Gold-Based Zero-Mode Waveguide. Applied Spectroscopy. 66 (2), 163-169 (2012).
- Fore, S., Yuen, Y., Hesselink, L., Huser, T. Pulsed-interleaved excitation FRET measurements on single duplex DNA molecules inside C-shaped nanoapertures. Nano Letters. 7 (6), 1749-1756 (2007).
- Rigneault, H., et al. Enhancement of single-molecule fluorescence detection in subwavelength apertures. Physical Review Letters. 95 (11), 117401 (2005).
- Foquet, M., et al. Improved fabrication of zero-mode waveguides for single-molecule detection. Journal of Applied Physics. 103 (3), 034301 (2008).
- Wada, J., et al. Fabrication of Zero-Mode Waveguide by Ultraviolet Nanoimprint Lithography Lift-Off Process. Japanese Journal of Applied Physics. 50 (6), 06 (2011).
- Fischer, U. C., Zingsheim, H. P. Submicroscopic pattern replication with visible light. Journal of Vacuum Science and Technology. 19 (4), 881-885 (1981).
- Deckman, H. W., Dunsmuir, J. H. Natural lithography. Applied Physics Letters. 41 (4), 377-379 (1982).
- Li, B., Zhou, D., Han, Y. Assembly and phase transitions of colloidal crystals. Nature Reviews Materials. 1 (2), 15011 (2016).
- Bohn, J. J., Tikhonov, A., Asher, S. A. Colloidal crystal growth monitored by Bragg diffraction interference fringes. Journal of Colloid and Interface Science. 350 (2), 381-386 (2010).
- Dimitrov, A. S., Nagayama, K. Continuous Convective Assembling of Fine Particles into Two-Dimensional Arrays on Solid Surfaces. Langmuir. 12 (5), 1303-1311 (1996).
- Pisco, M., et al. Nanosphere lithography for optical fiber tip nanoprobes. Light: Science & Applications. 6 (5), 16229 (2017).
- Chandramohan, A., et al. Model for large-area monolayer coverage of polystyrene nanospheres by spin coating. Scientific Reports. 7, 40888 (2017).
- Besra, L., Liu, M. A review on fundamentals and applications of electrophoretic deposition (EPD). Progress in Materials Science. 52 (1), 1-61 (2007).
- Yu, J., et al. Preparation of High-Quality Colloidal Mask for Nanosphere Lithography by a Combination of Air/Water Interface Self-Assembly and Solvent Vapor Annealing. Langmuir. 28 (34), 12681-12689 (2012).
- Jamiolkowski, R. M., et al. Nanoaperture fabrication via colloidal lithography for single molecule fluorescence analysis. PLoS ONE. 14 (10), 0222964 (2019).
- Innocenzi, P., et al. Evaporation of Ethanol and Ethanol-Water Mixtures Studied by Time-Resolved Infrared Spectroscopy. The Journal of Physical Chemistry A. 112 (29), 6512-6516 (2008).
- Rieger, J. The glass transition temperature of polystyrene. Journal of Thermal Analysis. 46 (3), 965-972 (1996).
- Donev, A., Torquato, S., Stillinger, F. H., Connelly, R. Jamming in hard sphere and disk packings. Journal of Applied Physics. 95 (3), 989-999 (2004).
- Kinz-Thompson, C. D., et al. Robustly Passivated, Gold Nanoaperture Arrays for Single-Molecule Fluorescence Microscopy. ACS Nano. 7 (9), 8158-8166 (2013).
- Korlach, J., et al. Selective aluminum passivation for targeted immobilization of single DNA polymerase molecules in zero-mode waveguide nanostructures. Proceedings of the National Academy of Sciences of the United States of America. 105 (4), 1176-1181 (2008).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. Journal of Visualized Experiments. (86), e50549 (2014).
- Plénat, T., Yoshizawa, S., Fourmy, D. DNA-Guided Delivery of Single Molecules into Zero-Mode Waveguides. ACS Applied Materials & Interfaces. 9 (36), 30561-30566 (2017).
- Kudalkar, E. M., Davis, T. N., Asbury, C. L. Single-Molecule Total Internal Reflection Fluorescence Microscopy. Cold Spring Harbor protocols. 2016 (5), 077800 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Hoogenboom, J. P., Derks, D., Vergeer, P., Blaaderen, A. v Stacking faults in colloidal crystals grown by sedimentation. The Journal of Chemical Physics. 117 (24), 11320-11328 (2002).
- Micheletto, R., Fukuda, H., Ohtsu, M. A Simple Method for the Production of a Two-Dimensional, Ordered Array of Small Latex Particles. Langmuir. 11 (9), 3333-3336 (1995).
- Denkov, N., et al. Mechanism of formation of two-dimensional crystals from latex particles on substrates. Langmuir. 8 (12), 3183-3190 (1992).
- Okubo, T. Convectional, sedimentation and drying dissipative patterns of colloidal crystals of poly(methyl methacrylate) spheres on a watch glass. Colloid and Polymer Science. 286 (11), 1307-1315 (2008).
- Ye, S., Routzahn, A. L., Carroll, R. L. Fabrication of 3D Metal Dot Arrays by Geometrically Structured Dynamic Shadowing Lithography. Langmuir. 27 (22), 13806-13812 (2011).
- Zhao, Y., et al. Dark-Field Illumination on Zero-Mode Waveguide/Microfluidic Hybrid Chip Reveals T4 Replisomal Protein Interactions. Nano Letters. 14 (4), 1952-1960 (2014).
- Goldschen-Ohm, M. P., White, D. S., Klenchin, V. A., Chanda, B., Goldsmith, R. H. Observing Single-Molecule Dynamics at Millimolar Concentrations. Angewandte Chemie International Edition. 56 (9), 2399-2402 (2017).
- Noriega, T. R., Chen, J., Walter, P., Puglisi, J. D. Real-time observation of signal recognition particle binding to actively translating ribosomes. eLife. 3, 04418 (2014).
- Uemura, S., et al. Real-time tRNA transit on single translating ribosomes at codon resolution. Nature. 464 (7291), 1012-1017 (2010).
- Choi, J., Puglisi, J. D. Three tRNAs on the ribosome slow translation elongation. Proceedings of the National Academy of Sciences of the United States of America. 114 (52), 13691-13696 (2017).
- Eid, J., et al. Real-Time DNA Sequencing from Single Polymerase Molecules. Science. 323 (5910), 133-138 (2009).
- Martin, W. E., Srijanto, B. R., Collier, C. P., Vosch, T., Richards, C. I. A Comparison of Single-Molecule Emission in Aluminum and Gold Zero-Mode Waveguides. The Journal of Physical Chemistry A. 120 (34), 6719-6727 (2016).
- Wenger, J., et al. Single molecule fluorescence in rectangular nano-apertures. Optics Express. 13 (18), 7035-7044 (2005).
- Pineda, A. C., Ronis, D. Fluorescence quenching in molecules near rough metal surfaces. The Journal of Chemical Physics. 83 (10), 5330-5337 (1985).
Tags
Bioingeniería Número 159 guías de onda de modo cero nano-apertura fluorescencia de molécula única litografía de nanoesfera cristal coloidal autoensamblajeErratum
Formal Correction: Erratum: Fabrication of Zero Mode Waveguides for High Concentration Single Molecule Microscopy
Posted by JoVE Editors on 08/10/2021.
Citeable Link.
An erratum was issued for: Fabrication of Zero Mode Waveguides for High Concentration Single Molecule Microscopy. A figure was updated.
Figure 3 was updated from:
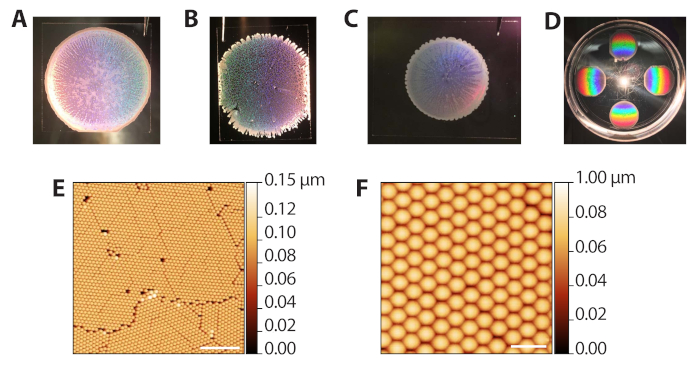
Figure 3: Representative results from evaporative deposition of colloids. (A) Example of optimal colloid deposition. (B) Example of an acceptable colloid deposition in which conditions were more humid (80% RH) than ideal. Holes in the crystal monolayer are apparent. (C) Example of an acceptable colloid deposition in which conditions were drier (65% RH) than optimal. The monolayer regions are slightly translucent while multilayered areas are white and opaque (perimeter and streaks inward). (D) A colloidal crystal illuminated with white light to highlight the rainbow diffraction from the crystals. (E) AFM image (tapping probe AFM in air) of a monolayer of hexagonally packed polystyrene beads from a successful colloid deposition (scale bar = 10 µm). (F) Expanded AFM image of packed beads (scale bar = 2 µm). Please click here to view a larger version of this figure.
to:
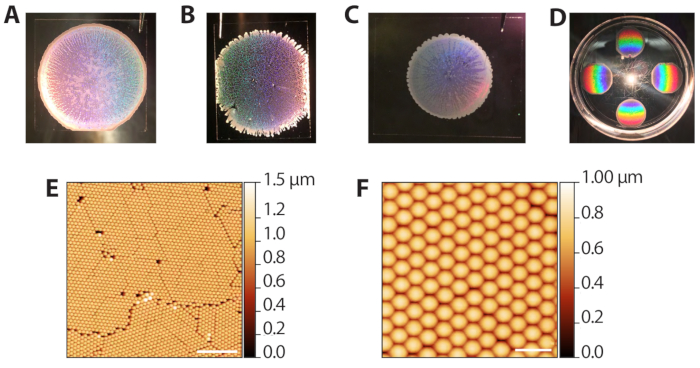
Figure 3: Representative results from evaporative deposition of colloids. (A) Example of optimal colloid deposition. (B) Example of an acceptable colloid deposition in which conditions were more humid (80% RH) than ideal. Holes in the crystal monolayer are apparent. (C) Example of an acceptable colloid deposition in which conditions were drier (65% RH) than optimal. The monolayer regions are slightly translucent while multilayered areas are white and opaque (perimeter and streaks inward). (D) A colloidal crystal illuminated with white light to highlight the rainbow diffraction from the crystals. (E) AFM image (tapping probe AFM in air) of a monolayer of hexagonally packed polystyrene beads from a successful colloid deposition (scale bar = 10 µm). (F) Expanded AFM image of packed beads (scale bar = 2 µm). Please click here to view a larger version of this figure.



