18.8:
البطاريات وخلايا الوقود
18.8:
البطاريات وخلايا الوقود
البطارية عبارة عن خلية جلفانية تُستخدم كمصدر للطاقة الكهربائية لتطبيقات محددة. توجد البطاريات الحديثة بأشكال متعددة لاستيعاب التطبيقات المختلفة، من بطاريات الأزرار الصغيرة مثل تلك التي تشغل ساعات اليد إلى البطاريات الكبيرة جدًا المستخدمة لتوفير الطاقة الاحتياطية لشبكات الطاقة في المدينة. تم تصميم بعض البطاريات للتطبيقات ذات الاستخدام الفردي ولا يمكن إعادة شحنها (الخلايا الأولية)، بينما يعتمد البعض الآخر على تفاعلات الخلايا القابلة للعكس بشكل ملائم والتي تسمح بإعادة الشحن بواسطة مصدر طاقة خارجي (خلايا ثانوية).
بطاريات للاستخدام الفردي (أساسي)
الخلية الجافة هي بطارية أساسية شائعة تستخدم الزنك كحاوية وأنود (“–” طرف) وقضيب جرافيت ككاثود (“+” طرف). يتم تعبئة علبة الزنك بمعجون إلكتروليت يحتوي على أكسيد المنغنيز (IV) وكلوريد الزنك (II) وكلوريد الأمونيوم والماء. يتم غمر قضيب الجرافيت في عجينة الإلكتروليت لإكمال الخلية. يتضمن تفاعل الخلية العفوي:
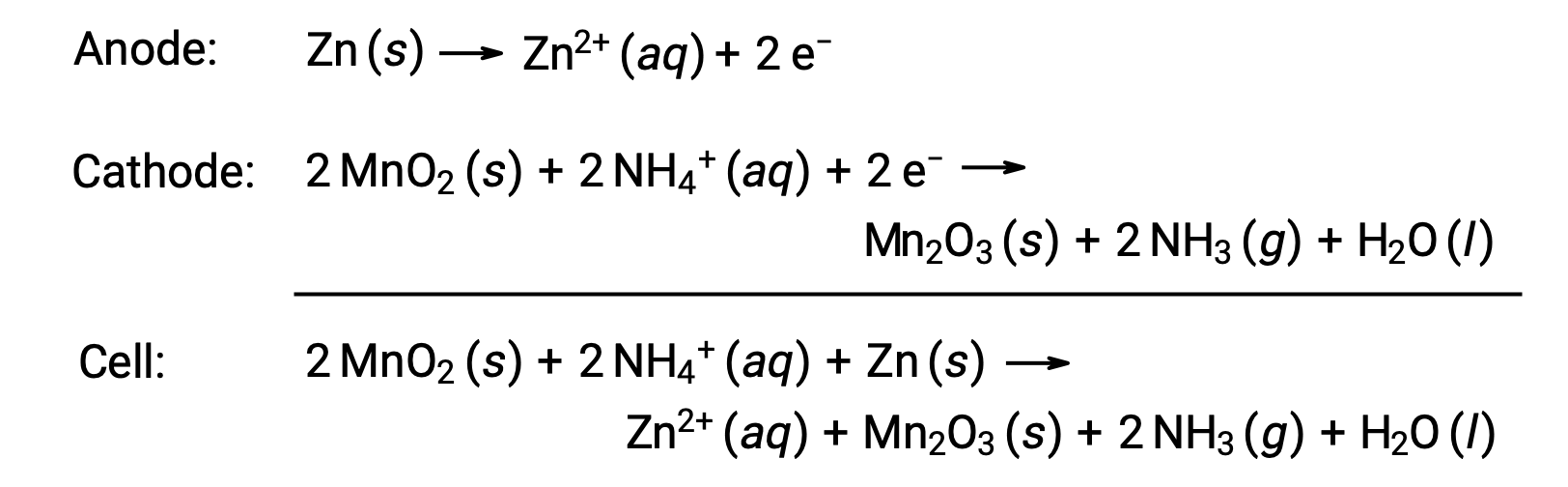
الجهد (<em جهد الخلية) لخلية جافة هو تقريبًا 1.5 فولت (Ecell ~ 1.5 فولت). تتوفر الخلايا الجافة بأحجام مختلفة (على سبيل المثال،D, C, AA, AAA). تشتمل جميع أحجام الخلايا الجافة على نفس المكونات وتُظهر نفس الجهد، ولكن الخلايا الأكبر تحتوي على كميات أكبر من متفاعلات الأكسدة والاختزال وبالتالي فهي قادرة على نقل كميات أكبر من الشحنة. مثل الخلايا الجلفانية الأخرى، يمكن توصيل الخلايا الجافة في سلسلة لإنتاج بطاريات ذات مخرجات جهد أكبر، إذا لزم الأمر.
تم تصميم البطاريات القلوية حول نفس أزواج الأكسدة والاختزال مثل الخلية الجافة. كما يوحي اسمها، تستخدم هذه الأنواع من البطاريات إلكتروليتات قلوية، غالباً من هيدروكسيد البوتاسيوم. التفاعلات هي
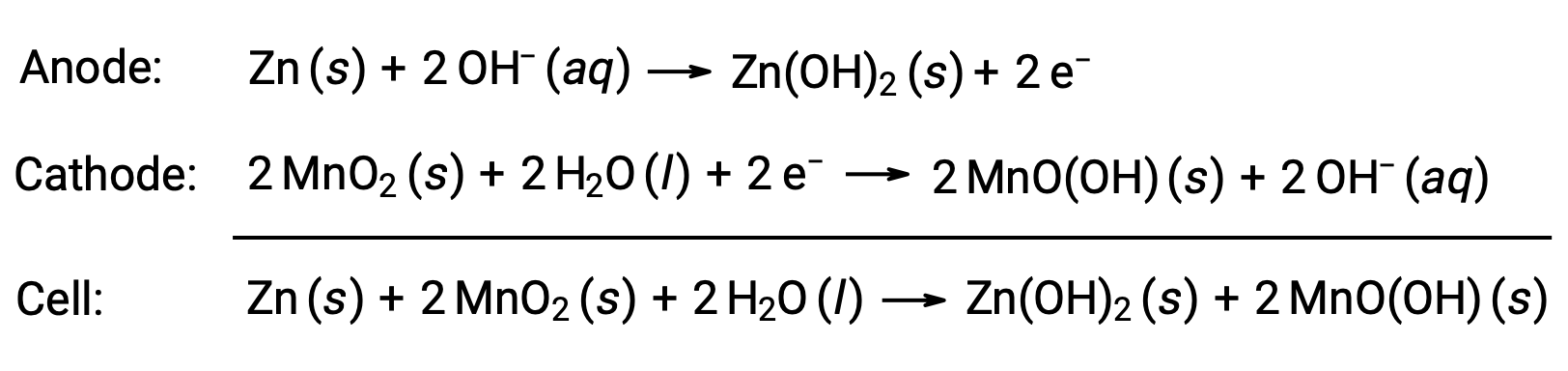
يمكن أن توفر البطارية القلوية حوالي ثلاثة إلى خمسة أضعاف طاقة خلية جافة من نفس الحجم (Eخلية = +1.43 فولت). البطاريات القلوية عرضة لتسريب هيدروكسيد البوتاسيوم، لذا يجب إزالتها من الأجهزة عند تخزينها على المدى الطويل. في حين أن بعض البطاريات القلوية قابلة لإعادة الشحن، إلا أن معظمها غير قابل لإعادة الشحن.
بطاريات (ثانوية) قابلة لإعادة الشحن
تتكون بطاريات النيكل والكادميوم أو NiCd من الكاثود المطلي بالنيكل، والأنود المطلي بالكادميوم، وقطب هيدروكسيد البوتاسيوم. يتم لف الألواح الموجبة والسالبة، التي يمنعها الفاصل من القَصر الكهربائي، معاً ووضعها في العلبة. يسمح هذا التصميم لخلية NiCd بتقديم تيار أكثر بكثير من بطارية قلوية مماثلة الحجم. ردود الفعل
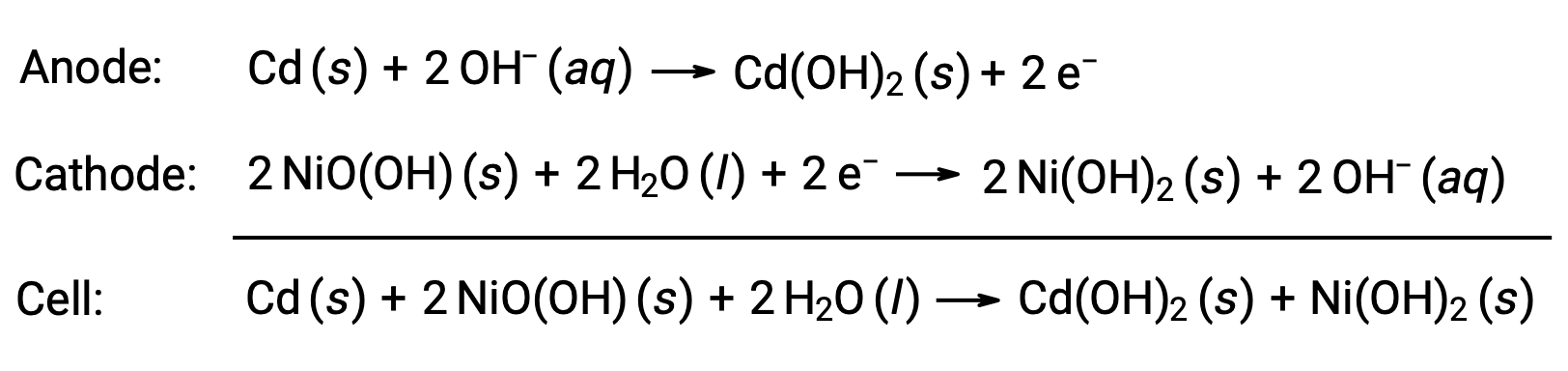
عند المعالجة بشكل صحيح، يمكن إعادة شحن بطارية NiCd حوالي 1000 مرة ( Eخلية ~ 1.3 فولت). الكادميوم معدن ثقيل سام، لذا لا ينبغي أبداً تمزيق أو حرق بطاريات NiCd، ويجب التخلص منها وفقاً لإرشادات النفايات السامة ذات الصلة.
تعد بطاريات الليثيوم-أيون من أشهر البطاريات القابلة لإعادة الشحن وتستخدم في العديد من الأجهزة الإلكترونية المحمولة. ردود الفعل
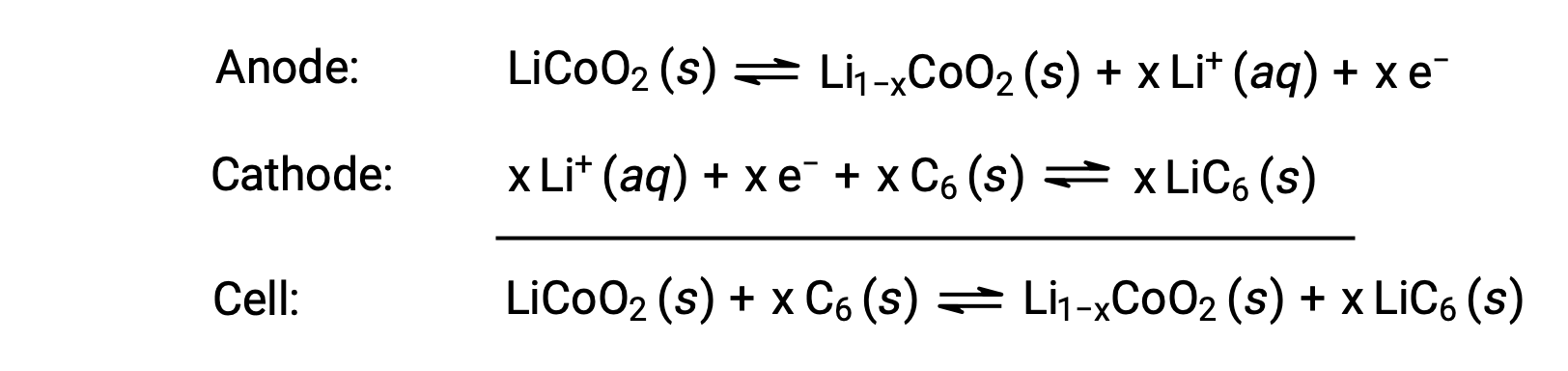
يؤدي القياس المتكافئ المتغير لتفاعل الخلية إلى تباين في جهد الخلية، ولكن بالنسبة للظروف النموذجية، لا تزيد قيمة x عادة عن 0.5، ويبلغ جهد الخلية 3.7 فولت تقريباً (Eخلية ~ 3.7). تشتهر بطاريات الليثيوم لأنها توفر كمية كبيرة من التيار، وهي أخف من البطاريات المماثلة من الأنواع الأخرى ، وتنتج جهداً كهربائياً ثابتاً تقريباً أثناء تفريغها، وتفقد شحنتها ببطء عند تخزينها.
تعد بطارية الرصاص الحمضية أيضاً نوعاً من البطاريات الثانوية التي يشيع استخدامها في السيارات. إنها غير مكلفة وقادرة على إنتاج التيار العالي الذي تتطلبه محركات بدء تشغيل السيارات. تفاعلات بطارية الرصاص الحمضية هي
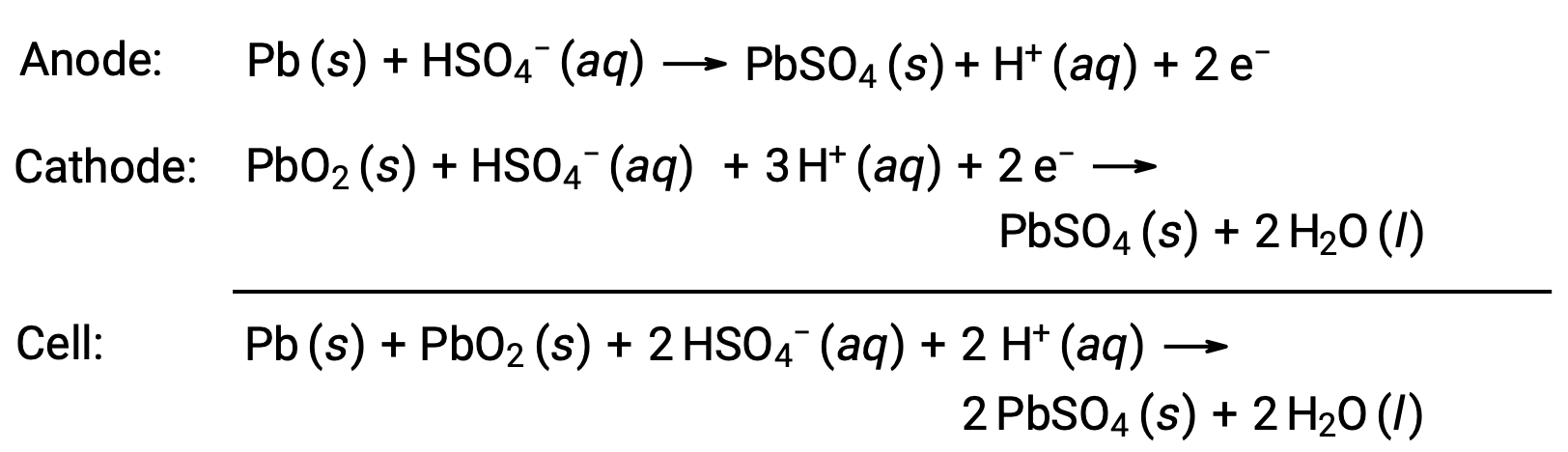
تنتج كل خلية 2 فولت (Eخلية ~ 2 فولت)، لذلك يتم توصيل ست خلايا في سلسلة لإنتاج بطارية سيارة بجهد 12 فولت. بطاريات الرصاص الحمضية ثقيلة وتحتوي على سائل كاوي بالكهرباء، H2SO4 (aq)، لكنها غالباً ما تكون البطارية المفضلة بسبب كثافة تيارها العالية. نظراً لأن هذه البطاريات تحتوي على كمية كبيرة من الرصاص، فيجب دائماً التخلص منها بشكل صحيح.
خلايا الوقود
خلية الوقود هي خلية كلفانية تستخدم أنواع وقود احتراق تقليدية، غالباً الهيدروجين أو الميثان، والتي يتم تغذيتها باستمرار في الخلية جنباً إلى جنب مع مادة مؤكسدة. داخل الخلية، يخضع الوقود والمؤكسد لنفس كيمياء الأكسدة والاختزال كما هو الحال عند احتراقهما، ولكن عبر كهروكيميائي محفّز يكون أكثر كفاءة بشكل ملحوظ. على سبيل المثال، تستخدم خلية وقود الهيدروجين النموذجية أقطاب الجرافيت المضمنة مع محفزات قائمة على البلاتين لتسريع تفاعلات نصف الخلية:
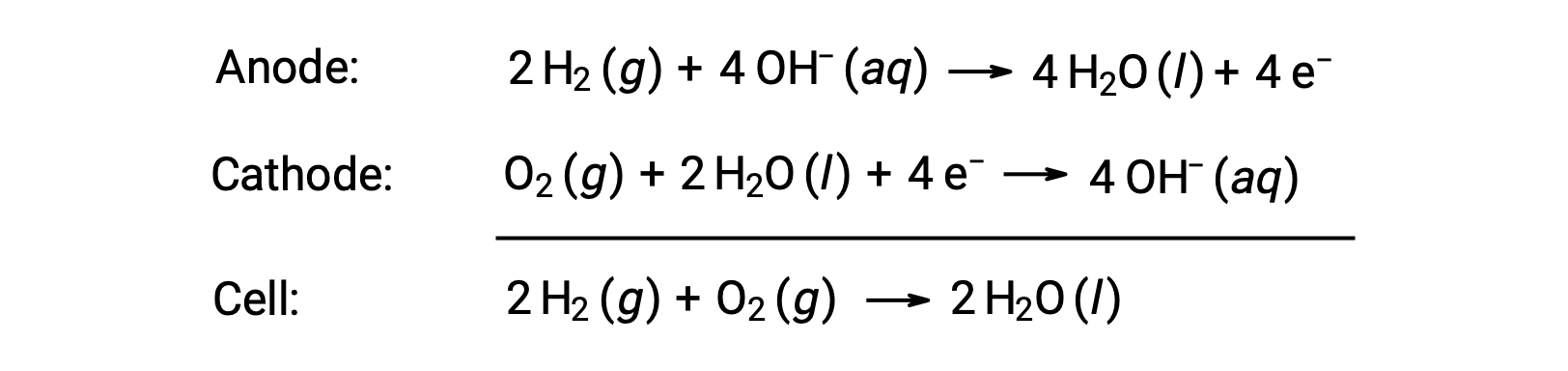
عادةً ما تُنتج هذه الأنواع من خلايا الوقود جهداً كهربائياً تقريباً 1.23 V (Eخلية ~ 1.23 فولت). بالمقارنة مع محرك الاحتراق الداخلي، فإن كفاءة الطاقة لخلية الوقود التي تستخدم نفس تفاعل الأكسدة والاختزال تكون عادةً أكثر من الضعف (~20%–25% لمحرك مقابل ~50%–75% لخلية طاقة). تُستخدم خلايا وقود الهيدروجين بشكل شائع في المهام الفضائية الطويلة، وقد تم تطوير نماذج أولية للمركبات الشخصية.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 17.5: Batteries, and Fuel Cells.
