18.8:
電池及び燃料電池
18.8:
電池及び燃料電池
電池とは、特定の用途のための電力源として使用されるような、電気化学反応を駆動力とするデバイスのことです。現代の電池には、腕時計に使われるような小さなボタン電池から、自治体の電力網にバックアップエネルギーを供給するための超大型の電池まで、さまざまな用途に応じて多様な形態があります。電池には、充電できない使い捨てタイプのもの(一次電池)と、可逆的な電気化学反応を利用して外部電源からの充電を可能にしたもの(二次電池)があります。
(使い捨て)一次電池
乾電池は一般的な一次電池であり、容器とアノード( “–”端子)の両方にZnを使用し、カソード( “+”端子)に黒鉛棒を使用します。Zn缶の中には、酸化マンガン(IV)、塩化亜鉛(II)、塩化アンモニウム、水を含む電解質ペーストが入っています。黒鉛棒を電解質ペーストに浸すことで電池が完成します。自発的な電池反応は、次の通りです。
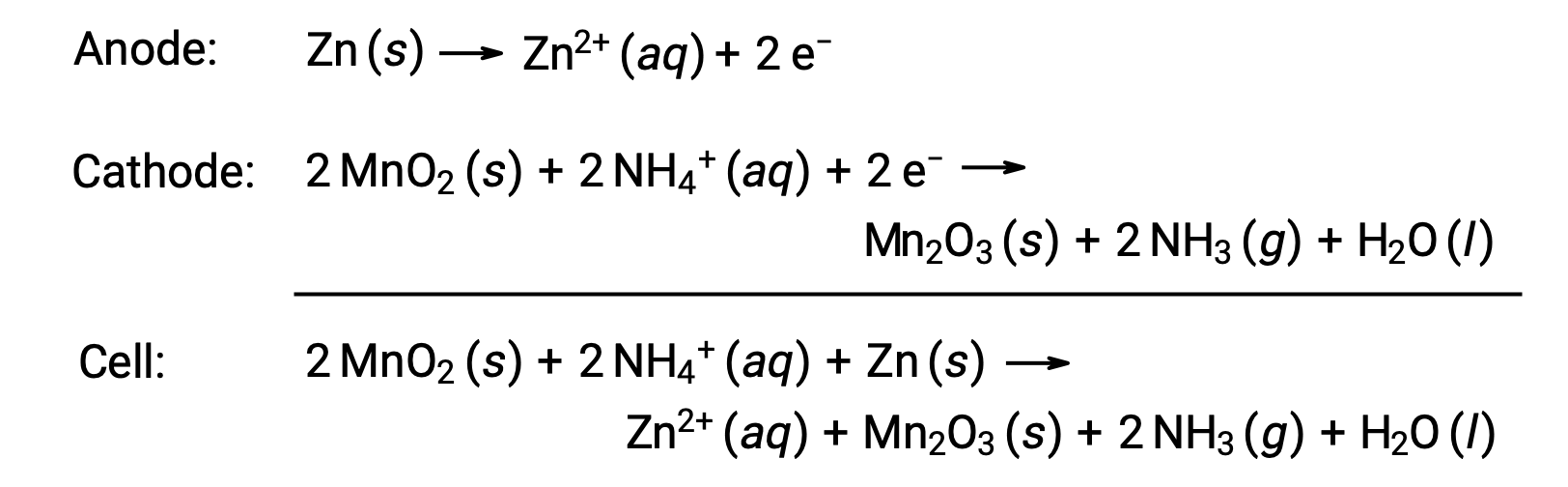
乾電池の電圧(電極電位差)は、約1.5 V(Ecell ~1.5V)です。乾電池には様々なサイズがある(例えば、単一型、単二型、単三型 など)。どのサイズの乾電池も構成要素は同じために電圧は同一ですが、大きなサイズの乾電池は酸化還元剤の量が多く、それに応じて大きな電荷を移動させることができます。他のガルバニ電池と同様に、必要に応じて乾電池を直列に接続することで、より高い電圧の電池を作ることができます。
アルカリ乾電池は、乾電池と同じ酸化還元反応を利用して設計された電池で、その名の通りアルカリ性の電解液(主に水酸化カリウム)を使用しています。その反応は次の通りです。
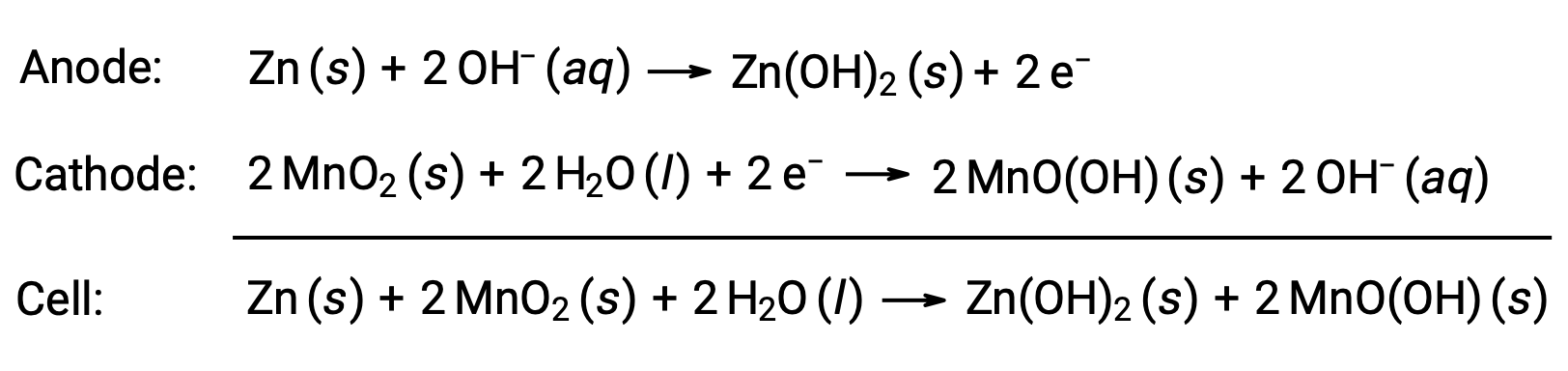
アルカリ乾電池は、同サイズの乾電池に比べて約3~5倍のエネルギーを供給することができる(Ecell = +1.43 V)。アルカリ乾電池は、水酸化カリウムが漏れやすいため、長期保存する場合は機器から外しておく必要があります。また、一部のアルカリ乾電池は充電可能ですが、ほとんどは充電できません。
(充電可能)二次電池
ニッケル・カドミウム(NiCd)電池は、ニッケルメッキされたカソード、カドミウムメッキされたアノード、水酸化カリウム電解質で構成されています。セパレーターで短絡を防いだ正極板と負極板を一緒に巻き込んで構築されています。この設計により、NiCd電池は同サイズのアルカリ電池よりもはるかに多くの電流を流すことができます。その反応は次の通りです。
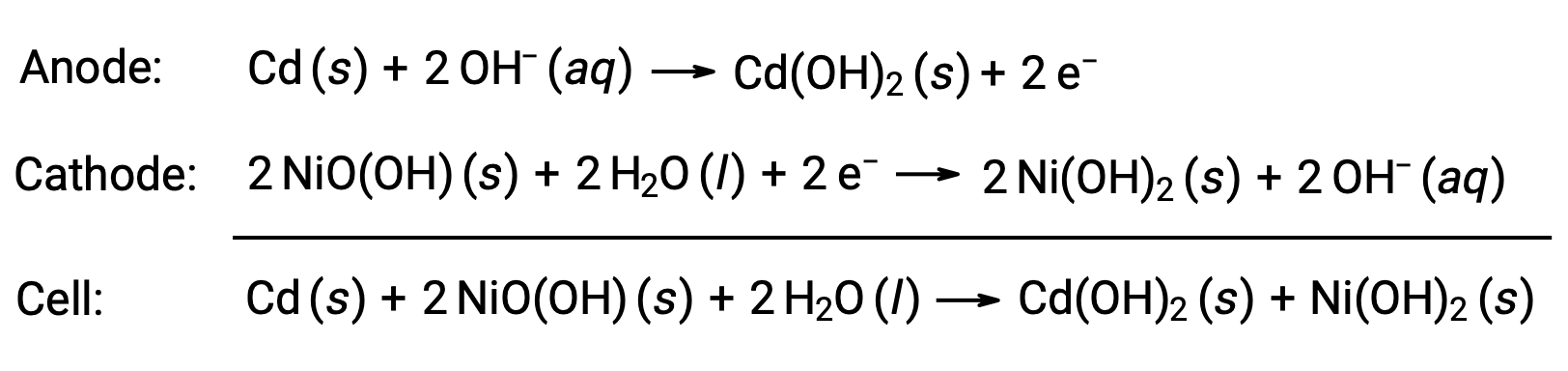
適切に扱えば、NiCd電池は約1000回(Ecell~1.3V)充電することができます。カドミウムは有毒な重金属であるため、NiCd電池は絶対に破裂させたり焼却したりせず、関連する有害廃棄物ガイドラインに従って廃棄する必要があります。
リチウムイオン電池は、最も一般的な二次電池であり、多くの携帯型電子機器に使用されています。その反応は次の通りです。
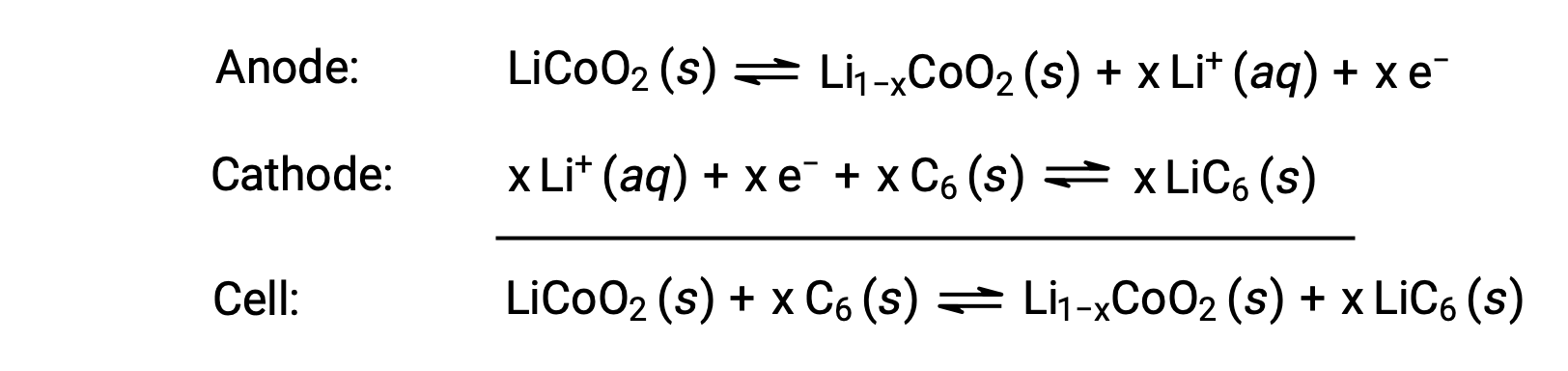
電池反応における化学量論が変化するために電極電位差も変化しますが、一般条件下のxは通常0.5以下で、電極電位差は約3.7 V(Ecell ~3.7 V)となります。リチウム電池は大電流を流すことができ、他の種類の電池に比べて軽く、放電してもほぼ一定の電圧が得られ、保存してもゆっくりとしか充電されない等の利点から非常に需要が高いです。
鉛蓄電池は、自動車用二次電池の一種であり、安価でスターターモーターに必要な大電流を流すことができます。鉛蓄電池の反応は次の通りです。
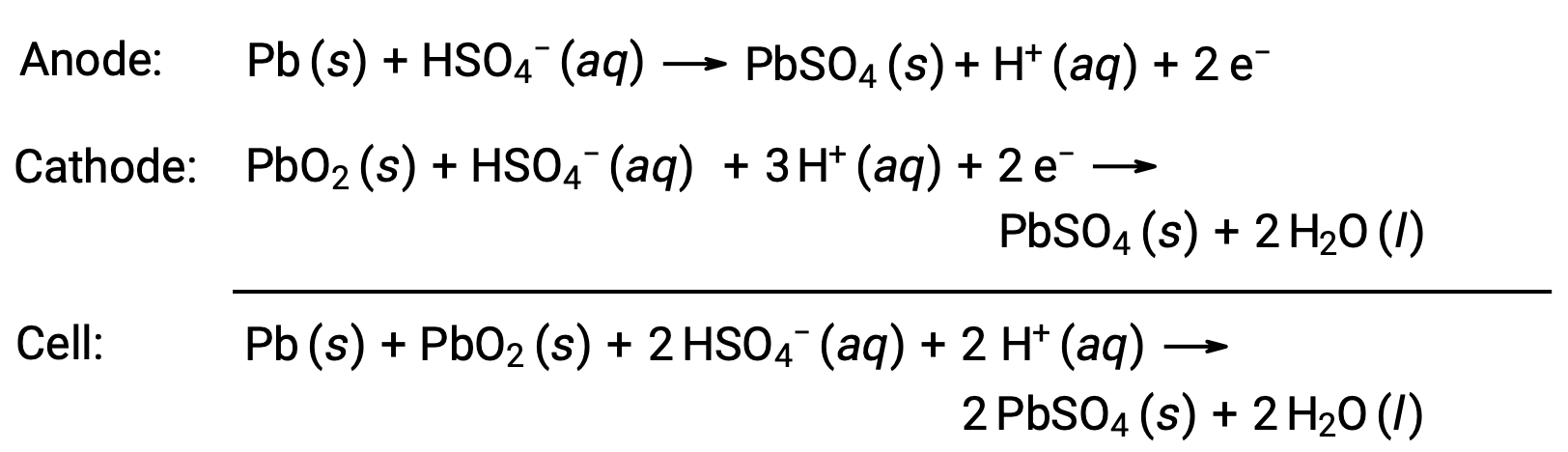
1個の電池で2 V(Ecell ~2 V)の電圧が得られるため、6個の電池を直列に接続すると12Vの自動車用バッテリーになります。鉛蓄電池は重く、電解液には腐食性のあるH2SO4(aq)が含まれていますが、電流密度が高いために今でもよく利用されます。これらの電池には大量の鉛が含まれているため、必ず適切に廃棄しなければなりません。
燃料電池
燃料電池とは、燃料(多くの場合、水素またはメタン)を酸化剤とともに連続的に電池に供給するガルバニ電池です。燃料電池内では、燃料と酸化剤は燃焼時と同じ酸化還元反応を起こすが、触媒を用いた電気化学反応によって反応効率が大幅に向上します。例えば、一般的な水素燃料電池では、グラファイト電極に白金系触媒を埋め込み、2つの半電池反応を促進させています。
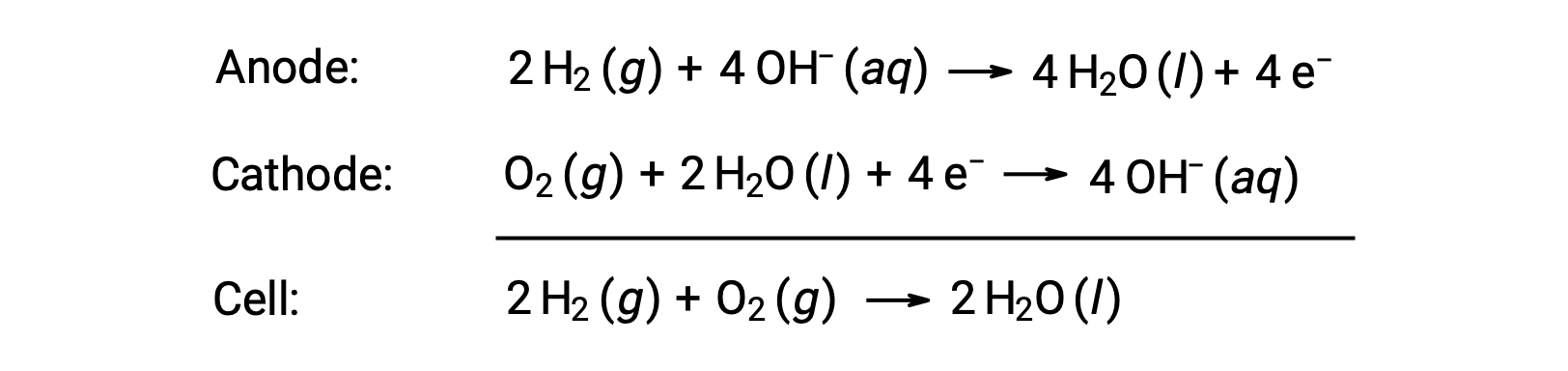
このタイプの燃料電池は、一般的に約1.23 Vの電圧を発生させる(Ecell ~1.23 V)。同じ酸化還元反応を利用する燃料電池のエネルギー効率は、内燃機関と比較して2倍以上になる(内燃機関:約20%–25%、燃料電池:約50%–75%)。水素燃料電池は、長期にわたる宇宙探索で使用されており、個人用車両のプロトタイプも開発されています。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 17.5: Batteries, and Fuel Cells.
