18.8:
Batteries et piles à combustible
18.8:
Batteries et piles à combustible
Une pile est une cellule galvanique utilisée comme source d’alimentation électrique pour des applications précises. Les piles modernes existent sous de nombreuses formes pour s’adapter à diverses applications, allant des toutes petites piles boutons telles que celles qui alimentent les montres de poignet aux très grandes batteries utilisées pour fournir de l’énergie de secours aux réseaux électriques municipaux. Certaines piles sont conçues pour des applications à usage unique et ne peuvent pas être rechargées (cellules primaires), tandis que d’autres sont basées sur des réactions de cellule facilement réversibles qui permettent la recharge grâce à une source d’alimentation externe (cellules secondaires).
Piles à usage unique (primaires)
Une pile sèche est une cellule primaire courante qui utilise le zinc à la fois comme réceptacle et comme anode (borne “–”) et une tige en graphite comme cathode (borne “+”). Le boîtier en Zn est rempli d’une pâte électrolytique contenant de l’oxyde de manganèse(IV), du chlorure de zinc(II), du chlorure d’ammonium et de l’eau. Une tige en graphite est immergée dans la pâte électrolytique pour compléter la pile. La réaction spontanée de la cellule implique :
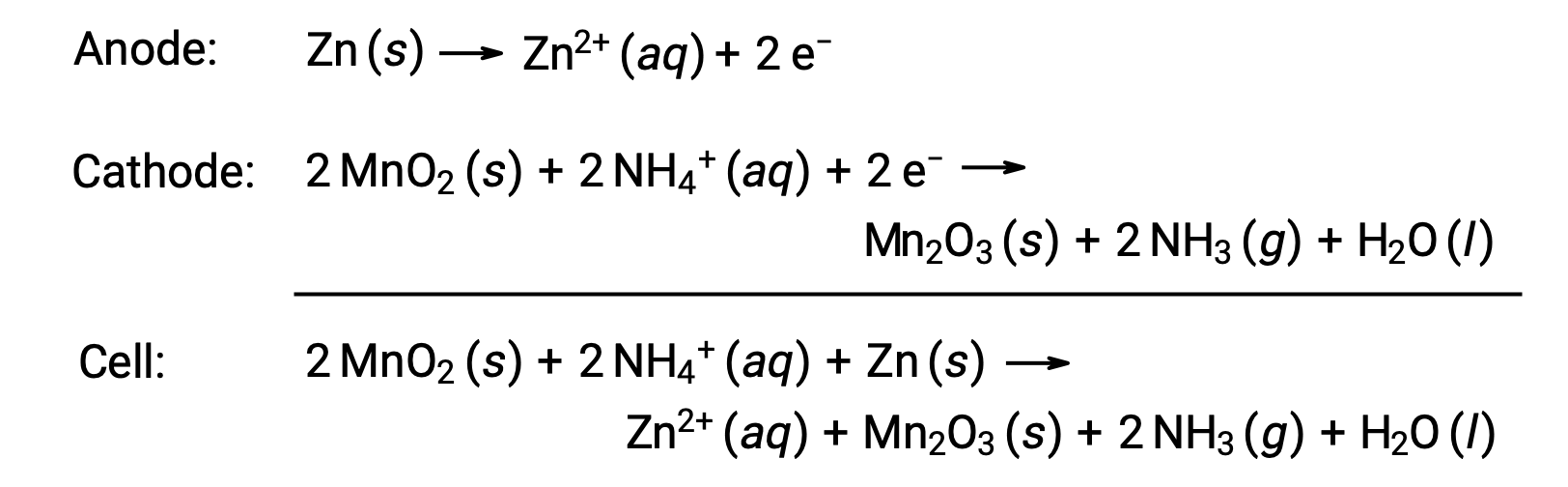
La tension (potentiel de cellule) d’une pile sèche est d’environ 1,5 V (Ecellule ~ 1,5 V). Les piles sèches sont disponibles dans des tailles différentes (par exemple, D, C, AA, AAA). Toutes les tailles de piles sèches comprennent les mêmes composants et présentent la même tension, mais les cellules plus grandes contiennent de plus grandes quantités de réactifs redox et sont donc capables de transférer des quantités de charge proportionnellement plus élevées. Comme les autres cellules galvaniques, les piles sèches peuvent être connectées en série pour produire des batteries avec des sorties de tension plus élevées, si nécessaire.
Les piles alcalines ont été conçues autour des mêmes couples redox que la pile sèche. Comme leur nom l’indique, ces types de piles utilisent des électrolytes alcalins, souvent de l’hydroxyde de potassium. Les réactions sont :
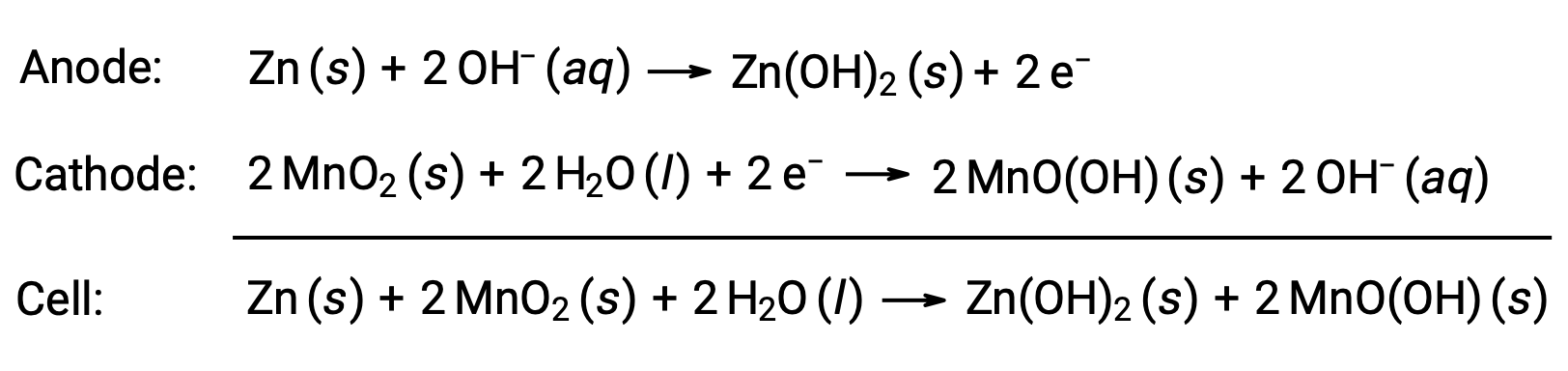
Une pile alcaline peut fournir environ trois à cinq fois l’énergie d’une pile sèche de taille similaire (Ecellule = +1,43 V). Les piles alcalines sont sujettes à des fuites d’hydroxyde de potassium. Elles doivent donc être retirées des dispositifs pour un stockage à long terme. Bien que certaines piles alcalines soient rechargeables, la plupart ne le sont pas.
Piles rechargeables (secondaires)
Les piles au nickel-cadmium, ou NiCd, sont constitués d’une cathode nickelé, d’une anode plaquée au cadmium et d’une électrode d’hydroxyde de potassium. Les plaques positive et négative, qui ne peuvent pas être court-circulées par le séparateur, sont enroulées ensemble et placées dans le boîtier. Cette conception permet à la cellule NiCd de fournir beaucoup plus de courant qu’une pile alcaline de taille similaire. Les réactions sont :
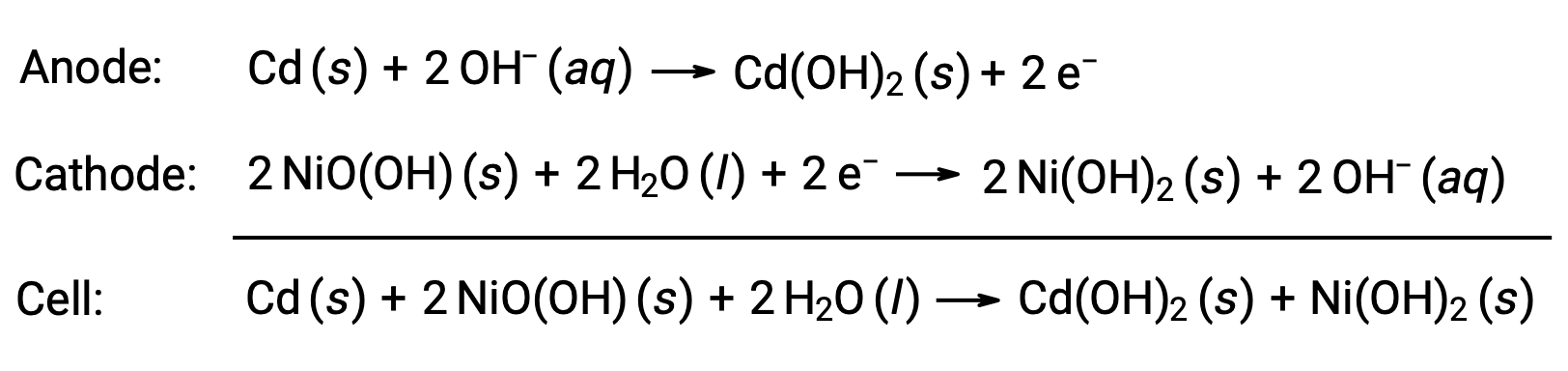
Lorsqu’elle est correctement utilisée, une pile NiCd peut être rechargé environ 1000 fois (Ecellule ~ 1,3 V). Le cadmium est un métal lourd toxique. Par conséquent, les piles NiCd ne doivent jamais être rompues ou incinérées et on doit s’en débarrasser conformément aux directives relatives aux déchets toxiques.
Les piles à l’ion lithium sont parmi les piles rechargeables les plus populaires et sont utilisées dans de nombreux appareils électroniques portables. Les réactions sont :
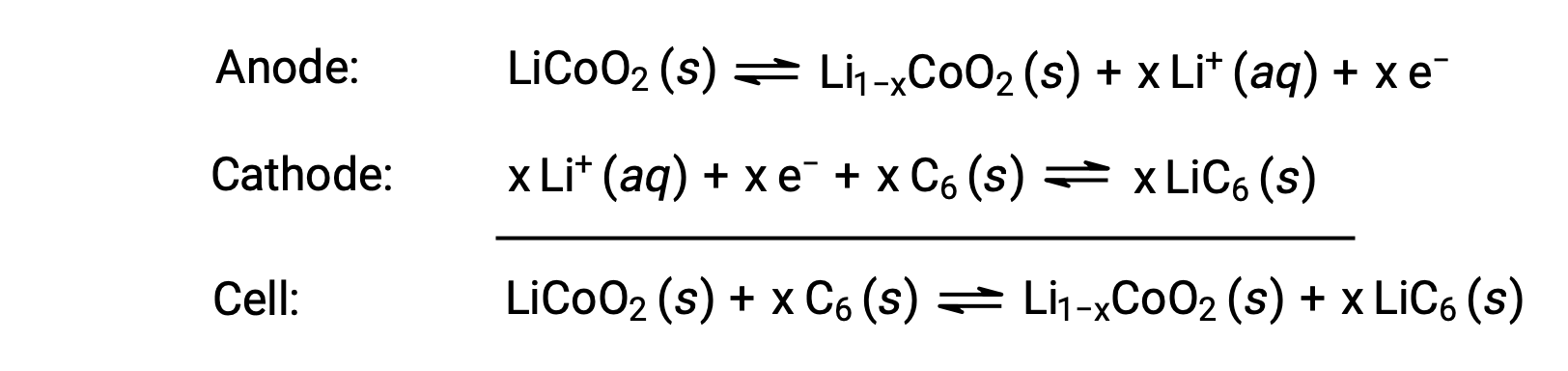
La stœchiométrie variable de la réaction des cellules entraîne une variation des tensions de cellule, mais dans des conditions usuelles, x n’est généralement pas supérieur à 0,5 et la tension de cellule est d’environ 3,7 V (Ecellule ~ 3,7). Les piles au lithium sont répandues car elles peuvent fournir une grande quantité de courant, elles sont plus légères que les autres types de piles comparables, elles produisent une tension presque constante lorsqu’elles se déchargent et perdent leur charge lentement lorsqu’elles sont stockées.
L’accumulateur au plomb-acide est également un type de batterie secondaire couramment utilisé dans les automobiles. Il est bon marché et capable de produire le courant élevé requis par les démarreurs d’automobiles. Les réactions d’une batterie au plomb sont :
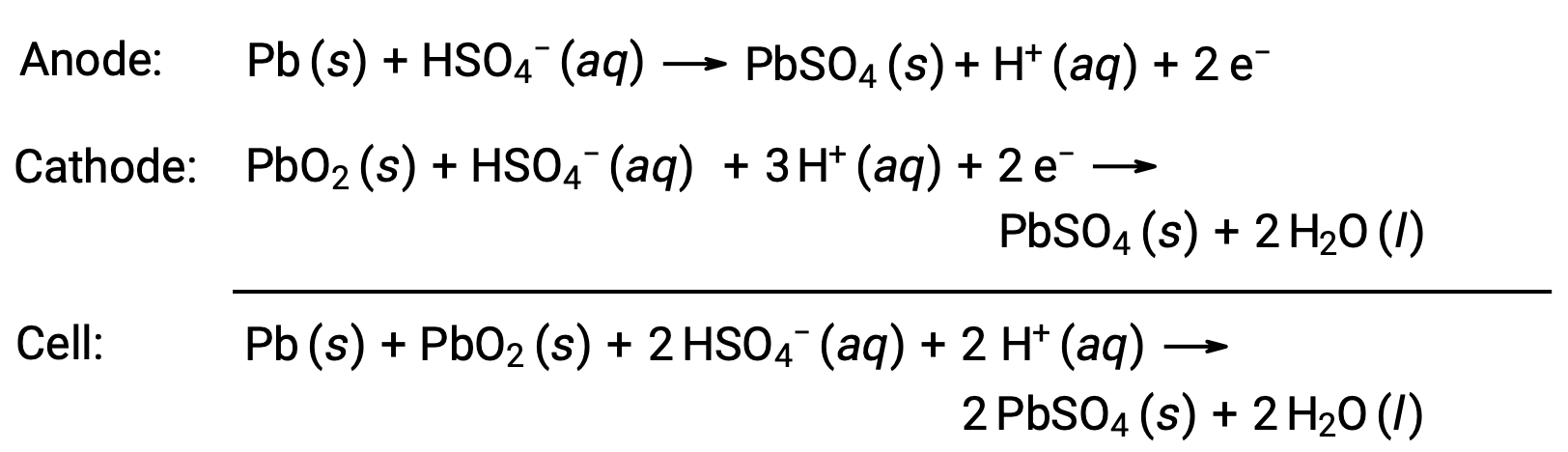
Chaque cellule produit 2 V (Ecellule ~ 2 V), de sorte que six cellules sont connectées en série pour produire une batterie de voiture de 12 V. Les batteries au plomb-acide sont lourdes et contiennent un électrolyte liquide caustique, H2SO4 (aq), mais demeurent souvent la batterie de choix en raison de leur forte densité de courant. Comme ces batteries contiennent une quantité importante de plomb, on doit s’en débarrasser de manière appropriée.
Piles à combustible
Une pile à combustible est une cellule galvanique qui utilise des combustibles traditionnels, le plus souvent de l’hydrogène ou du méthane, qui sont alimentés en permanence dans la pile avec un oxydant. À l’intérieur de la cellule, le combustible et l’oxydant sont soumis à la même chimie redox que lorsqu’ils subissent une combustion, mais via une catalyse électrochimique qui est beaucoup plus efficace. Par exemple, une pile à hydrogène type utilise des électrodes en graphite intégrées à des catalyseurs à base de platine pour accélérer les réactions des deux demi-cellules :
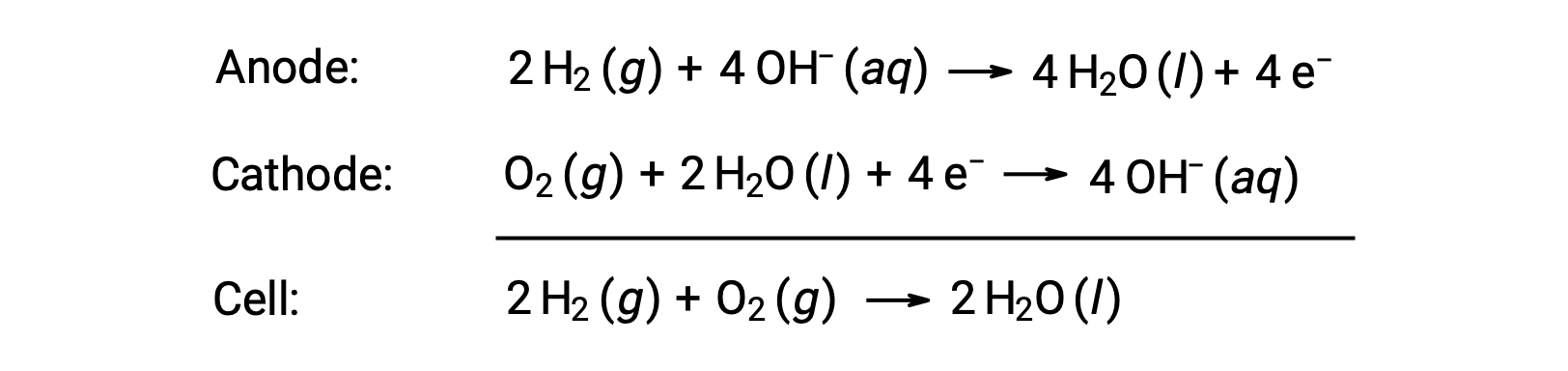
Ces types de piles à combustible produisent généralement des tensions d’environ 1,23 V (Ecellule ~ 1,23 V). Par rapport à un moteur à combustion interne, le rendement énergétique d’une pile à combustible utilisant la même réaction d’oxydoréduction est généralement plus du double (~20 %–25 % pour un moteur contre ~50 %–75 % pour une pile à combustible). Les piles à hydrogène sont couramment utilisées dans les missions spatiales prolongées et des prototypes de véhicules personnels ont été mis au point.
Ce texte est adapté de Openstax, Chimie 2e, Section 17.5 : Batteries et piles à combustible.
