18.8:
Baterias e Células de Combustível
18.8:
Baterias e Células de Combustível
Uma bateria é uma célula galvânica que é utilizada como fonte de energia elétrica para aplicações específicas. As baterias modernas existem em várias formas para acomodar várias aplicações, desde as pequenas pilhas tipo botão, tais como as que alimentam os relógios de pulso até baterias muito grandes utilizadas para fornecer energia de reserva às redes elétricas municipais. Algumas baterias foram concebidas para aplicações de utilização única e não podem ser recarregadas (células primárias), enquanto que outras se baseiam em reações de células convenientemente reversíveis que permitem o recarregamento através de uma fonte de alimentação externa (células secundárias).
Baterias de Utilização Única (Primárias)
Uma pilha seca é uma bateria primária comum que usa zinco tanto como recipiente como ânodo (terminal “–”) e uma haste de grafite como cátodo (terminal “+”). A lata de Zn é enchida com uma pasta eletrolítica contendo óxido de manganês(IV), cloreto de zinco(II), cloreto de amónio, e água. Uma haste de grafite está imersa na pasta de eletrólitos para completar a pilha. A reação espontânea da pilha envolve:
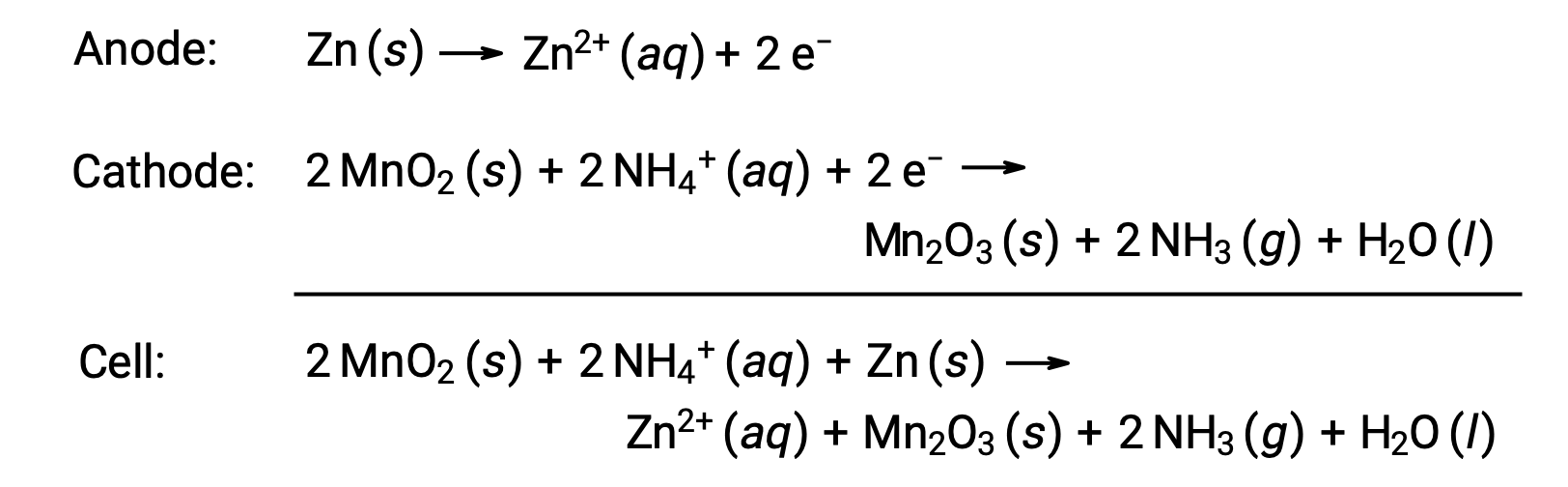
A voltagem (potencial celular) de uma pilha seca é de aproximadamente 1,5 V (Ecell ~ 1,5 V). As pilhas secas estão disponíveis em vários tamanhos (por exemplo, D, C, AA, AAA). Todos os tamanhos de pilhas secas compreendem os mesmos componentes e apresentam a mesma voltagem, mas pilhas maiores contêm maiores quantidades de reagentes redox e, portanto, são capazes de transferir quantidades de carga proporcionalmente maiores. Tal como outras células galvânicas, as pilhas secas podem ser ligadas em série para produzir baterias com maiores saídas de voltagem, se necessário.
As pilhas alcalinas foram concebidas em torno dos mesmos pares redox da pilha seca. Como o seu nome sugere, estes tipos de pilhas utilizam eletrólitos alcalinos, muitas vezes hidróxido de potássio. As reações são
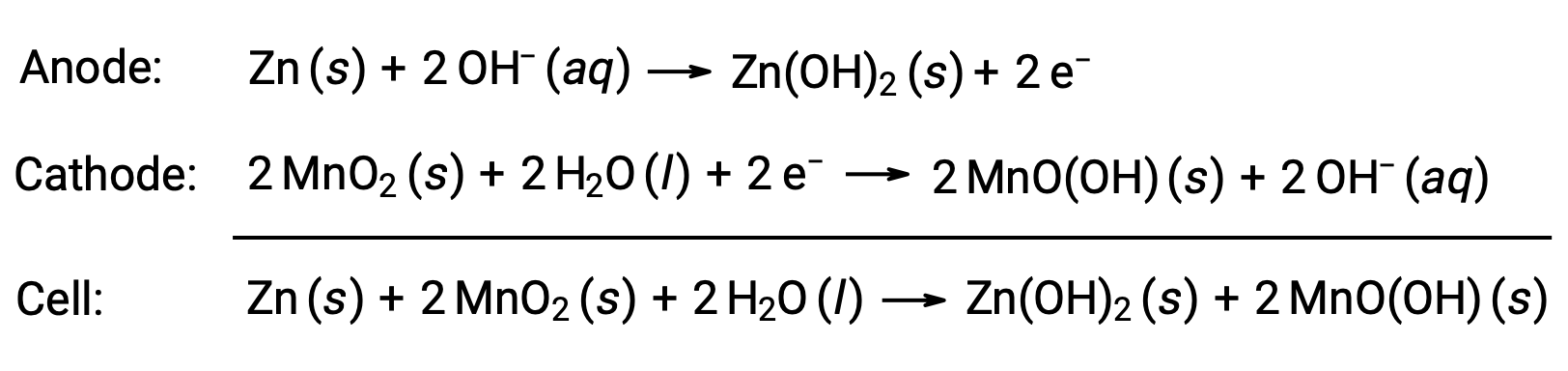
Uma pilha alcalina pode fornecer cerca de três a cinco vezes a energia de uma pilha seca de tamanho semelhante (Ecell = +1,43 V). As pilhas alcalinas têm tendência a verter hidróxido de potássio, pelo que devem ser removidas dos dispositivos para armazenamento a longo prazo. Embora algumas pilhas alcalinas sejam recarregáveis, a maioria não é.
Baterias Recarregáveis (Secundárias)
As baterias de níquel-cádmio, ou NiCd, são constituídas por um cátodo revestido por níquel, um ânodo revestido por cádmio, e um elétrodo de hidróxido de potássio. As placas positivas e negativas, que são impedidas de entrar em curto-circuito pelo separador, são enroladas e colocadas na caixa. Este design permite que a bateria NiCd forneça muito mais corrente do que uma pilha alcalina de tamanho semelhante. As reações são
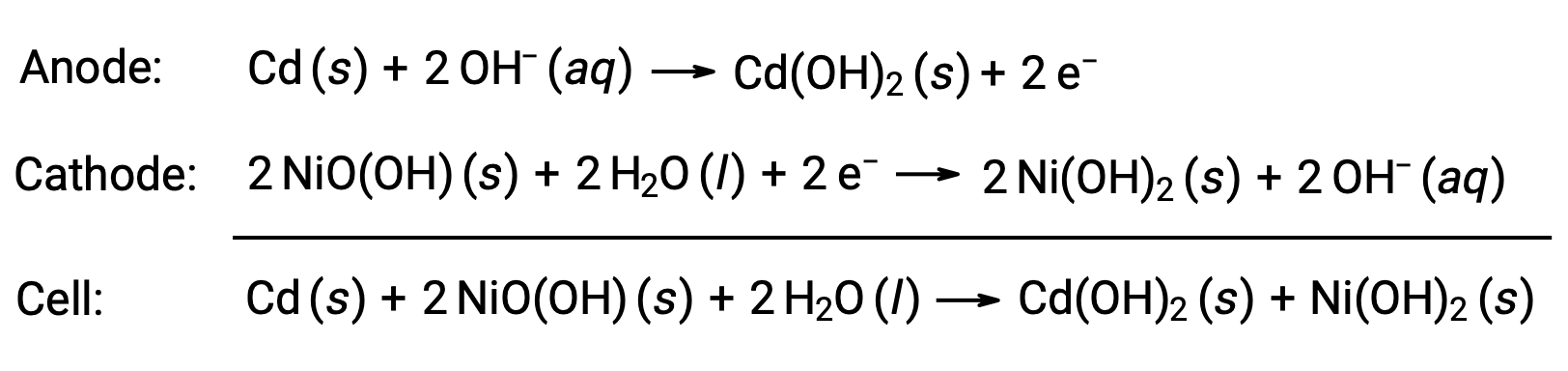
Quando devidamente tratada, uma bateria NiCd pode ser recarregada cerca de 1000 vezes (Ecell ~ 1,3 V). O cádmio é um metal pesado tóxico, pelo que as baterias NiCd nunca devem ser rompidas ou incineradas, devendo ser eliminadas em conformidade com as diretivas aplicáveis relativas aos resíduos tóxicos.
As baterias de ião de lítio estão entre as pilhas recarregáveis mais populares e são utilizadas em muitos dispositivos eletrónicos portáteis. As reações são
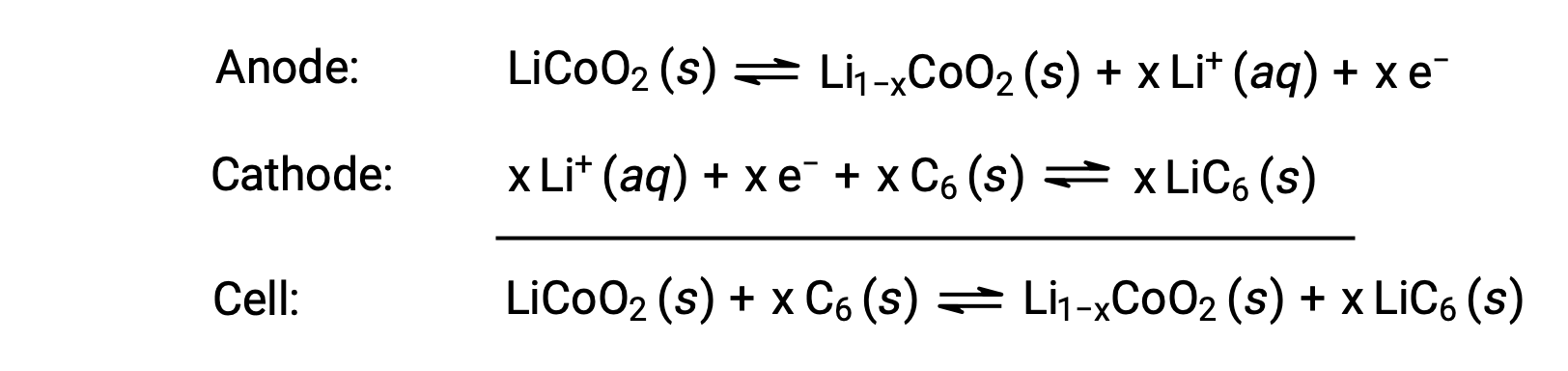
A estequiometria variável da reação da célula leva à variação das voltagens da célula, mas para condições típicas, x geralmente não é mais que 0,5, e a voltagem da célula é de aproximadamente 3,7 V (Ecell ~ 3,7). As baterias de lítio são populares porque podem fornecer uma grande quantidade de corrente, são mais leves do que as baterias comparáveis de outros tipos, produzem uma voltagem quase constante à medida que são descarregadas, e apenas perdem lentamente a carga quando armazenadas.
A bateria de chumbo-ácido é também um tipo de bateria secundária normalmente utilizada em automóveis. É barata e capaz de produzir a corrente elevada requerida por motores de arranque de automóveis. As reações para uma bateria de chumbo-ácido são
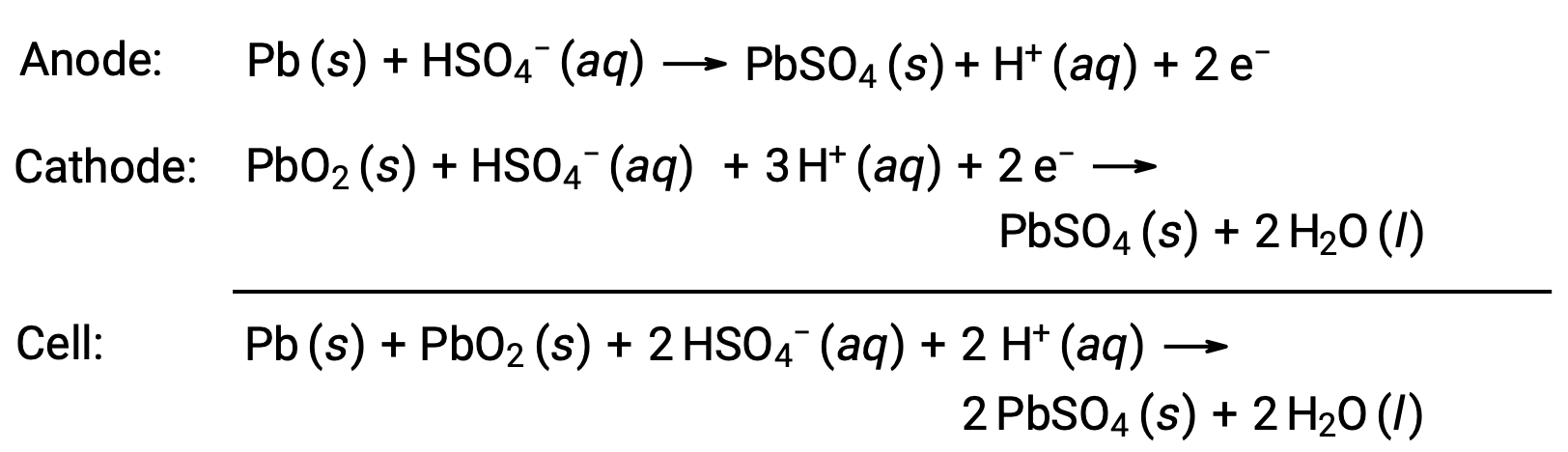
Cada célula produz 2 V (Ecell ~ 2 V), pelo que seis células são ligadas em série para produzir uma bateria de 12 V. As baterias de chumbo-ácido são pesadas e contêm um eletrólito cáustico líquido, H2SO4 (aq), mas muitas vezes continuam a ser a bateria de eleição devido à sua elevada densidade de corrente. Uma vez que estas baterias contêm uma quantidade significativa de chumbo, devem ser sempre eliminadas correctamente.
Células de Combustível
Uma célula de combustível é uma célula galvânica que utiliza combustíveis tradicionais, mais frequentemente hidrogénio ou metano, que são continuamente alimentados para a célula juntamente com um oxidante. Dentro da célula, o combustível e o oxidante sofrem a mesma química redox de quando são queimados, mas através de um eletroquímico catalisado que é significativamente mais eficiente. Por exemplo, uma célula de combustível de hidrogénio típica utiliza elétrodos de grafite embebidos em catalisadores à base de platina para acelerar as duas reações de semi-célula:
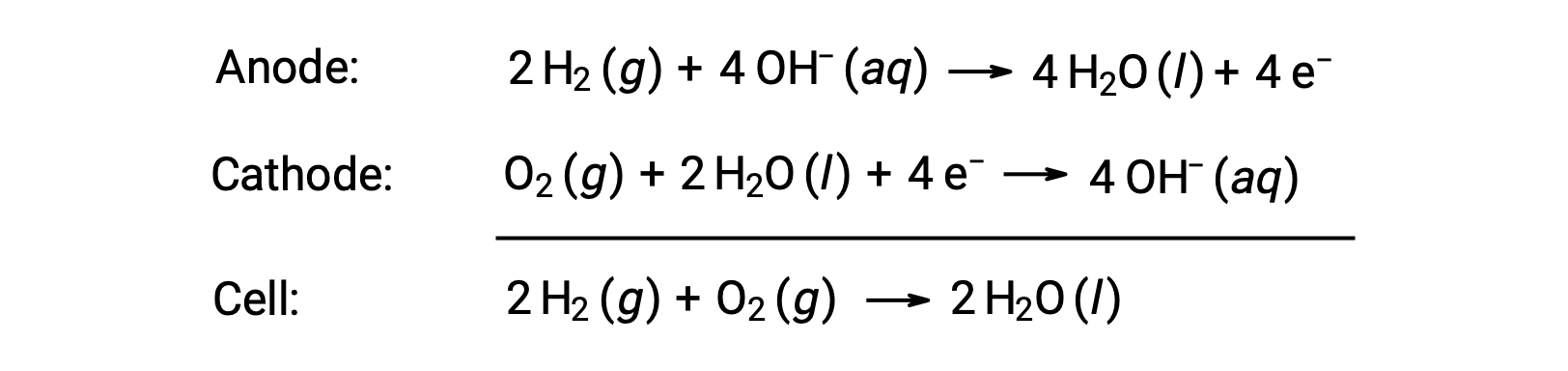
Estes tipos de células de combustível produzem geralmente voltagens de aproximadamente 1,23 V (Ecell ~ 1,23 V). Em comparação com um motor de combustão interna, a eficiência energética de uma célula de combustível que utiliza a mesma reação redox é normalmente mais do dobro (~20%–25% para um motor versus ~50%–75% para uma célula de combustível). Células de combustível de hidrogénio são comumente usadas em missões espaciais extensas, e foram desenvolvidos protótipos para veículos pessoais.
Este texto é adaptado de Openstax, Chemistry 2e, Section 17.5: Batteries, and Fuel Cells.
