18.8: 电池和燃料电池
电池是原电池(伽凡尼电池),用作特定应用的电源。 现代电池有多种形式,可用于各种应用,从微型按钮电池 (例如为腕表供电的电池) 到用于向城市电网提供备用能量的超大电池。 某些电池专为一次性使用而设计,不能充电 (主电池) ,而另一些电池则基于方便可反转的电池反应,允许外部电源 (次电池) 充电。
一次性 (主) 电池
干电池是一种常见的主电池,它使用锌作为容器和阳极 (“–”端子) ,使用石墨杆作为阴极 (“ + ”端子)。 锌罐中装有一种电解质糊,其中含有氧化锰,氯化锌,氯化铵和水。 一根石墨杆浸入电解质糊中以完成电池。 自发电池反应包括:
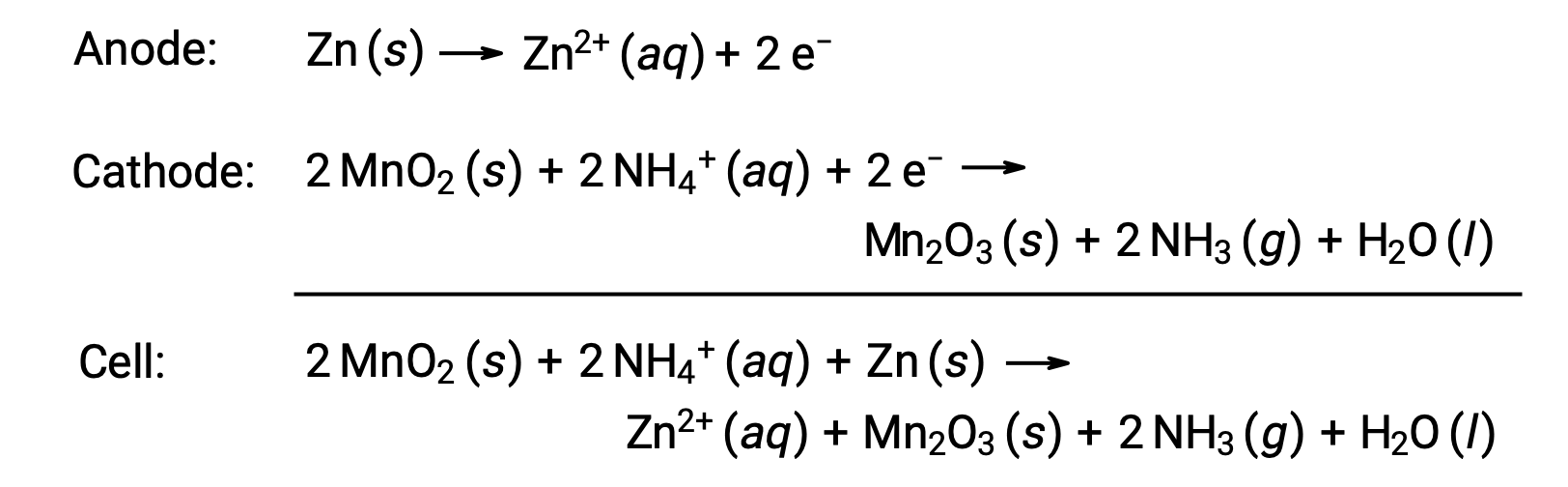
干电池的电压 (电池电势) 约为 1.5 V (Ecell ~ 1.5 V)。 干电池提供各种尺寸 (例如 D , C , AA , AAA)。 所有尺寸的干电池都包含相同的组件并具有相同的电压,但较大的电池包含较大数量的氧化还原反应物,因此能够相应地转移较大的电荷。 与其他原电池(伽凡尼电池)一样,如果需要,干电池可以串联连接至具有更大电压输出的产率电池。
碱性电池的设计与干电池相同。 顾名思义,这些类型的电池使用碱性电解质,通常是氢氧化钾。 反应是
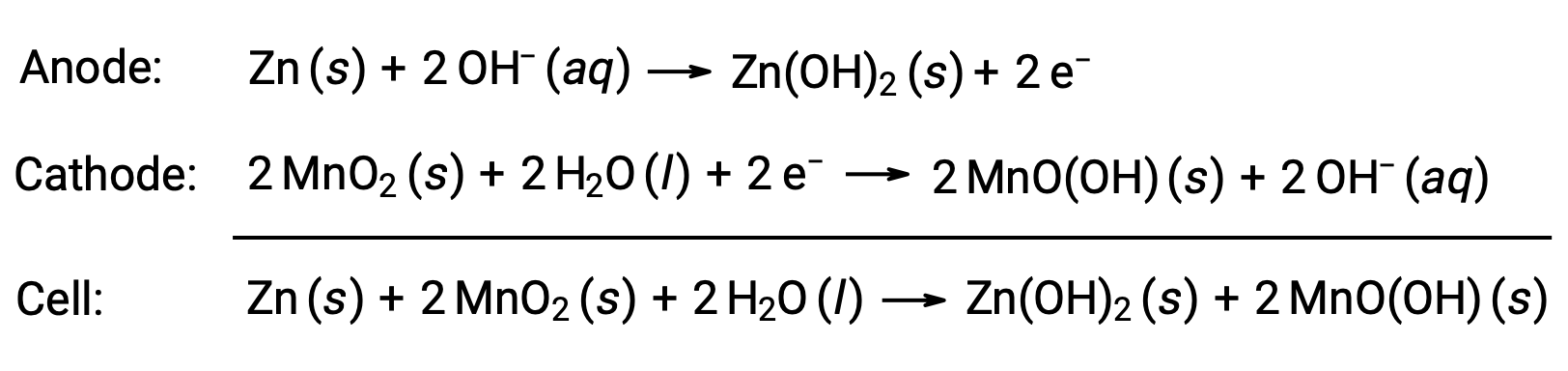
碱性电池的能量容量可达干电池类似尺寸 (Ecell =+1.43 V) 的三到五倍。 碱性电池容易泄漏氢氧化钾,因此应将其从设备中取出,以便长期存放。 虽然一些碱性电池可以充电,但大多数电池不能充电。
可充电 (辅助) 电池
镍镉或镍镉电池由镀镍阴极,镀镉阳极和氢氧化钾电极组成。 正极和负极板由分离器防止短路,它们一起滚动并放入壳体中。 这种设计使镍镉电池提供的电流比类似尺寸的碱性电池大得多。 反应是
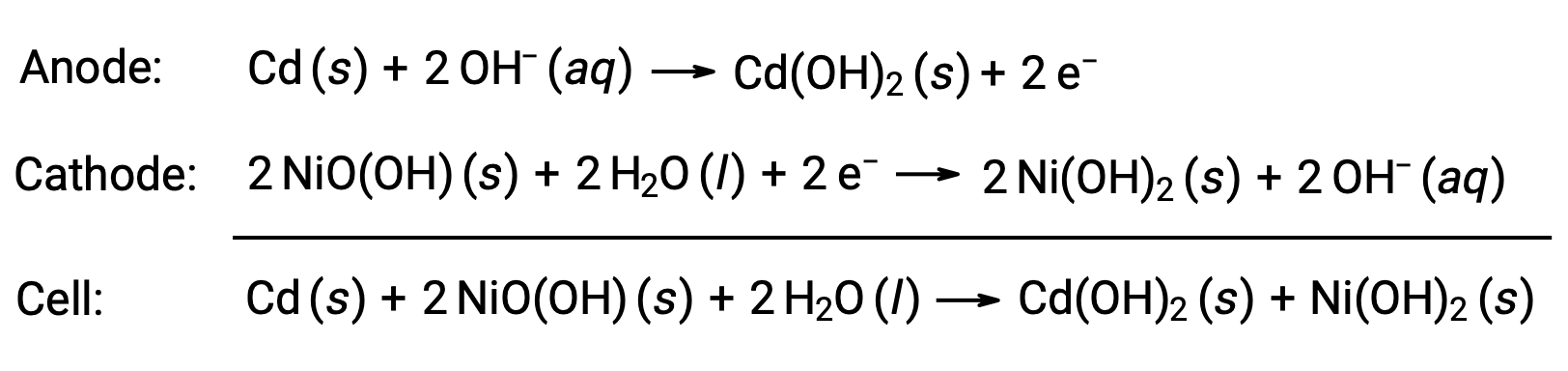
正确处理后,镍镉电池可充电约 1000 次 (电池 ~ 1.3 V)。 镉是一种有毒重金属,因此镍镉电池绝不应破裂或焚烧,应按照相关的有毒废物准则进行处置。
锂离子电池是最流行的充电电池之一,用于许多便携式电子设备。 反应是
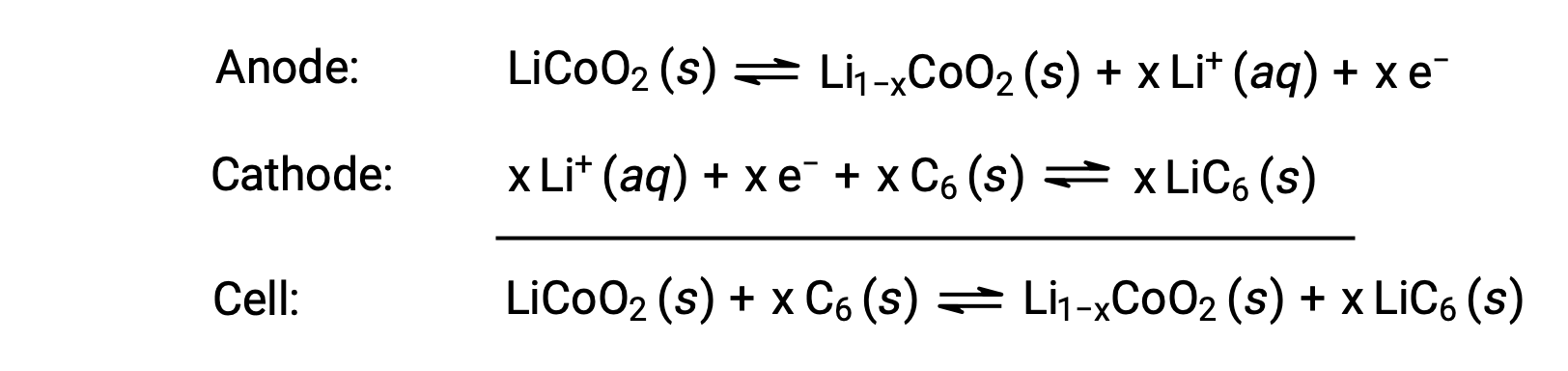
电池反应的可变化学光度测量会导致电池电压发生变化,但在典型情况下, x 通常不超过 0.5 ,电池电压约为 3.7 V (E 电池 ~ 3.7)。 锂电池很受欢迎,因为它们可以提供较大的数量电流,比其他类型的同类电池更轻,在放电时会产生几乎恒定的电压,并且只会在存储时慢慢失去电荷。
铅酸蓄电池也是汽车中常用的二级蓄电池。 它价格低廉,能够产生汽车起动电动机所需的高电流。 铅酸蓄电池的反应是
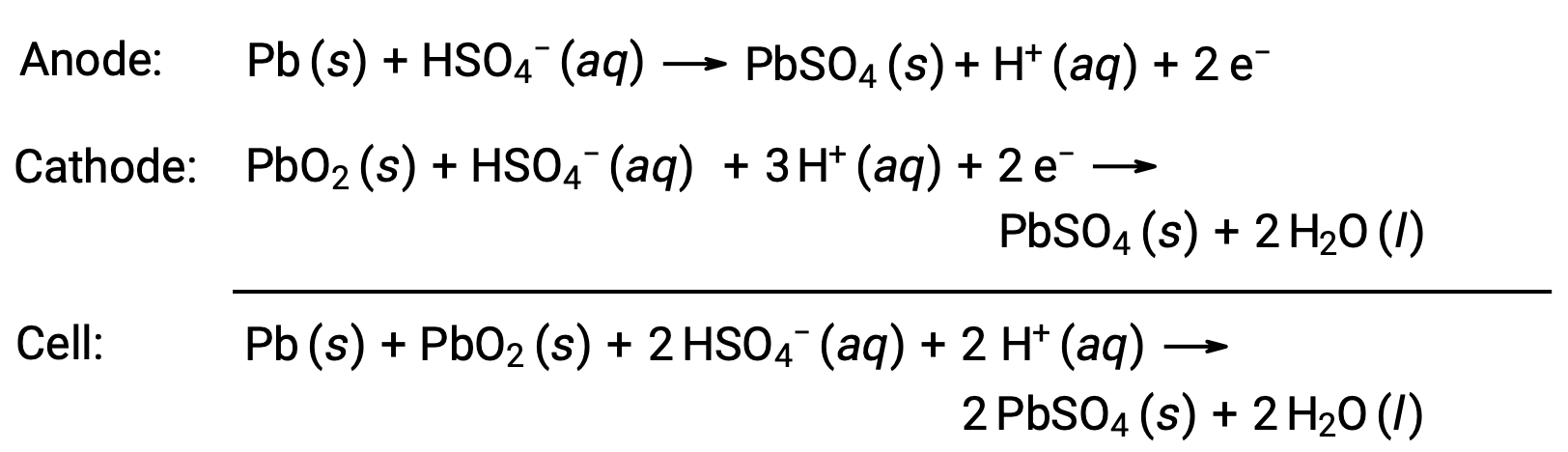
每个电池产生 2 V (Ecell ~ 2 V) ,因此六个电池串联以产生一个 12 V 汽车蓄电池。 铅酸电池很重,含有腐蚀性液体电解质 H2SO4 (AQ) ,但由于其高电流密度,通常仍是首选电池。 由于这些电池含有大量的铅数量,因此必须始终正确处置。
燃料电池
燃料电池是一种原电池(伽凡尼电池),它使用传统的可燃物燃料,最常见的是氢气或甲烷,这些燃料与氧化物一起持续供给电池。 在电池中,燃料和氧化物的氧化还原化学与燃烧时的化学性质相同,但通过催化的电子化学,其效率显著提高。 例如,典型的氢燃料电池使用嵌入铂基催化剂的石墨电极加速两种半电池反应:
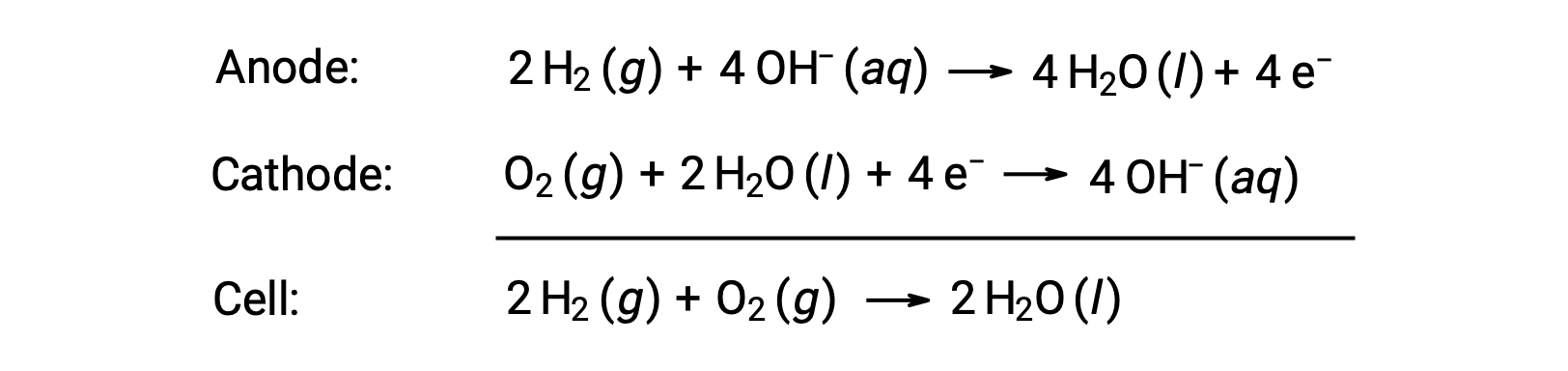
这些类型的燃料电池通常产生约 1.23 V (电池 ~ 1.23 V) 的电压。 与内燃机相比,使用相同氧化还原反应的燃料电池的能量效率通常要高出一倍多 (发动机为~20% – 25% ,燃料电池为 ~50% – 75%)。 氢燃料电池通常用于扩展空间飞行任务,并开发了个人车辆的原型。
本文改编自 Openstax , 化学 2e ,第 17.5 节:电池和燃料电池。


